Перейти к:
Современные проблемы антибиотикорезистентности грамотрицательных возбудителей нозокомиальных инфекций в Ростовской области
https://doi.org/10.21886/2219-8075-2019-10-3-
Аннотация
Цель: провести анализ распространенности штаммов грамотрицательных бактерий - возбудителей инфекционных осложнений, устойчивых к карбапенемам, в том числе, за счет продукции карбапенемаз, выделенных из различного клинического биоматериала у госпитализированных пациентов стационаров города Ростова-на-Дону и области.
Материалы и методы: исследовали 366 грамотрицательных бактериальных изолятов, пациентов из 16 отделений 9 лечебно-профилактических стационаров г. Ростова-на-Дону и области. Изоляты выделяли традиционным микробиологическим методом. Видовую идентификацию штаммов и чувствительность к антимикробным препаратам определяли на автоматическом анализаторе Vitek 2 (BioMerieux, Франция). Нечувствительные к карбапенемам штаммы тестировали на наличие карбапенемаз с помощью CIM-теста. МБЛ выявляли по эффекту подавления их активности в присутствии ЭДТА. Гены МБЛ детектировали ПЦР-РВ тест-наборами «АмплиСенс MDR MBL-FL», «АмплиСенс MDR KPC/OXA-48-FL». Вывод о продукции БЛРС делали по наличию синергизма цефалоспоринов III-IV поколения с клавулановой кислотой методом двойных дисков.
Результаты: из 366 исследованных изолятов грамотрицательные бактерии составили 74,2%. Из них: Klebsiella pneumoniae 33,0%, Escherichia coli 19,0%, Acinetobacter baumannii 18,0%, Pseudomonas aeruginosa 15,0%. Резистентность к карбапенемам обнаружена у 90,9% штаммов A.baumannii, более 50% P.aeruginosa и K.pneumoniae. Продукция БЛРС детектирована у более чем 90 % K.pneumoniae и около 80 % E.coli. У изолятов A.baumannii и K.pneumoniae было выявлено наличие генов группы OXA и NDM, у P.aeruginosa группы VIM.
Заключение: энтеробактерии устойчивые к бета-лактамам, продуцирующие бета-лактамазы расширенного спектра и карбапенемазы являются одними из ведущих возбудителей инфекционных осложнений в стационарах Ростова-на-Дону и области, практически не уступая по частоте встречаемости бактериям рода Acinetobacter spp. и P.aeruginosa. Это определяет важность детекции механизмов резистентности не только для назначения оптимальной этиотропной терапии, но и для эпидемиологического контроля распространения резистентных штаммов и разработки мероприятий инфекционного контроля.
Для цитирования:
Куцевалова О.Ю., Покудина И.О., Розенко Д.А., Мартынов Д.В., Каминский М.Ю. Современные проблемы антибиотикорезистентности грамотрицательных возбудителей нозокомиальных инфекций в Ростовской области. Медицинский вестник Юга России. 2019;10(3):91-96. https://doi.org/10.21886/2219-8075-2019-10-3-
For citation:
Kutsevalova O.Yu., Pokudina I.O., Rozenko D.A., Martynov D.V., Kaminsky M.Yu. Modern problems of antibiotic resistance gram-negative nosocomial infections in the Rostov region. Medical Herald of the South of Russia. 2019;10(3):91-96. (In Russ.) https://doi.org/10.21886/2219-8075-2019-10-3-
Введение
На сегодняшний день гнойно-воспалительные осложнения, вызванные аэробными грамотрицательными возбудителями, являются серьёзной проблемой для российских стационаров, в частности для отделений реанимации гнойной хирургии. Осложнения, обусловленные грамотрицательными бактериями, вызывают наибольшие сложности при выборе антибиотикотерапии. Это связано с особенностями механизмов устойчивости к антибиотическим препаратам, которые ведут к формированию полирезистентностных штаммов [1][2][3][4][5][6]. По данным литературы, у некоторых штаммов энтеробактерий зарегистрировано наличие одновременно нескольких β -лактамаз и дополнительных механизмов устойчивости, таких как снижение проницаемости наружной мембраны.
Эффективной антибиотикотерапии препятствует рост антибиотикорезистентности возбудителей инфекционных осложнений. Помочь в данной ситуации может знание основных механизмов резистентности возбудителей, микробиологический мониторинг и разработка протоколов эмпирической антибактериальной терапии для каждого конкретного стационара.
Одной из актуальных проблем является устойчивость бактерий к β-лактамным антибиотикам, в частности к карбапенемам. Распространение среди энтеробактерий бета-лактамаз расширенного спектра (БЛРС) привело к резистентности к цефалоспоринам III—IV поколений. Сложившаяся ситуация способствовала активному использованию карбапенемных препаратов. Но врачи столкнулись с новой проблемой, связанной с резистентностью к карбапенемам. Значимый рост резистентности к карбапенемным препаратам, в том числе и за счет продукции ферментов металло-β-лактамаз (МБЛ), расщепляющих все β-лактамные антибиотики, за исключением азтреонама, распространение БЛРС стали значимой проблемой в клинической практике и химиотерапии инфекций. Ситуация усугубляется тем, что полирезистентные бактерии, продуцирующие БЛРС и карбапенемазы, распространяются во внебольничную среду вызывая внебольничные инфекции, затрудняя проведение ранней адекватной антибактериальной терапии [7][8][9][10][11][12][13][14][15].
Цель исследования — провести анализ распространенности штаммов грамотрицательных бактерий - возбудителей инфекционных осложнений, устойчивых к карбапенемам, в том числе за счет продукции карбапенемаз, выделенных из различного клинического биоматериала у госпитализированных пациентов стационаров Ростова- на-Дону и области.
Материалы и методы
В исследование включены 366 грамотрицательных бактериальных изолята, собранных в рамках обследования пациентов (мужчин и женщин) в возрасте от 18 до 85 лет из 16 отделений 9 лечебно-профилактических стационаров г. Ростова-на-Дону и области в период с марта 2018 г. по апрель 2019 г. Все включенные в исследование изоляты были расценены как нозокомиальные с учетом их вероятной этиологической значимости в развитии инфекционной патологии и соответствия критериям развития нозокомиальной инфекции (развитие инфекции не менее чем через 48 часов после госпитализации, не находившейся в инкубационном периоде и не явившейся следствием предшествующей госпитализации). Исследованные изоляты в соответствии с источниками их выделения и локализацией инфекций распределились следующим образом: кожа и мягкие ткани — 32 %, брюшная полость — 11 %, дыхательная система — 42 %, инфекции крови — 7 %, прочие — 6 %.
Изоляты выделяли классическими бактериологическими методами с использованием стандартных селективных и дифференциально-диагностических сред для энтеробактерий. Видовую идентификацию штаммов и чувствительность к антибиотикам проводили на автоматическом анализаторе Vitek 2 (BioMerieux, Франция).
Чувствительность изолятов интерпретировали в соответствии с Российскими клиническими рекомендациями «Определение чувствительности микроорганизмов к антимикробным препаратам» Версия 2018-03 [16]. Для контроля качества определения чувствительности использовали штамм: E. coli ATCC 25922, E. coli ATCC 35218 и P aeruginosa АТСС 27853, K. pneumoniae ATCC®700603.
Критерием включения изолятов в исследование генетических детерминант резистентности было снижение чувствительности хотя бы к одному из карбапенемов (имипенему, эртапенему, меропенему) и результаты тестирования на наличие продукции карбапенемаз с помощью CIM-теста (carbapenemin ictivation method) [17].
Выявление продукции металло- β-лактамаз осуществляли фенотипическим методом, основанном на эффекте подавления активности МБЛ в присутствии ЭДТА. Штаммы, резистентные к карбапенемам, тестировали на наличие генов, кодирующих продукцию металло-беталактамаз, методом ПЦР-РВ тест-наборами «АмплиСенс MDR MBL-FL» (IMP, NDM, VIM) и «АмплиСенс MDR KPC/OXA-48-FL» (разработанных ФБУН Центральный НИИ эпидемиологии Роспотребнадзора, Россия). В качестве положительных контролей использовали штаммы E. coli, K. pneumoniae и P. aeruginosa с заведомо установленной продукцией карбапенемаз.
Вывод о продукции БЛРС делали по наличию синергизма цефалоспоринов III-IV поколения (цефепима и цефтазидима) с клавулановой кислотой с помощью метода двойных дисков.
В ходе исследования чувствительности выделенных изолятов к β-лактамным антибиотикам, установлено, что наибольший уровень резистентности к карбапенемам (имипенему и меропенему) обнаружен у штаммов A.baumannii, который составил 90,9 % к обоим препаратам. Исследование с помощью ПЦР метода этих изолятов A. baumannii позволило обнаружить гены приобретенных карбапенемаз относящихся к группам OXA-40. У одного штамма было зарегистрировано наличие гена МБЛ группы NDM.
Доля нечувствительных штаммов синегнойных палочек в нашем исследовании составила 58,2 % и 54,5 % к имипенему и меропенему соответственно. Среди штаммов P.aeruginosa с возможной продукцией карбапенемаз по результатам CIM-теста и фенотипического теста с ЭДТА, с помощью ПЦР-метода было обнаружено наличие генетических детерминант, относящихся к VIM- группе, кодирующих металло-β-лактамазы.
Для энтеробактерий, наиболее высокие показатели нечувствительности к карбапенемам (эртапенему, имипенему и меропенему) наблюдались среди изолятов K.pneumoniae — 58,3 %, 53,3 % и 55,8 % соответственно. Продукция карбапенемаз фенотипическим методом была установлена у 16,8 % изолятов K.pneumoniae и 1,4 % — E. coli. Основным типом карбапенемаз среди этих штаммов были ферменты группы OXA-48, относящиеся к сериновым карбапенемазам класса D. В единичных случаях среди изолятов K.pneumoniae встречались штаммы, продуцирующие металло-бета-лактамазы группы NDM.
Следует отметить, что у подавляющего большинства исследованных изолятов K.pneumoniae так же наблюдался высокий уровень резистентности к цефалоспоринам. В частности к цефепиму — 95,0 %, цефотаксиму — 96,7 %, при этом продукция БЛРС методом двойных дисков была выявлена у 93,3 %. Среди изолятов E. coli, уровень резистентности к цефепиму составил 79,7 %; к цефотаксиму — 84,1 %; за счет продукции БЛРС устойчивость реализуется у 76,8 %. Бактерии, продуцирующие БЛРС рассматривались как резистентные ко всем пенициллинам, цефалоспоринам. Нередко регистрировалась резистентность к аминогликозидам и фторхинолонам за счет ассоциированной полирезистентности.
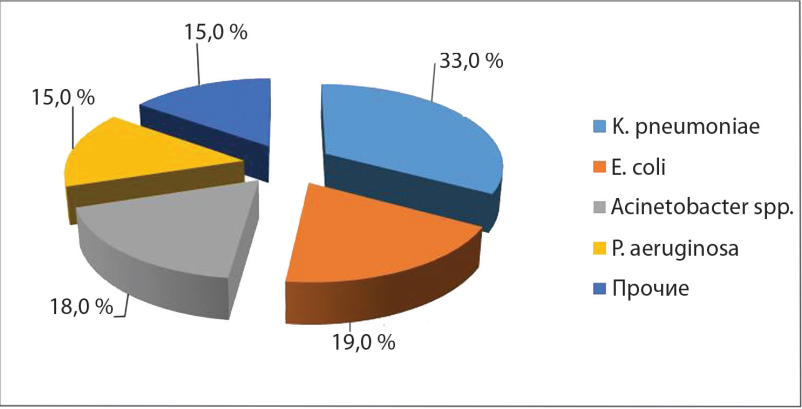
Рисунок 1. Видовой состав возбудителей инфекционного процесса у госпитализированных пациентов Ростова-на-Дону (n=366).
Figure 1. The species composition of the causative agents of the infectious process in hospitalized patients of Rostov-on-Don (n = 366).
Обсуждение
В сложившейся ситуации с множественной лекарственной устойчивостью возбудителей, в том числе к цефалоспоринам, карбапенемы долгое время оставались препаратами выбора для лечения тяжелых инфекций. Полученные данные свидетельствуют о том, что проблема циркуляции штаммов K.pneumoniae, A.baumannii, P.aeruginosa, обладающих множественной устойчивостью к антимикробным препаратам, в том числе к карбапенемам и цефалоспоринам, становится актуальной и для нашего региона.
Данное исследование позволило установить, что устойчивость к карбапенемам у исследованных возбудителей реализуется с помощью различных механизмов, в том числе за счет наиболее важного из них — действия карбапенемаз и оксациллиназ, в частности ферментов группы OXA и NDM. Генетические детерминанты этих ферментов были детектированы у K. pneumoniae (OXA- 48 и NDM) и Acinetobacter spp (OXA-40 и NDM). Особую опасность представляют штаммы, продуцирующие металло-β-лактамазы группы NDM, которые являются наиболее распространенным типом металло-β-лактамаз и гидролизуют почти все клинически используемые β-лактамные антибиотики [18].
Также показана широкая распространенность в стационарах г. Ростова-на-Дону штаммов-продуцентов БЛРС: у K.pneumoniae они были детектированы в 93,3 % случаев, у E. coli в — 76,8 %.
Сложившаяся ситуация требует современных методов микробиологической диагностики: использование современных критериев определения чувствительности к антимикробным препаратам, внедрение фенотипических методов исследования чувствительности. С помощью фенотипических тестов можно получить достоверную информацию еще до проведения молекулярно-генетических методов.
Перспективы разработки новых антибиотиков для лечения нозокомиальных инфекций выглядят удручающе. В феврале 2017 г. Всемирная организация здравоохранения (ВОЗ) впервые представила перечень резистентных микроорганизмов, представляющих наибольшую опасность и требующих внедрения новых активных антимикробных препаратов (АМП). Первоочередными в данном перечне являются карбапенеморезистентные штаммы грамотри- цательные бактерии (A.baumannii, P.aeruginosa и энтеробактерии с продукцией БЛРС и карбапенемаз [19][20].
В рамках эпидемиологического исследования «Оценка чувствительности клинических изолятов Enterobacterales и Pseudomonas aeruginosa к цефтазидиму/авибактаму в России с помощью диско-диффузионного метода» протестированы 109 штаммов, полученных из стационаров г. Ростова-на-Дону и области. Результаты показали, высокий уровень активности in vitro (93,6 %) в отношении изолятов Enterobacterales и Pseudomonas aeruginosa. Исключение составили 6,4 % штаммов с вероятной продукцией МБЛ. Данное эпидемиологическое исследование продолжается.
Заключение
На основании проведенного исследования можно сделать вывод о высоком уровне резистентности к цефалоспоринам и карбопенемам среди госпитальных штаммов грамотрицательных бактерий и, что особенно настораживает, о распространенности штаммов, продуцирующих карбапенемазы среди представителей Enterobacterales в стационарах Ростова-на-Дону и области. Такая ситуация ведет к неизбежному росту числа случаев неэффективной терапии, росту антибиотикорезистентности и необходимости использования новых антибактериальных препаратов.
Энтеробактерии являются одними из ведущих возбудителей инфекционных осложнений в стационарах Ростова-на-Дону, практически не уступая по частоте встречаемости бактериям A.baumannii и P. aeruginosa. Система микробиологического мониторинга к кар- бапенемам и другим антибактериальным препаратам и их рациональное применение остается актуальной, поскольку являются важными факторами, способствующими сдерживанию роста распространенности карбапенемаз и сохранению активности антибиотиков. Учитывая быстрое распространение карбапенемазопродуцирующих штаммов и разнообразие карбапе- немаз, на сегодняшний день микробиологическая лаборатория приобретает особое значение. Назначения антибактериальных препаратов должны основываться на результатах микробиологической диагностики. Наличие в клинических микробиологических лабораториях методов выявления продукции БЛРС и карбапенемаз необходимо для эффективного инфекционного контроля. Микробиологический мониторинг формирования антибиотикорезистентности является важным методом оценки эффективности антибиотикотерапии и возможности эмпирического назначения антибактериальных химиопрепаратов. Детекция механизма резистентности бактерий к карбапенемам важна и способствует как в назначении оптимальной этиотропной терапии пациенту, так и для эпидемиологического мониторинга распространения резистентных штаммов, мероприятий инфекционного контроля.
Список литературы
1. Шаталова Е.В., Парахина О.В., Красноухов А.И. Значимость микробиологического мониторинга в современной системе профилактики инфекций, связанных с оказанием медицинской помощи // Антибиотики и химиотерапия. - 2017. - Т. 62. № 11-12. - С. 35-38.
2. Вильямс Д. Резистентность к бета-лактамным антибиотикам // Антибиотики и химиотерапия. – 1997. – Т. 42, № 10. – С. 5-9.
3. Яковлев С.В. Оптимизация эмпирической антибактериальной терапии госпитальных инфекций, вызванных грамотрицательными микроорганизмами //РМЖ. - 2005. – №5. – C. 278
4. Бисекенова А.Л., Адамбеков Д.А., Рамазанова Б.А., Чакемова Г.С. Этиологическая структура инфекций, вызванных грамотрицательными микроорганизмами в хирургический стационарах г. Алматы и профиль их антибиотикорезистентности // Вестник КГМА им. И.К. Ахунбаева. - 2016. - № 4. - С. 120-124.
5. Витик А.А., Суханова Н.В., Пыленко Л.Н. Этиология и антибиотикорезистентность возбудителей нозокомиальных инфекций в гнойно-септическом отделении анестизиологии и реанимации // Университетская медицина Урала. - 2017. - Т. 3. № 2 (9). - С. 40-44.
6. Куцевалова О.Ю., Кит О.И., Панова Н.И., Розенко Д.А., Якубенко C.В., Геворкян Ю.А Современные тенденции антибиотикорезистентности грамотрицательных возбудителей нозокомиальных инфекций в Ростовской области // Антибиотики и химиотерапия. - 2018.- 63. - С.11—12
7. Крыжановская О.А. Чувствительность к антибиотикам и механизмы устойчивости к карбапенемам Acinetobacter baumannii, Pseudomonas aeruginosa и Klebsiella pneumoniae, выделенных у детей в отделениях реанимации и интенсивной терапии: Автореферат диссертации на соискание ученой степени кандидата медицинских наук. Москва, 2016.- 119 с.
8. 8. Покудина И.О., Коваленко К.А. Распространенность и вклад в антибиотикоустойчивость β-лактамаз у амбулаторных изолятов Klebsiella pneumoniae // Международный журнал прикладных и фундаментальных исследований. - 2016. - №12. - С.295-298
9. Эйдельштейн М.В., Сухорукова М.В., Склеенова Е.Ю., Иванчик Н.В., Микотина А.В., и др. Антибиотикорезистентность нозокомиальных штаммов Pseudomonas aeruginosa в стационарах России: результаты многоцентрового эпидемиологического исследования «МАРА- ФОН» 2013-2014. // Клиническая микробиология антимикробная химиотерапия. - 2017. – Т. 19.№1. - С.37-41.
10. Эйдельштейн М.В., Сухорукова М.В., Склеенова Е.Ю., Иванчик Н.В., Микотина А.В., и др. Антибиотикорезистентность нозокомиальных штаммов Enterobacteriaceae в стационарах России: результаты многоцентрового эпидемиологического исследования «МАРАФОН» 2013- 2014. // Клиническая микробиология антимикробная химиотерапия. - 2017.- Т. 19. - № 1. - С.49-56.
11. Antimicrobial resistance surveillance in Europe 2011. Surveillance report http://www.ecdc.europa.eu/en/publications/Publications/antimicrobial-resistancesurveillance-europe-2011
12. Gupta N., Limbago B.M., Patel J.B., Kallen A.J. Carbapenemresistant Enterobacteriaceae: epidemiology and prevention // Clin Infect Dis. - 2011. – V.53. - P. 60-67.
13. Breidenstein E.B., de la Fuente-Nunez C., Hancock R.E. Pseudomonas aeruginosa: all roads lead to resistance //Trends Microbiol. - 2011. – V.19(8). - P.419-426.
14. Mulvey M.R., Grant J.M., Plewes K., Roscoe D., Boyd D.A. New Delhi metallo-β-lactamase in Klebsiella pneumoniae and Escherichia coli, Canada // Emerg. Infect. Dis. — 2011. — Vol. 17, N 1. — P. 103–106.
15. Егорова С.А, Кафтырева Л.А., Л.В. Липская Л.В. Штаммы энтеробактерий, продуцирующие бета-лактамазы расширенного спектра и металло- β-лактамазу NDM-1, вы- деленные в стационарах в странах балтийского региона // Инфекция и иммунитет. - 2013. - Т. 3. - № 1.- C. 29–36.
16. Клинические рекомендации «Определение чувствительности микроорганизмов к антимикробным препаратам» Вер. 2015-02. Доступно по URL: http://www.antibiotic.ru/minzdrav/files/docs/clrec-dsma2015.pdf
17. van der Zwaluw K., de Haan A., Pluister G.N., Bootsma H.J., de Neeling A.J., Schouls L.M. The Carbapenem inactivation method (CIM), a simple and lowcost alternative for the Carba NP test to assess phenotypic carbapenemase activity in Gram-negative rods. // PLOS One. – 2015. – V.10: e0123690.
18. Ma B., Fang C., Lu L., Wang M., Xue X.Y. et al. The antimicrobial peptide thanatin disrupts the bacterial outer membrane and inactivates the NDM-1 metallo-β-lactamase. // Nature Communications. 10. doi: 10.1038/s41467-019-11503-3.
19. Козлов Р.С., Стецюк О.У., Андреева И.В. Цефтазидим-авибактам: новые «правила игры» против полирезистентных грамотрицательных бактерий // Клин микробиология антимикробная химиотерапия.- 2018.- Т. 20.- №1 С.3-14
20. Соломенный А.П., Зубарева Н.А., Гончаров А.Е. Генотипический анализ нозокомиальных штаммов Acinetobacter baumannii // Клиническая микробиология и антимикробная химиотерапия. - 2015. - Т. 17. - № 4. - С. 297-300.
Об авторах
О. Ю. КуцеваловаКуцевалова Ольга Юрьевна - к.б.н., заведующая лабораторией клинической микробиологии, врач-бактериолог.
Ростов-на-ДонуИ. О. Покудина
Россия
Покудина Инна Олеговна - к.б.н., старший научный сотрудник лаборатория «Биомедицина».
Ростов-на-ДонуД. А. Розенко
Розенко Дмитрий Александрович - заведующий отделением, врач анестезиолог реаниматолог.
Ростов-на-ДонуД. В. Мартынов
Мартынов Дмитрий Викторович - к.м.н., заведующий Отделением анестезиологии и реанимации №1.
Ростов-на-ДонуМ. Ю. Каминский
Каминский Михаил Юрьевич - к.м.н., заведующий отделением анестезиологии-реанимации №7, врач анестезиолог реаниматолог.
Ростов-на-ДонуРецензия
Для цитирования:
Куцевалова О.Ю., Покудина И.О., Розенко Д.А., Мартынов Д.В., Каминский М.Ю. Современные проблемы антибиотикорезистентности грамотрицательных возбудителей нозокомиальных инфекций в Ростовской области. Медицинский вестник Юга России. 2019;10(3):91-96. https://doi.org/10.21886/2219-8075-2019-10-3-
For citation:
Kutsevalova O.Yu., Pokudina I.O., Rozenko D.A., Martynov D.V., Kaminsky M.Yu. Modern problems of antibiotic resistance gram-negative nosocomial infections in the Rostov region. Medical Herald of the South of Russia. 2019;10(3):91-96. (In Russ.) https://doi.org/10.21886/2219-8075-2019-10-3-
JATS XML






































