Перейти к:
Диагностическая ценность С–пептида и модифицированных индексов HOMA при различных нарушениях углеводного обмена на фоне терапии глюкокортикоидами
https://doi.org/10.21886/2219-8075-2018-9-1-23-31
Аннотация
Цель: оценка диагностической ценности С-пептида и модифицированных индексов HOMA при различных нарушениях углеводного обмена (НУО) на фоне терапии глюкокортикоидами. Материалы и методы: обследовано 193 пациентов с диагнозом системная красная волчанка (СКВ) - 63, системный васкулит (СВ) – 45 и хронический гломерулонефрит (ХГН) – 76 человек, из которых 98 человек получали пульс-терапию глюкокортикоидами (ПТГК) (1 серия в 3 сеанса), а 95 - терапию ГК per os. Всем пациентам проведены стандартные клинико-лабораторные исследования, пероральный глюкозо-толерантный тест (ПГТТ), а также оценка С-пептида, индексов HOMA-IR и HOMA-islet. Результаты: Проведение ПГТТ выявило, что у пациентов, принимающих ГК per os нарушение гликемии натощак (НГН), нарушение толерантности к глюкозе (НТГ), сахарных диабет (СД), развиваются статистически значимо чаще, чем при ПТГК. У пациентов обеих групп с выявленными СД и НТГ значения С-пептида и индекса HOMA-IR до проведения лечения и ПГТТ были выше, чем при отсутствии НУО и НГН, что говорит о наличии инсулинорезистентности у данной категории больных. При СД выявлено снижение секреторной функции β-клеток, что проявлялось в виде снижения показателей индекса HOMA-islet. Заключение: НУО реже встречаются при проведении ПТГК, чем при терапии per os. Индекс HOMA-IR может быть использован для прогноза развития НУО у больных на фоне интенсивной терапии ГК, а также при длительной per os терапии.
Для цитирования:
Валеева Ф.В., Нуруллина Г.И. Диагностическая ценность С–пептида и модифицированных индексов HOMA при различных нарушениях углеводного обмена на фоне терапии глюкокортикоидами. Медицинский вестник Юга России. 2018;9(1):23-31. https://doi.org/10.21886/2219-8075-2018-9-1-23-31
For citation:
Valeeva F.V., Nurullina G.I. С–peptide and modifi ed HOMA–index in different carbohydrate metabolism disturbances during glucocorticoid therapy. Medical Herald of the South of Russia. 2018;9(1):23-31. (In Russ.) https://doi.org/10.21886/2219-8075-2018-9-1-23-31
Введение
Глюкокортикоиды (ГК), например, кортизол у человека и кортикостерон у грызунов? вырабатываются корой надпочечников и играют ключевую роль в регуляции гомеостаза глюкозы и метаболизма питательных веществ. Синтетические ГК, например, дексаметазон и преднизолон, применяются в медицинской практике в качестве противовоспалительных, противоаллергических препаратов, а также в качестве иммуносупрессантов [1]. Несмотря на широкое назначение этих препаратов при различных патологических состояниях, они могут вызывать выраженные побочные метаболические эффекты, включая периферическую инсулинорезистентность (ИР) и нарушение толерантности к глюкозе (НТГ), а также явную гипергликемию и сахарный диабет (СД) [2][3]. Способность ГК вызывать ИР периферических тканей является основным объяснением их влияния на гомеостаз глюкозы [4]. Широко известно, что любое снижение чувствительности к инсулину периферических тканей, например, при введении ГК, вызывает компенсаторное адаптивное повышение функции β-клеток поджелудочной железы [5]. В случае, если β-клетки не могут приспособиться к повышению потребности в инсулине, вызванному лечением ГК, возможно возникновение постпрандиальной и/или тощаковой гипергликемии. Степень выраженности и прогрессирование указанных изменений зависят от нескольких параметров, включая дозу препаратов, период введения и индивидуальную переносимость [6][7]. Помимо компенсаторной реакции островковых клеток на возникновение ИР, ГК способны напрямую влиять на функцию β -клеток, что может еще более усложнять регуляцию гликемии. Помимо влияния на образование инсулина, стероидные гормоны могут также менять секрецию других гормонов островковых клеток, таких как глюкагон, соматостатин и амилин, играющих важную роль в поддержании гомеостаза глюкозы. Все эти изменения секреции гормонов островковых клеток могут способствовать диабетогенному действию ГК. Валидизированным методом оценки ИР является оценка гомеостатической модели (HOMA). Однако данные по эффективности данного индекса противоречивы, в связи с тем, что у некоторых пациентов его валидность ограничена, особенно при низком ИМТ, снижении функции β—клеток и высоком уровне глюкозы крови натощак [8]. Помимо данного индекса используют показатель С—пептид, который, в отличие от инсулина, не подвергается значимому клиренсу в печени, и при физиологическом и супрафизиологическом уровне С— пептида наблюдается линейная кинетика [9][10]. Таким образом, было сделано предположение, что периферический уровень С-пептида лучше отражает секрецию инсулина поджелудочной железой, чем собственно периферический уровень инсулина.
Цель исследования - оценка диагностической ценности показателей С-пептида и модифицированных индексов HOMA при нарушениях углеводного обмена (НУО) на фоне терапии глюкокортикоидами в разных режимах введения.
Материалы и методы
На базе кафедры госпитальной терапии ФГБОУ ВО «Казанский государственный медицинский университет» Министерства здравоохранения РФ проведено исследование с участием 193 пациентов с диагнозом системная красная волчанка (СКВ), системный васкулит (СВ) и хронический гломерулонефрит (ХГН), из которых 98 человек получали ПТ ГК (в/в кап. введение 10-15 мг/кг преднизолона в сутки на 250 мл 0,9%-го физиологического раствора, 3 дня подряд (1 серия в 3 сеанса); курсовая доза составляла 1800-3000 мг., а 95 - терапию ГК per os в дозировке 7,5-25 мг/сут.
Критерии включения в исследование: пациенты с установленным диагнозом СКВ, СВ, ХГН с наличием показаний к назначению пульс-терапии ГК и находящиеся на поддерживающей терапии ГК внутрь более 3-х месяцев в дозах от 7,5 до 25 мг/сут; возраст старше 18 лет; наличие информированного согласия на включение в исследование; нормогликемия натощак (уровень глюкозы капиллярной крови от 3,5 до 5,5 ммоль/л).
Критерии исключения из исследования: беременность и лактация; алкогольная и наркотическая зависимости; наличие злокачественного новообразования любой локализации, острого нарушения мозгового кровообращения, инфаркта миокарда, инфекционных заболеваний и/или тяжелых сопутствующих заболеваний; сахарный диабет; гликемия натощак более 5,5 ммоль/л; отказ от подписания информированного согласия.
Все больные проходили стандартное клиническое обследование (сбор жалоб, анамнеза, физическое обследование, оценка антропометрических показателей - массы тела, рост, индекса массы тела (ИМТ) (индекс Кетле = масса тела (кг/рост м2), 18,5-24,9 - нормальная масса тела; 25-29,9 - избыточная масса тела; 30-34,9 - ожирение 1 степени; 35-39,9 - ожирение 2 степени; 40-44,5 - ожирение 3 степени). Состояние печени определяли с помощью УЗИ и маркеров цитолиза. Характеристика обследуемых пациентов представлена в табл. 1.
Таблица/ Table 1.
Клиническая характеристика обследуемых больных
Patient clinical characteristics
| Группа ПТ ГК (n=98) Steroid pulse therapy group (n=98) | Группа терапии ГК per os (n=95) Per os therapy group (n=95) | ||||
|---|---|---|---|---|---|---|
| СКВ (31) | ХГН (46) | СВ (12) | СКВ (32) | ХГН (30) | СВ (33) |
Возраст (лет) Age (years) | 36,03±11,65 | 39,5±15,78 | 52,48±10,04 | 34,75±9,87 | 37,2±14,12 | 49,87±11,52 |
Мужчины Men | 11 (35,5%) | 26 (56,5%) | 10 (47,6%) | 13 (40,6%) | 14 (46,7%) | 15 (45,5%) |
Женщины Women | 20 (64,5%) | 20 (43,5%) | 11 (52,4%) | 19 (59,4%) | 16 (53,3%) | 18 (54,5%) |
Длительность заболевания Duration of a disease | 3,87±2,16 | 2,51±1,78 | 2,60±1,39 | 4,12±3,69 | 2,12±2,08 | 3,04±1,87 |
Сопутствующая патология/ Comorbidity | ||||||
ГБ 1 ст. Hypertensive disease 1 st. | 4 (12,9%) | 8 (17,4%) | 1 (4,8%) | 1 (3,1%) | 2 (6,7%) | 3 (9,1%) |
ГБ 2 ст. Hypertensive disease 2 st. | 11 (35,5%) | 18 (39,1%) | 16 (76,2%) | 11 (34,4%) | 13 (43,3%) | 18 (54,5%) |
ГБ 3 ст. Hypertensive disease 3 st. | 6 (19,4%) | 5 (10,9%) | 4 (19,0%) | 10 (31,3%) | 8 (26,7%) | 11 (33,3%) |
Стеатогепатоз Steatohepatosis | 5 (16,1%) | 8 (17,4%) | 4 (19,0%) | 11 (34,4%) | 12 (40,0%) | 16 (48,5%) |
ЖКБ Cholelithiasis | 5 (16,1%) | 6 (13,0%) | — | 3 (9,4%) | 4 (13,3%) | 2 (6,1%) |
Индекс массы тела/ Body mass index | ||||||
Норма | 18 (58,1%) | 25 (54,3%) | 13 (61,9%) | 16 (50,0%) | 15 (50,0%) | 18 (54,5%) |
Избыточная масса тела Overweight | 7 (22,6%) | 11 (23,9%) | 6 (28,5%) | 5 (15,6%) | 6 (20,0%) | 7 (21,2%) |
Ожирение 1 степени Obesity Class I | 3 (9,7%) | 6 (13,1%) | 1 (4,8%) | 3 (9,4%) | 4 (13,3%) | 5 (15,2%) |
Ожирение 2 степени Obesity Class II | 2 (6,5%) | 3 (6,5%) | 1 (4,8%) | 3 (9,4%) | 2 (6,7%) | 1 (3,0%) |
Ожирение 3 степени Obesity Class III | 1 (3,1%) | 1 (2,2%) | — | 3 (9,4%) | 4 (13,3%) | 3 (9,1%) |
Примечание: ГБ — гипертоническая болезнь; ЖКБ — желчекаменная болезнь.
Note: SLE — systemic lupus erythematosus; CG — chronic glomerulonephritis; SA - systemic angiitis.
Все пациентам был проведен пероральный глюкозо толерантный тест (ПГТТ): пациентам, получающим ПТ ГК, - через 72 часа после завершения курса и пациентам, получающим терапию ГК per os, - натощак во время пребывания в стационаре. Нормальным результатом считали концентрацию глюкозы менее 7,8 ммоль/л через два часа после приема 75г глюкозы. Состояние, при котором у пациентов выявлялся нормальный результат ПГТТ (менее 7,8 ммоль/л), но был исходно повышенный уровень гликемии натощак до начала проведения теста (5,5 до 6,1 ммоль/л), расценивалось как нарушенная гликемия натощак (НГН). При концентрации глюкозы 7,8-11,1 ммоль/л результат расценивали как нарушение толерантности к глюкозе (НТГ). Показатели гликемии считались диабетическими, если концентрация глюкозы была более 11,1 ммоль/л через два часа после проведения теста.
Всем пациентам проводилось вычисление индекса инсулинорезистентности HOMA-IR и функции β-клеток (HOMA-islet) с использованием формулы, предложенной X. Li с соавт. (2004):
Homa-IR = 1,5 + глюкоза крови натощак (ммоль/л) x уровень С-пептида натощак (пмоль/л) /2800 |
HOMA-islet = 0,27 x уровень С-пептида натощак (пмоль/л)/(глюкоза крови натощак (ммоль/л) - 3,5) + 50 |
Исследование проведено в соответствие с международными стандартами GCP.
Статистическая обработка материалов исследования проведена с использованием программного обеспечения SPSS 15.0., Statistica 8.0 for Windows (StatSoft Inc., США) с вычислением средних значений, стандартного отклонения от среднего. При анализе межгрупповых различий применяли критерий Вилкоксона, критерий Манна-Уитни, критерий χ2. Для определения диагностической ценности показателей был проведен ROC-анализ с определением точки отсечения чувствительности, специфичности и расчета площади под кривой (AUC). Значение вероятности р<0,05 демонстрировало статистическую достоверность.
Результаты исследования
Оценка частоты развития НУО показала, что в группе пациентов, получающих ПТ ГК, они развивались статистически значимо реже, чем при длительном приеме ГК per os (р=0,035). В группе пациентов, получающих терапию ГК per os, все варианты нарушений углеводного обмена встречались чаще по сравнению с пациентами, получающими ПТ ГК: НТГ, р=0,038, и СД, p=0,049. НГН, р=0,069, при условии, что длительная терапия проводилась в дозах более 20 мг в сутки (рис. 1).
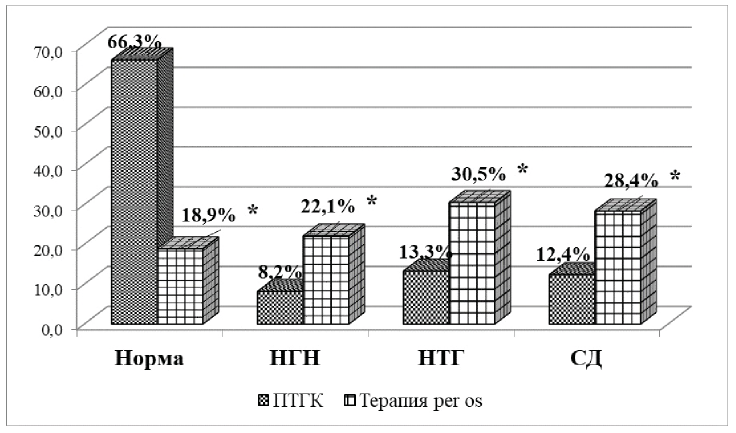
*— p<0,05 (критерий Манна—Уитни, сравнение режимов ГК)
Рисунок 1. Нарушения углеводного обмена у обследуемых больных
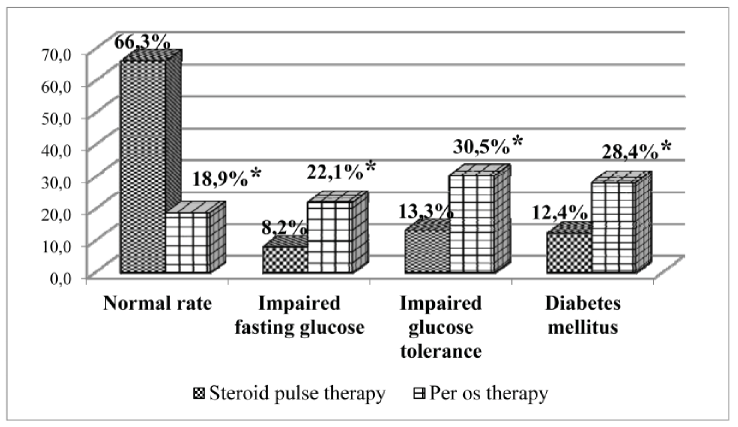
*— p<0.05 (Mann—Whitney test, GC therapy regimen comparison)
Fig. 1. Carbohydrate metabolism disorders in evaluated patients
Максимальный уровень глюкозы крови при проведении сеанса пульс терапии ГК был выше у пациентов с НТГ (15,3 ммоль/л [13,6; 17,3]) и СД (17,7 ммоль/л [13,0; 18,4]), по сравнению с пациентами с НГН (11,1 ммоль/л [9,7; 11,6]) и при отсутствии нарушений углеводного обмена (9,4 ммоль/л [8,3; 10,5]) и обычно регистрировался в диапазоне 4-6 часов после сеанса ПТ ГК.
У всех пациентов наблюдалось достоверное повышение уровня С-пептида и индекса HOMA-IR на пике гликемии, то есть в диапазоне 4-6 часов после сеанса ПТ ГК (р <0,05). Однако в группах с НУО нормализации индекса HOMA-IR после ПТ ГК не происходило, что говорит о формировании более выраженной ИР у данной категории больных. Кроме того, достоверно значимое снижение индекса HOMA—islet на пике гликемии наблюдалось только в группе пациентов с диабетическими цифрами гликемии после ПГТТ, проведенном после ПТ ГК (р <0,05). Снижение индекса HOMA-islet отражает нарушение общей функциональной активности β-клеток у пациентов с СД (рис. 2).
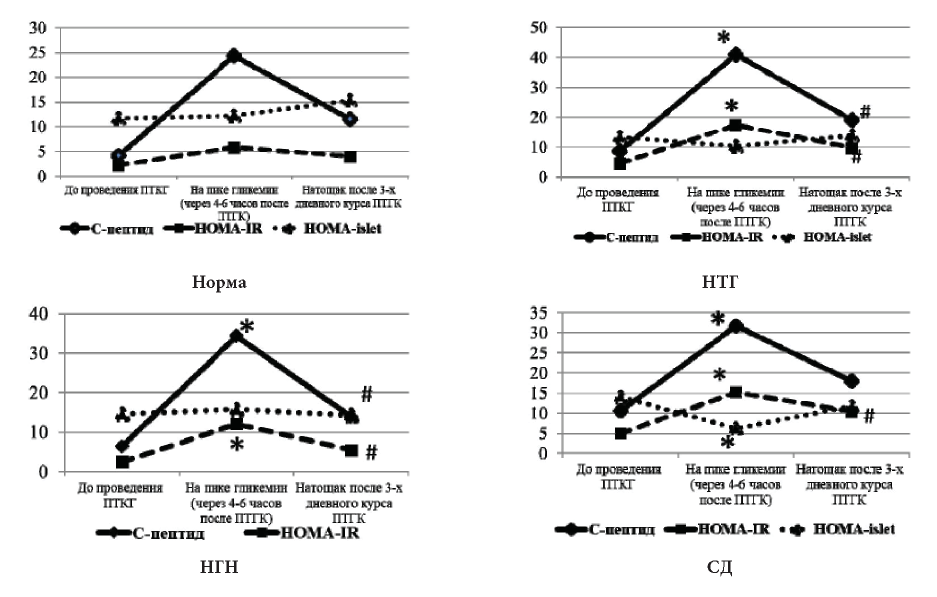
Рисунок 2. Показатели С-пептида, индексов HOMA у пациентов с различными нарушениями углеводного обмена.
Примечание: показатели адаптированы для совместного размещения на графике
*— p<0,05 — различия до ПТ ГК и на пике гликемии;
# — p<0,05 — различия между до и после ПТ ГК.
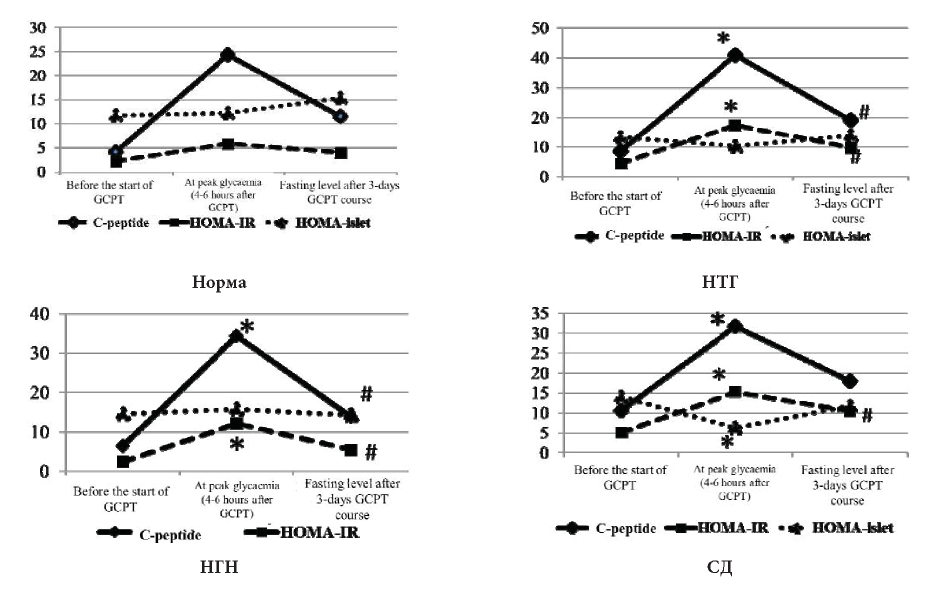
Fig. 2. C-peptide values and HOMA-indexes in patients with different carbohydrate metabolism disorders.
Note: figures are adapted for combined data presentation on the same figure
*— p<0,05 — difference before GCPT and at peak glycaemia
# — p<0,05 — difference before and after GCPT.
Уровень С—пептида и модифицированного индекса HOMA-IR у пациентов с диабетическими цифрами гликемии, по результатам перорального глюкозотолерантного теста, проведенного после ПТ ГК, был выше по сравнению с остальными группами во всех исследуемых точках: до (1052,58 при СД и 450,44 при отсутствии НУО), после ПТ ГК (1822,16 при СД и 1201,88 при отсутствии НУО) (р<0,05). На пике гликемии у пациентов с НТГ С-пептид был также выше, чем у пациентов без НУО (р <0,05) (4099,44 и 2332,85 соответственно).
Другая картина наблюдалась при анализе модифицированного индекса HOMA-islet. У пациентов без нарушений углеводного обмена индекс HOMA-islet показал повышение на пике гликемии при проведении сеанса пульс терапии ГК, что свидетельствует о хорошем секреторном ответе β—клеток на инфузию глюкокортикоидов, и снижение после трёхдневного курса ПТ ГК. У пациентов с нарушенной функцией β-клеток (НТГ и СД) наблюдалось снижение индекса HOMA-islet на пике гликемии после инфузии ГК (103,35 и 64,60). При этом после курса ПТ ГК у пациентов с СД отсутствовало возвращение индекса HOMA-islet к нормальным значениям (рис. 3).
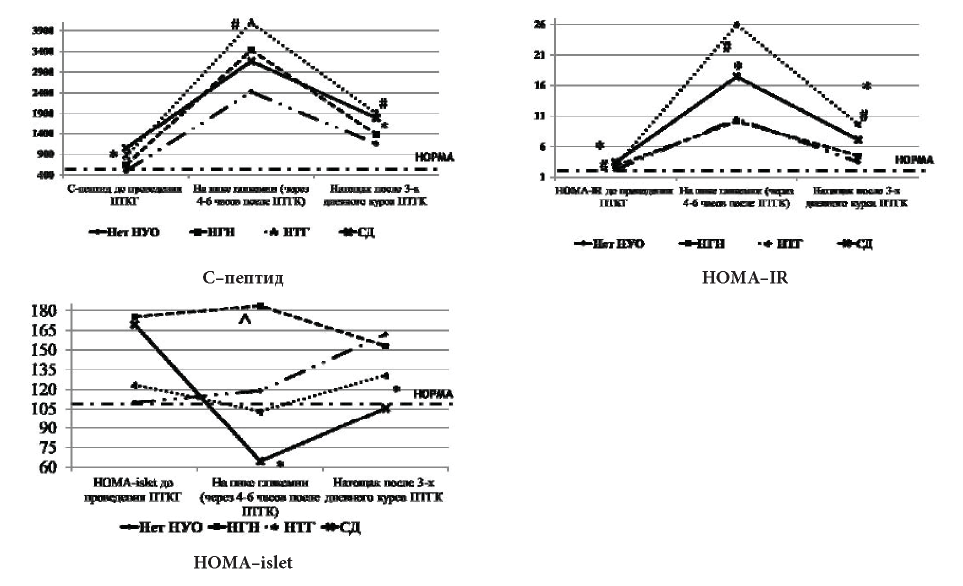
Рисунок 3. Значения С-пептида и индексов HOMA у пациентов, получающих ПТ ГК
* — p<0,05 — различия между группами СД и нет нарушений углеводного обмена;
# — p<0,05 — различия между группами НТГ и нет нарушений углеводного обмена;
^ — p<0,05 — различия между группами НГН и НТГ и СД.
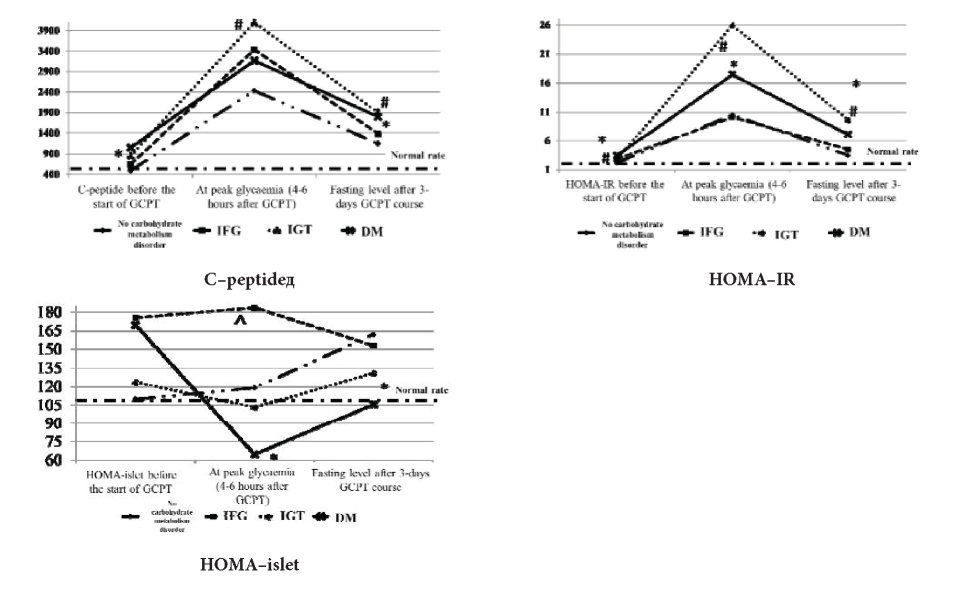
Fig. 3. C-peptide values and HOMA-indexes in patients receiving GCPR
* — p<0,05 — difference between groups with DM and normal carbohydrate metabolism;
# — p<0,05 — difference between groups with IGT and normal carbohydrate metabolism;
^ — p<0,05 — difference between groups with IFG, IGT and DM
Анализ диагностической ценности определения С-пептида в качестве маркера нарушения углеводного обмена методом ROC-анализа определило пороговое значение 1049,27, для которого были определены чувствительность — 91,83%, специфичность - 89,83% и площадь под кривой (AUC) - 0,916. Для HOMA-IR пороговым было выбрано значение 3,49, для которого чувствительность составила 90,67%, специфичность - 87,64% и AUC - 0,885. Для HOMA-islet пороговым оказалось значение 167,58, для которого чувствительность составила 83,33%, специфичность - 73,61% и AUC - 0,745.
Исходно в группе пациентов, получающих длительную терапию per os, определялся более высокий уровень С-пептида как до, так и после проведения ПГТТ у лиц с НГН, НТГ, СД, по сравнению с группой без НУО (р <0,05). Вместе с увеличением С-пептида отмечался достоверный прирост расчетного показателя НОМА-IR, по сравнению с группой нормы по ПГТТ во всех группах с нарушениями углеводного обмена (р <0,05). Индекс HOMA-islet у пациентов с НТГ и СД был выше после проведения ПГТТ, чем в группах пациентов с отсутствием нарушений углеводного обмена и НГН (р <0,05) (рис. 4).
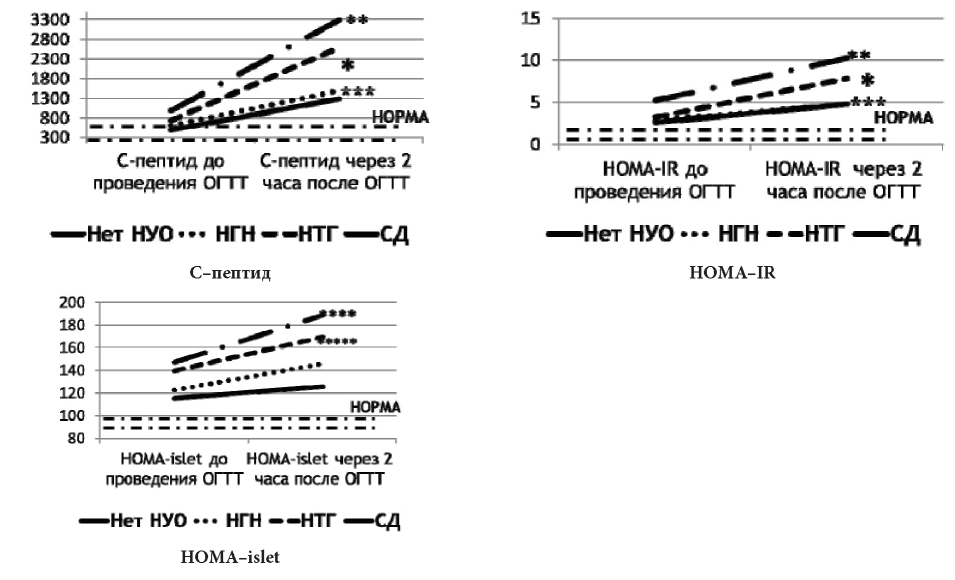
Рисунок 4. Значение С-пептида и индексов HOMA у пациентов, получающих терапию per os
* - p<0,05 - различия между группами НТГ и нет НУО;
** - p<0,05 - различия между группами СД и нет НУО;
*** - p<0,05 - различия между группами НГН и нет НУО;
**** - p<0,05 - различия между группами СД и нет НУО, НГН;
***** - p<0,05 - различия между группами НТГ и нет НУО, НГН..
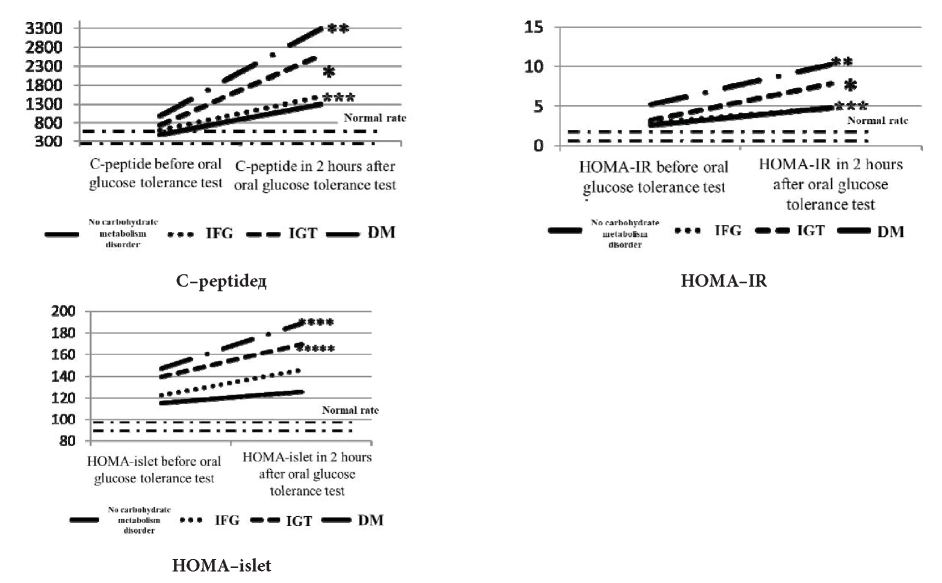
Fig. 4. C-peptide values and HOMA-index in patients on oral GC therapy
* - p<0,05 — difference between groups with IGT and normal carbohydrate metabolism;
** - p<0,05 — difference between groups with DM and normal carbohydrate metabolism;
*** - p<0,05 — difference between groups with IFG and normal carbohydrate metabolism;
**** - p<0,05 — difference between groups with DM, normal carbohydrate metabolism and IFG;
***** - p<0,05 — difference between groups with IGT, normal carbohydrate metabolism and IFG..
Анализ диагностической ценности определения С-пептида в качестве маркера нарушения углеводного обмена методом ROC-анализа выявил пороговое значение 1245,96, для которого были определены чувствительность - 91,57%, специфичность - 88,63% и площадь под кривой - 0,908. Для HOMA-IR пороговым было выбрано значение 4,13, для которого чувствительность составила 92,63%, специфичность - 87,96% и AUC - 0,898. Для HOMA-islet пороговым оказалось значение 167,58, для которого чувствительность составила 91,67%, специфичность - 75,34% и AUC - 0,836.
Обсуждение
Диабетогенный эффект ГК ограничивает их клиническое применение, особенно у лиц с факторами риска СД. Побочные эффекты ГК включают неблагоприятное влияние на периферические ткани, включая скелетные мышцы, печень, костную и жировую ткань, которое преимущественно выражается в снижении чувствительности к инсулину, что приводит к повышению потребности в нем [11][12]. В ответ на вызванную введением ГК инсулинорезистентность эндокринная часть поджелудочной железы реагирует компенсаторным изменением функции и массы β-клеток, что приводит к гиперинсулинемии и стимулированному выбросу инсулина для поддержания нормогликемии [13].
В проведенном исследовании показано, что именно длительное применение ГК в средних дозах (15-25 мг/ сут), а не пульс-терапия сверхдозами ГК способствует большей частоте развития НУО (в особенности СД и НТГ). У пациентов с СКВ, СВ и ХГН выявление высоконормальных значений С-пептида, а также увеличенных показателей индексов HOMA-IR и HOMA-islet в сочетании с высоконормальными значениями гликемии натощак до проведения ПТ ГК свидетельствует о высокой вероятности развития нарушений углеводного обмена. Выявление снижения индекса НОМА-islet на пике гликемии и неполного его восстановления после ПТ ГК в группе пациентов с диабетическими цифрами гликемии отражает снижение общей функциональной активности β-клеток поджелудочной железы. При длительной перо- ральной терапии ГК основным механизмом нарушений углеводного обмена является инсулинорезистентность, которая определяется достоверным приростом расчетного показателя НОМА-IR до и после проведения ПГТТ.
Показано, что вычисленные параметры имеют достаточно высокий уровень чувствительности, что позволяет рекомендовать применение данных параметров для скрининга больных с нарушениями углеводного обмена и выявления СД на фоне терапии ГК у пациентов с заболеваниями иммуновоспалительного генеза.
Заключение
Определение только уровня гликемии, который был нормальным у всех пациентов, включенных в исследование, и уровня С-пептида недостаточно для оценки состояния углеводного обмена у больных до начала ПТ ГК и длительной per os терапии. В связи с чем можно рекомендовать проведение оценки индекса НОМА-IR, НОМА-islet пациентам до начала интенсивной терапии ГК, а также на фоне per os терапии, что даст возможность прогнозирования у пациентов с заболеваниями иммуновоспалительного генеза развития нарушений углеводного обмена, в частности СД.
Список литературы
1. Решетняк Т.М., Середавкина Н.В., Дыдыкина И.С., Насонов Е.Л. // Глюкокортикоиды в терапии системной красной волчанки. Клиницист. - 2013. - № 3-4. - С. 14-26.
2. Lupi I, Cosottini M, Caturegli P, Manetti L, Urbani C, Cappellani D et al. Diabetes insipidus is an unfavorable prognostic factor for response to glucocorticoids in patients with autoimmune hypophysitis. Eur J Endocrinol. 2017; 177(2):127-135. doi: 10.1530/EJE-17-0123.
3. Suh S, Park MK. Glucocorticoid-Induced Diabetes Mellitus: An Important but Overlooked Problem. Endocrinol Metab (Seoul). 2017; 32(2):180-189. doi: 10.3803/EnM.2017.32.2.180.
4. Румянцева С.А., Силина Е.В., Орлова А.С., Орлов В.А., Болевич С.Б. Гипергликемия и свободнорадикальный дисбаланс как прогностические маркеры острого нарушения мозгового кровообращения. // Анналы клинической и экспериментальной неврологии. - 2012. - Т. 6. № 4. - С. 26-29.
5. Martínez BB, Pereira AC, Muzetti JH, Telles FP, Mundim FG, Teixeira MA. Experimental model of glucocorticoid-induced insulin resistance. Acta Cir Bras. 2016; 31(10):645-649. doi: 10.1590/S0102-865020160100000001.
6. Кондратьева Л.В., Панафидина Т.А., Герасимова Е.В., Горбунова Ю.Н., Попкова Т.В., Насонов Е.Л. Сахарный диабет и гипергликемия у больных ревматоидным артритом. // Современная ревматология. - 2014. - № 3. - С. 23-27. doi.org/10.14412/1996-7012-2014-3-23-27.
7. JensenDH, Aaboe K, Henriksen JE, Vølund A, Holst JJ, Madsbad S et al. Steroid-induced insulin resistance and impaired glucose tolerance are both associated with progressive decline of incretin effect in firstdegree relatives of patients with type 2 diabetes. Diabetologia. 2012;55(5):1406-16. doi: 10.1007/s00125-012-2459-7.
8. Ha CH, Swearingin B, Jeon YK. Relationship of visfatin level to pancreatic endocrine hormone level, HOMA-IR index, and HOMA β-cell index in overweight women who performed hydraulic resistance exercise. J Phys Ther Sci. 2015; 27(9):2965-9. doi: 10.1589/jpts.27.2965.
9. Tuzun S, Oner C, Dabak MR, Kasikci HO, Sargin M. Relation of Muscle Indices with Metabolic Parameters and C-Peptide in Type 2 Diabetes Mellitus. J Coll Physicians Surg Pak. 2017; 27(11):673-677. doi: 2740.
10. Leighton E, Sainsbury CA, Jones GC. A Practical Review of C-Peptide Testing in Diabetes. Diabetes Ther. 2017; 8 (3):475-487. doi: 10.1007/s13300-017-0265-4.
11. Caplan A, Fett N, Rosenbach M, Werth VP, Micheletti RG. Prevention and management of glucocorticoid-induced side effects: A comprehensive review: Ocular, cardiovascular, muscular, and psychiatric side effects and issues unique to pediatric patients. J Am Acad Dermatol. 2017;76(2):201-207. doi: 10.1016/j.jaad.2016.02.1241.
12. Oray M, Abu Samra K, Ebrahimiadib N, Meese H, Foster CS. Long-term side effects of glucocorticoids. Expert Opin Drug Saf. 2016; 15 (4):457-65. doi: 10.1517/14740338.2016.1140743.
13. Movahedi M, Beauchamp ME, Abrahamowicz M, Ray DW, Michaud K, Pedro S et al. Risk of Incident Diabetes Mellitus Associated With the Dosage and Duration of Oral Glucocorticoid Therapy in Patients With Rheumatoid Arthritis. Arthritis Rheumatol. 2016; 68 (5):1089-98. doi: 10.1002/art.39537.
Об авторах
Ф. В. ВалееваРоссия
д.м.н., проф., заведую- щая кафедрой эндокринологии
Г. И. Нуруллина
Россия
ассистент кафедры госпитальной терапии
Рецензия
Для цитирования:
Валеева Ф.В., Нуруллина Г.И. Диагностическая ценность С–пептида и модифицированных индексов HOMA при различных нарушениях углеводного обмена на фоне терапии глюкокортикоидами. Медицинский вестник Юга России. 2018;9(1):23-31. https://doi.org/10.21886/2219-8075-2018-9-1-23-31
For citation:
Valeeva F.V., Nurullina G.I. С–peptide and modifi ed HOMA–index in different carbohydrate metabolism disturbances during glucocorticoid therapy. Medical Herald of the South of Russia. 2018;9(1):23-31. (In Russ.) https://doi.org/10.21886/2219-8075-2018-9-1-23-31







































