Перейти к:
Функциональное состояние щитовидной железы новорожденных от матерей с диффузным токсическим зобом
https://doi.org/10.21886/2219-8075-2019-10-3-24-31
Аннотация
Цель: изучить функциональное состояние щитовидной железы (ЩЖ) у новорожденных от матерей с диффузным токсическим зобом (ДТЗ), в зависимости от уровня антител к рецепторам тиреотропного гормона (АТ-рТТГ).
Материалы и методы. Обследовано 68 новорожденных от 67 матерей с ДТЗ. В группу контроля вошли 49 новорожденных от 49 матерей без патологии ЩЖ. Для оценки функционального состояния ЩЖ новорожденных определяли уровни тиреотропного гормона (ТТГ), свободного тироксина (свТ4), АТ-рТТГ в пуповинной крови и высчитывали коэффициент ТТГ/свТ4, который позволяет дифференцировать врожденный гипотиреоз от неонатального тиреотоксикоза. На 4-7-ой день жизни всем новорожденным проводилось ультразвуковое исследование (УЗИ) ЩЖ.
Результаты. Новорожденные от матерей с ДТЗ имели более низкие росто-весовые показатели по сравнению с аналогичными показателями контрольной группы и у них чаще наблюдалась гиперплазия ЩЖ. Показано, что повышенное содержание АТ-рТТГ в сыворотке крови беременных женщин с ДТЗ и в пуповинной крови новорожденных может способствовать развитию неонатального тиреотоксикоза, выявленного у 16,2% новорожденных.
Выводы: повышенные уровни АТ-рТТГ в сыворотке крови матерей с ДТЗ, особенно во второй половине беременности, и в пуповинной крови новорожденных оказывают влияние на формирование гиперплазии ЩЖ новорожденных и способствуют развитию неонатального тиреотоксикоза.
Ключевые слова
Для цитирования:
Ворохобина Н.В., Ловкова Ю.С., Кузнецова А.В., Ковалева Ю.В., Баранов В.Л. Функциональное состояние щитовидной железы новорожденных от матерей с диффузным токсическим зобом. Медицинский вестник Юга России. 2019;10(3):24-31. https://doi.org/10.21886/2219-8075-2019-10-3-24-31
For citation:
Vorokhobina N.V., Lovkova Y.S., Kuznetsova A.V., Kovalyova Yu.V., Baranov V.L. Functional condition of the thyroid gland of newborns from methers with a diffuse toxic goiter. Medical Herald of the South of Russia. 2019;10(3):24-31. (In Russ.) https://doi.org/10.21886/2219-8075-2019-10-3-24-31
Введение
Тиреоидные гормоны обеспечивают нормальный рост и развитие плода, дифференцировку его тканей и органов, в первую очередь, морфологическое и функциональное развитие центральной нервной системы, а также регуляцию метаболических процессов. Нормальное содержание гормонов щитовидной железы (ЩЖ) в крови обеспечивает физиологическую адаптацию к процессу родов и к изменениям температурных условий окружающей среды после рождения [1][2].
Дисфункция ЩЖ у женщины во время беременности негативно сказывается на её функциональном состоянии, а также на развитии плода и новорожденного [3]. Тиреотоксикоз — синдром, обусловленный избыточным содержанием тиреоидных гормонов в крови и их токсическим действием на различные органы и ткани. Наиболее частой причиной тиреотоксикоза при беременности является диффузный токсический зоб (ДТЗ), специфическими маркерами которого являются тиреостимулирующие АТ-рТТГ [4][5]. У детей, рожденных от матерей с ДТЗ, возрастает риск аномалий развития. Лечение ДТЗ тиреостатиками во время беременности приводит к повышению частоты врожденного гипотиреоза. Антенатально гипотиреоз проявляется задержкой внутриутробного развития и брадикардией. После рождения обращают на себя внимание сонливость, гипотония, вялое сосание, пупочная грыжа, сухость и иктеричность кожных покровов. В более позднем возрасте без соответствующей коррекции и наблюдения существует риск задержки физического и психомоторного развития [6][7][8].
Весьма актуален, но мало изучен вопрос о влиянии АТ-рТТГ на функциональное состояние ЩЖ плода и новорожденного. Согласно исследованиям последних лет, тиреостимулирующие АТ-рТТГ, легко преодолевающие плацентарный барьер, у 2—3 % новорожденных от матерей с ДТЗ могут способствовать возникновению внутриутробного и неонатального тиреотоксикоза, а также формированию зоба. Его клиническая картина разворачивается через несколько дней после рождения. Внутриутробно сформировавшаяся гипотрофия с постнатально прогрессирующей потерей веса, тахикардия, тремор, офтальмопатия, преждевременный краниостеноз определяют тяжесть состояния новорожденного. В свою очередь тяжесть и продолжительность тиреотоксикоза обусловлена уровнем материнских АТ-рТТГ, продолжающих циркулировать в кровотоке ребенка. Обычно легкие его формы устраняется самостоятельно через 2-6 месяцев после исчезновения из кровотока ребенка материнских иммуноглобулинов или на фоне приема женщиной в период лактации терапевтической дозы тиреостатических препаратов. Тяжелые формы, сопровождающиеся аритмией и сердечной недостаточностью, могут приводить к летальному исходу, поэтому требуют применение тиреостатиков непосредственно у новорожденных в расчете на их массу тела [9][10][11].
Цель исследования — определить объем и функциональное состояние ЩЖ у новорожденных от матерей с ДТЗ, в зависимости от уровня АТ-рТТГ в сыворотке крови.
Материалы и методы
Работа имеет вид сравнительного открытого проспективного исследования, которое проведено в соответствие с международными стандартами GCP.
Обследованы 117 новорожденных, которые были разделены на две группы. Основную группу составили 68 детей от 67 матерей с ДТЗ (62 доношенных ребенка, среди них одна двойня, и 6 недоношенных детей, родившихся при сроке 34—36 недель беременности). В контрольную группу вошли 49 доношенных детей от 49 матерей без патологии ЩЖ.
У всех пациенток с ДТЗ во время беременности проводилась тиреостатическая терапия: 40 женщин принимали производные имидазола (ПИ) (мерказолил, тирозол), 31 женщина получала производные пропилтоурацила (ПТУ) (пропилтиоурацил, пропицил). 4 женщины с ДТЗ выбыли из исследования (самопроизвольное прерывание беременности при сроке 18-21 неделя), но продолжали получать тиреостатическую терапию
Стартовая лечебная доза ПИ, принятая как терапевтическая, составила 20 мг/сутки. В качестве лечебной (терапевтической) дозы ПТУ использовали 100-200 мг/ сутки. После устранения основных симптомов тиреотоксикоза антитиреоидная терапия либо полностью отменялась, либо был рекомендован прием тиреостатиков в поддерживающих дозах: ПИ — 5 мг/сутки, ПТУ — 50 мг/сутки.
В зависимости от применяемых режимов тиреостатической терапии и характера течения ДТЗ беременные женщины были разделены на три подгруппы.
Пациентки первой подгруппы (n=17) получали тиреостатическую терапию в течение 6—10 недель до достижения стойкого эутиреоза с ремиссией ДТЗ до родов без рецидивов тиреотоксикоза. У беременных второй подгруппы (n=15) тиреостатическая терапия продолжалась в течение всего срока беременности в связи с риском рецидива тиреотоксикоза из-за высокого уровня АТ-рТТГ. Пациенткам третьей подгруппы (n=35) проводилась антитиреоидная терапия, включающая прием тиреостатиков в терапевтических дозах в начале лечения с постепенным их снижением до полной отмены на основании нормализации клинических и гормональных показателей. Однако после достижения эутиреоза на фоне отмены терапии у этих женщин были отмечены рецидивы тиреотоксикоза.
Всем новорожденным детям на 4—7-й день жизни осуществлялось УЗИ ЩЖ на аппарате Voluson 730, Expert GE. Измерение долей ЩЖ проводили при продольном и поперечном сканировании, объем ЩЖ рассчитывали по формуле J.Brunn [12]. Содержание в пуповинной крови новорожденных свТ4, ТТГ и АТ-рТТГ определяли имму- ноферментным методом с использованием стандартных наборов фирмы «Алкор-Био» (Россия) и «DRG diagnostics» (Германия).
Референсные интервалы формировались на основании данных контрольной группы. Для уровня свТ4 в сыворотке крови они находились в интервале от 10,5 до 20,4 пмоль/л, для уровня ТТГ - от 0,7 до 2,1 мМЕ/л. Границей нормы для АТ-рТТГ считали уровень <1,1 МЕ/л.
Провести точную оценку функционального состояния ЩЖ новорожденного позволяет определение отношения уровня ТТГ к уровню свТ4 в пуповинной крови (ТТГ/свТ4). Данный коэффициент разработан в отделе эндокринологии репродукции НИИ акушерства, гинекологии и репродуктологии им. Д.О. Отта. Показано, что у новорожденных от матерей без патологии ЩЖ его значения находятся в пределах от 0,27 до 0,72. Значения коэффициента ТТГ/свТ4 вне указанных пределов свидетельствовали о наличии у новорожденного гипертиреоза или гипотиреоза соответственно [13].
Статистический анализ полученных результатов проводили, применяя стандартные пакеты прикладных программ STATISTICA for WINDOWS (версия 7). Проверку гипотезы о равенстве двух средних проводили с помощью t-критерия Стьюдента. Для углубленной оценки риска события, определения диагностической ценности показателей АТ-рТТГ, а также для исследования характера взаимосвязи между показателями различных групп использовали ROC-анализ, однофакторный дисперсионный анализ (ANOVA) с определением точного критерия
Фишера (ТКФ) и корреляционный анализ. Данные в тексте, в таблицах и на графиках представлены в виде М±SD (где М — средняя арифметическая, SD — среднеквадратичное отклонение). Выводы базировались только на статистически значимых различиях. Достигнутый уровень значимости (p) рассчитывался на всех этапах статистического анализа. Критерием статистической достоверности полученных результатов считали величину p < 0,05 [14].
Результаты
В исследовании проанализировано состояние новорожденных с учётом особенностей течения ДТЗ у обследованных женщин. Более низкие росто-весовые показатели, а также оценка по шкале Апгар отмечены у новорождённых от матерей с ДТЗ третьей подгруппы, имевших рецидивы тиреотоксикоза после отмены тире- остатиков (табл. 1).
Таблица / Table 1
Показатели доношенных новорожденных от матерей, включенных в исследование
Indicators of full-term newborns from mothers included in the study
Показатели Indicators | 1 подгруппа 1st subgroup (n=17) | 2 подгруппа 2st subgroup (n=14) | 3 подгруппа 3st subgroup (n=31) | Контрольная группа Control group (n=49) |
|---|---|---|---|---|
Масса тела, г Body weight, g | 3318,8±111,1 | 3283,3±113,4 | 3049,5±75,1***^ | 3469,2±36,9 |
Длина тела, см Body length, cm | 50,6±0,5 | 51,1±0,6 | 50,2±0,4* | 51,3±0,2 |
Апгар I, балл Apgar I, score | 7,7±0,1* | 7,7±0,1* | 7,6±0,1** | 8,0±0,1 |
Апгар II, балл Apgar II, score | 8,1±0,1 | 7,9±0,1* | 7,9±0,1* | 8,2±0,1 |
Примечание: *p < 0,05, **p < 0,01, ***p < 0,001 относительно показателей новорожденных от матерей контрольной группы; ^p < 0,05 относительно показателей новорожденных от матерей первой подгруппы.
Notes: * p < 0.05, ** p < 0.01, *** p < 0.001 relative to indicators of newborns from mothers of the control group; ^p < 0.05 relative to the performance of newborns from mothers of the 1st subgroup.
В пуповинной крови новорожденных основной группы обнаружен более высокий уровень АТ-рТТГ, по сравнению с тем же показателем в контрольной группе, особенно у детей, рожденных от матерей с рецидивирующим течением ДТЗ (рис. 1).
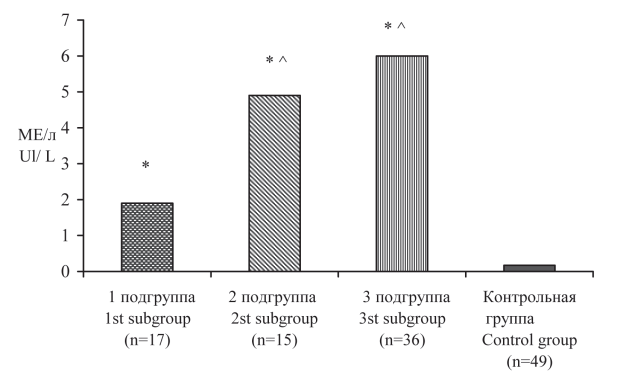
Рисунок 1. Содержание АТ-рТТГ в пуповинной крови новорожденных.
Figure 1. The content of AB-rTSH in the cord blood of newborns.
Примечание: *p < 0,001 относительно показателей новорожденных от матерей контрольной группы; ^р < 0,01 относительно показателей новорожденных от матерей с ДТЗ из 1 подгруппы.
Notes: *p < 0.001 regarding the performance of newborns from mothers of the control group; ^p < 0.01 relative to indicators of newborns from mothers with DTG from 1st subgroup.
Выявлена прямая корреляция между уровнем АТ- рТТГ в сыворотке крови во II триместре беременности (коэффициент корреляции Пирсона (R)=0,28, p <0,025), а также в III триместре беременности (коэффициент корреляции Пирсона (R)=0,623, p <0,0001) и их уровнем в пуповинной крови, что подтверждает высокую проницаемость плацентарного барьера для тиреостимулирующих аутоантител [10].
Размеры ЩЖ всех доношенных новорожденных от матерей с ДТЗ варьировались в пределах от 0,76 см3 до 4,47 см3 и в среднем составили 1,76±0,19см3, что превышало соответствующий показатель новорожденных от матерей контрольной группы (0,55±0,01см3, p<0,001). Установлено, что максимальное увеличение объема ЩЖ имелось у новорожденных от матерей второй подгруппы, которые получали антитиреоидную терапию в минимальных дозах до момента родоразрешения по причине высокого риска рецидива тиреотоксикоза (табл. 2).
Таблица / Table 2
Объем щитовидной железы доношенных детей от всех матерей, включенных в исследование
The volume of the thyroid gland of full-term babies from all mothers included in the study
Подгруппы Subgroups | Объем щитовидной железы (см3) Thyroid volume (cm3) | ТКФ FET |
|---|---|---|
1 подгруппа | 1,28±0,30* | 0,2 |
1st subgroup |
|
|
2 подгруппа | 2,65±0,6***^ | 0,02 |
2st subgroup |
|
|
3 подгруппа | 1,6±0,2*** | 0,04 |
3st subgroup |
|
|
Контрольная группа | 0,55±0,01 | - |
Control group |
|
|
Примечание: *p < 0,05, ***p < 0,001 относительно показателей контрольной группы; ^р < 0,05 относительно показателей первой подгруппы; ТКФ (точный критерий Фишера) — взаимосвязь между приемом тиреостати- ческих препаратов матерями с ДТЗ и размером щитовидной железы их новорожденных.
Notes: *p < 0.05, ***p < 0.001 relative to indicators of the control group; ^p < 0.05 relative to indicators of 1st subgroup; FET (Fisher’s exact test) — the relationship between taking thyreostatic drugs from mothers with DTG and the size of the thyroid gland of their newborns.
У новорожденных от матерей с рецидивирующим течением ДТЗ и с повышенным уровнем АТ-рТТГ в пуповинной крови размеры ЩЖ были больше, чем у новорожденных с нормальными значениями данного показателя. При этом максимальные размер ЩЖ выявлен у детей от матерей второй подгруппы, что может говорить о сочетанном влиянии длительной тиреостатической терапии и трансплацентарного переноса АТ-рТТГ (табл. 3).
Таблица / Table 3
Объем щитовидной железы доношенных новорожденных в подгруппах матерей с ДТЗ в зависимости от уровня АТ-рТТГ в пуповинной крови
The volume of the thyroid gland of full-term newborns in subgroups of mothers with DTG, depending on the level of AB-rTSH in umbilical cord blood
| Объем ЩЖ (см3) новорожденных: Thyroid volume (cm3) of newborns: | ||
|---|---|---|
Уровень АТ-рТТГ в пуповинной крови в подгруппах матерей с ДТЗ: The level of AB-rTSH in cord blood in subgroups of mothers with DTG: | АТ-рТТГ<1,1 МЕ/л AB-rTSH <1.1 IU / L | АТ-рТТГ>1,1 МЕ/л AB-rTSH >1.1 IU / L |
1 подгруппа 1st subgroup | 0,98±0,31 | 1,44±0,43^^ |
2 подгруппа 2st subgroup | 1,61±0,77 | 3,14±0,47* |
3 подгруппа 3st subgroup | 1,28±0,27 | 2,01±0,22* ^ |
Примечание: *p < 0,05 относительно показателя новорожденных с уровнем АТ-рТТГ < 1,1 МЕ/л в пуповинной крови; ^p <0,05, ^^p < 0,01 относительно показателя новорожденных с уровнем АТ-рТТГ>1,1 МЕ/л в пуповинной крови от матерей с ДТЗ второй подгруппы.
Notes: *p < 0.05 relative to the indicator of newborns with the level of AB-rTSH < 1.1 IU / l in umbilical cord blood; ^p < 0.05, ^^p < 0.01 relative to the indicator of newborns with the level of AB-rTSH > 1.1 IU /1 in umbilical cord blood from mothers with DTG 2st subgroups.
Функциональное состояние ЩЖ новорожденных определяли по уровню свТ4 ТТГ в пуповинной крови и коэффициенту ТТГ/свТ4. Наиболее частым (52,9 %) нарушением функционального состояния ЩЖ новорожденных от матерей с ДТЗ был субклинический гипотиреоз (ТТГ/свТ4> 0,72). Он диагностировался только на лабораторном уровне, носил транзиторный характер без клинических проявлений, как при рождении, так и отдаленно, и не потребовал медикаментозной коррекции. Значительное преобладание субклинического гипотиреоза отмечено у новорожденных от матерей из второй подгруппы, которые получали антитиреоидную терапию в постоянном режиме вплоть до родоразрешения. Выявлена прямая положительная связь между длительностью тиреостатической терапии и частотой гипотиреоза у новорожденных.
Неонатальный тиреотоксикоз (ТТГ/свТ4 < 0,27), напрямую связанный с высоким уровнем АТ-рТТГ, был выявлен у 11 детей (16,2 %), рожденных от матерей с ДТЗ. При этом его частота была сопоставима в каждой из подгрупп матерей с ДТЗ. Масса тела новорожденных составила 2932,7±97,5 г и значимо отличалась показателей остальных новорожденных от матерей с ДТЗ (p < 0,05) и новорожденных от матерей без тиреоидной патологии (p < 0,001). Такие клинические проявления тиреотоксикоза, как тахикардия более 200 ударов в минуту, тремор, повышенная нервно-мышечная возбудимость были отмечены лишь у одного новорожденного. Тяжесть состояния данного ребенка повлекла необходимость назначения тиреостатической терапии в дозе 0,5 мг/кг массы тела и перевода в детскую городскую больницу для дальнейшего наблюдения и лечения. Полная нормализация функции ЩЖ была достигнута к четырём месяцам жизни. У остальных новорожденных неонатальный тиреотоксикоз диагностирован только на основании изменения уровня гормонов в пуповинной крови и не сопровождался клиническими проявлениями, что не повлияло на сроки выписки из родильного дома. Обнаружена прямая положительная связь между уровнем АТ-рТТГ в сыворотке крови матерей во второй половине беременности и частотой неонатального тиреотоксикоза (рис. 2).
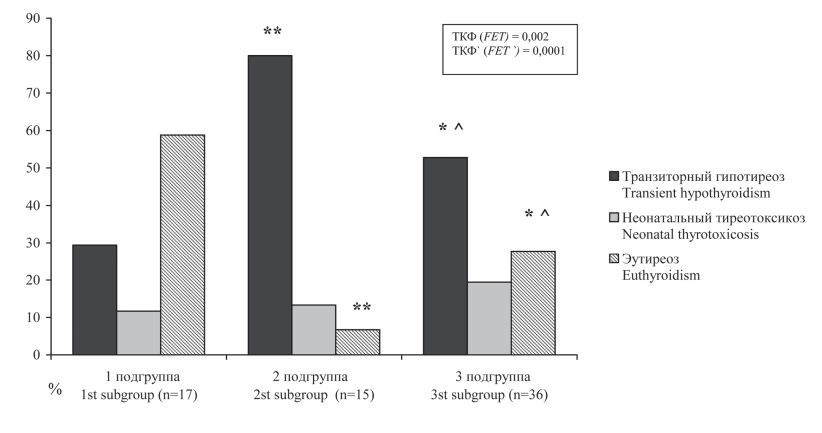
Рисунок 2. Частота нарушения функции ЩЖ новорожденных в подгруппах матерей с ДТЗ.
Figure 2. The frequency of thyroid dysfunction in newborns in subgroups of mothers with DTG.
Примечание: *p < 0,01, **p < 0,001 относительно показателей детей от матерей первой подгруппы; ^p < 0,05, между показателями новорожденных от матерей второй и третьей подгрупп; ТКФ - взаимосвязь длительности тиреостатической терапии у беременных с ДТЗ и частоты транзиторного гипотиреоза у их новорожденных; ТКФ' — взаимосвязь уровня АТ-рТТГ в сыворотке крови матерей с ДТЗ и частоты неонатального тиреотоксикоза у их новорожденных.
Notes: *p < 0.01, **p < 0.001 relative to the indicators of children from mothers of the 1st subgroup; ^p < 0.05, between the rates of newborns from mothers of 2st and 3st subgroups; FET (Fisher’s exact test) — the relationship between the duration of thyreostatic therapy in pregnant women with DTG and the frequency of transient hypothyroidism in their newborns; FET' (Fisher’s exact test) — the relationship between the level of AB-rTSH in the serum of mothers with DTG and the frequency of neonatal thyrotoxicosis in their newborns.
Актуальным является вопрос о степени влияния АТ- рТТГ, проникающих от матери к плоду через плаценту, на функциональное состояние фетальной и неонатальной ЩЖ [9][15][16]. Анализ результатов, представленных в табл. 4, подтвердил высокий риск развития неонатального тиреотоксикоза у новорожденных от матерей с повышенным уровнем АТ-рТТТ в сыворотке крови, сохраняющимся на протяжении всей беременности, независимо от длительности, проводимой тиреостатиче- ской терапии.
Таблица / Table 4.
Уровень АТ-рТТГ в пуповинной крови новорожденных в зависимости от функционального состояния их ЩЖ в подгруппах матерей с ДТЗ
We level of AB-rTSH in cord blood of newborns, depending on the functional state of their thyroid gland in subgroups of mothers with DTG
Подгруппы матерей с ДТЗ Subgroups of mothers with DTG | Уровень АТ-рТТГ в пуповинной крови (МЕ/л) The level of AB-rTSH in cord blood (IU /l) | ||
|---|---|---|---|
Новорожденные от матерей с ДТЗ, имеющие: Newborns from mothers with DTG having: | |||
Транзиторный гипотиреоз Transient hypothyroidism (n=36) | Неонатальный тиреотоксикоз Neonatal thyrotoxicosis (n=11) | Эутиреоз Euthyroidism (n=21) | |
1 подгруппа | 1,9±0,6 | 3,8+1,3 * | 0,9±0,1 |
1st subgroup |
|
|
|
2 подгруппа | 3,4±0,7* | 15,3±0,1***^^^ | 1,4±0,2aa |
2st subgroup |
| ТКФ (FET) = 0,0001 |
|
3 подгруппа | 4,4±0,7 | 17,0±3,3***^^^ | 3,9±1,6 |
3st subgroup |
| ТКФ (FET ') <0,0001 |
|
Примечание: *p < 0,05, ***p < 0,001 относительно показателей новорожденных с эутиреозом; ^^p < 0,01, ^^^p < 0,001 относительно показателей новорожденных с гипотиреозом; ТКФ (точный критерий Фишера) — взаимосвязь уровня АТ-рТТГ и частоты возникновения неонатального тиреотоксикоза.
Notes: *p < 0.05, ***p < 0.001 relative to indicators of newborns with euthyroidism; ^^p < 0.01, ^^^p < 0.001 relative to the performance of newborns with hypothyroidism; FET (Fisher’s exact test) — the relationship between the level of AB-rTSH and the frequency of neonatal thyrotoxicosis
Обсуждение
Данные о том, что тиреотоксикоз оказывает негативное влияние на рост и развитие плода [8][17], нашли подтверждение и в настоящем исследовании. Было показано, что новорожденные от матерей с ДТЗ имели более низкие росто-весовые показатели по сравнению с новорожденными от матерей контрольной группы (p < 0,001).
Известно, что АТ-рТТГ свободно преодолевают плацентарный барьер [10][11]. В исследовании показано, что средний уровень АТ-рТТГ в пуповинной крови у новорожденных во всех трех подгруппах матерей с ДТЗ превышал нормальные значения новорожденных от матерей без патологии ЩЖ. Максимальные значения АТ- рТТГ отмечены у детей, матери которых имели рецидив тиреотоксикоза во время беременности. Подтверждена прямая корреляционная связь между уровнем АТ-рТТГ в крови беременных женщин, особенно во II и III триместрах, и их содержанием в пуповинной крови новорожденных. Таким образом, чем выше уровень АТ-рТТГ в сыворотке крови беременных с ДТЗ, особенно во второй половине беременности, тем в большем количестве они обнаруживаются в пуповинной крови новорожденных, и, следовательно, тем выше риск неонатального тиреотоксикоза. Эти данные согласуются с результатами исследований других авторов [10].
Важно отметить, что циркулирующие в кровотоке матери АТ-рТТГ, как у самих пациенток с ДТЗ, так и у их новорожденных способствовали гиперплазии ЩЖ. Следует подчеркнуть, что у новорожденных от матерей с отягощенным рецидивирующим течением ДТЗ и повышенным уровнем АТ-рТТГ в пуповинной крови размеры ЩЖ были больше, чем у новорожденных с нормальным уровнем АТ-рТТГ. Максимальные размеры ЩЖ выявлены у детей от матерей второй подгруппы, получавших тиреостатики в течение всей беременности, что подтверждает отрицательное влияние длительной тиреостатической терапии и трансплацентарного переноса АТ-рТТГ [18][19].
Высокая частота субклинического гипотиреоза (более 50 %) у новорожденных связана с трансплацентарным переходом тиреостатических препаратов. Субклиническая гиперфункция ЩЖ была выявлена у 16,2 % новорожденных. Данный феномен можно связать с трансплацентарным переходом АТ-рТТГ, что подтверждается значительным их преобладанием у этих новорожденных (р < 0,001). Обнаружена прямая положительная связь между уровнем АТ-рТТГ в пуповинной крови и частотой возникновения неонатального тиреотоксикоза. Полученные результаты свидетельствуют о необходимости тщательного подбора доз и оценки режимов антитиреоидной терапии у беременных с ДТЗ, а также мониторинг уровня АТ-рТТГ в сыворотке крови данных пациенток во время беременности с целью снижения риска функциональных нарушений ЩЖ у плода и новорожденного.
Выводы.
- Выявлена прямая положительная связь между высоким уровнем АТ-рТТГ в сыворотке крови матерей с ДТЗ, особенно во второй половине беременности, уровнем АТ-рТТГ в пуповинной крови и степенью увеличения ЩЖ новорожденных.
- Среди всех новорожденных от обследованных матерей с ДТЗ неонатальный тиреотоксикоз был выявлен в 16,2 % случаев при наличии в сыворотке крови их матерей и в пуповинной крови новорожденных высокого уровня АТ-рТТГ.
Список литературы
1. De Escobar G.M., Obregón M.J., Del Rey F.E. Iodine deficiency and brain development in the first half of pregnancy // Public Health Nutr. – 2007. – Vol. 10. – P. 1554-1570. DOI: 10.1017/S1368980007360928
2. Rebagliato M., Murcia M., Alvarez-Pedrerol M., Espada M., Fernández-Somoano A. et at. Iodine supplementation during pregnancy and infant neuropsychological development. INMA Mother and Child Cohort Study // Am. J. Epidemiol. – 2013. – Vol. 177. – P. 944-953. DOI: 10.1093/aje/kws333
3. Laurberg P., Andersen S.L. Therapy of endocrine disease: antithyroid drug use in early pregnancy and birth defects: time windows of relative safety and high risk? // Eur. J. Endocrinol. – 2014. – Vol. 171. – P. R13–R20. DOI: 10.1530/EJE-14-0135
4. МакДермот М.Т. Секреты эндокринологии // 4-е изд., испр. и доп. пер. с англ. - М.: Изд-во БИНОМ, 2010. –С. 390-405.
5. Шустов С.Б. Клиническая эндокринология // М.: Медицинское информационное агентство, 2012. – 632 с.
6. Abraham P., Avenell A., McGeoch S.C. Antithyroid drug regimen for treating Graves’ hyperthyroidism // Cochrane Database Syst. Rev. – 2010. – Vol. 20 (1):CD003420. DOI: 10.1002/14651858.CD003420.pub4
7. Laurberg P., Bournaud C., Karmisholt J., Orgiazzi J. Management of Graves’ hyperthyroidism in pregnancy: focus on both maternal and fetal thyroid function, and caution against surgical thyroidectomy in pregnancy // Eur. J. Endocrinol. – 2009. – Vol. 160. – P. 1–8. DOI: 10.1530/EJE-08-0663
8. Besançon A., Beltrand J., Le Gac I., Luton D., Polak M. Management of neonates born to women with Graves’ disease: a cohort study // Eur. J. Endocrinol. – 2014. – Vol. 170. – P. 855–862. DOI: 10.1530/EJE-13-0994
9. Polak M., Vuillard E., Guibourdenche J., Castanet M., Luton D. Congenital hyperthyroidism: the fetus as a patient // Hormone Research. – 2006. – Vol. 65. – P. 235-242. DOI: 10.1159/000092454
10. Kahaly G.J. Bioassays for TSH receptor antibodies: quo vadis? // Eur. Thyroid. J. – 2015. – Vol. 4. – P. 3–5. DOI: 10.1159/000375445
11. Morgenthaler N.G., Ho S.C., Minich W.B. Stimulating and blocking thyroid-stimulating hormone (TSH) receptor autoantibodies from patients with Graves`disease and autoimmune hypothyroidism have very similar concentration, TSH receptor affinity, and binding sites // J. Clin. Endocrinol. Metab. – 2007. – Vol. 92(3). – P. 1058–1065. DOI: org/10.1210/jc.2006-2213
12. Brunn J., Block U., Ruf G. Volumetrie der Schilddriise mittels Real time-Sonogrophie // Dtsch. Med. Wochenschr. - 1981. - Bd. 106. - S. 1338-1340.
13. Айламазян Э.К., Потин В.В., Крихели И.О. Щитовидная железа и репродукция // Медицинский академический журнал. - 2008. - том 8, №1. - С. 22-28.
14. Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA // М.: Медиа Сфера, 2002. – 305 с.: ил.
15. Cooper D.S., Laurberg P. Hyperthyroidism in pregnancy // Lancet Diabetes Endocrinol. – 2013. – Vol.1. – P. 238–249. DOI: org/10.1016/S2213-8587(13)70086-X
16. Polak M., Le Gac I., Vuillard E. Fetal and neonatal thyroid function in relation to maternal Graves’ disease // Best Pract. Res. Clin. Endocrinol. Metab. – 2004. – Vol. 18. – P. 289–302.
17. Phoojaroenchanachai M., Sriussadaporn S., Peerapatdit T., Vannasaeng S., Nitiyanant W., Boonnamsiri V., Vichayanrat A. Effect of maternal hyperthyroidism during late pregnancy on the risk of neonatal low birth weight // Clin. Endocrinol. (Oxf). - 2001. – Vol. 54. – P. 365–370.
18. Nakamura H., Noh J.Y., Itoh K., Fukata S., Miyauchi A., Hamada N. Comparison of methimazole and propylthiouracil in patients with hyperthyroidism caused by Graves’ disease / [et al.] // J. Clin. Endocrinol. Metab. – 2007. – Vol. 92. – P. 2157–2162. DOI: 10.1210/jc.2006-2135.
19. Huel C., Guibourdenche J., Vuillard E., Ouahba J. Use of ultrasound to between fetal hyperthyroidism and hypothyroidism on discovery of a goiter // Ultrasound Obstet. Gynecol. – 2009. – Vol. 33. – P. 412–420. DOI: 10.1002/uog.6315.
Об авторах
Н. В. ВорохобинаРоссия
Ворохобина Наталья Владимировна – д.м.н., профессор, заведующая кафедрой эндокринологии имени акад. В.Г. Баранова.
Санкт-ПетербургЮ. С. Ловкова
Россия
Ловкова Юлия Сергеевна – врач-эндокринолог; аспирант кафедры эндокринологии имени акад. В.Г. Баранова.
Санкт-Петербург
А. В. Кузнецова
Россия
Кузнецова Алла Васильевна – к.м.н., доцент кафедры эндокринологии имени акад. В.Г. Баранова.
Санкт-ПетербургЮ. В. Ковалева
Россия
Ковалева Юлия Викторовна – к.м.н., доцент кафедры эндокринологии имени акад. В.Г. Баранова.
Санкт-ПетербургВ. Л. Баранов
Россия
Баранов Виталий Леонидович – д.м.н., профессор, профессор кафедры эндокринологии имени акад. В.Г. Баранова.
Санкт-ПетербургРецензия
Для цитирования:
Ворохобина Н.В., Ловкова Ю.С., Кузнецова А.В., Ковалева Ю.В., Баранов В.Л. Функциональное состояние щитовидной железы новорожденных от матерей с диффузным токсическим зобом. Медицинский вестник Юга России. 2019;10(3):24-31. https://doi.org/10.21886/2219-8075-2019-10-3-24-31
For citation:
Vorokhobina N.V., Lovkova Y.S., Kuznetsova A.V., Kovalyova Yu.V., Baranov V.L. Functional condition of the thyroid gland of newborns from methers with a diffuse toxic goiter. Medical Herald of the South of Russia. 2019;10(3):24-31. (In Russ.) https://doi.org/10.21886/2219-8075-2019-10-3-24-31







































