Перейти к:
Фармакогенетические аспекты терапии вилдаглиптином у больных с впервые выявленным сахарным диабетом 2 типа
https://doi.org/10.21886/2219-8075-2019-10-3-83-90
Аннотация
Цель: изучить роль полиморфизма rs5219 в KCNJ11 в формировании вариабельности ответа на терапию вилдаглиптином у пациентов с впервые выявленным сахарным диабетом 2 типа (СД 2).
Материалы и методы: обследовано 48 пациентов с впервые выявленным СД 2 типа. Всем пациентам был назначен вилдаглиптин в дозе 50 мг/сут. В течение 6 месяцев наблюдения при необходимости проводили титрование дозы препарата или назначали другую сахароснижающую терапию. Изучалась динамика основных показателей гликемического контроля и индекса массы тела, также определялось наличие полиморфизма rs5219 в гене KCNJ11.
Результаты: все пациенты-носители аллеля T достигли целевых значений гликированного гемоглобина (HbA1c) через 3 месяца монотерапии вилдаглиптином по сравнению с пациентами с диким типом гена, которые достигли целевых значений HbA1c только в 44,4% случаев. Увеличение дозы до 100 мг/сут потребовалось у 35% пациентов с диким типом гена и у 17,9% пациентов с полиморфизмом rs5219. Назначение комбинированной гипогликемизирующей терапии было необходимо у 40% пациентов с диким типом гена и ни у одного из пациентов с полиморфизмом.
Заключение: наличие полиморфного аллеля T rs5219 в гене KCNJ11 позволяет прогнозировать высокую эффективность монотерапии вилдаглиптином у пациентов с впервые выявленным СД 2 типа.
Ключевые слова
Для цитирования:
Шорохова П.Б., Баранов В.Л., Ворохобина Н.В., Матезиус И.Ю., Башнина Е.Б., Яковенко К.А. Фармакогенетические аспекты терапии вилдаглиптином у больных с впервые выявленным сахарным диабетом 2 типа. Медицинский вестник Юга России. 2019;10(3):83-90. https://doi.org/10.21886/2219-8075-2019-10-3-83-90
For citation:
Shorokhova P.B., Baranov V.L., Vorokhobina N.V., Matezius I.Yu., Bashnina E.B., Jakovenko K.A. Pharmacogenetic aspects of vildagliptin treatment in patients with newly diagnosed type 2 diabetes mellitus. Medical Herald of the South of Russia. 2019;10(3):83-90. (In Russ.) https://doi.org/10.21886/2219-8075-2019-10-3-83-90
Введение
Современные методы лечения сахарного диабета 2 типа (СД 2) включают модификацию образа жизни и применение пероральных сахароснижающих препаратов (ПССП) уже в дебюте заболевания. Имеющиеся на сегодняшний день знания о патогенезе СД 2 и механизмах развития гипергликемии диктуют необходимость выбора лекарственного препарата, оказывающего влияние на максимальное число звеньев нарушений углеводного метаболизма [1][2].
У больных СД 2 к моменту постановки диагноза показана выраженная дисфункция β-клеток на фоне глюкозо- и липотоксичности. С этим связано снижение чувствительности островковых клеток поджелудочной железы к действию эндогенных инкретинов: глюкагоноподобного пептида 1 (ГПП-1) и глюкозозависимого инсулинотропного полипептида (ГИП), снижение инкретинсти- мулированной секреции инсулина. На фоне нарастания гипергликемии и инсулинорезистентности отмечается выраженное снижение инкретинового ответа на нагрузку глюкозой, а также повышается концентрация фермента дипептидилпептидазы 4 типа (ДПП-4) [3]. Фермент ДПП-4 инактивирует ГПП-1 и ГИП в течение нескольких минут после их секреции в кишечнике. Однако при ингибировании ДПП-4 повышается уровень и активность циркулирующих в крови инкретинов, что приводит к тому, что их биологические эффекты пролонгируются. В результате усиливается секреция эндогенного инсулина, подавляется секреция глюкагона α-клетками, при этом отсутствует риск тяжелых гипогликемических состояний за счет глюкозозависимого механизма действия [4]. Таким образом, инкретин-направленная терапия способствует в определенной степени восстановлению функции островковых клеток, что приводит к улучшению показателей гликемического контроля.
Согласно основным положениям консенсуса Российской ассоциации эндокринологов по инициации и интенсификации сахароснижающей терапии СД 2, ингибиторы ДПП-4 вследствие оптимального сочетания эффективности и безопасности при их применении наряду с метформином и агонистами рецепторов ГПП-1 отнесены к препаратам первой линии для старта сахароснижающей терапии [5]. Одним из наиболее часто использующихся в клинической практике представителей данного класса ПССП является вилдаглиптин.
Однако, несмотря на ряд преимуществ при применении инкретин-направленной терапии, отмечается значительная вариабельность индивидуальной восприимчивости пациентов к терапии ингибиторами ДПП-4 [6]. Аллельные варианты генов, кодирующих ферменты биотрансформации, транспортеры и точки приложения лекарств, а также полиморфизмы генов риска развития СД 2 могут быть связаны с индивидуальными различиями в результатах применения антидиабетических препаратов [7]. Ряд генов, таких как KCNQ1, PAX4, TCF7L2, kCnJ11, ABCC8, MTNR1B и WFS1, экспрессирующихся преимущественно в β-клетках поджелудочной железы, играет ключевую роль в поддержании гомеостаза глюкозы и являются основными регуляторами инкретин-опосредованных влияний. Следовательно, однонуклеотидные полиморфизмы (ОНП) вышеперечисленных генов могут ассоциироваться с вариабельностью терапевтического эффекта при применении ингибиторов ДПП-4 [8]. Ген KCNJ11, локализующийся на коротком плече 11 хромосомы, кодирует центральную субъединицу Kir6.2 АТФ-зависимых калиевых каналов (КАТФ - каналов) β- и α-клеток поджелудочной железы. Полиморфизмы гена KCNJ11 могут влиять на интенсивность секреции инсулина и глюкагона путем изменения функциональной активности калиевых каналов. В связи с этим, изменения аминокислотной последовательности белка Kir6.2 рассматриваются с одной стороны, как фактор риска развития сахарного диабета, а с другой стороны, как фактор определяющий индивидуальную восприимчивость к терапии сахароснижающими препаратами [9][10]. Весьма немногочисленны исследования, посвященные оценке влияния полиморфизмов гена KCNJ11 на эффективность терапии и ДПП-4. В работе J. Jamaluddin и соавт. в 2016 г. продемонстрировано, что ответ на терапию вилдаглиптином, ситаглиптином и линаглиптином, возможно, определяется носительством полиморфизма rs 2285676 гена KCNJ11, уровнем триглицеридов крови и диастолического артериального давления [11].
Таким образом, на сегодняшний день в научной литературе представлены единичные фармакогенетические исследования по изучению ассоциации полиморфных маркеров гена KCNJ11 с терапевтическим эффектом вилдаглиптина, что определяет актуальность проведения дальнейших исследований в данной области.
Цель исследования - изучить роль полиморфизма rs5219 (C>T) гена KCNJ11 в формировании вариабельности ответа на терапию вилдаглиптином у больных с впервые выявленным сахарным диабетом 2 типа.
Материалы и методы
Работа выполнена на базе кафедры эндокринологии им. акад. В.Г. Баранова ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России. После разъяснения целей и задач работы каждый наблюдаемый подписал информированное согласие на участие в данном исследовании. В когортное исследование с проспективным наблюдением включались больные с впервые выявленным сахарным диабетом 2 типа (СД2) и индексом массы тела (ИМТ) > 25 кг/м2 при отсутствии у них противопоказаний к назначению вилдаглиптина. Пациенты, имеющие показания к инсулинотерапии, хронические заболевания внутренних органов в стадии обострения, тяжелые формы печеночной и почечной недостаточности, а также психические заболевания или иные факторы, влияющие на приверженность терапии, в исследование не включались. Стандартное обследование больных включало расчет ИМТ, оценку общеклинических и лабораторных показателей с углубленным изучением таких параметров углеводного обмена, как уровень глюкозы плазмы натощак и постпрандиально, гликированный гемоглобин (HbA1c). После проведенного обследования всем включенным в исследование пациентам с верифицированным диагнозом СД2 назначали диету №9 и вилдаглиптин в начальной дозе 50 мг в сутки с последующим динамическим наблюдением. Повторное обследование проводили через 3 и через 6 месяцев после начала лечения. При этом, оценивали динамику уровня глюкозы плазмы натощак и пост- прандиально, уровень гликированного гемоглобина. В случае недостаточной эффективности сахароснижающей терапии (сохраняющаяся гипергликемия натощак и/или после приема пищи, отсутствие достижения индивидуального целевого уровня гликированного гемоглобина) дозу препарата повышали или назначали комбинацию сахароснижающих средств. Через 6 месяцев лечения, анализируя результаты исследования, проводили сопоставление групп пациентов с различными генетическими полиморфизмами по выраженности клинического ответа на терапию вилдаглиптином и характеру проводимой сахароснижающей терапии.
Молекулярно-генетический анализ выполняли методом полимеразной цепной реакции в режиме реального времени (ПЦР — РВ). Для выделения ДНК пациентов из лейкоцитов цельной венозной крови применяли сорбционный метод с использованием набора реактивов «Проба — ГС — Генетика» (ДНК-Технология, Россия). С целью выявления аллельных вариантов генов использовали соответствующие наборы реагентов для определения полиморфизма Glu23Lys (rs5219) гена KCNJ11 (Синтол, Россия). Детекцию продуктов амплификации проводили в режиме реального времени на приборе ДТ-Лайт (ДНК- Технология, Россия).
Для анализа данных применяли методы непараметрической статистики: критерий Вилкоксона для сравнения связанных показателей, критерий Манна — Уитни для сравнения независимых показателей, тест Краскела — Уоллиса для рангового дисперсионного анализа, критерий χ2, точный критерий Фишера, рассчитывали проценты от общего. Для оценки динамики клинико-лабораторных показателей: ИМТ, уровня глюкозы крови натощак и постпрандиально введен показатель Δ%, который вычисляли по формуле Δ% = (X2-X1)/X1*100%, где X1 — исходное значение показателя, X2 — конечное значение показателя. Данный параметр позволяет оценить динамику показателей вне зависимости от исходного уровня и диапазона колебаний показателя для каждого конкретного пациента [12]. В тексте статьи показатели представлены в виде медианы, нижних и верхних про- центилей (Me [25р; 75р]). Уровнем статистической значимости различий было принято р < 0,05. Статистический анализ проводили с использованием прикладного пакета программ Statistica 10.0 (StatSoft, США).
Результаты
В исследование было включено 48 пациентов — 30 женщин (62,5 %) и 18 мужчин (37,5 %) — с впервые выявленным СД2, имеющих избыточную массу тела или ожирение без противопоказаний к назначению вилдаглиптина. Медиана возраста участников исследования составила 59 [55;62] лет, ИМТ 30,60 [28,46; 32,40] кг/м2, уровень гликемии натощак 8,4 [7,7; 9,2] ммоль/л, уровень гликемии постпрандиально 10,3 [9,5;11,5] ммоль/л, уровень HbA1c 7,25 [6,80; 8,60] %. После проведенного обследования всем включенным в исследование пациентам с верифицированным диагнозом СД2 была назначена диета №9 и вилдаглиптин в начальной дозе 50 мг в сутки. В связи с недостаточным эффектом от приема вилдаглип- тина в первые 3 месяца лечения у 18 пациентов доза препарата была увеличена до 100 мг в сутки, а 2 больным к терапии вилдаглиптином был добавлен метформин. При этом отмечалось снижение уровня глюкозы крови как натощак, так и постпрандиально. Целевого уровня глики- рованного гемоглобина через 3 месяца терапии достигли 36 (75 %) пациентов. Через 6 месяцев лечения вилдаглип- тин в дозе 50 мг в сутки получали 28 (58,3 %) пациентов, в дозе 100 мг в сутки — 12 (25 %) пациентов, 8 (16,7 %) пациентам потребовалось назначение комбинации сахароснижающих препаратов. При этом индивидуальных целей гликемического контроля достигли 46 (95,8 %) пациентов из 48, в том числе все пациенты, получающие монотерапию вилдаглиптином в любой дозе.
При генотипировании пациентов по полиморфизму rs5219 (С > Т) гена KCNJ11 было установлено: СС — генотип имели 20 (41,7 %) пациентов, СТ — генотип 18 (37,5 %) пациентов и ТТ — генотип 10 (20,8 %) пациентов. Распределение частот аллелей и генотипов соответствовало уравнению Харди-Вайнберга. Частота минорного аллеля Т составила при этом 40 %. Для реализации поставленной цели и задач были сформированы второй группы пациентов, сопоставимых по возрасту и полу (р > 0,05). В первую группу вошли 20 больных с диким типом гена KCNJ11, вторую составили 28 носителей мутантного аллеля Т в гомо- или гетерозиготном состоянии (СТ — и ТТ — генотипы).
Оценка показателей углеводного обмена, ИМТ и нежелательных явлений, возникших на фоне терапии вилдаглиптином, в выделенных группах проводилась через 3 и 6 месяцев от начала лечения. При этом учитывалась доза препарата, необходимая для достижения целевых показателей, а также оценивалась необходимость проведения комбинированной терапии.
На фоне проводимой трехмесячной монотерапии вилдаглиптином установлено достоверное снижение (р < 0,05) ИМТ, уровней гликемии натощак и постпрандиально, гликированного гемоглобина как в группе пациентов с «диким» типом гена KCNJ11, так и у больных СД 2 типа с носительством полиморфизма rs5219. При этом, различий в динамике клинико-лабораторных показателей (Δ %) в зависимости от дозы препарата (50 или 100 мг в сутки) выявлено не было (р > 0,05).
Через 6 месяцев от начала терапии вилдаглиптином установлено достоверное (р < 0,05) снижение глюкозы крови натощак и постпрандиально, уровня гликированного гемоглобина по сравнению с исходными показателями и результатами трехмесячного лечения. Достоверных различий по показателю Δ% глюкозы крови натощак и после приема пищи в зависимости от дозы препарата выявлено не было (р >0,05). Динамика ИМТ, глюкозы крови натощак и постпрандиально, гликированного гемоглобина за весь период наблюдения с учетом носительства полиморфизма rs5219, дозы вилдаглиптина представлена на рис. 1 — 4.
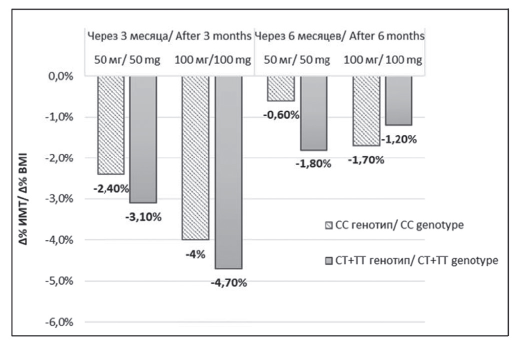
Рисунок 1. Динамика ИМТ у пациентов с впервые выявленным сахарным диабетом 2 типа на фоне терапии вилдатлиптином в зависимости от дозы препарата и генотипа.
Figure 1. Dynamics of BMI in patients with newly diagnosed type 2 diabetes mellitus receiving vildagliptin depending on the drag dose and the genotype.
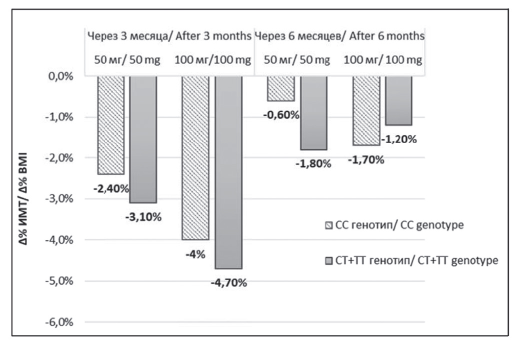
Рисунок 2. Динамика глюкозы крови натощак у пациентов с впервые выявленным сахарным диабетом 2 типа на фоне терапии вилдатлиптином в зависимости от дозы препарата и генотипа.
Figure 2. Dynamics of fastingglycemia in patients with newly diagnosed type 2 diabetes mellitus receiving vildagliptin depending on the drag dose and the genotype.
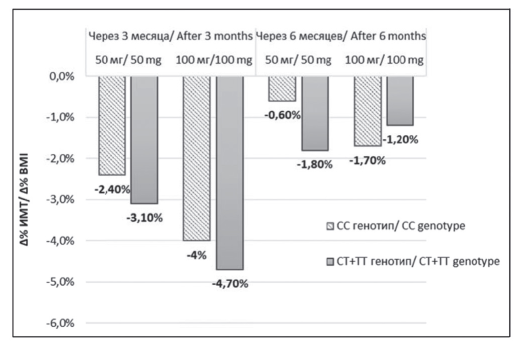
Рисунок 3. Динамика глюкозы крови постпрандиально у пациентов с впервые выявленным сахарным диабетом 2 типа на фоне терапии вилдатлиптином в зависимости от дозы препарата и генотипа.
Figure 3. Dynamics of postprandial glycemia in patients with newly diagnosed type 2 diabetes mellitus receiving vildagliptin depending on the drag dose and the genotype.
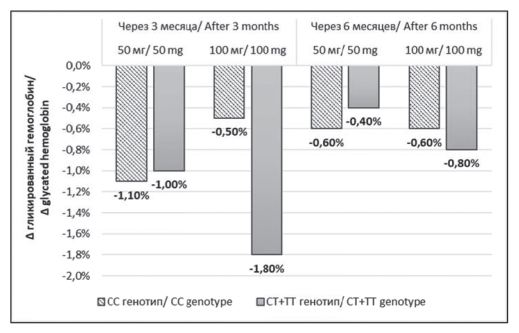
Рисунок 4. Динамика гликированного гемоглобина у пациентов с впервые выявленным сахарным диабетом 2 типа на фоне терапии вилдаглиптином в зависимости от дозы препарата и генотипа.
Figure 4. Dynamics of HbAlc in patients with newly diagnosed type 2 diabetes mellitus receiving vildagliptin depending on the drag dose and the genotype.
Представляется важным тот факт, что наличие мутации в гене KCNJ11 статистически значимо сказалось на количестве пациентов, достигших целевого уровня (ЦУ) HbA1c через 3 месяца монотерапии вилдаглиптином. Так, все пациенты с аллельными вариантами гена KCNJ11, получавшие монотерапию вилдаглиптином, достигли ЦУ HbA1c через 3 месяца от начала лечения. Среди пациентов без полиморфизма rs5219 в гене KCNJ11 более половины больных (55,6%) не достигли ЦУ гликемического контроля, что повлекло за собой необходимость проведения коррекции сахароснижающей терапии. Данные по достижению ЦУ HbA 1c через 3 месяца терапии вилдаглиптином представлены в табл. 1.
Таблица / Table 1
Уровень гликированного гемоглобина у пациентов, получающих монотерапию вилдаглиптином через 3 месяца в зависимости полиморфизма в гене KCNJ11
Values of HbA1c in patients receiving vildagliptin monotherapy after 3 months depending on the KCNJ11 polymorphism
HbA1c через 3 месяца терапии HbAlc after 3 months of therapy | Полиморфизм в гене KCNJ11 Polymorphism in KCNJ11 gene | p | |||||
|---|---|---|---|---|---|---|---|
Пациенты без полиморфизма rs5219 Patients without rs5219 polymorphism | Пациенты с полиморфизмом rs5219 Patients with rs5219 polymorphism | ||||||
Абс. Abs. | % | 95% ДИ 95% CI | Абс Abs. | % | 95% ДИ 95% CI | ||
Выше целевого уровня Above target level | 10 | 55,6 | 33,7-75,4 | 0 | 0,0 | 0,0-12,1 | < 0,001# |
Ниже целевого уровня или равен ему Lower than or equal to the target level | 8 | 44,4 | 24,6-66,3 | 28 | 100,0 | 87,9-100,0 | |
Всего Total | 18 | 100,0 |
| 28 | 100,0 |
|
|
Примечание: # — значимость точного метода Фишера.
Note: # — Fishers exact test.
Следует отметить, что через 6 месяцев от начала лечения у всех пациентов, получавших вилдаглиптин в качестве монотерапии, был достигнут индивидуальный целевой уровень HbA1c. При этом, 28 (70 %) больных получали препарат в дозе 50 мг/сутки и 12 (30 %) пациентов — в дозе 100 мг. Что позволяет судить, об адекватности проводимой терапии в плане коррекции назначаемой дозы вилдаглиптина.
Вместе с тем, в группах больных с различными аллельными вариантами гена KCNJ11, у которых проводилась коррекция терапии, выявлены статистически достоверные различия. Так, число пациентов, носителей полиморфного аллеля Т, которым потребовалось повышение дозы вилдаглиптина до 100 мг/сут или же назначение комбинированной терапии, оказалось значимо меньше в сравнении с пациентами, имеющими генотип СС (р < 0,001). Данные по коррекции терапии за весь период наблюдения в зависимости от полиморфизма гена KCNJ11 представлены в табл. 2.
Таблица / Table 2
Коррекция терапии у пациентов при лечении вилдатлиптином в зависимости от полиморфизма в гене KCNJ11 за весь период исследования
Correction of therapy in patients receiving vildagliptin depending on the KCNJ11 polymorphism over the entire study period
Доза вилдаглиптина (мг/сут) / терапия Vildagliptin dose (mg/day) / therapy | Период исследования Study period | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
Исходно Initial | 0-3 месяц 0-3 month | 3-6 месяц 3-6 month | ||||||||||
Полиморфизм в гене KCNJ11 | ||||||||||||
CC - генотип CC - genotype | СТ - и ТТ - генотип CT - & TT - genotype | CC - генотип CC - genotype | СТ - и ТТ - генотип CT - & TT - genotype | СС - генотип CC - genotype | СТ - и ТТ - генотип CT - & TT - genotype | |||||||
| Абс. Abs. | % | Абс. Abs. | % | Абс. Abs. | % | Абс. Abs. | % | Абс. Abs. | % | Абс. Abs. | % |
50 | 20 | 100,0 | 28 | 100,0 | 5 | 25,0 | 23 | 82,1 | 5 | 25,0 | 23 | 82,1 |
100 | 0 | 0,0 | 0 | 0,0 | 13 | 65,0 | 5 | 17,9 | 7 | 35,0 | 5 | 17,9 |
Комбинированная терапия Combination therapy | 0 | 0,0 | 0 | 0,0 | 2 | 10,0 | 0 | 0,0 | 8 | 40,0 | 0 | 0,0 |
Обсуждение
Полученные в результате исследования данные свидетельствуют о том, что на фоне приема вилдаглиптина удалось достичь выраженного статистически значимого улучшения клинико-лабораторных показателей у всех больных с впервые выявленным СД 2 типа вне зависимости от генотипа. В целом, по результатам 6-месячной сахароснижающей терапии индивидуальных целевых уровней HbA1c удалось достичь у 95,8 % пациентов. Примерно в 17% случаев для этого потребовалось назначение второго сахароснижающего препарата. Таким образом, монотерапия вилдаглиптином оказалась эффективной у 80% пациентов. При оценке нежелательных явлений за весь период исследования у 7 пациентов была зафиксирована гипогликемия легкой степени, которая купировалась больными самостоятельно, и у 4 участников отмечалось снижение аппетита, что, однако, не потребовало отмены проводимой терапии. Эти данные убедительно свидетельствуют о пользе хорошей переносимости и безопасности проводимой фармакотерапии в группе больных с впервые выявленным СД 2 типа, что согласуется с основным принципом пациент-ориентированного подхода при подборе антигипергликемического лечения [13].
С другой стороны, анализ данных, полученных при статистической обработке результатов проведенного исследования, позволил выявить достоверные различия в индивидуальной восприимчивости к терапии вилдаглиптином у пациентов в зависимости от генотипа по полиморфизму rs5219 гена KCNJ11. Так, через 3 месяца от начала терапии вилдаглиптином индивидуальный целевой уровень показателей углеводного метаболизма был достигнут у 44,4% пациентов, через 6 месяцев монотерапии вилдаглиптином — у 90 % пациентов с генотипом СС гена KCNJ11. В то время как у всех пациентов с аллельными вариантами гена KCNJ11, получавших монотерапию вилдаглиптином, через 3 месяца от начала лечения содержание гликированного гемоглобина достигло индивидуального целевого уровня (р < 0,001). По итогам 6-месячного наблюдения только четверть пациентов с «диким» типом гена получала исходную терапию вилда- глиптином 50 мг в сутки, у 35 % доза была увеличена до 100 мг в сутки у 40 % потребовалось назначение комбинации сахароснижающих препаратов. В то же время, в группе пациентов, носителей полиморфного аллеля Т в гомо- или гетерозиготном состоянии исходную терапию вилдаглиптином в дозе 50 мг в сутки по итогам исследования получали 82,1 % больных, повышение дозы потребовалось в 17,9 % случаев, необходимости в комбинации антидиабетических препаратов не возникло ни у одного из пациентов (р < 0,001).
На сегодняшний день в доступной мировой литературе практически отсутствуют четкие данные о проведенных фармакогенетических исследованиях в группе глиптинов. Однако, появляется все больше сведений, уточняющих роль КАТФ — каналов в инициации высвобождения инсулина и глюкагона в островковых клетках поджелудочной железы. В β-клетках и δ-клетках метаболизм глюкозы вызывает электрическую активность и секрецию гормонов путем закрытия чувствительных к АТФ калиевых каналов. Напротив, закрытие КАТФ — каналов, по-видимому, имеет противоположный эффект в α-клетках, где генетическая или фармакологическая инактивация канала ассоциирована с ингибированием секреции. Нарушение регуляции этого механизма может лежать в основе взаимных изменений секреции инсулина и секреции глюкагона, обнаруживаемых при СД2. Активирующие мутации генов калиевых каналов вызывают широкий спектр нарушений углеводного метаболизма, степень тяжести которых варьируется от неонатального сахарного диабета (НСД) до СД 2 типа [14]. В работе J. Sastre и соавт. (2014) продемонстрирована эффективность ситаглиптина при наличии у пациента активирующей мутации Kir6.2 [15]. По всей видимости, восприимчивость к инкретин-направленной терапии, может зависеть от аминокислотного полиморфизма Kir6.2 структурных субъединиц КАТФ — каналов. Хотя окончательную оценку значения аллельных вариантов гена KCNJ11 для формирования индивидуального ответа на терапию ингибиторами ДПП —4 еще предстоит произвести в ходе дальнейших фармакогенетических исследований.
Выводы
- Наличие полиморфизма rs5219 (С > Т) в гене KCNJ11 оказывает существенное положительное влияние на выраженность гипогликемизирующего эффекта вилдаглиптина у пациентов с впервые выявленным СД2.
- У пациентов с носительством полиморфизма rs5219 отмечена более эффективная нормализация показателей углеводного обмена, достижение целевых уровней глики- рованного гемоглобина в более короткие сроки при применении начальной дозы вилдаглиптина 50 мг в сутки, по сравнению с пациентами с диким типом гена KCNJ11.
- Материалы проведенного исследования свидетельствуют о целесообразности выполнения молекулярногенетического тестирования по полиморфному локусу rs5219 гена KCNJ11 у пациентов с впервые выявленным СД 2 типа, результаты которого необходимо учитывать при проведении персонифицированной стартовой сахароснижающей терапии.
- Выявление при проведении молекулярно-генетического анализа полиморфного аллеля Т rs5219 гена KCNJ11 в гомо- или гетерозиготном состоянии позволяет прогнозировать высокую эффективность терапии вилдаглиптином в стартовой дозе 50 мг в сутки у больных с впервые выявленным сахарным диабетом 2 типа.
Список литературы
1. DeFronzo R.A. From the triumvirate to the ominous octet: A new paradigm for the treatment of type 2 diabetes mellitus. // Diabetes. – 2009. – V.58(4). – P.773–795. doi:10.2337/db09-9028.
2. Schwartz S.S., Epstein S., Corkey B.E., Grant S.F.A., Gavin J.R., Aguilar R.B. The time is right for a new classification system for diabetes: rationale and implications of the β-cell–centric classification schema. // Diabetes Care. – 2016. – V.39(8). – P. 179–186. http://doi.org/10.2337/dci16-0011.
3. Демидова Т.Ю., Куленок С.Г., Гасанзаде П.А. Патогенетические предпосылки применения ингибиторов дипептидилпептидазы-4 в управлении сахарным диабетом типа 2 // Consilium Medicum. – 2017. – Т. 19, № 4 – С. 23–28. https://doi.org/10.26442/2075-1753_19.4.23-28.
4. Fonseca V., Schweizer A., Albrecht D., Baron M.A., Chang I., Dejager S. Addition of vildagliptin to insulin improves glycaemic control in type 2 diabetes. // Diabetologia. – 2007. – V.50(6). – P. 1148–1155. https://doi.org/10.1007/s00125-007-0633-0
5. Дедов И.И, Шестакова М.В, Аметов А.С, Анциферов М.Б., Галстян Г.Р., Майоров А.Ю. и др. Инициация и интенсификация сахароснижающей терапии у больных сахарным диабетом 2 типа: обновление консенсуса совета экспертов Российской ассоциации эндокринологов (2015) // Сахарный диабет. – 2015. – Т. 18., № 1. – С. 5-23. doi: 10.14341/DM201515-23.
6. Aso Y., Ozeki N., Terasawa T., Naruse R., Hara K., Suetsugu M., et al. Serum level of soluble CD26/dipeptidyl peptidase-4 (DPP-4) predicts the response to sitagliptin, a DPP-4 inhibitor, in patients with type 2 diabetes controlled inadequately by metformin and/or sulfonylurea. // Transl Res. – 2012. – V.159(1). – P. 25–31. doi: 10.1016/j.trsl.2011.09.005.
7. Semiz S., Dujic T., Causevic A. Pharmacogenetics and personalized treatment of type 2 diabetes. // Biochem.Med. – 2013. – V.23(2). – P.154–171. doi: 10.11613/BM.2013.020.
8. Jamaluddin J.L., Huri H.Z., Vethakkan S.R., Mustafa N. Pancreatic gene variants potentially associated with dipeptidyl peptidase-4 inhibitor treatment response in Type 2 diabetes. // Pharmacogenomics. – 2014. – V.15(2). – P. 235–249. http://doi.org/10.2217/pgs.13.234.
9. Dawed A.Y., Zhou K., Pearson E.R. Pharmacogenetics in type 2 diabetes: influence on response to oral hypoglycemic agents. // Pharmacogenomics and Personalized Medicine. – 2016. – V.9. – P.17–29. https://doi.org/10.2147/PGPM.S84854.
10. Haghvirdizadeh P., Mohamed Z., Abdullah N.A., Haghvirdizadeh P., Haerian M.S., Haerian B.S. KCNJ11: Genetic Polymorphisms and Risk of Diabetes Mellitus. // J Diabetes Res. – 2015. – V.2015. – P.1-9. doi:10.1155/2015/908152.
11. Jamaluddin J.L., Huri H.Z., Vethakkan S.R. Clinical and genetic predictors of dipeptidyl peptidase-4 inhibitor treatment response in type 2 diabetes mellitus. // Pharmacogenomics. – 2016. – V.17(8). – P.867–881. doi: 10.2217/pgs-2016-0010.
12. Методы статистической обработки медицинских данных: Методические рекомендации для ординаторов и аспирантов медицинских учебных заведений, научных работников / сост.: Кочетов А.Г., Лянг О.В., Масенко В.П., Жиров И.В., Наконечников С.Н., Терещенко С.Н. – М.: РКНПК, 2012. – 42 с.
13. Inzucchi S.E., Bergenstal R.M., Buse J.B., Diamant M., Ferrannini E., Nauck et al. Management of hyperglycaemia in type 2 diabetes, 2015: a patient-centred approach. Update to a Position Statement of the American Diabetes Association and the European Association for the Study of Diabetes. // Diabetologia. – 2015. – V.58(3). – P.429-442. doi:10.1007/s00125-014-3460-0
14. Ashcroft FM, Rorsman P. K(ATP) channels and islet hormone secretion: new insights and controversies. // Nat Rev Endocrinol. – 2013. – V.9(11). – P.660–669. doi:10.1038/nrendo.2013.166
15. Sastre J, Luque A, del Val F, Aragonés A, López J. Long-term efficacy of glibenclamide and sitagliptin therapy in adult patients with KCNJ11 permanent diabetes. // Diabetes Care. – 2014. – V.37(3). – P.e55-56. doi: 10.2337/dc13-2280
Об авторах
П. Б. ШороховаРоссия
Шорохова Полина Борисовна - аспирант кафедры эндокринологии им. акад. В.Г. Баранова.
Санкт-Петербург
В. Л. Баранов
Россия
Баранов Виталий Леонидович - д.м.н., профессор, профессор кафедры эндокринологии им. акад. В.Г. Баранова.
Санкт-ПетербургН. В. Ворохобина
Россия
Ворохобина Наталья Владимировна - д.м.н., профессор, заведующий кафедрой эндокринологии им. акад. В.Г. Баранова.
Санкт-Петербург
И. Ю. Матезиус
Россия
Матезиус Ирина Юрьевна - к.м.н., доцент, доцент кафедры эндокринологии им. акад. В.Г. Баранова.
Санкт-Петербург
Е. Б. Башнина
Россия
Башнина Елена Борисовна, д.м.н., профессор, профессор кафедры эндокринологии им. акад. В.Г. Баранова.
Санкт-Петербург
К. А. Яковенко
Россия
Яковенко Ксения Александровна - студент 6 курса, ле-
чебный факультет.
Рецензия
Для цитирования:
Шорохова П.Б., Баранов В.Л., Ворохобина Н.В., Матезиус И.Ю., Башнина Е.Б., Яковенко К.А. Фармакогенетические аспекты терапии вилдаглиптином у больных с впервые выявленным сахарным диабетом 2 типа. Медицинский вестник Юга России. 2019;10(3):83-90. https://doi.org/10.21886/2219-8075-2019-10-3-83-90
For citation:
Shorokhova P.B., Baranov V.L., Vorokhobina N.V., Matezius I.Yu., Bashnina E.B., Jakovenko K.A. Pharmacogenetic aspects of vildagliptin treatment in patients with newly diagnosed type 2 diabetes mellitus. Medical Herald of the South of Russia. 2019;10(3):83-90. (In Russ.) https://doi.org/10.21886/2219-8075-2019-10-3-83-90
JATS XML







































