Перейти к:
Биомаркеры в диагностике острого повреждения почек после органосохраняющего хирургического лечения локализованного рака почки
https://doi.org/10.21886/2219-8075-2018-9-3-77-83
Аннотация
Цель: оценка перспектив использования биомаркеров для проведения экспресс-диагностики развития острого повреждения почек (ОПП) после резекции почки в условиях тепловой ишемии почки (ТИП) по поводу клинически локализованного рака почки. Материал и методы: изучены данные 100 больных локализованным раком почки Т1N0М0 в возрасте 56,5±8,7 года, перенесших резекцию почки в условиях тепловой ишемии. В крови больных при помощи метода ИФА с использованием стандартных тест-систем измеряли концентрацию «ранних маркеров ОПП»: цистатин С (BioVendor, Чехия), NGAL (BCMDiagnostics, США), L-FABP (Hycult Biotechnology, Нидерланды), а также фиксировали продолжительность ТИП и оценивали скорость диуреза. Измерения были выполнены за сутки и через 16 часов после оперативного вмешательства. У всех больных диагностировали и классифицировали наличие или отсутствие ОПП в раннем послеоперационном периоде согласно общепринятой классификации KDIGO. Полученные результаты обрабатывались при помощи пакета MicrosoftExcel, статистическая достоверность результатов определялась на основе использования непараметрического критерия Вилкоксона. Одновременно производился экспертный анализ клинических данных и результатов лабораторных исследований. Результаты: был разработан способ ранней диагностики ОПП у больных, перенесших резекцию почки в условиях ТИП, основанный на последовательном определении концентраций ранних биохимических маркеров ОПП, продолжительности ТИП и скорости диуреза. Выводы: применение разработанного способа позволяет диагностировать развитие ОПП у больных, подвергнутых резекции почки в условиях ТИП уже через 16 часов после оперативного вмешательства (до начала возрастания уровня креатинина).
Ключевые слова
Для цитирования:
Димитриади С.Н., Франциянц Е.М., Ушакова Н.Д., Розенко Д.А., Величко А.В. Биомаркеры в диагностике острого повреждения почек после органосохраняющего хирургического лечения локализованного рака почки. Медицинский вестник Юга России. 2018;9(3):77-83. https://doi.org/10.21886/2219-8075-2018-9-3-77-83
For citation:
Dimitriadi S.N., Frantsiyants E.M., Ushakova N.D., Rozenko D.A., Velichko A.V. Biomarkers in diagnostics of acute kidney injury after the organ-preserving surgery of localized renal cancer. Medical Herald of the South of Russia. 2018;9(3):77-83. (In Russ.) https://doi.org/10.21886/2219-8075-2018-9-3-77-83
Введение
В настоящее время стандартом лечения локализованного почечно-клеточного рака (ПКР) является органосохраняющий хирургический метод, а именно резекция почки, позволяющая, в отличие от нефрэктомии, сохранить функционально здоровую паренхиму оперируемого органа. Это снижает риск развития почечной недостаточности в послеоперационном периоде. При проведении резекции очень часто используется тепловая ишемия почки (ТИП), формируемая путем временного пережатия почечных сосудов. Активное использование ТИП обусловлено возможностью идеальной визуализации хирургического слоя во время проведения резекции опухоли, минимизации кровопотери, улучшения доступа к полостной системе почки на фоне снижения ее тургора, а также снижения риска развития кровотечений в послеоперационном периоде за счет усиления дополнительного гемостатического эффекта швов, наложенных на паренхиму почки в условиях ТИП после реперфузии (на фоне восстановления тургора почки). В то же время прекращение почечного кровотока и последующая реперфузия почки может привести к формированию острого ишемического тубулярного некроза, повреждению клеток канальцев нефрона и, как следствие, к развитию острого повреждения почек (ОПП), вероятность формирования которого пропорциональна продолжительности ТИП [1][2].
Согласно современным представлениям, ОПП представляет собой потенциально обратимое повреждение почечной паренхимы разной этиологии и патогенеза, для которого свойственно быстрое (в течение нескольких часов или дней) и резкое (в несколько раз) падение скорости клубочковой фильтрации (СКФ) [3]. ОПП провоцирует ряд расстройств гомеостаза и приводит к развитию азотемии, ацидоза и других нарушений водно-электролитного баланса; в конечном итоге это влечет за собой возрастание риска развития осложнений, повышение частоты повторных госпитализаций и уровня внутригоспитальной летальности, достигающей 28-90 %. У больных, перенесших операцию по поводу локализованного рака почки, в послеоперационном периоде осложнения в виде развития ОПП возникают в 30 % случаев.
Согласно современным представлениям, ОПП проявляется возрастанием креатинина сыворотки крови на > 0,3 мг/дл (26,5 мкмоль/л) в течение 48 ч. или же может иметь место увеличение содержания креатинина в сыворотке крови в > 1,5 раза от исходных значений в течение последующих 7 дней. В ряде случаев фиксируется снижение диуреза до < 0,5 мл/кг/ч в течение 6 ч. [4].
Возрастание концентрации креатинина сыворотки крови обычно регистрируется лишь спустя 48-72 часа от момента развития ОПП. Это может быть связано со значительным функциональным резервом почек, препятствующим увеличению концентрации креатинина сыворотки до момента «выключения» из функционирования 60 % почечной паренхимы. Концентрация креатинина сыворотки крови зависит от множества факторов, не связанных с мочевыделительной системой. В связи с этим для осуществления диагностики ОПП на ранних стадиях развития этого процесса целесообразно использовать более чувствительные маркеры, чем концентрация креатинина сыворотки крови и скорость клубочковой фильтрации, величина которой также напрямую зависит от уровня креатинина [5].
В этом плане существенный интерес представляет изучение потенциальной диагностической роли биомаркеров, связанных с острым повреждением почечной паренхимы, клеточной пролиферацией и дифференцировкой, апоптозом, с нарушениями иммунного ответа и продукции цитокинов и хемокинов, а не с фильтрационной функцией почек [6]. Согласно литературным источникам, такими биомаркерами могут служить цистатин С, ИЛ-18, KIM-1, L-FABP и NGAL [7].
Цель исследования — оценка перспектив использования биомаркеров для проведения экспресс-диагностики ОПП после резекции почки в условиях ТИП по поводу клинически локализованного рака почки.
Материалы и методы
Ретроспективно изучены клинические данные 100 больных, находившихся на лечении в ФГБУ Ростовском научно-исследовательском онкологическом институте Минздрава России в период с 2015 по 2017 гг. с гистологически подтвержденным локализованным почечно-клеточным раком TlNOMO в возрасте 58,7±8,1 лет, подвергнутых резекции почки в условиях ТИП, продолжительность которой составила 15-21 минуту. Перед операцией всем больным было проведено стандартное обследование, предусмотренное для пациентов с объемным образованием почки: УЗИ, KT или МРТ. Собранные данные включали: возраст, пол, демографические сведения, анамнез заболевания и описание сопутствующей патологии.
Критерии включения в исследование — возраст пациента старше 18 лет; проведение резекции почки по поводу ПКР (открытой или лапароскопической) в условиях ТИП длительностью 15-21 минуту; нормальные исходные значения концентрации креатинина сыворотки крови. Критерии исключения — возраст моложе 18 лет; длительность ТИП более 21 минуты или менее 15 минут; исходно повышенная концентрация креатинина сыворотки крови.
При помощи метода ИФА с использованием стандартных тест-систем измеряли концентрацию «ранних маркеров ОПП» в сыворотке крови и в моче: цистатин С (BioVendor, Чехия), KIM-I (BCMDiagnostics, США), NGAL (BCMDiagnostics, США), L-FABP (Hycult Biotechnology, Нидерланды), ИЛ-18 (BenderMedsystems, США), а также фиксировали продолжительность ТИП и оценивали скорость диуреза. Измерения были выполнены за сутки и через 16 часов после оперативного вмешательства. У всех больных диагностировали и классифицировали наличие или отсутствие ОПП в раннем послеоперационном периоде согласно общепринятой классификации KDIGO.
Полученные результаты обрабатывались при помощи пакета Microsoft Excel, статистическая достоверность результатов определялась на основе использования непараметрического критерия Вилкоксона. Одновременно производился экспертный анализ клинических данных и результатов лабораторных исследований.
Результаты
Анализ полученных результатов продемонстрировал следующее:
- У принявших участие в исследовании пациентов имеет место достаточно вариабельный уровень исходных концентраций изученных маркеров в сыворотке крови и в моче.
- Исходные концентрации цистатина С в сыворотке крови больных, у которых впоследствии развилось ОПП, обычно превышают уровень 1000 нг/мл; у пациентов, избежавших развития ОПП, исходный уровень цистатина С в сыворотке крови ниже 1000 нг/мл.
- Динамика концентраций маркеров в сыворотке крови пациентов, подвергнутых резекции почки, также в существенной степени вариабельна, наиболее хаотично изменяются концентрации биомаркеров ИЛ-18 и KIM -1
- Стереотипы параллельных изменений концентраций биомаркеров цистатина С, NGAL и L-FABP в сыворотке крови у пациентов с ОПП и без этого синдрома, различаются между собой.
- Оценка изменений концентраций цистатина С, NGAL и L-FABP в сыворотке крови каждого больного дает более достоверную информацию о риске развития ОПП, чем анализ средних величин концентраций биомаркеров.
Динамика средних значений концентраций биомаркеров в сыворотке крови и в моче пациентов представлена в табл. 1-4.
Таблица / Table 1.
Концентрации биомаркеров в сыворотке крови больных, у которых не развилось ОПП
Serum concentration of biomarkers in patients without AKI
| Цист С, нг/мл Cystatin С, ng\rnl | KIM-1, нг/мл KIM-1, ng\ml | NGAL, нг/мл NGAL, ng\ml | ИЛ-18, пг/мл IL-18, pg\ml | L-FABP, пг/мл L-FАВР, pg\rnl |
|---|---|---|---|---|---|
До операции Before the surgery | |||||
Средние значения концентраций Mean concentration level | 971,34±272,14 | 0,18±0,10 | 3,41 ±1,55 | 51,35±56,85 | 462,01±188,45 |
Через 16 часов после операции 16 hours after the surgery | |||||
Средние значения концентраций Mean concentration level | 1171,46±392,63 | 0,18±0,08 | 3,41 ±1,46 | 49,45±42,19 | 559,10±250,41 |
Таблица / Table 2.
Концентрации биомаркеров в сыворотке крови больных, у которых развилось ОПП
Serum concentration of biomarkers inpatients with AKI
| Цист С, нг/мл Cystatin С, ngXml | KIM-1, нг/мл KIM-1, ngXml | N GAL, нг/мл NGAL, ngXml | ИЛ-18, пг/мл IL-18, pgXrnl | L-FABP, пг/мл L-FABP, pgXrnl |
|---|---|---|---|---|---|
До операции Before the surgery | |||||
Средние значения концентраций Mean concentration level | 1288,75±57,22 | 0,14±0,10 | 3,03±0,74 | 82,15±118,28 | 1143,35±1490,37 |
Через 16 часов после операции 16 hours after the surgery | |||||
Средние значения Mean concentration level концентраций | 1393,61±639,73* | 0,11 ±0,08 | 4,15±1,65* | 84,88±88,25 | 1314,84±484,33* |
Таблица / Table 3
Концентрации биомаркеров в моче больных, у которых не развилось ОПП
Urinary concentration of biomarkers inpatients without AKl
| Цист С, нг/мл Cystatin С, ng\ml | KIM-1, нг/мл KIM-1, ng\ml | NGAL, нг/мл NGAL, ng\ml | ИЛ-18, пг/мл IL-18, pgXrnl | L-FABP, пг/мл L-FABP, pgXrnl |
|---|---|---|---|---|---|
До операции Before the surgery | |||||
Средние значения концентраций Mean concentration level | 1704,89±1613,29 | 1,54±0,93 | 0,17±0,16 | 14,34± 12,13 | 518,86±683,46 |
Через 16 часов после операции 16 hours after the surgery | |||||
Средние значения концентраций Mean concentration level | 1614,81±1058,08 | 1,82± 1,18 | 0,59±0,30 | 27,04±12,78 | 3500,34±2953,83 |
Таблица / Table 4
Концентрации биомаркеров в моче больных, у которых развилось ОПП
Urinary concentration of biomarkers in patients with AKI
| Цист С, нг/мл Cystatin С, ngXml | KIM-1, нг/мл KIM-1, ngXml | NGAL, нг/мл NGAL, ngXml | ИЛ-18, пг/мл IL-18, pgXrnl | L-FABP, пг/мл L-FABP, pgXrnl |
|---|---|---|---|---|---|
До операции Before the surgery | |||||
Средние значения концентраций Mean concentration level | 1341,33±591,55 | 1,20±1,09 | 0,16±0,21 | 23,83±22,92 | 206,60±153,33 |
Через 16 часов после операции 16 hours after the surgery | |||||
Средние значения концентраций Mean concentration level | 3786,14±3376,39 | 2,66±2,15 | 0,40±0,26 | 35,22±32,33 | 8188,45±7315,31 |
Анализ индивидуальных реакций отдельных пациентов позволил идентифицировать специфику стереотипных реакций концентраций цистатина С, NGAL и L-FABP у пациентов с ОПП и без этого синдрома; у больных с развившимся впоследствии ОПП имело место параллельное возрастание исходных концентраций этих маркеров более чем на 10 %.
На основании результатов экспертного анализа полученных результатов клинических и лабораторных исследований была разработана оригинальная персонифицированная шкала риска для ранней диагностики ОПП и ее графическая интерпретация в виде трехмерной модели.
На первом этапе разработки шкалы все выделенные экспертами факторы (риска развития ОПП) были разделены на три группы (отражающие три основных измерения уровня риска развития ОПП). Каждая группа факторов откладывалась на отдельной оси трехмерной модели:
а) показатели, измеряемые до начала операции (исходная концентрация цистатина С в сыворотке крови), ось Z;
б) показатели, измеряемые во время проведения операции (продолжительность ТИП), ось Y;
в) показатели, измеряемые после операции, ось X:
- скорость диуреза;
- изменение концентраций цистатина С, NGAL и L- FABP.
Если концентрация цистатина С крови до операции составляла более чем 1000 нг/мл, то этому показателю присваивали условное числовое значение в I балл (полученное условное числовое значение откладывали по оси Z) (см. табл. 5, рис. 1).
Если продолжительность ТИП составляла от 15 до 21 минуты, то этому показателю присваивалось условное числовое значение в I балл (полученное условное числовое значение откладывали по оси Y) (см. табл. 6, рис. 1).
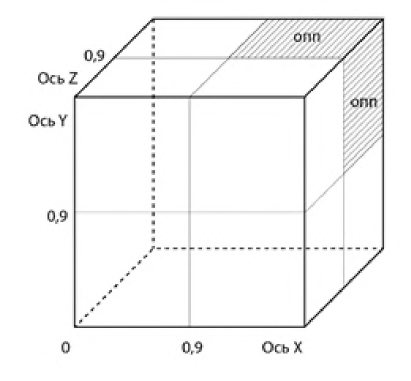
Рисунок 1. Трехмерная модель шкалы экспресс- диагностики ОПП.
Figure 1. Three-dimensional model of the early diagnostic scale of AKI.
Таблица / Table 5
Предоперационный уровень цистатина С (ось Z) в крови пациентов
Serum Cystatin С concentration (axis Z) inpatients
Показатель Index | 0 баллов (Z = 0) 0 score (Z = O) | 1 балл (Z = I) 1 score (Z = I) |
|---|---|---|
Цистатин С крови до операции Serum cystatain С concentration in patient before surgery | < 1000 нг/мл (ng\ml) | > 1000 нг/мл (ng\ml) |
Таблица / Table 6
Продолжительность ТИП (ось Y) при резекции почки
Duration of warm ischemia time (WIT) during partial nephrectomy (axis Y)
Показатель Index | 0 баллов (Z = 0) 0 score (Z = 0) | 1 балл (Z = 1) 1 score (Z = 1) |
|---|---|---|
Продолжительность ТИП | <15 мин. | 15-21 мин. |
Duration of WIT | <15 min | 15-21 min |
На втором этапе были определены весовые коэффициенты, отражающие относительную значимость каждого откладываемого по оси X показателя (по отношению к остальным формирующим данную ось величинам).
Весовые коэффициенты межу формирующими ось X элементами были распределены следующим образом:
- скорость диуреза — 0,4;
- концентрация цистатина С — 0,2;
- концентрация NGAL — 0,2;
- концентрация L-FABP — 0,2.
Концентрациям биомаркеров, измеренных через 16 часов после операции, присваиваются соответствующие символы, которые затем используются в формуле расчета уровня риска развития ОПП:
- концентрации цистатина С присваивается символ b,
- концентрации NGAL присваивается символ с;
- концентрации L-FABP присваивается символ d
При этом при расчете уровня риска развития ОПП используются следующие балльные оценки:
- b = 0, если через 16 часов после операции прирост концентрации цистатина С крови составил < 10 % b = 1, если через 16 часов после операции прирост концентрации цистатина С крови составил > 10 %;
- с= 0, если через 16 часов после операции прирост концентрации NGAL крови составил < 10 %; с = 1, если через 16 часов после операции прирост концентрации NGAL крови составил > 10 %;
- d = 0, если через 16 часов после операции прирост концентрации L-FABP крови составил < 10 %; d = 1, если через 16 часов после операции прирост концентрации L-FABP крови составил > 10 %;
Показателю скорости диуреза больного присваивался символ а. Если через 16 часов после операции скорость диуреза составляла <70 мл/час, то этому показателю присваивалось условное числовое значение в I балл (а = 1).
Если через 16 часов после операции скорость диуреза составляла > 70 мл/час, то этому показателю присваивалось условное числовое значение в 0 баллов (а = 0) (см. табл. 3, рис. 1).
Сумма символов а, b и с, умноженных на соответствующий весовой коэффициент, составляла условное числовое значение, которое откладывали по оси X (см. табл. 7, рис. 1).
Таблица / Table 7
Таблица подсчёта скорости диуреза, прироста концентраций маркеров ОПП в крови через 16 часов после операции (ось X)
Tablefor calculating the rate of diuresis, increase in concentration of markers of AKI in blood serum in 16 hours after the surgery
Показатель Index | Весовой коэффициент Weight coefficient | 0 баллов 0 score | 1 балл 1 score | Результат (произведение числа баллов на весовой коэффициент) Residts (multiplying the number of points by the weighting factor) |
|---|---|---|---|---|
Скорость диуреза (a) Rate of diuresis | 0,4 | >70 мл/час > 70 ml/h | <70 мл/час < 70 ml/h |
|
Прирост концентрации цистатина С крови (b) Increase in serum cystatain C concentration in patient | 0,2 | < 10 % | > 10 % |
|
Прирост концентрации NGAL крови (с) Increase in serum NGAL concentration in patient | 0,2 | <10 % | > 10 % |
|
Прирост концентрации L-FABP крови (d) Increase in serum L-FABP concentration in patient | 0,2 | < 10 % | > 10 % |
|
Итого по оси X Total along the axis |
| |||
Затем по формуле рассчитывали сумму баллов а,
а = X + Y + Ζ,
где X = a*0,4 + b*0,2 + с*0,2 + d*0,2;
0,4; 0,2 — весовые коэффициенты.
Если полученная сумма баллов (а) попадала в числовой интервал 2,8 < а < 3, то диагностировали ОПП.
Трехмерная модель шкалы представлена на рис. 1.
Если на представленной модели (рис.1), все прямые, проведенные из точек, соответствующих полученным числовым значениям, пролегали через заштрихованную зону, то это указывало, что у данного больного развилось ОПП.
На третьем этапе была сформирована трёхмерная персонифицированная шкала риска для ранней диагностики ОПП (см. рис. 1).
Обсуждение
Полученные результаты указывают на достаточно большие индивидуальные колебания концентраций маркеров ОПП у разных пациентов, что в существенной степени затрудняет как анализ средних значений показателей, так и идентификацию собственно информативных изменений. Включенные в метод факторы, по которым оценивается уровень риска развития ОПП, отражают различные источники формирования данного синдрома. В частности, о наличии у больного скрытых форм почечной недостаточности свидетельствуют высокие исходные концентрации цистатина С; повреждающее воздействие длительной ТИП на фоне хирургической травмы является триггером развития ОПП. Выявленный в данном исследовании синхронный рост концентраций цистатина С, NGAL и L-FABP позволяет идентифицировать эти факторы в качестве индикаторов нарушения функции почечной паренхимы.
Заключение
Результаты проведенных исследований указывают на то, что динамика концентраций биомаркеров цистатина С, L-FABP и NGAL в сыворотке крови коррелирует со снижением функции почек в послеоперационном периоде и в совокупности с такими показателями, как скорость диуреза и продолжительность ТИП, может быть использована в качестве основы способа ранней диагностики ОПП в клинической практике. Применение разработанного способа позволяет диагностировать развитие ОПП у больных, подвергнутых резекции почки в условиях ТИП уже через 16 часов после оперативного вмешательства (до начала возрастания уровня креатинина), что, в свою очередь, позволяет начать мероприятия по своевременному предупреждению и лечению данного осложнения (исключить нефротоксические препараты, начать нефропротективную инфузионную терапию или заместительное лечение).
Список литературы
1. Porpiglia F., Fiori C., Bertolo R., Morra I., Russo R., et al. Long-term functional evaluation of the treated kidney in a prospective series of patients who underwent laparoscopic partial nephrectomy for small renal tumors. // European Urology. – 2012. – Vol. 62(1). – P. 130 – 135. doi: 10.1016/j.eururo.2012.02.001
2. Димитриади С.Н., Кит О.И., Медведев В.Л. Технические особенности выполнения лапароскопической резекции почки при почечно-клеточном раке. // Онкоурология. – 2014. – Т. 10, №2. – С.16-21. Doi: 10.17650/1726-9776-2014-10-2-16-21
3. Hoste E.A., Clermont G., Kersten A., Venkataraman R., Angus D.C., et al. RIFLE criteria for acute kidney injury are associated with hospital mortality in critically ill patients: a cohort analysis. // Crit Care. – 2006. – Vol. 10. – N. 3. – P. 73. DOI: 10.1186/cc4915
4. KDIGO Clinical Practice Guideline for Acute Kidney Injury. - Kidney International Supplements; 2012. doi:10.1038/kisup.2012.1
5. Якубцевич Р. Э., Спас В. В., Протасевич П. П. Современные подходы к оценке острого повреждения почек (классификация, диагностика) Часть 1. // Журнал Гродненского государственного медицинского университета. – 2016. – №2. – С. 22–24.
6. Ермоленко В. М., Николаев А. Ю. Острая почечная недостаточность. - М.: ГОЭТАР-Медиа. – 2010.
7. Charlton J.R., Portilla D., Okusa M.D. A basic science view of acute kidney injury biomarkers. // Nephrol Dial Transplant. – 2014. – V. 29(7). – P. 1301-11. doi: 10.1093/ndt/gft510
Об авторах
С. Н. ДимитриадиРоссия
Димитриади Сергей Николаевич, старший научный сотрудник отделения онкоурологии, д.м.н.
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Е. М. Франциянц
Россия
Франциянц Елена Михайловна, заместитель генерального директора по науке, руководитель лаборатории патогенеза злокачественных опухолей, д.б.н., профессор.
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Н. Д. Ушакова
Россия
Ушакова Наталья Дмитриевна, врач-анестезиолог-реаниматолог отделения анестезиологии и реанимации, д.м.н., профессор.
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Д. А. Розенко
Россия
Розенко Дмитрий Александрович, заведующий отделением анестезиологии и реанимации, врач-анестезиолог-реаниматолог.
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
А. В. Величко
Россия
Величко Алексей Вячеславович, врач-аспирант.
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Рецензия
Для цитирования:
Димитриади С.Н., Франциянц Е.М., Ушакова Н.Д., Розенко Д.А., Величко А.В. Биомаркеры в диагностике острого повреждения почек после органосохраняющего хирургического лечения локализованного рака почки. Медицинский вестник Юга России. 2018;9(3):77-83. https://doi.org/10.21886/2219-8075-2018-9-3-77-83
For citation:
Dimitriadi S.N., Frantsiyants E.M., Ushakova N.D., Rozenko D.A., Velichko A.V. Biomarkers in diagnostics of acute kidney injury after the organ-preserving surgery of localized renal cancer. Medical Herald of the South of Russia. 2018;9(3):77-83. (In Russ.) https://doi.org/10.21886/2219-8075-2018-9-3-77-83






































