Перейти к:
Робот-ассистированные и торакоскопические операции в лечении больных с опухолями вилочковой железы
https://doi.org/10.21886/2219-8075-2018-9-2-15-25
Аннотация
Цель: сравнительный анализ результатов хирургического лечения пациентов с опухолями тимуса посредством выполнения стернотомии и торакотомии (СТ), видеоторакоскопических (ВТС) и робот-ассистированных (РА) вмешательств. Материалы и методы: проанализированы результаты хирургического лечения 138 пациентов с новообразованиями вилочковой железы (ВЖ): СТ выполнено 78-ми больным, ВТС – 47-ми, РАО – 13-ти (65 мужчин, 73 женщины). Средний возраст больных составил 50,5±12,7 лет (от 19 до 81 года). Результаты: Средняя длительность операции при СТ тимомтимэктомии (ТТЭ) составила 91,2±33,4 мин., при ВТС – 93,6±25,5 мин., при РА – 142,7±26,9 мин. После СТ у 6 (7,7 %) пациентов были осложнения в послеоперационном периоде, у 2 (2,6 %) летальный исход. После ВТС у одного больного осложнилось послеоперационное течение. Длительность пребывания пациента в стационаре после СТ ТТЭ составила 10,1±3,6 сут., после ВТС – 6,6±1,9 сут., после РА — 6,3±1,4 сут. Локорегиональных рецидивов и прогрессирования заболевания в отдаленном периоде не выявлено. Хорошие эффекты (А и В) после ВТС ТТЭ достигнуты в 20,0 % случаев, при РА – в 27,3 %, а при СТ ТТЭ – в 8,4 % наблюдений. Заключение: продемонстрированы безопасность и эффективность миниинвазивных технологий (МИТ) в хирургическом лечении пациентов с тимомами, установлены преимущества ВТС и РА ТТЭ в сравнении с СТ.
Ключевые слова
Для цитирования:
Ветшев П.С., Аблицов А.Ю., Санадзе А.Г., Аблицов Ю.А., Василашко В.И., Крячко В.С., Лукьянов П.А., Магомедов Б.А. Робот-ассистированные и торакоскопические операции в лечении больных с опухолями вилочковой железы. Медицинский вестник Юга России. 2018;9(2):15-25. https://doi.org/10.21886/2219-8075-2018-9-2-15-25
For citation:
Vetshev P.S., Ablitsov A.Yu., Sanadze A.G., Ablitsov Yu.A., Vasilashko V.I., Kryachko V.S., Lukyanov P.A., Magomedov B.A. Robot-assisted and thoracoscopic surgery in the treatment of patients with tumors of the thymus gland. Medical Herald of the South of Russia. 2018;9(2):15-25. (In Russ.) https://doi.org/10.21886/2219-8075-2018-9-2-15-25
Введение
Опухоли вилочковой железы (ВЖ), или тимуса, являются наиболее частыми новообразованиями переднего средостения. Для их обозначения в 1900 г. H. Grandhomme и R. Scminke предложили термин «тимома». Большинство отечественных и зарубежных специалистов к опухолям тимуса относят только органоспецифические новообразования. Эти опухоли отвечают следующим критериям: а) гистогенез тимомы связан с эпителиальным компонентом тимуса; б) опухолевые эпителиальные клетки обладают минимальной атипией; в) лимфоидный слой тимуса не подвергается опухолевой трансформации [1][2][3][4][5][6][7][8][9].
Среди всех опухолевых заболеваний удельный вес тимом составляет примерно 0,2-1,5 % случаев. Они встречаются у 10-40 % пациентов с новообразованиями переднего средостения [10]. В свою очередь, общий объем тимом достигает 90 % среди всех опухолей ВЖ. У мужчин и женщин тимомы встречается в практически одинаковом соотношении, с частотой 0,15 случаев на 100000 населения.
Согласно гистологической классификации эпителиальных новообразований тимуса, предложенной экспертами ВОЗ, выделяют несколько типов тимом:
- Тип А (медулярноклеточные, темноклеточные, веретеноклеточные).
- Тип АВ (смешанные тимомы).
- Тип В1 (преимущественно кортикальноклеточные, лимфоидные, органоидные).
- Тип В2 (кортикальноклеточные).
- Тип В3 (эпителиальные, плоскоклеточные, атипичные, высокодифференцированный рак тимуса).
- Тип С (карциномы тимуса).
При относительно низком (менее 4 %) потенциале лимфогенного (или гематогенного) распространения тимомы сохраняют высокую способность к инвазивному росту и образованию имплантационных метастазов плевральной полости, что во многом зависит от морфологического типа опухоли. Следует отметить, что наиболее агрессивным ростом обладают тимомы типа В2, В3 и карцинома тимуса. Намного реже встречаются метастазы при тимомах типа А, АВ и В1. Так же к прогностическим критериям при лечении пациентов относят степень инвазии опухоли или стадию заболевания (табл. 1).
Таблица/Table I.
TNM классификация от ВОЗ (2015)
TNM classification from WHO (2015)
T (первичная опухоль) (primary tumor) | Тх - первичная опухоль не может быть определена / primary tumor cannot be assessed Т0 - нет признаков первичной опухоли / no evidence of primary tumor Т1 - полностью инкапсулированная опухоль / tumor completely encapsulated Т2 - опухоль прорастает в окружающую жировую клетчатку / tumor invades pericapsular connective tissue Т3 - опухоль прорастает в соседние структуры (перикард, средостение, плевру, грудную стенку, крупные сосуды и легкие) / tumor invades into neighboring structures (pericardium, mediastinal pleura, thoracic wall, great vessels and lung) Т4 - диссеминация опухоли по перикарду или плевре / tumor with pleural or pericardial dissemination |
N (регионарные лимфатические узлы) (regional lymph nodes) | Nх - нет объективных данных о метастазах в регионарных лимфоузлах / regional lymph nodes cannot be assessed N0 - отсутствие метастазов в регионарные лимфатические узлы / no regional lymph node metastasis N1 - метастазирование в лимфоузлы переднего средостения / metastasis in anterior mediastinal lymph nodes N2- наличие метастазов в другие внутригрудные лимфатические узлы, кроме лимфоузлов переднего средостения / metastasis in other intrathoracic lymph nodes excluding anterior mediastinal lymph nodes N3 - метастазирование в прескаленные и/или надключичные лимфоузлы / metastasis in scalene or supraclavicular lymph nodes |
М (отдаленные метастазы) (distant metastasis) | Мх - нет объективных данных о наличии отдаленных метастазов / distant metastasis cannot be assessed М0 - нет отдаленных метастазов / no distant metastasis М1 - наличие отдаленных метастазов / distant metastasis |
Группирование стадий по TNM:
- стадия - T1N0M0;
- стадия - T1N0M0;
- стадия - T1N1M0; T2N1M0; T3N(0,1)M0;
- стадия - T4N(0,1,2,3)M0; T(0,1,2,3,4)N(2,3)M0; T(0,1,2,3,4)N(0,1,2,3)M1.
На начальных стадиях новообразования ВЖ, как правило, могут протекать бессимптомно. Их выявление возможно лишь при профилактических рентгенологических обследованиях. Нередко клиническое течение опухолей тимуса связано с таким заболеванием как генерализованная миастения (ГМ). Различные клинические формы ГМ сопровождают тимомы в 25-75 % случаев. В свою очередь, у 15-20 % больных данной патологией выявляют новообразования ВЖ [1][3][4][6][10][11][12].
Состояние пациентов оценивают согласно тяжести клинических проявлений миастении по классификации американского фонда ГМ (МGFA) [13], где
1 - изолированная слабость только окулярных мышц, во всех других мышцах сила нормальная;
2А - преобладание умеренной слабости мышц туловища, либо проксимальных отделов конечностей, либо и того и другого;
2В - преобладание умеренной слабости бульбарной и дыхательной мускулатуры либо и того и другого;
ЗА - преобладание средней степени слабости мышц туловища, либо проксимальных отделов конечностей, либо и того и другого;
ЗВ - преобладание средней степени слабости бульбарной и дыхательной мускулатуры либо и того и другого;
4А - преобладание тяжелой степени слабости мышц туловища, либо проксимальных отделов конечностей, либо и того и другого;
4В - преобладание тяжелой степени слабости бульбарной и дыхательной мускулатуры либо и того и другого;
5 - интубация с или без механической вентиляции, кроме случаев обычных послеоперационных вмешательств.
В отдельных случаях заболевание может принимать кризовое течение в виде миастенического, холинергического или смешанного криза, что проявляется выраженным нарушением функции бульбарной и дыхательной мускулатуры, требующей перевода пациентов на ИВЛ. Кризы существенно утяжеляют состояние пациентов и наблюдаются у 10-30 % больных ГМ. Наибольший риск развития криза возникает при ГМ 2В и 3В. Важно отметить, что при отсутствии миастении и характерных синдромов клинические признаки тимомы появляются уже на поздней стадии в результате компрессии соседних органов, которая проявляется болями в грудной клетке, одышкой, кашлем, нарушениями сердечного ритма. Широкое использование в диагностике МСКТ привело к более ранней диагностике опухолей тимуса и способствовало улучшению результатов лечения больных, благодаря увеличению числа пациентов с ранними стадиями заболевания.
Наличие тимомы является показанием к проведению планового оперативного вмешательства, а наиболее радикальным методом лечения считают тимомтимэктомию (ТТЭ), которая заключается в полном удалении тимомы вместе с ВЖ, окружающей жировой клетчаткой и лимфатическими узлами переднего средостения [4][9][10][12][14]. Долгие годы в качестве основного доступа для ТТЭ использовали полную, а затем частичную срединную стернотомию или торакотомию (СТ). Развитие видеоэндоскопических систем, фиброволоконных светопроводников и микроинструментария изменили методические подходы к хирургическому лечению пациентов с тимомами. Появились публикации об удалении опухолей тимуса с помощью миниинвазивных технологий (МИТ), таких как видеоторакоскопическая (ВТС) и робот-ассистированная (РА) ТТЭ [2][14][15][16]. Появление альтернативных методик и расширение «хирургической линейки» заставило специалистов задуматься о выборе оптимального способа хирургического лечения новообразований ВЖ.
Pfister W.A. и соавт. [11] опубликовали данные о 22-х пациентах с I и II стадией тимомы, оперированных при помощи МИТ. В группе ВТС ТТЭ было 8 больных, в группу РА вмешательств вошло 14 человек. Среднее время ВТС операции составило 92 минуты, при РА удалении тимомы - 137 минут. Среднее время пребывания пациентов стационаре в группах - около 5 дней. В ходе наблюдения, которое длилось 22 месяца, был выявлен один случай локальной рецидива. Явных преимуществ одного метода в сравнении с другим не установлено.
Pennathur A. и соавт. [12] сообщили о результатах оперативного лечения 40-ка пациентов с тимомами I и II стадии. Удаление опухоли посредством СТ выполнено у 22-х больных, ВТС ТТЭ выполнена у 18-ти пациентов. Длительность пребывания в стационаре оказалась короче в группе МИТ. В ходе наблюдения существенных различий по рецидиву заболевания и 5-летней выживаемости в группах не выявлено.
Ye В. и соавт. [16] сообщили о результатах лечения 46 больных с I стадией тимомы, из которых ВТС вмешательство выполнено 25-ти пациентам, РА ТТЭ — 21-му больному. Длительность операции и интраоперационная кровопотеря достоверно не отличались у двух групп. Послеоперационное пребывание в стационаре (3,7 и 6,7 дня) и срок дренирования плевральной полости (1,1 и 3,6 дня) были короче в группе больных, перенесших РА вмешательство. Рецидивов заболевания в сравниваемых группах не отмечено. По данным этого исследования выделены незначительные преимущества роботизированного комплекса в хирургическом лечении тимом, но также отмечена более высокая стоимость этого метода, что естественно.
Rowse P.G. и соавт. [17] опубликовали опыт 56-ти ТТЭ у пациентов с I и II стадиями заболевания. У 45-ти больных выполнено ВТС вмешательство, в 11-ти случаях произведено РА удаление опухоли ВЖ. Продолжительность операции была меньше при ВТС способе. В то же самое время не было никаких различий по времени пребывания в стационаре и рецидиву заболевания в сравниваемых группах. В ходе своего исследования авторы отметили преимущества видеоторакоскопии над роботизированным комплексом.
Xie А. и соавт. [18] провели сравнительный мета-анализ хирургического лечения 1061 пациента с тимомой на основании 414-ти публикации. ВТС методика применена у 540-ка больных, в 521-м случае опухоль удалена посредством СТ. Средний объем отделяемого по дренажу и средняя продолжительность пребывания в стационаре была больше у пациентов, оперированных из СТ. Показатели выживаемости и безрецидивного течения были выше в группе МИТ.
Friedant A.J и соавт. [19] сравнили данные 516-ти статей с общим числом пациентов, равным 2038-ми. В группе больных, в лечении которых использованы МИТ, 94,89 % имели I и II стадию тимомы, по Masaoka. В группе традиационных вмешательств этот показатель был равен 78,62%. Пациенты, оперированные с помощью МИТ, имели значительно меньшие объем кровопотери и длительность пребывания в стационаре. Однако существенных различий по длительности операции, наличию послеоперационных осложнений и рецидиву заболевания между группами не выявлено.
Использование видеоторакоскопии и роботизированного комплекса, по сравнению с открытым доступом, несомненно снижает операционную травму, риски респираторных и сердечно-сосудистых осложнений после операции за счет меннее травматичного доступа и более прецизионной техники. К положительным факторам также относят ускорение реабилитации и сокращение продолжительности пребывания пациентов в хирургическом ТТЭ [11][13][18][20][21][22][23][24][25]. Кроме того, в литературе пока недостаточно данных для корректного сравнительного анализа ВТС и РА операций, а мнения исследователей не во всем совпадают [17][26], поэтому накопление опыта, а также объективная оценка ближайших и отдаленных результатов миниинвазивных способов ТТЭ представляют несомненный научно-практический интерес.
Цель исследования: сравнительный анализ результатов хирургического лечения пациентов с опухолями тимуса посредством выполнения открытых, ВТС и робот- РАО вмешательств.
Материал и методы
Под наблюдением находились 138 пациентов с новообразованиями ВЖ, из которых 78-ми больным выполнено открытое удаление опухоли, 47-ми - ВТС операция, 13-ти - РА вмешательство (65 мужчин и 73 женщины). Возраст больных с тимомами - от 19 до 81 года (в среднем, 50,5±12,7). По возрасту, полу, сопутствующим заболеваниям, стадии опухолевого поражения (TNM), клинической форме и тяжести миастении группы пациентов были сопоставимы (р>0,05). Необходимо отметить, что в последние годы отмечаем рост миниинвазивных ТТЭ, что связано с приобретением опыта, необходимого для выполнения этих вмешательств, и ощутимыми их преимуществами (рис. 1).
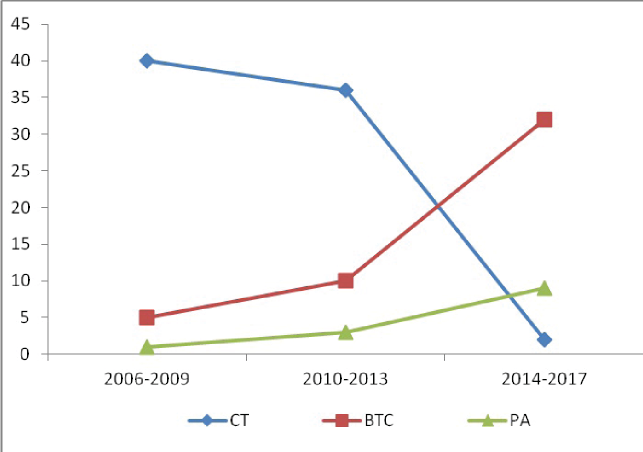
Рисунок 1. Динамика оперативных вмешательств по годам.
Figure 1. Dynamics of surgical interventions by years.
У 108 (78,3 %) из 138-ми пациентов опухоли тимуса были ассоциированы с различными клиническими проявлениями генерализованной миастении. Чаще всего встречалась миастения 2В и 3В. Средний размер тимомы в данной группе больных был 5,4±2,9 см. В 20 (14,5 %) случаях отмечены жалобы, указывающие на развитие компрессионного синдрома переднего средостения. Остальные 10 пациентов (7,3 %) имели бессимптомное течение заболевания. Средний размер новообразования ВЖ в группе больных без миастении был 8,4±4,4 см.
Обязательным методом обследования больного при подозрении на опухоль тимуса считается МСКТ, а при необходимости — с контрастным усилением. Также использовали МРТ в случае подозрения на инвазивный рост или распространение тимомы на легкие и другие органы переднего средостения. Результаты этих исследований представляют наиболее полную информацию для выбора адекватного метода лечения (рис. 2).
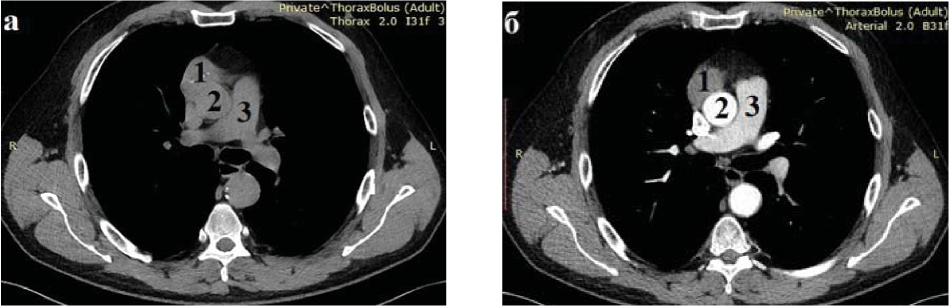
Рисунок 2. КТ органов грудной клетки без контрастного (а) и с контрастным усилением (б): 1 - тимома; 2 - аорта; 3 - легочный ствол.
Figure 2. СТ of the chest without contrast (a) and with contrast enhancement (b): 1 - thymoma; 2 - aorta; 3 - pulmonary trunk.
Миниинвазивные операции выполняли как из правостороннего, так и из левостороннего доступа. Следует отметить что к моменту проведения первой РА операции мы располагали большим опытом открытых и ВТС вмешательств на средостении, выполненных как через правую, так и левую плевральные полости, что было описано ранее [17][21]. Хотя ряд зарубежных исследователей рекомендуют левосторонний доступ при операциях на ВЖ [16][24][25], но наиболее оправданным считается правосторонний доступ. Это связано с большим пространством в правой плевральной полости и лучшими возможностями для движения манипуляторов. Также при операциях на переднем средостении один из троакаров вводится в плевральную полость в 5-м межреберье по среднеключичной линии. В этом положении при вмешательстве через левую плевральную полость инструмент может оказывать давление на сердце, приводя в некоторых позициях к нарушениям сердечной деятельности. Отсутствие тактильной чувствительности при РА операции не всегда позволяет надежно предотвратить это осложнение.
Из 78-ми пациентов, оперированных посредством СТ, в 41 (52,6 %) случае выполнена ТТЭ. У 36 (46,2 %) больных выполнена расширенная ТТЭ, дополненная резекцией пораженных опухолью соседних органов - легкого, перикарда, плевры, левой или правой плечеголовной вены. У 1 (1,2 %) пациента выполнена циторедуктивная операция с удалением большей части опухоли. Чаще всего использовали срединную стернотомию (64), реже - боковую правостороннюю (9) и левостороннюю (5) торакотомию.
В группе ВТС вмешательств 37 (78,2 %) пациентам выполнена ТТЭ, в 4 (8,5 %) случаях - расширенная ТТЭ с резекцией плевры и перикарда, у 6 (12,8 %) больных - циторедуктивная операция. Через правую плевральную полость выполнены 37 оперативных вмешательств, 10 - через левую плевральную полость (рис. 3).
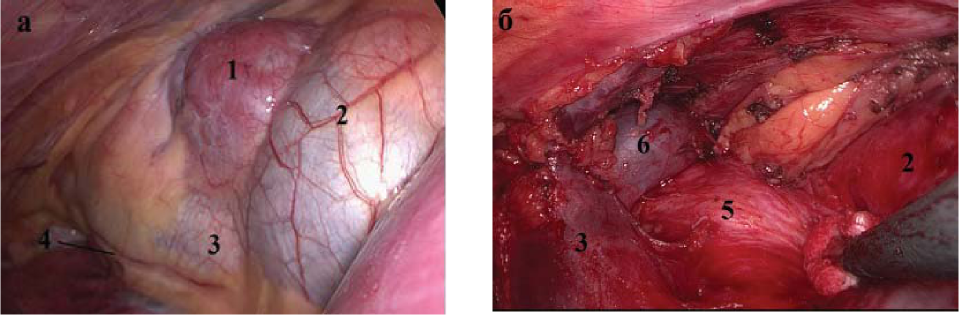
Рисунок 3. Макрофото переднего средостения до начала ТТЭ (а) и после удаления опухоли ВЖ (б): 1 - тимома, 2 - перикард, 3 - верхняя полая вена, 4 - правый диафрагмальный нерв, 5 - аорта, 6 - левая плечеголовная вена.
Figure 3. Macrophoto of anterior mediastinum to the beginning of the TTE (a) and after removal of the tumor TG (b): 1 - thymoma, 2 pericardium, 3 - upper hollow vein, 4 - right phrenic nerve, 5 - aorta, 6 - left brachiocephalic vein.
С помощью роботизированного комплекса Da Vinchi 10 (76,9 %) пациентам выполнена ТТЭ; 2 (15,4 %) - расширенная ТТЭ, 1 (7,7 %) - циторедуктивная операция. Все операции выполнены из правостороннего доступа (рис. 4). В сравниваемых группах конверсий не было.
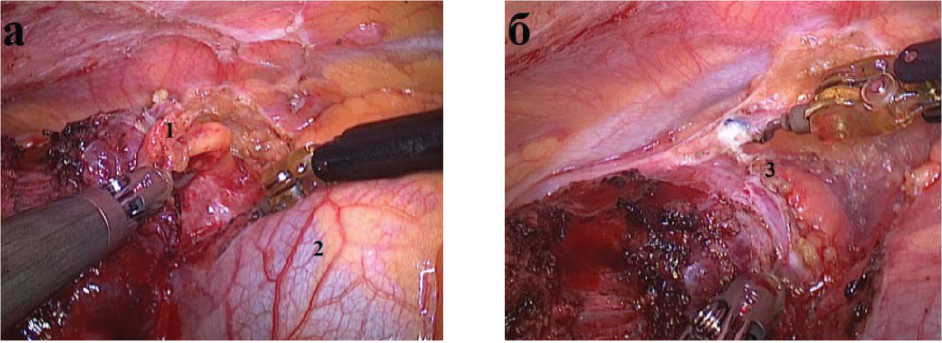
Рисунок 4. Этапы РА операции: а - отделение тимомы (1) от перикарда (2); б - мобилизация верхних отростков тимуса (3) - правый отросток.
Figure 4. Stages of RA operation: a - separation of thymoma (1) from pericardium (2); b - mobilization of the upper processes of thymus (3) - right process.
Все мининвазивные вмешательства на ВЖ выполняли под общим обезболиванием с раздельной интубацией бронхов. Следует отметить некоторые различия анестезиологического обеспечения РА операций от ВТС. Главной особенностью является затрудненный доступ анестезиолога к голове пациента после установления робот-хирургической консоли. Контроль всех параметров жизнедеятельности во время операции традиационно проводится по монитору анестезиолгогического комплекса.
Перевод на самостоятельное дыхание и экстубацию обычно выполняли на операционном столе. При тяжелом течении миастении с необходимостью продленной искусственной вентиляции легких в послеоперационном периоде, в операционной пациента переинтубировали на однопросветную эндотрахеальную трубку и переводили на аппаратном дыхании в реанимацию, где в последующем принимали решение о возможности экстубации по мере восстановления самостоятельного дыхания.
Статистические расчеты выполнены на персональном компьютере с использованием приложения Microsoft Excel и пакета статистического анализа данных SPSS v.13. Для сравнения средних величин и установления значимости различий между группами проводили статистическую обработку по непараметрическим тестам Манна-Уитни и Краскела-Уоллисса. Различия считали статистически значимыми при р<0,05.
Результаты
Окончательное определение степени инвазии и стадии заболевания проводили по классификации TNM (2015) на основании интраоперационной ревизии опухолевого процесса и заключения патоморфологического исследования всех удалённых препаратов (табл. 2).
Таблица/Table 2.
Распределение пациентов по стадии заболевания
The distribution of patients by stage of disease
Стадия заболевания по TNM The stage of the disease according to TNM | Число пациентов / Number of patients | |||
|---|---|---|---|---|
ВТС / VTS (n=47) | РА / RA (n=13) | СТ / ST (n=78) | Всего / Total (n=138) | |
Стадия I / Stage I | 13 (27,7 %) | 2 (15,4 %) | 11 (14,1%) | 26 (18,8%) |
Стадия II / Stage II | 25 (53,2 %) | 8 (61,5 %) | 30 (38,5%) | 63 (45,7%) |
Стадия III / Stage III | 8 (17,0 %) | 3(23,1 %) | 36 (46,2%) | 47 (34,1%) |
Стадия IV / Stage IV | 1(2,1 %) | - | 1(1,3%) | 2 (1,5%) |
При гистологическом исследовании удаленной опухоли установлен морфологический тип тимомы на основании классификации опухолей тимуса (ВОЗ 2015 г.). Все удаленные новообразования относились к истинным тимомам - опухолям тимуса эпителиального происхождения. Более подробное распределение гистологических типов опухоли представлено в табл. 3.
Таблица/Table 3.
Распределение пациентов по гистологическому типу опухоли
The distribution of patients according to histological type of the tumor
Гистологический тип опухоли Histological type of tumor | Число пациентов / Number of patients | |||
|---|---|---|---|---|
ВТС / VTS (n=47) | ВТС / VTS (n=47) | ВТС / VTS (n=47) | ВТС / VTS (n=47) | |
А | 8 (17,0 %) | 2 (15,4 %) | 9 (11,5 %) | 19 (13,8 %) |
АВ | 8 (17,0 %) | 1 (7,7 %) | 12 (15,4 %) | 21 (15,2 %) |
В1 | 13 (27,7 %) | 2 (15,4 %) | 24 (30,8 %) | 39 (28,3 %) |
В2 | 9 (19,2 %) | 5 (38,5 %) | 24 (30,8 %) | 38 (27,5 %) |
В3 | 5 (10,6 %) | 3 (23,1 %) | 8 (10,3 %) | 16 (11,6 %) |
С | 4 (8,5 %) | - | 1 (1,3 %) | 5 (3,6 %) |
При изучении непосредственных результатов в группах анализу и оценке были подвергнуты следующие показатели: время операции, срок дренирования, продолжительность приема НПВС, длительность послеоперационного койко-дня (табл. 4).
Таблица/ Table 4.
Анализ непосредственных результатов вмешательств
Analysis of immediate results of interventions
Оперативный доступ Operative access | Время операции (мин.) Operation time (min.) | Дренирование (сут.) Drainage (day) | НПВС (сут.) NAID (day) | Койко-день (сут.) Bed-day (day) |
|---|---|---|---|---|
ВТС / VTS | 93,6±25,5 | 1,6±0,7 | 1,9±0,8 | 6,6±1,9 |
РА / RA | 142,7±26,9 | 1,4±0,5 | 1,7±0,9 | 6,3±1,4 |
СТ / ST | 91,2±33,4 | 2,1±0,6 | 3,7±0,7 | 10,1±3,6 |
р | <0,05 | <0,05 | <0,05 | <0,05 |
Примечание. Время операции - период от разреза до наложения последнего шва. При РА операций с учетом докинга.
Note: The operation time is the period from the cut to the last seam. In RA operation with regard to docking
Во всех анализируемых группах интраоперационных осложнений не зафиксировано. При открытых вмешательствах у 6 (7,7 %) из 78 пациентов были осложнения в послеоперационном периоде: миастенический криз - 2 наблюдения, внутриплевральное кровотечение - 2 случая, пневмоторакс - 1, фибрилляция предсердий - 1. Самым тяжелым осложнением после операции является возникновение криза на фоне тяжелой ГМ 3В. У одного пациента развился криз на 2-е сутки, что потребовало проведение реанимационных мероприятий и повторной интубации с продленной ИВЛ до 5-и суток; у другого больного криз возник на 3-и сутки после вмешательства и потребовал ИВЛ до 6-ти суток. Два эпизода кровотечения в плевральную полость, потребовало рестернотомии и остановки кровотечения. Источниками кровотечения в обоих случаях являлись мелкие венозные сосуды в области ложа вилочковой железы. У одного пациента было выполнено дренирование плевральной полости на 2-е сутки по причине развития спонтанного пневмоторакса. Консервативное лечение по поводу фибрилляции предсердий проводилась в течение 2-х суток.
Было отмечено 2 (2,6 %) летальных исхода. Первый пациент с ГМ 3В умер от дыхательной недостаточности на фоне тяжелой ХОБЛ на 15-е сутки после хирургического вмешательства. Второй больной с миастенией 3А скончался от ТЭЛА на 6-е сутки после операции, не смотря на проводимые профилактические мероприятия.
Послеоперационное течение осложнилось у одного пациента с миастенией 3В после ВТС ТТЭ (2,1 %) в виде ухудшения миастенического статуса, который потребовал продленной ИВЛ до 2-х суток. Летальных исходов не отмечено. В группе РАО послеоперационных осложнений и летальных исходов зафиксировано не было.
Отдаленные результаты оперативного лечения пациентов анализировали, учитывая специфику данного заболевания. В первую очередь изучали онкологический аспект хирургического вмешательства, что включало в себя отсутствие рецидива опухоли и появления метастазов. Для решения этого вопроса больным в течение пяти лет ежегодно выполняли компьютерную томографию органов грудной клетки.
У больных с ГМ через год проводили анализ выраженности и эффективности компенсации миастенических расстройств после операции согласно международной классификации клинических проявлений: эффект А (полная безмедикаментозная ремиссия) отсутствие симптомов заболевания длительностью более 1 года без применения специфической терапии; эффект В (медикаментозная ремиссия) - отсутствие симптомов заболевания либо минимальные проявления на фоне приема поддерживающих доз иммуносупрессивных препаратов; эффект С (хорошая компенсация состояния) - существенный регресс симптомов и отсутствие прогрессирования болезни на фоне постоянной антихолинэстеразной и/или иммуносупрессивной терапии; эффект D (отсутствие эффекта терапии) - прогрессирование заболевания, экзацербация симптомов болезни частотой 1 и более раз в год, наличие стойких миастенических проявлений, нарушающих работоспособность и самообслуживание пациентов; эффект Е - летальный исход, в том числе в течение 30 дней после тимомтимэктомии [4][10][13][14]. (рис. 5).

Рисунок 5. Оценка эффективности хирургического лечения миастении в группах на 1 год после операции
Figure 5. Evaluation of the effectiveness of surgical treatment of myasthenia gravis in groups for 1 year after surgery
Обсуждение
Проведенное исследование показало, что у большинства пациентов была II стадия заболевания по TNM с наличием инвазии опухоли в капсулу и жировую клетчатку средостения. Реже всего встречалась IV стадия тимомы с наличием плевральных и перикардиальных имплантов. По гистологическим критериям, в целом, отмечалось преобладание тимом типа В, в частности тимомы типа В1 (28,3 %) и В2 (27,5%). Меньше всего встречались тимомы типа С или так называемые карциномы тимуса, которые наблюдались в 3,6 % случаях. Такое распределение пациентов по морфологическому критерию опухоли соответствовало литературным данным.
При сравнении непосредственных результатов обращает на себя внимание статистически достоверное различие по длительности операций в группах. Большая продолжительность РА ТТЭ, по нашему мнению, связана как с меньшим опытом выполнения этих вмешательств, так и дополнительными затратами на установку робот-хирургического комплекса (докинг). Несмотря на то что средняя длительность миниинвазивных операций выше, чем при открытом доступе, отмечено снижение таких показателей, как срок дренирования плевральной полости и продолжительность послеоперационного койко-дня. Также в группах МИТ отмечено уменьшение выраженности болевого синдрома, что требовало назначения небольших доз НПВС (кетонал, кетопрофен). В тоже время у больным после СТ требовалось назначение наркотических анальгетиков. При этом не выявлено достоверных отличий по остальным показателям в группах МИТ. Это позволяет судить о том, что хирургическая агрессия на организм при МИТ значительно меньше и благоприятно сказывается на восстановлении пациента.
В отдаленные сроки из 8-ми пациентов, которым выполнена циторедуктивная операция, у 7-ми больных отмечено прогрессирование заболевания, что привело к летальному исходу в 3-х случаях. В группе ВТС вмешательств у 1-го пациента с инвазивной тимомой типа В3 наступила стабилизация онкопроцесса после проведенного химиолучевого лечения.
Анализ отделенных результатов радикальных ТТЭ с точки зрения онкологического процесса показал отсутствие локорегиональных рецидивов и прогрессирования заболевания у пациентов во всех группах.
Изучение результатов хирургического лечения ГМ при опухоли тимуса через год, также показало некоторое преимущество МИТ над открытыми вмешательствами. Хорошие эффекты (А и В) после ВТС ТТЭ достигнуты в 20,0 % случаев, после РА - 27,3 %, а после традиционной ТТЭ - в 8,4 % наблюдений. Следует отметить, что 1 случай летального исхода, связанный с осложненным течением ГМ, был только в группе открытых операций, что сопоставимо с ранее опубликованными данными.
Заключение
Таким образом, на основании собственного опыта, совпадающего с данными зарубежных авторов МИТ при хирургическом лечении пациентов с тимомами продемонстрировали безопасность и эффективность. Также были установлены преимущества ВТС и РА технологии при выполнении ТТЭ в сравнении с открытыми операциями. В то же самое время отмечено отсутствие очевидных различий по сравниваемым показателям между группами больных, оперированных с использованием МИТ. Полученные результаты свидетельствуют о целесообразности использования ВТС и РА вмешательств у этой категории пациентов. При этом стоить выделить такие преимущества робот-хирургического комплекса, как более комфортные условия работы оператора, сидящего за удобной консолью; улучшенные движения инструментов (7 степеней свободы движений и возможность поворота на 360 градусов) позволяет производить сложные трехмерные движения, обеспечивая безопасную и комфортную препаровку тканей вблизи сосудов, нервов и в отдаленных отделах контрлатерального средостения; высокое разрешение и трехмерное изображение способствует усилению качества изображения операционного поля; устранение тремора рук обеспечивает точность выполняемых визуально-координационных движений. Отмеченные преимущества РА хирургии могут оказаться полезными при выполнении операций по поводу тимом с инвазией в соседние органы и анатомические структуры, при сложных топографо-анатомических взаимоотношениях, требующих повышенной прецизионности оперирования.
Список литературы
1. Калинин А.П., Майстренко Н.А., Ветшев П.С. Хирургическая эндокринология. - М.-СПб.: Питер, 2004. – 462 с.
2. Никишов В.Н., Сигал Е.И., Сигал А.М., Потанин В.П., Сигал Р.Е., Матвеев В.Ю. Опыт применения видеоторакоскопии при заболеваниях вилочковой железы // Эндоскопический журнал. - 2010. - №3. - С. 18-24.
3. Полоцкий Б.Е., Мачаладзе З.О., Давыдов М.И., Малаев С.Г., Карселадзе А.И., Савёлов Н.А. Новообразования вилочковой железы (Обзор литературы) // Сибирский онкологический журнал. - 2008. - №1. - С. 75–84.
4. Шевченко Ю.Л., Ветшев П.С., Ипполитов Л.И., Животов В.А., Фатьянова А.С. Сорокалетний опыт хирургического лечения генерализованной миастении // Хирургия. – 2004. – № 5. – С. 32-38.
5. Raica М., Ribatti D. Head and neck: Th ymus: Th ymoma: an overview. // Atlas of Genetics and Cytogenetics in Oncology and Haematology. – 2013. – V.17, №3. – P.:221-228.
6. Song Y., Zhou L., Miao F., Chen G., Zhu Y., Gao X. et al. Increased frequency of thymic T follicular helper cells in myasthenia gravis patients with thymoma. // Journal of Th oracic Disease. – 2016. – V.8(3). – P.314-322. doi: 10.21037/ jtd.2016.03.03
7. Th omas C.R., Wright C.D., Loehrer P.J. Th ymoma: State of the Art. // Journal of Clinical Oncology. – 1999. – V.17(7). – P.2280-2289. doi: 10.1200/JCO.1999.17.7.2280
8. Venuta F., Anile M., Diso D., Vitolo D., Rendina E.A., De Giacomo T. et al. Th ymoma and thymic carcinoma. // European Journal of cardio-thoracic Surgery. – 2010. – V.37(1). – P.1325.
9. Ruffi é Р., Gory-Delabaere G., Fervers B., Regnard J.F, Resbeut M. Epithelial tumours of the thymus. // British Journal of Cancer. – 2001. – V.84(2). – P.51–54.
10. Шкроб О.С., Ветшев П.С., Ипполитов И.Х., Зайратьянц О.В., Пономарев А.Б. Тимомы с миастеническим синдромом. // Хирургия. – 1998. – № 6. – С. 95-99.
11. Pfi ster W.A., Baste J.M., Piton N., Bubenheim M., Melki J., Wurtz A. et al. Th ymomectomy by minimally invasive surgery. Comparative study videosurgery versus robot-assisted surgery. // Revue des Maladies Respiratoires. – 2017. – V.34(5). – P.544-552. doi: 10.1016/j.rmr.2017.01.002
12. Pennathur А., Qureshi I., Schuchert M.J., Dhupar R., Ferson P.F., Gooding W.E. et al. Comparison of surgical techniques for early-stage thymoma: Feasibility of minimally invasive thymectomy and comparison with open resection. // Th e Journal of Th oracic and Cardiovascular Surgery. – 2011. – V.141(3). – P. 694-701. doi: 10.1016/j.jtcvs.2010.09.003
13. Разумовский А.Ю., Алхасов А.Б., Митупов З.Б., Санадзе А.Г., Сиднев Д.В., Даллакян Д.Н. и др. Торакоскопическое удаление вилочковой железы при миастении у детей. // Хирургия. – 2013. - №3. – С. 55-60.
14. Xie X., Gan X., Chen B., Shen Z., Wang M., Zhang H. et al. Left - and right-sided video-assisted thoracoscopic thymectomy exhibit similar eff ects on myasthenia gravis. // Journal of Th oracic Disease. – 2016. – V.8(1). – P.124-132. doi: 10.3978/j.issn.2072-1439.2016.01.40
15. Кузин М.И., Шкроб О.С., Тодуа Ф.И., Ветшев П.С., Соколов А.Л., Ипполитов И.Х. и др. Диагностическая и лечебная тактика при опухолевом поражении вилочковой железы у больных миастенией // Хирургия. - 1988. - № 11. - С. 72–77.
16. Ye B., Tantai J.C., Li W., Ge X.X., Feng J., Cheng M. et al. Video-assisted thoracoscopic surgery versus robotic-assisted thoracoscopic surgery in the surgical treatment of Masaoka stage I thymoma. // World Journal of Surgical Oncology. – 2013. – V.11. – P.157. doi: 10.1186/1477-7819-11-157
17. Rowse P.G., Roden A.C., Corl F.M., Allen M.S., Cassivi S.D., Nichols F.C. et al. Minimally invasive thymectomy: the Mayo Clinic experience. // Annals of Cardiothoracic Surgery. – 2015. – V.4(6). – P.519-526. doi: 10.3978/j.issn.2225319X.2015.07.03
18. Xie A., Tiahjiono R., Phan K., Yan T.D. Video-assisted thorascopic surgery versus open thymectomy for thymoma: a systemetic review. // Annals of Cardiothoracic Surgery. – 2014. – V.4(6). – P.495-508. doi: 10.3978/j.issn.2225-319X.2015.08.01
19. Friedant A.J., Handorf E.A., Su S., Scott W.J. Minimally Invasive versus Open Th ymectomy for Th ymic Malignancies: Systematic Review and Meta-Analysis. // Journal of Th oracic Oncology. – 2016. – V.11, №1. – P. 30-38. doi: 10.1016/j. jtho.2015.08.004
20. Аблицов Ю.А., Кашеваров С.Б., Василашко В.И., Аблицов А.Ю., Орлов С.С., Травин Н.О. Видеотехнологии в торакальной хирургии // Вестник НМХЦ им. Н.И.Пирогова. – 2007.- №1.- С. 100-101.
21. Карпов О.Э., Ветшев П.С., Махнев Д.А., Епифанов С.А., Даминов В.Д., Зуев А.А. и др. Инновационные технологии в хирургии и медицинской реабилитации. // Вестник НМХЦ им. Н.И.Пирогова. – 2016.- № 3.- С. 24-31.
22. Курганов И.А., Богданов Д.Ю. Роль и место малоинвазивных хирургических технологий в лечении заболеваний вилочковой железы. // Эндоскопическая хирургия. – 2013. - № 6. – С. 49-54.
23. Li Y., Wang J. Left -sided approach video-assisted thymectomy for the treatment of thymic diseases. // World Journal of Surgical Oncology. – 2014. – V.12(1). – P. 1-7. doi: 10.1186/14777819-12-398
24. Mineo T.C., Pompeo E., Lerut T.E., Bernardi G., Coosemans W., Nofroni I. Th oracoscopic thymectomy in autoimmune myasthesia: results of left -sided approach. // Annals of Th oracic Surgery. – 2000. – V. 69. – P. 1537-1541.
25. Kaufman A.J., Flores R.M. Minimally invasive thymectomy for thymoma: does surgical approach matter or is it a question of stage? // Journal of Th oracic Disease. – 2016. – V.8(12). – P. 1711-1714. doi: 10.21037/jtd.2016.12.104
Об авторах
П. С. ВетшевРоссия
Ветшев Петр Сергеевич, д.м.н., проф., Действительный член Международного хирургического общества (ISS) и Международной ассоциации хирургов-эндокринологов (IAЕS), заместитель председателя Московского общества хирургов, советник генерального директора по клинической и научной работе.
Москва.
А. Ю. Аблицов
Аблицов Алексей Юрьевич, к.м.н., доцент кафедры грудной и сердечно-сосудистой хирургии с курсом рентгенэндоваскулярной хирургии, врач-торакальный хирург. Москва.
А. Г. Санадзе
Санадзе Александр Георгиевич, д.м.н., проф., руководитель отдела нервно-мышечной патологии с Российским Миастеническим центром НИИ Общей патологии и патофизиологии РАМН.
Москва.
Ю. А. Аблицов
Аблицов Юрий Алексеевич, д.м.н., проф. кафедры грудной и сердечно-сосудистой хирургии с курсом рентгенэндоваскулярной хирургии, врач-торакальный хирург. Москва.
В. И. Василашко
Василашко Виктор Иванович, к.м.н., доцент кафедры грудной и сердечно-сосудистой хирургии с курсом рентгенэндоваскулярной хирургии, заведующий торакальным отделением отделением. Москва.
В. С. Крячко
Крячко Виктор Сергеевич, ординатор кафедры грудной и сердечно-сосудистой хирургии с курсом рентгенэндоваскулярной хирургии.
Москва.
П. А. Лукьянов
Лукьянов Павел Андреевич, аспирант кафедры грудной и сердечно-сосудистой хирургии с курсом рентгенэндоваскулярной хирургии. Москва.
Б. А. Магомедов
Магомедов Бульямин Алипханович, аспирант кафедры грудной и сердечно-сосудистой хирургии с курсом рентгенэндоваскулярной хирургии. Москва.
Рецензия
Для цитирования:
Ветшев П.С., Аблицов А.Ю., Санадзе А.Г., Аблицов Ю.А., Василашко В.И., Крячко В.С., Лукьянов П.А., Магомедов Б.А. Робот-ассистированные и торакоскопические операции в лечении больных с опухолями вилочковой железы. Медицинский вестник Юга России. 2018;9(2):15-25. https://doi.org/10.21886/2219-8075-2018-9-2-15-25
For citation:
Vetshev P.S., Ablitsov A.Yu., Sanadze A.G., Ablitsov Yu.A., Vasilashko V.I., Kryachko V.S., Lukyanov P.A., Magomedov B.A. Robot-assisted and thoracoscopic surgery in the treatment of patients with tumors of the thymus gland. Medical Herald of the South of Russia. 2018;9(2):15-25. (In Russ.) https://doi.org/10.21886/2219-8075-2018-9-2-15-25






































