Перейти к:
Особенности подбора антикоагулянтной терапии у больных с критической ишемией нижних конечностей после реконструктивных операций
https://doi.org/10.21886/2219-8075-2018-9-2-43-50
Аннотация
Цель: улучшить результаты лечения больных облитерирующим атеросклерозом с критической ишемией нижних конечностей путем индивидуального подбора антикоагулянтной терапии для профилактики возникновения тромбозов после реконструктивных операций на артериях нижних конечностей. Материалы и методы: 82 пациента разделенны на две группы: I группа (48 пациентов) – реконструктивные операции на артериях нижних конечностей и антикоагулянтная терапия под контролем коагулограммы. II группа (34 пациента) – реконструктивные операции с подбором антикоагулянтной терапии с помощью показателей гемостазиограммы и теста Тромбодинамики Т-2. Результаты: из 48 пациентов I исследуемой группы хороший эффект у 36 больных (75,00 %), у 9 (18,75 %) – удовлетворительный, а в 3-х наблюдениях (6,25 %) – неудовлетворительный. Во II группе хорошие результаты у 33-х (97,06 %) больных, а у 1-го (2,94 %) пациента удовлетворительный результат. Неудовлетворительных результатов не было. Проанализировано количество повторных операций в течение 1 года, выполненных в I группе, которых статистически достоверно было в 2 раза больше, чем во II. Все повторные операции связаны с развившимися тромботическими осложнениями. При сочетании большинства показателей гемостазиограммы и теста «Тромбодинамика Т-2» проводилась коррекция дозы гепаринотерапии, увеличивая на 2500 ЕД, т.е. пациент получал по 7500ЕД 4 р\сут. Если при проведении «Тромбодинамики Т-2» и коагулограммы на 6 сутки после оперативного лечения определялась гиперкоагуляция, то доза гепарина увеличивалась повторно на 2500 ЕД. Выводы: Сравнительный анализ показателей гемостазиограммы в первые часы после выполненного оперативного лечения малопоказателен для прогнозирования частоты тромботических осложнений, в то время как через 6 суток после оперативного лечения указывает на наличие статистически значимых отличий между исследуемыми группами. Это свидетельствует о более адекватном подборе дозы гепарина во II группе.
Ключевые слова
Для цитирования:
Кательницкий И.И., Кательницкий И.И., Ливадняя Е.С. Особенности подбора антикоагулянтной терапии у больных с критической ишемией нижних конечностей после реконструктивных операций. Медицинский вестник Юга России. 2018;9(2):43-50. https://doi.org/10.21886/2219-8075-2018-9-2-43-50
For citation:
Katelnitsky I.I., Katelnitsky I.I., Livadnyaya E.S. Features of selection of anticoagulant therapy in patients with critical ischemia of lower extremities after reconstructive operations. Medical Herald of the South of Russia. 2018;9(2):43-50. (In Russ.) https://doi.org/10.21886/2219-8075-2018-9-2-43-50
Введение
Тромботические осложнения после выполнения реконструктивных операций на брюшной аорте и артериях нижних конечностей, по данным различных авторов, развиваются в 25-59 % случаев, в зависимости от длительности наблюдения за пациентами [1][2][3]. В результате хирургической травмы происходят местные изменения реологических свойств крови и микроциркуляции, которые начинают развиваться уже через несколько минут от начала хирургического вмешательства [4][5][6]. Далее наблюдается генерализация реологических сдвигов, а именно повышение адгезивно-агрегационной активности форменных элементов, снижение способности эритроцитов к деформации при прохождении через капилляры [7][8]. Эти изменения происходят в сроки от 18 до 24 часов, а нормализация данных показателей наступает только на 7-8-е сутки после операции [9][10].
Цель исследования: улучшить результаты лечения больных облитерирующим атеросклерозом с критической ишемией нижних конечностей за счет индивидуального подбора антикоагулянтной терапии с целью профилактики возникновения тромбозов после реконструктивных операций на артериях нижних конечностей.
Материалы и методы
В работе изучены данные о 82-х больных хроническими облитерирующими заболеваниями артерий нижних конечностей (ХОЗАНК) с критической ишемией нижних конечностей, проходивших лечение в отделении сосудистой хирургии клиники Ростовского Государственного медицинского университета в период с 2012 по 2016 гг. Все пациенты были разделены на две сопоставимые по возрасту, полу, степени ишемии нижних конечностей группы.
В первую группу вошли 48 больных, которым были выполнены реконструктивные операции на артериях нижних конечностей и проводилась антикоагулянтная терапия нефракционированным гепарином в дозировке 20000 ЕД в сутки под контролем коагулограммы. Дальнейший подбор дозы гепарина в послеоперационном периоде проводился, основываясь на данных гемостазиограммы.
Вторую исследуемую группу составили 34 больных, которым выполнялись реконструктивные операции с подбором антикоагулянтной терапии с помощью показателей гемостазиограммы и теста Тромбодинамики Т-2.
При сочетании большинства показателей гемостазиограммы и теста «Тромбодинамика Т-2» проводилась коррекция дозы гепаринотерапии путем увеличения на 2500 ЕД разовой дозы, то есть пациент получал по 7500ЕД 4 раза в сутки. Если при проведении теста «Тромбодинамика Т-2» и коагулограммы на 6-е сутки после оперативного лечения определялась гиперкоагуляция по большинству показателей, то доза гепарина увеличивалась повторно на 2500 ЕД, поэтому трем пациентам второй исследуемой группы потребовалась доза 10000 ЕД 4 раза в сутки после шестого дня гепаринотерапии. Пациент, у которого произошел тромбоз в раннем послеоперационном периоде, несмотря на коррекцию гепаринотерапии, имел наиболее выраженную гиперкоагуляцию. Таким образом, сочетание выполнения коагулограммы и теста «Тромбодинамика Т-2» позволяло выделить группу пациентов, которым достоверно требовалась коррекция гепаринотерапии.
Пациенты с врожденными заболеваниями системы крови, поражениями печени, селезенки, костного мозга в анамнезе в исследование включены не были.
Всем 82-м пациентам были выполнены реконструктивные операции на артериях нижних конечностей. Во время оперативного лечения выполнялись инфузии гепарина 5 тыс. ЕД внутривенно до наложения зажима на сосуды. В послеоперационном периоде первоначально назначался гепарин по 5 тыс. ЕД 4 раз в сутки подкожно, в течение первых 4-7 суток в обеих исследуемых группах. Как в первой, так и во второй исследуемых группах проводилась коррекция антикоагулянтной терапии при наличии признаков гиперкоагуляции. Пациентам первой группы она выполнялась, основываясь на показателях гемостазиограммы. Оценивался уровень тромбинового времени, РФМК, АЧТВ, антитромбина III, МНО и фибриногена. Анализ выполнялся через шесть часов и на шестые сутки после оперативного лечения. Пациентам второй группы данные коагулограммы дополнялись выполнением теста «Тромбодинамика Т-2», проводившимся в те же сроки, что и гемостазиограмма. Проводилась оценка показателей скорости роста сгустка/стационарной скорости, времени задержки роста сгустка, начальной скорости роста сгустка, плотности сгустка, размера фибринового сгустка и наличия спонтанных сгустков. Также в послеоперационном периоде ежедневно применяли препараты, улучшающие реологические свойства крови (реополиглюкин, трентал, антиагреганты, аспирин).
Из табл. 1 видно, что до оперативного лечения различия между 2 исследуемыми группами по всем показателям коагулограммы не достигают порога статистической значимости, что указывает на сопоставимость пациентов I и II групп. Таким образом, все пациенты, вошедшие в исследование, имели исходно гиперкоагуляционное состояние в связи с наличием атеросклеротического поражения.
Таблица/ Table 1.
Сравнение показателей коагулограммы больных I и II группы до операции
Comparison of coagulogram indices I and IIgroups before surgery
Показатели пациентов до оперативного вмешательства Indicators of patients before operative intervention | Группа сравнения Comparison group (I группа) (n=48) | Основная группа Basic group (2 группа) (n=34) | p | ||
|---|---|---|---|---|---|
Среднее Average (M) | Стандартное отклонение Standard Deviation (s) | Среднее Average (M) | Стандартное отклонение Standard Deviation (s) | ||
Тромбиновое время (сек.) Thrombin time (sec) | 11,27 | 1,20 | 11,80 | 1,45 | 0,098 |
РФМК (мг/100мл) RFMC (mg /100 ml) | 4,42 | 1,12 | 3,97 | 1,06 | 0,068 |
АЧТВ (сек) APTT (s) | 24,52 | 3,14 | 26,33 | 4,49 | 0,064 |
Антитромбин (%) Antithrombin (%) | 71,04 | 6,82 | 68,82 | 8,43 | 0,18 |
МНО INR | 0,94 | 0,17 | 0,98 | 0,17 | 0,12 |
Фибриноген (г/л) Fibrinogen (g / L) | 4,64 | 0,94 | 4,34 | 0,72 | 0,14 |
Примечание: p — значимость различий показателей в I и II группах до оперативного вмешательства.
Note: p — significance of differences in indicators in groups I and II before surgery.
Обработка полученных данных проводилась на персональном компьютере типа IBM PC/AT с использованием прикладных программ Statistica 6,1 и электронных таблиц Excel 2007. В соответствии с рекомендациями О.Ю. Ребровой (2002) по обработке численных результатов экспериментов в медицине, производились все рассчеты. На первом этапе была произведена описательная статистика, в ходе которой проверялась соответствие изучаемых данных нормальному распределению по критерию Колмогорова-Смирнова. При сравнении групп проверялось также равенство дисперсий в сравниваемых группах согласно критерию Левена. В случае положительного решения этих двух проблем для определения значимости статистических различий количественных показателей в сформированных группах применялся t (критерий Стъюдента), при отрицательном решении использовались непараметрические методы — критерий Манна-Уитни. Для сравнения связанных групп использовали критерий Стъюдента при возможности его применения, в ином случае применялся критерий Вилкоксона. Для сравнения бинарных данных использовались точный критерий Фишера и χ2. Использовались общепринятые уровни значимости: p<0,05; p<0,01 и p<0,001. Для изучения связи изучаемых признаков использовали коэффициент корреляции по Пирсону (r) или Спирмену с общепризнанной оценкой силы связи: r<0.25 — слабая корреляция, 0,25> r <0,75 — умеренная корреляция, r > 0,75 — сильная корреляция.
Результаты
Для оценки результатов лечения взята шкала А.В. Покровского (табл. 2).
Таблица/ Table 2.
Шкала изменений в клиническом статусе (А.В. Покровский)
Scale of changes in clinical status (A.V. Pokrovsky)
Клинический статус Clinical status | Баллы Scores | Интерпретация Interpretation | Характеристика Characteristic |
|---|---|---|---|
Хороший Good | +3 | Значительное улучшение Significant improvement | Заживление трофических язв и исчезновение симптомов ишемии Healing of trophic ulcers and disappearance of symptoms of ischemia |
+2 | Умеренное улучшение Moderate improvement | Отсутствие трофических расстройств, при сохранении симптомов ишемии. Появление болей при ходьбе на более длительные, чем до операции дистанции, то есть улучшение на одну степень ишемии. ЛПИ не нормализовался, но вырос более, чем на 0,1. The absence of trophic disorders, with the preservation of symptoms of ischemia. The appearance of pain during walking for longer than before the operation of the distance, that is, an improvement in one degree of ischemia. ABI did not return to normal, but grew by more than 0.1. | |
Удовлетвори тельный Satisfactory | + 1 | Минимальное улучшение Minimal improvement | Нет клинического улучшения, при увеличении ЛПИ, более чем на 0.1. Клиническое улучшение без прироста ЛПИ более чем на 0.1. There is no clinical improvement, with an increase in ABI, by more than 0.1. Clinical improvement without ABI increment by more than 0.1. |
Без динамики Without dynamics | 0 | Без изменений No changes | Нет изменения в степени ишемии и нет увеличения ЛПИ No changes in the degree of ischemia and no increase in ABI |
-1 | Незначительное ухудшение Minor deterioration | Нет изменения в степени ишемии, но ЛПИ уменьшилось больше, чем на 0.1. Ухудшение статуса без уменьшения ЛПИ на 0. 1 и более. No changes in the degree of ischemia, but the ABI decreased by more than 0.1. Deterioration of the status without reducing the ABI by 0. 1 or more. | |
Неудовлетвори тельный Unsatisfactory | -2 | Умеренное ухудшение Moderate worsening | Усугубление ишемии минимум на одну степень. Малая ампутация. Increased ischemia at least one degree. Small amputation. |
-3 | Значительное ухудшение Significant worsening | Ухудшение статуса более, чем на одну степень ишемии. Большая ампутация The deterioration in the status of more than one degree of ischemia. Large amputation |
Из 48-и пациентов I исследуемой группы в раннем послеоперационном периоде был достигнут хороший эффект у 36-и больных (75,00 %), у 9-и пациентов (18,75 %) результат был удовлетворительным. В 3-х наблюдениях (6,25 %) отмечены неудовлетворительные результаты.
Во II группе хорошие результаты лечения в раннем послеоперационном периоде достигнуты у 33-х (97,06 %) больных, а у 1-го (2,94 %) пациента отмечен удовлетворительный результат. Неудовлетворительных результатов выявлено не было (рис.1).
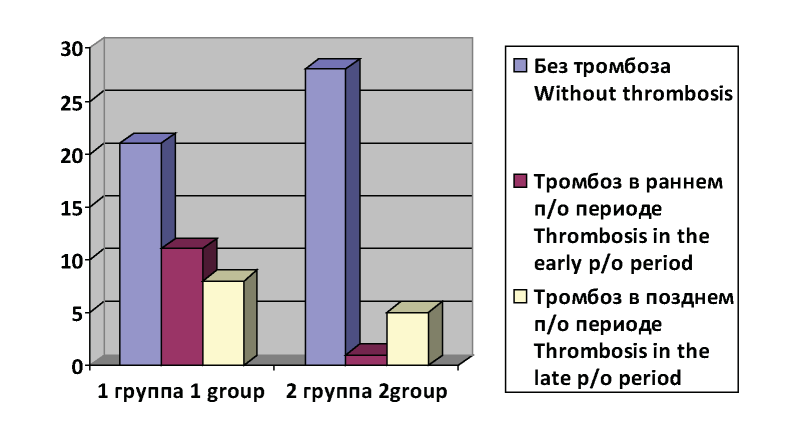
Рисунок 1. Наличие тромбозов в раннем и позднем послеоперационном периодах в исследуемы группах пациентов.
Figure 1. The presence of thromboses in the early and late postoperative periods in the study groups of patients.
В исследуемой группе у одного больного после реконструктивной операции в раннем послеоперационном периоде возникли осложнения тромботического характера, что составило 2,94 %.
Анализ результатов ближайшего и отдаленного послеоперационных периодов, показателей проходимости шунтов, частоты ампутаций, осложнений и летальных исходов показал, что среди пациентов первой группы в раннем послеоперационном периоде тромбоз развился у 11-ти больных, что составило 22,92 % (значимость различий в сравнении с исследуемой группой p=0,022), все они оперированы повторно. Случаев летального исхода в раннем послеоперационном периоде среди пролеченных пациентов не было.
В I группе ампутация выполнена 5-ти (10,42 %) пациентам. Во II исследуемой группе ампутация выполнена 1-му (2,94 %) пациенту. В обеих исследуемых группах выполнение ампутации обусловлено развитием тромбозов реконструированных артериальных сегментов в раннем послеоперационном периоде, приведшими к развитию острой ишемии и гангрены нижних конечностей. Однако во второй группе количество ампутаций значительно ниже, что связано с меньшим количеством тромбозов шунтов в результате более адекватной антикоагулянтой терапии.
В позднем послеоперационном периоде в первой группе тромбоз шунта диагностирован у 8-ми (16,7 %) пациентов, во второй исследуемой группе у 5-ти (14,71 %) больных, значимость различий между группами p=0,57.
Анализируя показатели коагулограммы пациентов I и II групп, полученные через 6 часов после оперативного лечения, достоверных различий по уровню тромбинового времени, АЧТВ, антитромбина III и фибриногена не выявлено (табл. 3). Средние показатели РФМК в I группе составили 2,00±1,70 мг/100мл, в то время как во второй группе средние значения данного показателя были на уровне 0,65±0,92 мг/100мл. Средний уровень МНО в I группе — 1,05±0,17, во II — 1,44±0,40. Таким образом, показатели РФМК могут быть предикторами тромботических осложнений, так как уровень МНО изменяется только через несколько дней от начала антикоагулянтной терапии, поэтому нельзя основываться на его значениях в первые часы после оперативного лечения. Таким образом, показатели гемостазиограммы малопоказательны для прогнозирования тромботических осложнений в раннем послеоперационном периоде.
Таблица/ Table 3.
Сравнение показателей коагулограммы больных I и II группы через 6 часов после операции
Comparison of coagulogram indices I and IIgroups in 6 hours after the operation
Показатели пациентов Indicators of patients | Группа сравнения The comparison group (I группа) (n=48) | Основная группа The basic group (II группа) (n=32) | p | ||
|---|---|---|---|---|---|
Среднее Average (M) | Стандартное отклонение Standard deviation (s) | Среднее Average (M) | Стандартное отклонение Standard deviation (s) | ||
Тромбиновое время (сек.) Thrombin time (sec) | 15,50 | 2,74 | 16,14 | 2,01 | 0,40 |
РФМК (мг/100мл) RFMK (mg / 100ml) | 2,00 | 1,70 | 0,65 | 0,92 | <0,001 |
АЧТВ (сек) APTT (s) | 44,46 | 11,26 | 44,29 | 12,20 | 0,86 |
Антитромбин III (%) Antithrombin III (%) | 98,81 | 19,74 | 99,68 | 17,30 | 0,84 |
МНО INR | 1,05 | 0,17 | 1,44 | 0,40 | <0,001 |
Фибриноген (г/л) Fibrinogen (g/ L) | 2,85 | 1,01 | 2,61 | 0,65 | 0,57 |
Примечание: p — значимость различий показателей в I и II группах.
Note: p — significance of differences in indicators in groups I and II.
Распределение пациентов I и II исследуемых групп по значению уровня тромбинового времени приведено на рис. 2. Статистически значимых различий между группами не отмечается. Тем не менее, по данной гистограмме можно выявить тенденцию к увеличению тромбинового времени у пациентов второй группы, что свидетельствует о более адекватной антикоагулянтной терапии, приводящей к развитию гипокагуляции, для предотвращения тромботических осложнений.
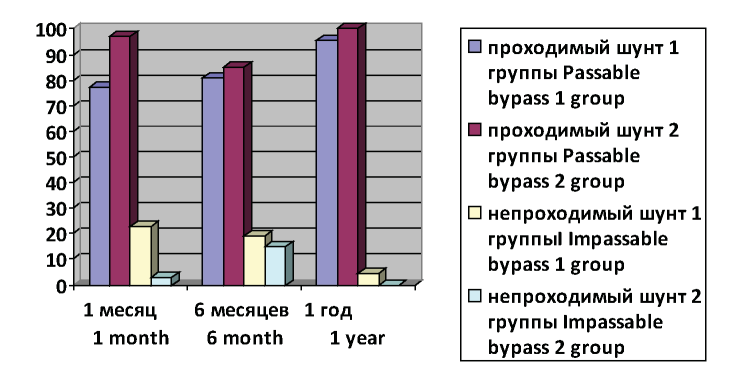
Рисунок 2. Проходимость шунтов в исследуемых группах в послеоперационном периоде.
Figure 2. Patency of grafts in the treatment groups in the postoperative period.
Аналогичная картина видна по показателям АЧТВ. Общепринятый в большинстве стационаров маркер адекватности гепаринотерапии не мог быть достоверным диагностическим предиктором возникновения тромбоза шунта. Гепаринотерапия, проводившаяся с коррекцией дозы по уровню АЧТВ в первой исследуемой группе, приводила к показателям АЧТВ от 40-55 сек., даже у пациентов с развившимися тромбозами шунтов в раннем послеоперационном периоде. Таким образом, коррекция дозы гепарина только на основании показателей АЧТВ является неадекватной и прогностически недостоверной.
Сравнительный анализ показателей коагулограммы пациентов первой и второй групп через 6 суток после оперативного лечения показал, что большинство показателей коагулограммы у пациентов I и II исследуемых групп имели статистически значимые различия (табл. 4).
Таблица/ Table 4.
Сравнение показателей коагулограммы больных I и II группы через 6 суток после операции
Comparison of coagulogram indices I and IIgroups 6 days after the operation
Показатели пациентов Indicators of Patients | Пациенты I группы Patients I group (n=48) | Пациенты II группы Patients II group (n=34) | p | ||
|---|---|---|---|---|---|
Среднее Average (M) | Стандартное отклонение Standard deviation (s) | Среднее Average (M) | Стандартное отклонение Standard deviation (s) | ||
Тромбиновое время (сек.) Thrombin time (sec) | 15,29 | 3,11 | 17,10 | 1,946 | 0,0029 |
РФМК (мг/100мл) RFMK (mg/100 ml) | 1,65 | 2,07 | 0,62 | 1,349 | 0,020 |
АЧТВ (сек) APTT (s) | 37,87 | 7,34 | 47,61 | 10,816 | <0,001 |
Антитромбин III (%) Antithrombin III (%) | 97,50 | 14,40 | 106,12 | 14,221 | 0,0066 |
МНО INR | 1,42 | 0,42 | 1,67 | 0,456 | 0,0095 |
Фибриноген (г/л) Fibrinogen (g / l) | 2,82 | 1,04 | 2,20 | 0,478 | 0,0020 |
Примечание: p - значимость различий показателей коагулограммы пациентов I и II групп через 6 суток после операции.
Note: p - significance of differences in coagulogram indices of patients of groups I and II at 6 days after the operation.
Высокая значимость различий между показателями гемостазиограммы, выполненной через 6 суток после оперативного лечения в обеих исследуемых группах, говорит о том, что во второй группе был произведен более адекватный подбор дозы гепарина, так как наряду со стандартными показателями коагулограммы всем пациентам проводился контроль состояния свертывающей системы крови с помощью теста «Тромбодинамика Т-2». Таким образом, доза гепарина подбиралась пациентам второй исследуемой группы индивидуально, ориентируясь на совокупности данных гемостазиограммы и теста «Тромбодинамика Т-2».
После оценки результатов лечения пациентов двух исследуемых групп получены статистически достоверные различия по проходимости шунтов через 1 месяц после оперативного лечения. При этом количество непроходимых шунтов в I группе было в 10 раз (22,92 %) выше, чем во второй - 2,94 %, что непосредственно связано с отсутствием тромбоза шунта и микротромбозов периферического русла.
Через 6 месяцев после выполненной реконструктивной операции достоверных статистически значимых различий между двумя группами не выявлено. Количество тромбозов у пациентов II группы составило 9 (19,15 %), у пациентов II группы - 5 (14,71 %). Значимость различий между группами (p) - 0,76. В отдаленном периоде тест «Тромбодинамика Т-2» не выполнялся, доза непрямых антикоагулянтов (варфрарина) подбиралась по уровню МНО, что является недостаточным для контроля и подбора дозы антикоагулянтных препаратов и как следствие, увеличению числа тромботических осложнений.
После оценки количества тромботических осложнений в сроки от 6 месяцев до 1 года после оперативного лечения, также не было выявлено достоверных отличий между двумя исследуемыми группами пациентов. В I группе у двух пациентов выявлен тромбоз шунта. Однако во II группе у всех 34 пациентов шунты были проходимы.
Также было проанализировано количество выполненных повторных операций в течение 1 года. Были получены статистически значимые различия между двумя исследуемыми группами пациентов. Количество повторных реконструкций, выполненных в первой группе, было два раза больше, чем во второй. Все выполненные повторные операции связаны с развившимися тромботическими осложнениями. Значимость различий между группами p=0,047 (рис.2).
В первой группе ампутация выполнена 5-ти (10,42 %) пациентам, во II исследуемой группе - 1-му (2,94 %) пациенту. В обеих группах выполнение ампутации обусловлено развитием тромбозов реконструированных артериальных сегментов в раннем послеоперационном периоде, приведших к развитию острой ишемии и гангрены нижних конечностей. Однако во второй группе снижение количества ампутаций связано с меньшим количеством тромбозов шунтов, это можно объяснить более адекватной антикоагулянтой терапией. Сравнение результатов лечения пациентов обеих исследумых групп свидетельствует о преобладании хороших результатов при отсутствии неудовлетворительных во второй исследуемой группе, в которой подбор дозы антикоагулянтной терапии основывался на совокупности данных коагулограммы и теста «Тромбодинамика Т-2».
После анализа результатов лечения через 6 месяцев после выполненной реконструктивной операции, достоверных статистически значимых различий между двумя группами не выявлено. Количество тромбозов у пациентов I группы - 9 (19,15 %), у пациентов II группы - 5 (14,71 %). Значимость различий между группами (p) - 0,76. В отдаленном периоде тест «Тромбодинамика Т-2» не выполнялся, доза антикоагулянтов (варфрарина) подбиралась индивидуально по уровню МНО, что является недостаточным для контроля и подбора дозы антикоагу- лянтных препаратов и как следствие, увеличению числа тромботических осложнений.
Оценивая количество тромботических осложнений через 1 год после оперативного лечения, также не выявлено достоверных отличий между двумя исследуемыми группами пациентов. В I группе у двух пациентов выявлен тромбоз шунта. Однако во II группе у всех 34-х пациентов шунты были проходимы.
Обсуждение
Получены достоверные статистически значимые различия между группами с тромбозами и без- в раннем послеоперационном периоде у пациентов после выполненных реконструктивных операций на артериях нижних конечностей при двойном контроле гемостазиограммы и теста «Тромбодинамика Т-2». Высокая значимость различий между показателями гемостазиограммы, результатами клинических данных говорит о необходимости адекватного подбора дозы гепарина, основываясь на совокупности данных коагулограммы и теста «Тромбодинамика Т-2» в раннем послеоперационном периоде. Отсутстствие различий между группами в позднем послеоперационном периоде говорит о необходимости дальнейшего контроля, подбора и корректировки дозы антикоагулянтов.
Выводы
- Высокая значимость различий между показателями гемостазиограммы и результатами клинических данных говорят о необходимости адекватного подбора дозы гепарина, основываясь на совокупности данных коагулограммы и теста «Тромбодинамика Т-2» в раннем послеоперационном периоде у пациентов после выполненных шунтирующих операций на артериях нижних конечностей.
- Сравнение результатов лечения двух исследуемых групп свидетельствует о положиетльной динамике при индивидуальном подборе дозы гепарина, что основано на совокупности данных коагулограммы и теста «Тромбодинамика Т-2».
- Сравнительный анализ показателей гемостазиограммы в первые часы после выполненного оперативного лечения малопоказателен для прогнозирования частоты тромботических осложнений, в то время как через 6 суток после оперативного лечения указывает на наличие статистически значимых отличий между двумя исследуемыми группами. Это свидетельствует о том, что во второй группе был проведен более адекватный подбор дозы гепарина.
- Отсутствие различий в позднем послеоперационном периоде между двумя группами свидетельствует о необходимости дальнейшего более тщательного контроля показателей свертывающей и противосвертывающей систем крови для дальнейшей коррекции дозы антикоагулянтной терапии и увеличения длительности функционирования шунтов.
Список литературы
1. Болдин Б.В., Родионов С.В., Голосницкий П.Ю., Туркин П.Ю., Варич Г.А., Лисенков О.П. и др. Факторы риска развития ранних окклюзий имплантата при реконструктивных операциях у больных облитерирующим атеросклерозом артерий нижних конечностей // Лечебное дело. – 2015. – № 4. – С. 90-96.
2. Лазаренко В.А., Бобровская Е.А., Парфенов Е.И. Частота тромбозов зоны реконструкции после оперативного вмешательства на брюшной аорте и артериях нижних конечностей в зависимости от вида операции. // Университетская наука: взгляд в будущее: материалы междунар. науч.-практ. конф., посвящ. 81-летию Курского ГМУ и 50-летию фарм. факультета. В 3-х томах. – Курск, 2016. – С. 299-301.
3. Bedenis R., Lethaby A., Maxwell H., Acosta S., Prins M.H. Antiplatelet agents for preventing thrombosis aft er peripheral arterial bypass surgery. // Cochrane Database Syst Rev. – 2015. – V.2. - CD000535. doi: 10.1002/14651858.CD000535.pub3.
4. Коваленко В.И., Темрезов М.Б., Климович Л.Г., Борсов М.Х. Факторы риска тромботических осложнений у больных с критической ишемией нижних конечностей // Российский медицинский журнал. – 2014. – № 1. – С. 34-37.
5. Липец Е.Н., Атауллаханов Ф.И., Пантелеев М.А. Интегральные лабораторные тесты гемостаза в диагностике гиперкоагуляции и оценке риска тромбоза Часть II. Чувствительность интегральных тестов к гиперкоагуляционным состояниям. // Онкогематология. – 2015. – Т. 10, № 3. – С. 73-91. doi:10.17650/1818-8346-2015-10-3-78-91.
6. Momot A., Taranenko I., Tsyvkina L., Semenova N., Molchanova I. Th e risk factors of thrombogenic, thrombophilia, and the principle for heparin prophylaxis in personalized medicine. // Anticoagulation therapy. - 2016. doi: 10.5772/64118
7. Hoff man M. Heparins: Clinical use and laboratory monitoring. // Lab Med. – 2010. – V.41(10). – P. 621-626. doi: 10.1309/ lmsxwc3a4lbijp2b.
8. Casu B., Naggi A., Torri G. Re-visiting the structure of heparin. // Carbohydr Res. – 2015. – V.403. – P.60-68. doi: 10.1016/j. carres.2014.06.023
9. Clagett G.P., Sobel M., Jackson M.R., Lip G.Y.H, Tangelder M, Verhaeghe R. Antithrombotic therapy in peripheral arterial occlusive disease. // Chest. – 2004. – V.126(3). – P.609S–626S. doi: 10.1378/chest.126.3_suppl.609s
10. Harter K, Levine M, Henderson SO. Anticoagulation drug therapy: a review. // West J Emerg Med. – 2015. – V.16(1). – P.11-17. doi: 10.5811/westjem.2014.12.22933Т 2. –2011. – С. 53-54
Об авторах
И. И. КательницкийРоссия
Кательницкий Иван Иванович, д.м.н., проф., заведующй кафедрой хирургических болезней №1. Ростов-на-Дону.
Иг. И. Кательницкий
Кательницкий Игорь Иванович, д.м.н., профессор кафедры хирургических болезней №1.
Ростов-на-Дону.
Е. С. Ливадняя
Ливадняя Екатерина Сергеевна, аспирант кафедры хирургических болезней №1.
Ростов-на-Дону.
Рецензия
Для цитирования:
Кательницкий И.И., Кательницкий И.И., Ливадняя Е.С. Особенности подбора антикоагулянтной терапии у больных с критической ишемией нижних конечностей после реконструктивных операций. Медицинский вестник Юга России. 2018;9(2):43-50. https://doi.org/10.21886/2219-8075-2018-9-2-43-50
For citation:
Katelnitsky I.I., Katelnitsky I.I., Livadnyaya E.S. Features of selection of anticoagulant therapy in patients with critical ischemia of lower extremities after reconstructive operations. Medical Herald of the South of Russia. 2018;9(2):43-50. (In Russ.) https://doi.org/10.21886/2219-8075-2018-9-2-43-50
JATS XML






































