Перейти к:
Экспрессия некоторых молекулярно-биологических маркеров при раке пищевода в зависимости от стадий заболевания и степени дифференцировки
https://doi.org/10.21886/2219-8075-2018-9-1-63-69
Аннотация
Цель. Изучить экспрессию молекулярно-биологических маркеров р53, bcl-2 и ki-67 иммуногистохимическим методом при раке пищевода в зависимости от стадий заболевания и степени дифференцировки, а также оценить их использования для прогнозирования течения злокачественного процесса. Материалы и методы. Исследование проведено в ткани плоскоклеточного рака пищевода 30 больных ретроспективной группы с II - III стадией заболевания. Иммуногистохимическое исследование проводили на срезах с парафиновых блоков, используя первичные мышиные моноклональные антитела p53, bcl-2, ki67. Для визуализации использовали систему детекции Reveal Polyvalent HRP-DAB Detection System. Результаты. Выявлены различия в частоте встречаемости и экспрессии молекулярно-биологических маркеров (p53, bcl-2 и ki-67), контролирующих апоптоз и пролиферацию в зависимости от стадии заболевания и степени дифференцировки опухоли. Заключение. При распространении рака пищевода отмечается повышение частоты встречаемости и уровня экспрессии р53+ и маркера пролиферации ki-67, а также пролиферативной активности опухолевых клеток. В опухолях II стадии была отмечена тенденция к более частой и интенсивной экспрессии bcl-2, чем при III стадии. Уменьшение степени дифференцировки рака пищевода характеризуется повышением как доли опухолей, экспрессирующих р53 и ki-67, так и уровня экспрессии данных маркеров опухолевыми клетками. При этом экспрессия bcl-2 имеет противоположную направленность. Выявленные различия могут быть использованы для прогнозирования течения злокачественного процесса.
Для цитирования:
Колесников Е.Н., Базаев А.Л., Златник Е.Ю., Новикова И.А., Ульянова Е.П., Шульгина О.Г., Попович О.А., Трифанов В.С., Кожушко М.А., Санамянц С.В., Харин Л.В., Кациева Т.Б., Мезенцев С.С. Экспрессия некоторых молекулярно-биологических маркеров при раке пищевода в зависимости от стадий заболевания и степени дифференцировки. Медицинский вестник Юга России. 2018;9(1):63-69. https://doi.org/10.21886/2219-8075-2018-9-1-63-69
For citation:
Kolesnikov E.N., Bazaev A.L., Zlatnik E.Yu., Novikova I.A., Ulianova E.P., Shulgina O.G., Popovich O.A., Trifanov V.S., Kozhushko M.A., Sanamyanc S.V., Kharin L.V., Kacieva T.B., Mesentsev S.S. Expression of some molecular and biological markers in esophageal tumors of various stages and grades. Medical Herald of the South of Russia. 2018;9(1):63-69. (In Russ.) https://doi.org/10.21886/2219-8075-2018-9-1-63-69
Введение
Рак пищевода входит в десятку мировых лидеров среди злокачественных новообразований с наихудшим прогнозом, занимая восьмое место как наиболее распространённая форма рака во всем мире (примерно 456 тыс. новых случаев в 2012 г. — 3,2% от общего числа) и шестое место как наиболее частая причина смерти от рака (около 400 тыс. смертей — 4,9%от общего числа), по данным Globoscan 2012 (IARC) [1]. В России же в структуре заболеваемости среди всех злокачественных новообразований рак пищевода находится на 14-м месте, а смертности — на 7-м. Пятилетняя выживаемость при раке пищевода составляет около 10%, причем зависимости от гистологического типа опухоли и степени опухолевой дифференцировки пока не выявлено [2]. В литературе есть единичные данные о зависимости выживаемости пациентов от степени морфологической дифференцировки опухоли, что нашло отражение в прогнозе отдаленных результатов между аденокарциномой и плоскоклеточным раком при I и II стадиях заболевания. Так, если при аденокарциноме прогноз оказался достоверно лучше при G1 и G2 (высоко- и умереннодифференцированные опухоли), по сравнению с G3 (низкодифференцированные), то при плоскоклеточном раке значимые различия отмечены при G1 как против G2, так и против G3. Кроме того, для плоскоклеточного рака пищевода T2-3N0M0 показаны различия при локализации опухоли в верхне-среднегрудном и нижнегрудном отделах пищевода [3]. На сегодняшний день применяется различный спектр маркеров для иммуногистохимического анализа опухолей и их метастазов: рецепторы, молекулы клеточной адгезии, белки регуляторы клеточного цикла и апоптоза. Однако их прогностическое значение при раке пищевода (РП) остается дискуссионной областью. Прогностическое значение аберрантной экспрессии р53, обнаруживаемое иммуногистохимически, при РП остается неясным. В ряде работ [4] показано, что белок p53 может быть обнаружен иммуногистохимически в 52-67% плоскоклеточных карцином пищевода, однако его гиперэкспрессия не оказывает влияния на прогноз заболевания. Напротив, в исследованиях Madani K. [5] и Wang L. [6], показано, что ИГХ- обнаружение повышенной экспрессии p53 является предиктором низкой 5 летней выживаемости, более развитых стадий TNM, метастазов в лимфатические узлы у пациентов с РП и, соответственно, может быть полезным биомаркером неблагоприятного прогноза заболевания. То есть вопрос о прогностической ценности р53 остается актуальным и в настоящее время.
В исследовании Wei W. [7] показано, что в тканях карциномы пищевода уровень экспрессии p53 положительно коррелировал с белком bcl-2. Это позволяет предположить, что изменения экспрессии bcl-2 могут коррелировать с прогрессированием опухоли при РП, что подчеркивает их важность в качестве прогностических маркеров. Важнейшей характеристикой опухоли является ее пролиферативная активность (ПА), современным методом определения которой служит оценка индекса ki- 67-положительных клеток. Антиген ki-67, выявляемый в ИГХ-исследовании соответствующими моноклональными антителами, представляет собой короткоживущий протеин, который разрушается в течение 1,5-2 часов. Поэтому антитела к ki-67 выявляют только делящиеся клетки, так как ki-67 не успевает накапливаться и не остается в покоящихся клетках [8]. Таким образом, именно данные маркеры позволяют детально охарактеризовать биологическое поведение опухоли, связанное с активностью процессов пролиферации и апоптоза. Но некоторые аспекты их прогностического значения при РП требуют уточнения и, следовательно, дополнительных исследований.
Цель исследования — изучить экспрессию молекулярно-биологических маркеров р53, bcl-2 и ki-67 иммуногистохимическим методом при раке пищевода в зависимости от стадий заболевания и степени дифференцировки, а также оценить их использования для прогнозирования течения злокачественного процесса.
Материалы и методы
В группу исследования вошли 30 пациентов ретроспективной группы с II-III стадией заболевания, которые получили хирургическое лечение по поводу рака пищевода в Ростовском научно-исследовательском онкологическом институте в период с 2009 по 2016 гг. По показаниям была выполнена операция в следующем объеме: субтотальная резекция пищевода, проксимальная резекция желудка с одномоментной внутриплевральной пластикой пищевода желудочным стеблем. Всем больным стандартно выполняли двухзональную лимфодиссекцию. Специальной (системной и локальной) противоопухолевой терапии не проводилось. Возраст больных варьировался от 33 до 76 лет, медиана возраста составила 57,8 года. Соотношение мужчин к женщинам было 2,8 к 1, что в процентном соотношении составляло 73,9% мужчин и 26,1% женщин.
Иммуногистохимическое исследование было проведено на срезах парафиновых блоков, предназначенных для стандартного морфологического исследования, с помощью моноклональных антител к p53 (клон DO-7, DAKO, концентрация 1:100), bcl-2 (клон Sp 66, DAKO, концентрация 1:100), ki-67 (клон H3060, Spring Biosience, концентрация 1:200), E-кадгерину (клон EP700Y, Thermo scientific, концентрация 1:100). Депарафинизацию и дегидратацию парафиновых срезов выполняли по стандартной методике. “Демаскировку” антигенов проводили в PT-LinkThermo, согласно протоколу. Окрашивали в автоматическом режиме с применением иммуностейнера Thermo Scientific 480. Визуализация иммуногистохимической реакции выполнялась с использованием системы детекции Reveal Polyvalent HRP-DAB DetectionSystem, докрашивали срезы гематоксилином Майера. Оценку результатов иммуногистохимической реакции проводили с применением светового микроскопа «Micros Austria MC300» (Австрия) под увеличением х10, х40. Опухоль считали положительной по р53, если было окрашено более 25% ядер опухолевых клеток и положительной по bcl-2 при наличии цитоплазматического окрашивания более 25% опухолевых клеток. Для оценки пролиферативной активности (ПА) подсчитывали количество ki- 67-положительных клеток, приходящихся на 200-300 опухолевых клеток. Индекс ki-67 определяли по формуле: ПА= число ki-67 положительных клеток х 100/общее количество клеток. Маркеры пролиферативной активности расценивали на основе наиболее часто употребляющегося способа оценки пролиферативной активности: 0%- 20% — низкая пролиферативная активность, 21%-50% — умеренная пролиферативная активность, 51%-100% — высокая пролиферативная активность.
Полученные данные обрабатывали методом статистической обработки на персональном компьютере с использованием электронных таблиц Excel 2013 и пакета прикладных программ Statistica 8.0 [9]. Различия между группами оценивались с помощь t-критерия Стьюдента.
Результаты
В ходе исследования была определена частота экспрессии p53 и bcl-2 в зависимости от стадии (табл. 1). В ядрах опухолевых клеток РП II стадии экспрессия р53 была отмечена в 100% (n=15), разброс количества окрашенных клеток при этом находился в пределах от 5% до 80% клеток, и в 66,7% (10 из 15) достиг точки разделения «cut-off» в 25% ядер опухолевых клеток. В группе больных РП III стадии накопление р53 в ядрах клеток встречалось также в 100% случаев (n=15), разброс клеток по экспрессии данного маркера находился в пределах от 10% до 80% ядер опухолевых клеток, и в 73,3% случаев (11 из 15) превысил значения «cut-off».
Таблица / Table 1.
Частота экспрессии p53 и bcl-2 в зависимости от стадии рака пищевода
The frequency of expression of p53 and bcl-2, depending on the stage of esophageal cancer
Стадия Stage | ИГХ-маркеры IHC markers | |||||||
|---|---|---|---|---|---|---|---|---|
p53+ | p53- | bcl-2+ | bcl-2- | |||||
Абс. Absolute | % | Абс. Absolute | % | Абс. Absolute | % | Абс. Absolute | % | |
II (n=15) | 10 | 66,7 | 5 | 33,3 | 13 | 86,7 | 2 | 13,3 |
III (n=15) | 11 | 73,3 | 4 | 26,7 | 10 | 66,7 | 5 | 33,3 |
Накопление bcl-2 было обнаружено в цитоплазме опухолевых клеток РП II стадии в 86,7% (13 из 15) случаев (табл.1). Несколько реже — в 66,7% (10 из 15) случаев — отмечена положительная реакция окрашивания к антителам bcl-2 цитоплазмы опухолевых клеток при РП III стадии. При этом в каждом из исследованных случаев отмечалось положительное окрашивание антителами к bcl-2 инфильтрирующих опухоль лимфоцитов, что являлось для нас внутренним положительным контролем.
Средние значения экспрессии исследованных маркеров в зависимости от стадии заболевания отражены в табл. 2. Из представленных в ней данных видно, что среднее содержание p53+ клеток в опухолях пищевода III стадии в 1,4 раза превосходит аналогичный показатель в опухолях II стадии (различия статистически достоверны, p<0,05).
Таблица/Table 2.
Среднее значение экспрессия исследованных маркеров в зависимости от стадии рака пищевода
The mean value of the expression of the examined markers, depending on the stage of esophageal cancer
Стадия Stage | Экспрессия ИГХ-маркеров, % клеток Expression of IHC markers,% of cells | ||
|---|---|---|---|
p53 | bcl-2 | ki-67 | |
II (n=15) | 36,8±6,4 | 51,1±7,8 | 22,3±4,1 |
III (n=15) | 52±4,3*↑ | 33,7±4,9 | 37,8±5,6*↑ |
Примечание: * — статистически достоверные отличия от показателей II стадии (p<0,05).
Note: * — statistically significant differences from the II stage indicators (p<0,05).
Количество bcl-2+ клеток при II стадии колебалось от 5 до 70%, в среднем составляя 51,1±7,8%, тогда как при III стадии — от 5 до 65% со средними значениями 33,7±4,9%. Таким образом, прослеживалась тенденция к повышению процента bcl-2+ клеток в опухоли при II стадии. Кроме того, были выявлены и некоторые различия в интенсивности окрашивания цитоплазмы опухолевых клеток в зависимости от стадии заболевания. Так, при опухолях пищевода II стадии цитоплазма клеток, как правило, имела яркую (в 46,7% случаев) или среднюю (в 53,3% случаев) интенсивность окрашивания и характеризовалась диффузным накоплением bcl-2. При опухолях III стадии отмечен диффузный характер окрашивания преимущественно средней интенсивности (в 80% случаев), а яркое окрашивание цитоплазмы наблюдалось в 20% случаев.
Доля пролиферирующих ki-67 положительных клеток в опухолях II стадии находилась в пределах от 10% до 70% клеток, при III стадии от 10% до 80%. Средние значения экспрессии ki-67 в опухолях III стадии превышали соответствующий показатель опухолей II стадии в 1,7 раза (р<0,05) (табл.2).
Проведенное иммуногистохимическое исследование пролиферативной активности (ПА) опухолей пищевода в зависимости от стадии заболевания выявило преобладание опухолей с низкой и умеренной ПА при II стадии, тогда как при III стадии преобладали опухоли с высокой ПА. Соотношение доли опухолей с низкой ПА к доле опухолей с высокой ПА при II стадии составило 9, а при III стадии — 1,2.
Итак, по мере нарастания распространенности РП отмечается повышение частоты встречаемости и уровня экспрессии р53+ и маркера пролиферации ki-67, а также пролиферативной активности опухолевых клеток. При этом в опухолях II стадии отмечена тенденция к более частой и интенсивной экспрессии bcl-2, чем при III стадии.
Также был проведен сравнительный анализ частоты экспрессии p53, bcl-2 в зависимости от степени дифференцировки опухоли (табл. 3).
Таблица/Table 3.
Частота экспрессии p53 и bcl-2 в зависимости от степени дифференцировки опухоли
The frequency of expression of p53 and bcl-2, depending on the degree of differentiation of the tumor
Степень дифференцировки Degree of differentiation | ИГХ-маркеры IHC markers | |||||||
p53+ | p53- | bcl-2+ | bcl-2- | |||||
Абс. Absolute | % | Абс. Absolute | % | Абс. Absolute | % | Абс. Absolute | % | |
G1 | 2 | 66,7 | 1 | 33,3 | 2 | 66,7 | 1 | 33,3 |
G2 | 12 | 63,2 | 7 | 36,8 | 16 | 84,2 | 3 | 15,8 |
G3 | 7 | 87,5 | 1 | 12,5 | 5 | 62,5 | 3 | 37,5 |
При оценке пролиферативного потенциала опухолей пищевода II и III стадии заболевания выявлено наличие среди каждой из них опухолей с низкой, умеренной и высокой пролиферативной активностью. Полученные результаты представлены на рис. 1.
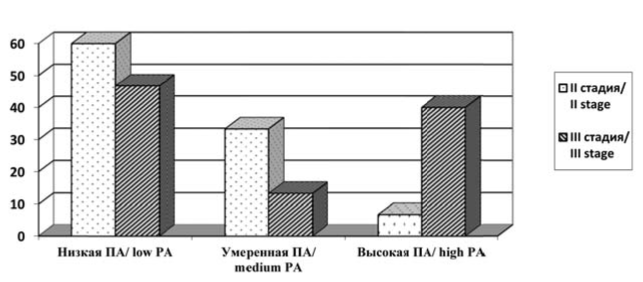
Рисунок 1. Доля опухолей с различной пролиферативной активностью (ПА) в зависимости от стадии заболевания, %.
Figure 1. Proportion of tumors with different proliferative activity (PA) depending on the stage of the disease, %.
Как видно из приведенных в табл. 3 данных, было выявлено возрастание доли р53+ случаев с увеличением степени злокачественности. Так, при G1 и G2 доля p53+ опухолей составила 66,7% (2 из 3) и 63,2% (7 из 12) соответственно, тогда как при G3 доля таких опухолей в 1,3 и 1,4 раза превосходила показатель G1 и G2 опухолей. Максимальное количество bcl-2+ опухолей было выявлено при G2, а именно в 84,2% случаев (16 из 19) в 1,3 раза ниже была их частота при G1 и G3- степени дифференцировки (в 66,7% и 62,5% случаев соответственно).
Результаты же количественной оценки экспрессии исследованных маркеров в зависимости от степени дифференцировки опухоли представлены в табл. 4. Анализ полученных данных позволил выявить, что среднее содержание p53+ клеток в опухолях пищевода G3 степени дифференцировки в 2 и 1,4 раза превосходило аналогичный показатель опухолей G1 и G2 (в обоих случаях различия статистически достоверны, p<0,05). При этом достоверной разницы средних значений экспрессии p53 между G1 и G2 опухолями выявлено не было, хотя этот показатель при G2 опухолях в 1,4 раза был выше в сравнении с G1 опухолями. Разброс количества p53 позитивных клеток при G1 находился в пределах от 5% до 70%, при G2 от 20% до 70%, и при G3 — от 55% до 85%.
Таблица /Table 4
Экспрессия ИГХ-маркеров в зависимости от степени дифференцировки опухолей
Expression of IHC markers depending on the degree of differentiation of tumors
Степень дифференцировки Degree of differentiation | Экспрессия ИГХ-маркеров, % клеток Expression of IHC markers,% of cells | ||
|---|---|---|---|
p53 | bcl-2 | ki-67 | |
G1 | 36,1±5,2 | 43,5±7,6 | 32,8±8,6 |
G2 | 51,9±7,6 | 44,9±4,3 | 25,5±5,2 |
G3 | 71,7±6 *↑**↑ | 26,7±6,4**↓ | 48,3±9,7**↑ |
Примечание: * — статистически достоверные отличия от показателей G1; ** — статистически достоверные отличия от показателей G2 (p<0,05).
Note: * — statistically significant differences from Gl; ** — statistically significant differences from G2 indices (p<0,05).
Минимальное среднее значение экспрессии bcl-2 было выявлено при низкодифференцированных опухолях (табл.4). Данные показатели были в 1,7 раза ниже соответствующих показателей Gl и G2 опухолей (p<0,05), между которыми различий не обнаружено. Разброс количества bcl-2+ клеток опухоли при Gl степени дифференцировки был от 5 до 70%, при G2 — от 10 до 70%, при G3 — от 5 до 55%. Были также выявлены некоторые различия интенсивности окрашивания цитоплазмы опухолевых клеток в при разной степени дифференцировки опухоли. Так, в опухолях пищевода Gl и G2 степени дифференцировки окрашивание цитоплазмы клеток характеризовалось яркой и средней интенсивностью (в 66,7% и 84,2% случаев соответственно), тогда как опухоли G3 характеризовались средней интенсивностью окрашивания в 100% исследованных случаев.
Из данных табл. 4 также видно, что доля пролиферирующих ki-67+ клеток в опухолях GI степени дифференцировки находилась в пределах от 10% до 50% клеток, тогда как при G2 и G3 от 10% до 80%. Средние значения экспрессии ki-67 в опухолях низкой степени дифференцировки в 1,4 раза превышали значения в опухолях G2 (p<0,05); при этом статистически достоверных различий экспрессии ki-67 между опухолями G1 и G2 выявлено не было.
При оценке пролиферативной активности опухолей пищевода в зависимости от степени дифференцировки выявлены некоторые различия (рис. 2). Так, превалирующими среди G1 опухолей были те, у которых ПА соответствовала низким значениям, опухолей с высокой ПА среди G1 нами выявлено не было. Напротив, опухоли G2 в большинстве случаев характеризовались низкой ПА, тогда как доля опухолей с умеренной и высокой ПА при G2 была равной. Половина опухолей G3 имела высокую ПА. Соотношение доли опухолей с низкой ПА к доле опухолей с высокой ПА при G2 степени дифференцировки составило 4,3, при G3 - 0,25.
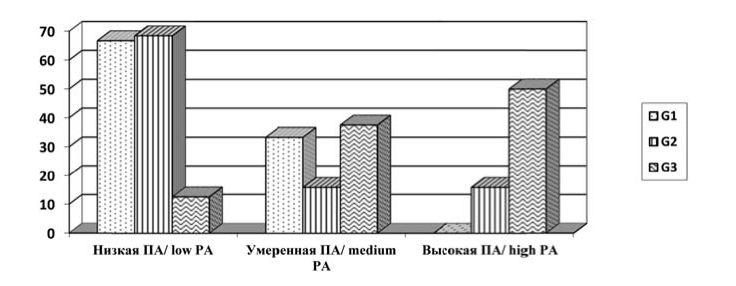
Рисунок 2. Доля опухолей с различной пролиферативной активностью (ПА) в зависимости от степени дифференцировки опухоли, %.
Figure 2. The proportion of tumors with different proliferative activity (PA), depending on the degree of differentiation of the tumor, %.
Обсуждение
Проведенное иммуногистохимическое исследование выявило различия в частоте встречаемости и экспрессии молекулярно-биологических маркеров (p53, bcl-2 и ki-67), контролирующих апоптоз и пролиферацию в зависимости от стадии заболевания и степени дифференцировки опухоли.
По мере нарастания распространенности рака пищевода отмечалось повышение частоты встречаемости и уровня экспрессии р53+ и маркера пролиферации ki-67, а также пролиферативной активности опухолевых клеток. При этом в опухолях II стадии была отмечена тенденция к более частой и интенсивной экспрессии bcl-2, чем при III стадии. Уменьшение степени дифференцировки РП характеризовалось повышением как доли опухолей, экспрессирующих р53 и ki-67, так и уровня экспрессии данных маркеров опухолевыми клетками. При этом экспрессия bcl-2 имела противоположную направленность.
Выводы
В результате ИГХ исследования были выявлены различия в частоте встречаемости и экспрессии молекулярно-биологических маркеров, контролирующих апоптоз и пролиферацию в зависимости от традиционных клинико-морфологических параметров опухоли (стадии и степени дифференцировки).
Выявленные различия экспрессии p53, bcl-2 и ki-67 в ткани плоскоклеточного рака пищевода могут быть использованы для прогнозирования течения злокачественного процесса.
Список литературы
1. Ferlay J., Soerjomataram I., Ervik M., Dikshit R., Eser S., Mathers C. et al. GlOBOCAN 2012: Estimated Cancer Icidence Mortality and Prevalence Worldwide in 2012. // Word Health Organization, International Agency for Researchon Cancer. International Agencyfor Researchon Cancer. [Online]. 2012. Available From: http://globocan.iarg.fr.
2. Мирончев А.О., Каган И.И., Мирончев О.В., Самойлов П.В Морфологические изменения пищевода при аденокарциноме и плоскоклеточном раке. // Экспериментальная и клиническая гастроэнтерология. - 2014. - №11 (111). - С. 61-64.
3. Тер-Ованесов М.Д., Левицкий А.В. Достижения в клинической онкологии опухолей ЖКТ в 2010 году: шаги вперед или реминисценции прошлого? // Практическая онкология. – 2011. – Т.12. - №1. – С.17-25.
4. Murata A., Baba Y., Watanabe M., Shigaki H., Miyake K., Karashima R., et al. Р53 immunohistochemical expression and patient prognosis in esophageal squamous cell carcinoma. // Med Oncol. – 2013. – Vol. 30. Issue 4. – С. 728.
5. Madani K., Zhao R., Lim H.J., Casson A.G. Prognostic value of p53 mutations in oesophageal adenocarcinoma: final results of a 15-year prospective study. // Eur J Cardiothorac Surg. – 2010. – Vol. 37. Issue 6. – С. 1427–1432. doi: 10.1016/j.ejcts.2009.12.018
6. Wang L., Yu X., Li J., Zhang Z., Hou J., Li F. Prognostic significance of p53 expression in patients with esophageal cancer: a meta-analysis BMC. // Cancer. – 2016. - №16. – С. 373.
7. Wei W., Wang Y., Yu X., Ye L., Jiang Y., Cheng Y. Expression of TP53, BCL-2, and VEGFA Genes in Esophagus Carcinoma and its Biological Significance. // Med SciMonit. – 2015. - №21. – С. 3016–3022.
8. Петров С.В., Райхлин Н.Т. Руководство по иммуногистохимической диагностике опухолей человека. – Казань; 2012.
9. Боровиков В.П. STATISTICA: искусство анализа данных на компьютере. Для профессионалов. – СПб.: Питер; 2001.
Об авторах
Е. Н. КолесниковРоссия
кандидат медицинских наук, заведующий
А. Л. Базаев
Россия
аспирант
Е. Ю. Златник
Россия
доктор медицинских наук, профессор, главный научный сотрудник
И. А. Новикова
Россия
кандидат медицинских наук, ведущий научный сотрудник
Е. П. Ульянова
Россия
научный сотрудник лаборатории иммунофенотипирования
О. Г. Шульгина
Россия
научный сотрудник
О. А. Попович
Россия
врач патологоанатом
В. С. Трифанов
Россия
кандидат медицинских наук, врач хирург
М. А. Кожушко
Россия
кандидат медицинских наук, врач хирург
С. В. Санамянц
Россия
кандидат медицинских наук, врач онколог
Л. В. Харин
Россия
научный сотрудник, врач хирург
Т. Б. Кациева
Россия
кандидат медицинских наук, врач хирург
С. С. Мезенцев
Россия
кандидат медицинских наук, врач хирург
Рецензия
Для цитирования:
Колесников Е.Н., Базаев А.Л., Златник Е.Ю., Новикова И.А., Ульянова Е.П., Шульгина О.Г., Попович О.А., Трифанов В.С., Кожушко М.А., Санамянц С.В., Харин Л.В., Кациева Т.Б., Мезенцев С.С. Экспрессия некоторых молекулярно-биологических маркеров при раке пищевода в зависимости от стадий заболевания и степени дифференцировки. Медицинский вестник Юга России. 2018;9(1):63-69. https://doi.org/10.21886/2219-8075-2018-9-1-63-69
For citation:
Kolesnikov E.N., Bazaev A.L., Zlatnik E.Yu., Novikova I.A., Ulianova E.P., Shulgina O.G., Popovich O.A., Trifanov V.S., Kozhushko M.A., Sanamyanc S.V., Kharin L.V., Kacieva T.B., Mesentsev S.S. Expression of some molecular and biological markers in esophageal tumors of various stages and grades. Medical Herald of the South of Russia. 2018;9(1):63-69. (In Russ.) https://doi.org/10.21886/2219-8075-2018-9-1-63-69
JATS XML






































