Перейти к:
Предиктивная диагностика метастатического поражения лимфоузлов у больных аденокарциномой желудка
https://doi.org/10.21886/2219-8075-2018-9-1-51-62
Аннотация
Для цитирования:
Кит О.И., Кутилин Д.С., Татимов М.З., Маслов А.А., Франциянц Е.М., Водолажский Д.И. Предиктивная диагностика метастатического поражения лимфоузлов у больных аденокарциномой желудка. Медицинский вестник Юга России. 2018;9(1):51-62. https://doi.org/10.21886/2219-8075-2018-9-1-51-62
For citation:
Kit O.I., Kutilin D.S., Tatimov M.Z., Maslov A.A., Frantsiyants E.M., Vodolazhsky D.I. Predictive diagnostics of lymph nodes metastatic lesion in patients with gastric adenocarcinoma. Medical Herald of the South of Russia. 2018;9(1):51-62. (In Russ.) https://doi.org/10.21886/2219-8075-2018-9-1-51-62
Введение
Во всем мире ежегодно диагностируется более 900 тыс. случаев рака желудка, что ставит данное заболевание на пятое место по распространенности среди всех онкологических заболеваний. Рак желудка является третьей ведущей причиной смерти от злокачественных новообразований в мире после рака легкого и рака печени. По данным за 2015 год, ежегодно от данного заболевания умирает более 800 тыс. человек [1]. Рак желудка занимает одно из ведущих мест в общей структуре онкологических заболеваний в РФ: 8,2% у мужчин и 5,4% у женщин. В структуре смертности населения России от злокачественных новообразований рак желудка занимает второе место с показателем 10,7% или 30788 человек в 2015 г. [2].
Аденокарцинома желудка составляет 95% от общего числа злокачественных новообразований данного органа [3]. Метастазы возникают у 90% больных, при этом выживаемость составляет 65% в случае ранней диагностики и менее 15% на поздних стадиях развития онкологического процесса [4]. Поэтому поиск потенциальных молекулярных и иммуногистохимических маркеров, пригодных для прогнозирования вероятности развития метастазов при этом заболевании является актуальной задачей.
Изменение копийности генов (Copy Number Variation или CNV) является одним из основных механизмов контроля раковой клеткой ключевых для выживания и малигнизации сигнальных путей. Копийность генов - вид генетического полиморфизма, возникающий в результате несбалансированных хромосомных перестроек, таких как делеции и дупликации. Результатом вариации может явиться снижение или повышение числа копий определенного гена, и, следовательно, пониженная или повышенная экспрессия продукта гена - белка или не кодирующей РНК. CNV представляют собой критические генетические события, которые способствуют развитию и прогрессированию злокачественных новообразований у человека [5]. Ранее было показано, что показатель копийности генов можно использовать в качестве предиктивного маркера при прогнозировании развития метастазов у пациентов с диагнозом рак желудка [6].
CNV являются следующим уровнем в понимании молекулярного контекста развития опухолевого процесса, включая метастазирование [7]. Амлификации генов HER2, CCNE1, MYC, KRAS и EGFR обнаружены в 9%, 5%, 2%, 1% и 1% случаев метастатического рака желудка соответственно [8]. Накопление CNV во время канцерогенеза желудка может быть результатом селекции, с помощью которого трансформированные клетки получают эволюционное преимущество [9]. Исследования выявили многочисленные увеличения (амплификации) и уменьшения копийности генов у пациентов с раком желудка, затрагивающие следующие участки хромосом: 3p22, 4q25, 8q24, 11p13, 20q13 (амплификации) и 1p36 9p21 (снижение копийности) [10]. Хотя большое количество CNV (волатильных областей) было идентифицировано при раке желудка, эта область исследования по-прежнему требует дальнейшего развития, для определения других генов, играющих важные роли в развитии рака желудка [9].
Не менее надежным маркером в прогнозировании развития метастазов является оценка показателей экспрессии белков. Так, при изучении аденокарциномы пищевода отмечается неблагоприятный прогностический эффект при избыточной экспрессии белка HER2 [11]. С-erbB-2 (HER2) — представитель семейства гомологичных трансмембранных рецепторов эпидермального фактора роста, обладающих тирозинкиназной активностью. Белок HER2, не имея собственного лиганда, взаимодействует с другими рецепторами и усиливает функционирование всей системы [11][12].
Область исследования экспрессии HER2 в последнее время значительно расширилась, охватив такие нозологии как рак молочной железы и рак желудка. Чувствительность и специфичность для диагностики аденокарциномы пищевода составляют 88 и 100% соответственно при одновременном гистохимическом определении HER2, c-myc, и анеуплоидии [13]. Единого мнения о прогностической ценности гиперэкспрессии белка HER2 при раке желудка пока нет [14]. Большинство исследований указывает на то, что избыточная мембранная экспрессия HER2 ассоциирована с плохим прогнозом заболевания и может служить прогностическим показателем для инвазивных характеристик опухоли и её метастазирования в лимфатические узлы [15].
Особое значение в прогнозировании поведения опухоли придают ее пролиферативной активности. Наиболее распространенным маркером пролиферации является регуляторный белок Ki 67. Несмотря на общее использование Ki 67 для индексации клеточной пролиферации, его прогностическая значимость при плоскоклеточном раке пищевода остается неубедительной. В трех исследованиях, включавших в общей сложности 192 пациента, наблюдался незначительный прогностический эффект этого маркера [11]. Напротив, исследование, проведенное Sittel C. et al. [16] показало, что высокая экспрессия Ki 67 является неблагоприятным фактором в прогнозе течения и общей безрецидивной выживаемости.
Ki 67 является надежным индикатором пролиферации практически во всех опухолевых образованиях человека. Антиген Ki 67, выявляемый соответствующими моноклональными антителами, представляет собой короткоживущий протеин, он разрушается в течение 1,5-2 часов. Поэтому, антитела к Ki 67 выявляют только делящиеся клетки, так как Ki-67 не успевает накапливаться и не остается в покоящихся клетках [17].
Транскрипционный фактор NFΚB (ядерный фактор «каппа-би») контролирует экспрессию генов иммунного ответа, апоптоза и клеточного цикла. Нарушение регуляции NFKB вызывает воспаление, аутоиммунные заболевания, а также развитие рака. Так как одним из важных свойств NFKB является его способность защищать клетку от апоптоза, гены его субъединиц относят к протоонкогенам. В норме активность сигнального пути NFKB в клетке находится под строгим контролем, однако мутации различных генов могут стать причиной его конститутивной активации. Это имеет место при лимфомах разного происхождения, множественной миеломе и раке [18].
Значительный объем материала представлен в литературе [9] и базе данных NCBI (https://www.ncbi.nlm.nih.gov/) о CNV генов и изменении экспрессии следующих белков при раке желудка: OCT1 (octamer transcription factor 1), GKN1 (gastrokinel), PIK3CA (Phosphatidylino- sitol-4,5-Bisphosphate 3-Kinase, Catalytic Subunit Alpha), S6K2 (ribosomal protein S6 kinase2), APC (adenomatous polyposis coli), IRX1 (Iroquois homeobox protein), MET (hepatocyte growth factor receptor), POU5F1B (POU domain class 5 transcription factor 1B,the OCT4 pseudogene), AURKA (centrosome-associated kinase aurora A), CCND1 (циклин D1 ), HV2, P53, C-MYC (V-Myc Avian Myelocytomatosis Viral Oncogene Homolog) и MDM2 (Mouse double minute 2 homolog).
Целью исследования — формирование панели маркеров для прогнозирования вероятности развития метастазов в лимфоузлы у пациентов с диагнозом аденокарцинома желудка на основании комплексного использования показателей относительной копийности генов и иммуногистохимической экспрессии белков, выбранных в процессе анализа баз данных и литературных источников.
Материалы и методы
Клиническим материалом для исследования послужили ткани (опухолевые и условно здоровые) 47 пациентов Юга России с гистологически подтвержденным диагнозом аденокарцинома G2-G3. Медиана возраста пациентов составила 67 лет (от 36 до 83 лет). По клинической классификации заболевания были сформированы две группы пациентов: с локализованной формой опухоли T3-4N0M0 (n=18) и местнораспространенной формой рака желудка T3-4N1-3M0 (n=29) (табл. 1).
Таблица/Table 1.
Клинико-морфологическая характеристика пациентов
Clinical and morphological characteristics of patients
Характеристика Characteristic | Переменные Variables | Количество (%) Quantity (%) |
|---|---|---|
Клиническая классификация | T3-4N0M0 | 18 (38%) |
Clinical classification | T3-4N1-3M0 | 29 (62%) |
Стадия дифференцировки опухоли (G) The stage of tumor differentiation (G) | 2 | 24 (51%) |
2-3 | 12 (26%) | |
3 | 11 (24%) | |
Пол Gender | Женщины | 14 (30%) |
women |
| |
Мужчины men | 33 (70%) | |
Возраст, лет | <60 | 11 (23%) |
Age, years | >60 | 36 (77%) |
Геномную ДНК экстрагировали из свежезамороженных операционных биоптатов тканей желудка с использованием лизирующего SDS-содержащего буфера в присутствии протеиназы-К и последующей фенол-хлороформной экстракцией [19]. Концентрацию полученных препаратов ДНК измеряли на флюориметре Qubit 2.0® (Invitrogen, США) с использованием набора Quant- iT™ dsDNA High-Sensitivity (HS) Assay Kit (Invitrogen, США). Для определения относительной копийности гена (rC) проводили Real Time- qPCR.
Принцип метода RT-qPCR заключается в одновременной амплификации гена-мишени и референсного гена в опытной и контрольной пробах. Вывод об изменении копийности гена делали на основании анализа соотношения сигналов, продуцируемых ампликонами изучаемой и референсной последовательностей, относительная величина определяется методом ΔΔCt [20]. Прямые и обратные праймеры были разработаны с использованием соответствующих референсных последовательностей NCBI GenBank в программе BLAST. Каждые 25 мкл ПЦР- смеси содержали 10 нг геномной ДНК, 0.2mM dNTP’s, по 600 нМ прямого и обратного праймеров для референтного гена или гена-мишени, 2.5 mM MgCl2, ПЦР-буфер, 0.05u/μl ДНК-полимеразы Thermus aquaticus («Синтол», Россия). В качестве красителя использовали SYBR®Green I (Invitrogen, США). Амплификация каждой из проб осуществляли в трех повторностях.
Количественная RT-PCR амплификация проводилась с использованием термоциклера CFX96 (Bio-Rad, USA) в соответствии с инструкциями производителя по следующей программе: 95 °C 3 мин., и 40 циклов при 95 °C 10 сек, 58 °C 30 секунд (чтение оптического сигнала красителя FAM для красителя SYBR-Green) и 72 °C 15 секунд. Первичные данные RT-qPCR получали с использованием программного обеспечения Bio-Rad CFX Manager (ver. 3.1). Генетический локус B2M использовали в качестве референсного для нормализации полученных показателей количественной RT-qPCR.
Относительную копийность (rC) вычисляли по формуле: rC= rCопухоль/ rCнорма =2-ΔCt (опухоль)/ 2-ΔCt (норма), где ΔCt=Ct(исследуемого гена) – Ct(B2M)).
Параллельно проводят иммуногистохимическое исследование на срезах парафиновых блоков, предназначенных для стандартного морфологического исследования, с помощью моноклональных антител к p53, Bcl-2, Ki-67 и c-erbB2 (Her2neu).
Депарафинизацию и дегидратацию парафиновых срезов выполняли по стандартной методике. «Демаскировку» антигенов проводили в PT-Link Thermo. Согласно протоколу, вначале срезы подвергались предварительному нагреву до 650С, далее происходило восстановление антигена в течение 20 минут при температуре 970С и охлаждение до 650С. После этого стекла промывали в течение 1-3 минут TBS-буфером (Dako) и помещали в автостейнер Thermo Scientific для окрашивания в автоматическом режиме. Визуализация иммуногистохимической реакции выполнялась с использованием системы детекции Reveal Polyvalent HRP-DAB Detection System. Перед заключением покровных стекол под бальзам Bio-Mount, срезы докрашивали гематоксилином Майера. Оценку результатов иммуногистохимической реакции проводили с применением светового микроскопа «Leica» (Германия) под увеличением х10, х20, х40.
В исследовании применяли следующие критерии оценки маркеров:
- Опухоль считали отрицательной по р53, если в ядрах клеток ткани опухоли отсутствовала реакция с антителами или количество окрашенных клеток было менее 25%, и положительной по р53, если было окрашено более 25% ядер опухолевых клеток.
- Опухоль считали отрицательной по bcl-2, если в ткани опухоли отсутствовала цитоплазматическая реактивность с антителами или количество окрашенных клеток было менее 25%, и положительной по bcl-2, если было окрашено более 25% опухолевых клеток.
- Для оценки пролиферативной активности (ПА) опухоли подсчитывали количество ki-67-положительных опухолевых клеток, приходящихся на 200-300 опухолевых клеток. Индекс ki-67 определяли по формуле
ПА (%)= число ki-67 положительных клеток х 100/ общее количество клеток
Маркеры пролиферативной активности расценивали на основе наиболее часто употребляющегося способа оценки пролиферативной активности: 0%-20% — низкая пролиферативная активность, 21%-50% — умеренная пролиферативная активность, 51%-100% — высокая пролиферативная активность.
- Экспрессию рецепторов c-erbB2 (Her2 /Neu) оценивали в плюсах: (+) — слабое мембранное окрашивание менее, чем в 10% клеток опухоли; (++) — умеренное мембранное окрашивание более, чем в 10% клеток опухоли; (+++) — сильное мембранное окрашивание более, чем в 10% клеток опухоли; (—) — отсутствие экспрессии или менее 5% иммунопозитивных опухолевых клеток, однако всегда учитывались характер и особенности иммуноокрашивания клеток. Степени 2+ и 3+ классифицировались как гиперэкспрессия HER2/neu.
Методы статистической обработки результатов
Полученные данные обрабатывали с использованием электронных таблиц Excel 2010 и пакета прикладных программ Statistica 8.0. Для оценки полученных результатов использовали непараметрические критерии (медиана, персентили 0,25 и 0,75, критерий Манна-Уитни, коэффициент корреляции Спирмена). Для сравнения частот встречаемости событий использовали критерий χ2 с оценкой правдоподобия точным критерием Фишера.
Для построения «Heatmap» и расчёта корреляционных связей между показателями относительной копийности 16-ти генетических локусов в группах T3-4N0M0 и T3- 4N1-3M0 использовали среду программирования R.
Результаты
Изменение относительной копийности генетических локусов у больных с аденокарциномой желудка
В ходе исследования получены данные об относительной копийности (rC) 15-тиядерных генов-участников ключевых сигнальных путей, регулирующих рост клетки, выживание, метастазирование и устойчивость к химиотерапии (APC, AURKA, CCND1, C-MYC, GKN1, HER2, IRXl, MDM2, MET, NFKB, OCT1, P53, PIK3CA, POU5F1B и S6K2) и некодирующего локуса HV2 мтДНК, у пациентов с локализованной формой опухоли T3-4N0M0 и местнораспространенной формой рака желудка T3-4N1-3M0 (рис. 1).
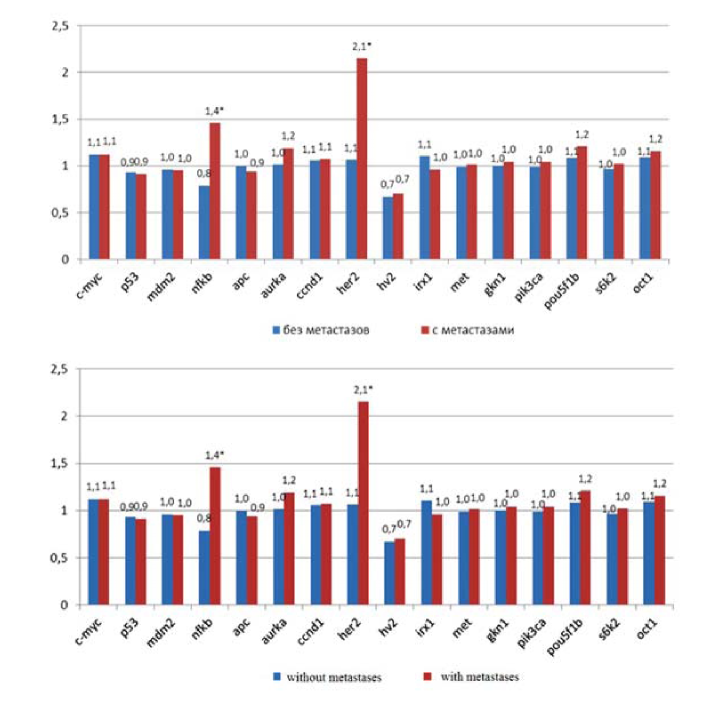
Рисунок 1. Относительная копийность 16-ти генетических локусов в группах T3-4N0M0 и T3-4N1-3M0.
Figure 1. Relative copy number of 16 genetic loci in groups T3-4N0M0 and T3-4N1-3M0.
В целом, 70% образцов опухолей желудка продемонстрировали амплификацию и/или потерю хотя бы по одному локусу. Наиболее частыми CNV-изменениями в образцах аденокарциномы желудка стала потеря копийности локуса мтДНК HV2 в 15-ти случаях (32%), кроме этого в трёх случаях HV2 был амплифицирован, по сравнению с неопухолевой тканью желудка. Тем не менее, достоверного изменения копийности в группе T3-4N0M0 относительно T3-4N1-3M0 не обнаружено.
Статистический анализ (критерий Манна-Уитни) выявил достоверное изменение копийности в группе T3- 4N0M0 относительно T3-4N1-3M0 только 2 из 16 локусов NFKB и HER2. У пациентов с местнораспространенной формой рака желудка наблюдалось увеличение копийности генов NFKB и HER2 в 1,75 и 1,9 раза (p<0,0005), по сравнению с копийностью этих генов у пациентов с локализованной формой опухоли.
Согласно корреляционному анализу полученных данных, выявлены прямые статистически достоверные ассоциации между амплификацией онкогенов NFKB и POU5F1B и метастазирование в региональные лимфоузлы (р<0,005). Также построение тепловых карт на основе коэффициента корреляции Спирмена, показывает значительные отличия в межгенной корреляции показателей копийности в группе пациентов с метастазами от группы пациентов без метастазов (рисунок 2). Как видно из представленных данных в опухолевой ткани желудка пациентов без метастазов преобладает отрицательная корреляции (при этом медиана (r)=-0,02), в противоположность группе пациентов с метастазами (при этом медиана (r)=0,10).
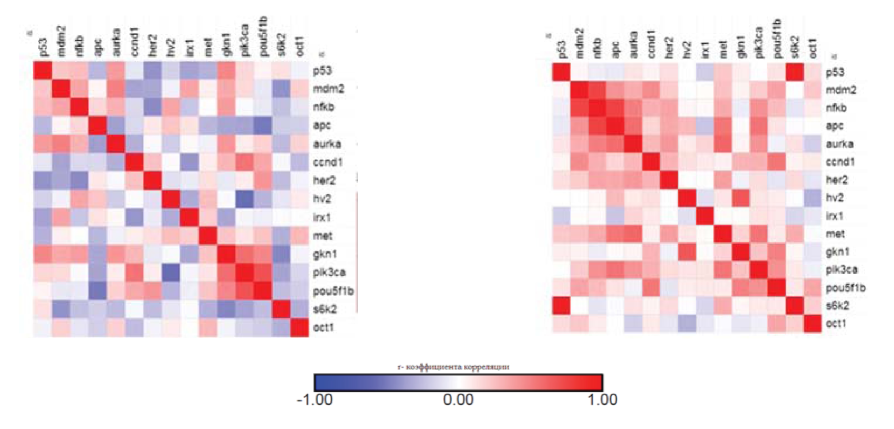
Рисунок 2. «Heatmap» корреляционных связей между показателями относительной копийности 16-ти генетических локусов в группах T3-4N0M0(слева) и T3-4N1-3M0(справа) (анализ выполнен в среде R).
Figure 2. «Heatmap» correlations between parameters relative copy number of 16 genetic loci in groups T3-4N0M0 (left) and T3-4N1-3M0 (right) (analysis is performed in R).
Условно генетические локусы, вошедшие в настоящую работу, можно разделить на группы — группу ллкусов, редко изменяющих свою копийность в выборке (менее 10%), таких как P53, MDM2, AURKA, IRX1, MET, PIK3CA, S6K2, и на группу «мажорных» маркеров, таких как C-MYC, NFKB, CCND1, HER2, HV2, POU5F1B, OCT1.
В табл. 2 представлена оценка эффективности идентификации риска регионарного метастазирования аденокарциномы желудка с глубокой инвазией при включении в тестирование маркеров, как статистически значимо дискриминирующих T3-4N0M0 и T3-4N1-3M0, так и продемонстрировавших потенциальную информативность для данных целей (согласно данным х2-теста).
Таблица/ Table 2.
Оценка дискриминации групп T3-4N0M0 и T3-4N1-3M0
Assessment of the discrimination of groups T3-4N0M0 and T3-4N1-3M0
Параметры Parameters | Набор исследованных генов Set of examined genes | ||
|---|---|---|---|
NFKB, POU5F1B | NFKB, POU5F1B, HER2 | NFKB, HER2 | |
X2 | 6,123 | 7,361 | 11,798 |
Вероятность (p) Probability (p) | 0,0743 | 0,009 | 0,0006 |
Относительный риск (RR) Relative risk (RR) | 6,828 | 4,345 | 2,209 |
95% доверительный интервал (CI 95%) 95% confidence interval (CI95%) | 0,961-48,51 | 1,115-16,926 | 1,37-3,562 |
Чувствительность (Se) Sensitivity (Se) | 91,7% | 87,5% | 62,1% |
Специфичность (Sp) Specificity (Sp) | 48,6% | 51,6% | 88,9% |
Обнаружение в опухоли амплификации по одному из двух маркеров (NFKB, POU5F1B) повышает риск метаста- зирования в регионарные лимфатические узлы почти в 7 раз, но без статистически значимой достоверности в пределах использованной нами выборки (95%CI:0,961-48,51, P>0,05). Добавление локуса HER2 в паттерн маркеров повышает уровень риска метастазирования только в 4 раза, однако это значение относительного риска статистически значимо (95%CI:1,115-16,926, P<0,05). Два из 16-ти исследованных локусов продемонстрировали статистическую значимость для дискриминации групп T3-4N0M0 и T3- 4N1-2M0 — NFKB и HER2 (чувствительность Se-62%; специфичность Sp - 88%). В целом, обнаружение в опухоли амплификации 2 этих локусов повышает риск метастазирования в регионарные лимфатические узлы в 2,2 раза (P<0,001).
Экспрессия белков р53, ki-67, bcl2, Her2/neu в опухолях желудка у пациентов с поражением и без поражения регионарных лимфоузлов
Положительная экспрессия р53 (>25%) в группе без метастазов была выявлена в 20% (6 из 30) пациентов, разброс количества окрашенных клеток при этом находился в пределах от полного отсутствия окрашивания до 15% (рис. 3) клеток, тогда как отрицательная реакция была отмечена в 80 % (24 из 30).
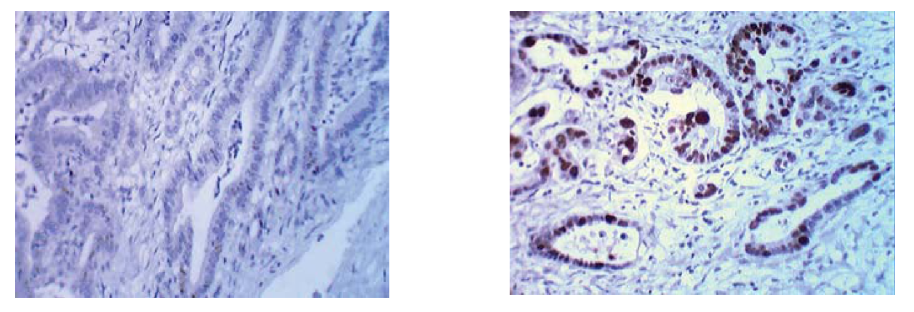
Рисунок 3. Экспрессия р53 в ядрах опухолевых клеток в группе без метастазов (слева) и в группе с метастазами (справа). Ув. Х 40.
Figure 3. p53 expression in tumor cells nuclei in the group without metastases (left) and in the group with metastases (right). (zoom X40).
В группе с метастазами накопление р53 в ядрах клеток встречалось у 40% (12 из 30) пациентов, разброс количества окрашенных клеток при этом находился в пределах от единичного окрашивания до 60% клеток, и в 10% (3 из 30) достиг точки разделения «cut-off» в 25% ядер опухолевых клеток (рис. 3).
Отрицательная экспрессия наблюдалась в 50% случаев (15 из 30). При распределении по критерию χ2 связь между факторным и результативным признаками была статистически значима (5,934> 3,841) при уровне значимости р<0.05. Среднее значение экспрессии р53 в ядрах опухолевых клеток в группе без метастазов было ниже на 52,4% по сравнению с экспрессией данного маркера из группы с метастазами (различия статистически достоверны р<0,05).
Положительная экспрессия bcl-2 в группе без метастазов была обнаружена в 40% случаев (18 из 30), разброс количества окрашенных клеток был небольшим и составлял от 10% и до 30% (рис. 4).
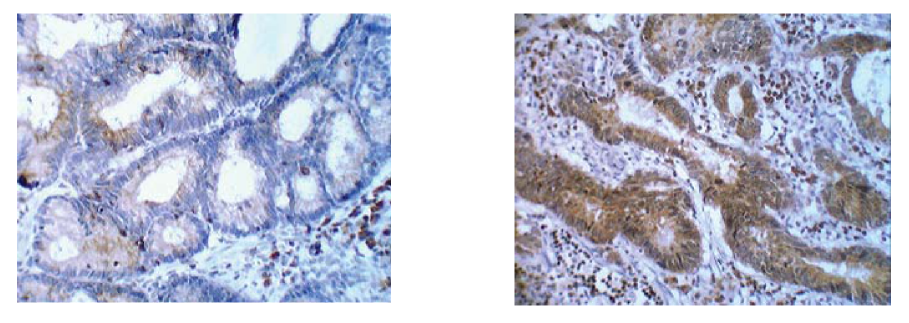
Рисунок 4. Экспрессия bcl-2 в цитоплазме опухолевых клеток в группе без метастазов (слева) и с метастазами (справа). Ув. Х 40.
Figure 4. bcl-2 expression in tumor cells cytoplasm in the group without metastases (left) and with metastases (right). (zoom X40)
Отсутствие окрашивания клеток к маркеру bcl-2 отмечалось в 60% (12 из 30). В группе с метастазами положительная реакция окрашивания к антителам bcl-2 цитоплазмы опухолевых клеток наблюдалась в 53,3% случаев (16 из 30) и разброс составлял от 25% и до 55% (рис.4). Отсутствие окрашивания было отмечено в 46,7% (14 из 30). При распределении по критерию χ2 связь между факторным и результативным признаками была статистически не значима (1,071< 3,841) при уровне значимости р>0.05. Хотя среднее значение окрашенных клеток маркером bcl-2 в группе без метастазов и было ниже на 19%, чем в группе с метастазами, однако разница оказалась статистически недостоверна р>0,05.
При оценке пролиферативного потенциала клеток исследуемых групп было выявлено наличие низкой, умеренной и высокой пролиферативной активности (ПА). В группе без метастазов наблюдалось равномерное распределение пролиферативной активности между пациентами, но все-таки низкая ПА преобладала и была отмечена у 40% (12 из 30) пациентов. Умеренная и высокая пролиферативная активность отмечалась у 33,3% (10 из 30) и 26,7 % (8 из 30) соответственно (рис. 5).
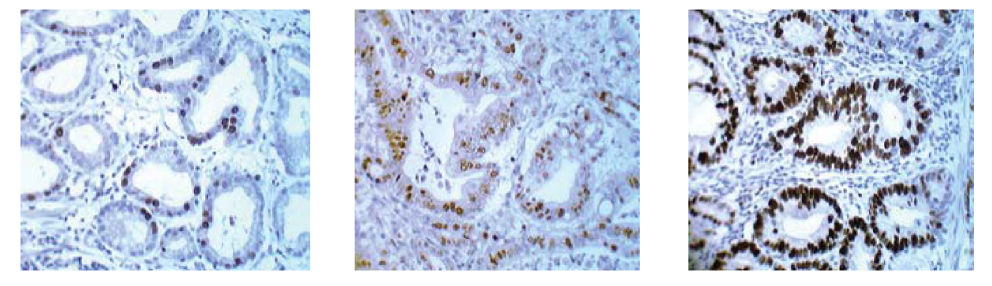
Рисунок 5. Экспрессия ki-67 в ядрах опухолевых клеток в группе без метастазов (слева, низкая) и с метастазами (по центру — умеренная и справа — высокая). Ув. Х 40.
Figure 5. ki-67 expression in tumor cells nuclei in the group without metastases (left, low expression) and with metastases (center — moderate expression and right — high expression). (zoom, X 40).
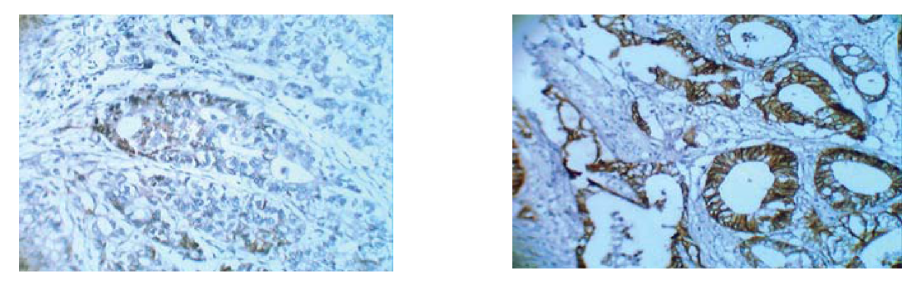
Рисунок.6. Слабая экспрессия с-erbB-2 (+) на мембранах опухолевых клеток в группе без метастазов и гиперэкспрессия с-erbB-2 (+++) на мембранах опухолевых клеток в группе с метастазами. Ув. Х 40.
Figure 6. Weak expression of c-erbB-2 (+) on tumor cells membranes in the group without metastases and overexpression of c-erbB-2 (+++) on tumor cells membranes in the group with metastases. (zoom, X 40).
В группе же с метастазами максимальное количество опухолей было выявлено с умеренной пролиферативной активностью и отмечалось у 56,7% больных (17 из 30)).
Тогда как высокая ПА была отмечена у 33,3% пациентов (4 из 30), а низкая — всего у 10% больных (3 из 30). Разброс пролиферирующих ki-67 положительных клеток в группе без метастаз находился в пределах от 15% до 60%, в группе с метастазами — от 20% до 70%. Соотношение доли опухолей с низкой ПА к доле опухолей с высокой ПА в группе без метастазов составило 1,5, тогда как в группе с метастазами — 0,3. При распределении по критерию χ2 связь между факторным и результативным признаками была статистически значима (7,437>5,991) при уровне значимости р<0.05.
Отсутствие экспрессии («-» — негативная иммуно- гистохимическая реакция) Her2 в группе без метастазов определялась в 66,7% случаев (20 из 30). Интенсивное окрашивание мембраны раковых клеток («++» — умереннопозитивная иммуногистохимическая реакция) наблюдалось в 20% случаев (5 из 30). В группе с метастазами отрицательная экспрессия с-erbB-2 определялась в 56,7% случаев (17 из 30), где полное отсутствие (-) наблюдалось в 46,7% (14 из 30 пациентов), а слабая мембранная реакция (+) в 10% (3 из 30 пациентов). В данной группе нами была отмечена тенденция к повышению экспрессии с-erbB-2. Так, гиперэкспрессия (++) и (+++) наблюдалась в 43,3 % случаев (13 из 30 наблюдений), из них (++) встречалась в 16,6% (5 из 30), («+++» — сильнопозитивная им- муногистохимическая реакция) — в 26,7% (8 случаев из 30) (рис.8). Хотя разброс количества положительно окрашенных клеток был неоднородным и находился от 10% до более 50%, в основном все-таки преобладал высокий процент окрашивания опухолевых клеток.
При распределении по критерию χ2 связь между факторным и результативным признаками также была статистически значима (5,079> 3,841) при уровне значимости р<0.05. Данные исследования приведены в табл. 3.
Таблица/ Table 3.
Анализ экспрессии с-егЬВ-2 у пациентов исследуемых групп
Analysis of c-erbB-2 expression in patients in the study groups
Экспрессия с-erbB-2 с-erbB-2 expression | Группа без метастазов (n=30) Group without metastases (n = 30) | Группа с метастазами (n=30) Group with metastases (n = 30) | χ2 | p | ||
|---|---|---|---|---|---|---|
Абс. Absolute | % | Абс. Absolute | % | |||
(-) | 20 | 66,7 | 14 | 46,7 |
|
|
(+) | 5 | 13,3 | 3 | 10 |
|
|
(++) | 5 | 20 | 5 | 16,6 | 5,079 | 0.0242 |
(+++) | - | - | 8 | 26,7 | ||
Всего Total | 30 | 100 | 30 | 100 |
|
|
Прогнозирование развития метастазов у пациентов с аденокарциномой желудка
На основании статистической обработки полученных выше результатов были выбраны прогностические значения копийности генов и экспрессии белков:
- при значениях rC NFKB1<при значениях rCNFKB1 > 0,8±0,02 и rCHER2<при значениях rCNFKB1 > 1,1±0,08 в комбинации с уровнем экспрессии в ядрах опухолевых клеток белка Ki 67игх <при значениях rCNFKB1 > 35,6±6,1 и негативной экспрессией HER2игх(-) прогнозируют отсутствие метастазов (чувствительность 75%);
- при значениях rCNFKB1 > 0,9±0,01 и rCHER2 > 2,0±0,1 в комбинации с уровнем экспрессии в ядрах опухолевых клеток белка Ki 67игх > 54,2±4,9 и позитивной экспрессией HER2игх (+++) прогнозируют развитие метастазов (чувствительность 70%).
Таким способом было осуществлено прогнозирование вероятности развития метастазов у 30 пациентов с диагностированной аденокарциномой желудка (см. клинические примеры).
Клинические примеры
1) Больной Р., дата рождения 06.02.1950 г., госпитализирован в отделении абдоминальной онкологии №1 РНИОИ 19.11.2014 г. с верифицированным диагнозом рак желудка, ФГС 09.10.2014 Сancer субкардиального отдела желудка. Атрофический анацидный (РН-5,0) Нр-не ассоциированный гастрит. Дуоденит.
При СРКТ органов грудной клетки, брюшной полости и малого таза 02.10.2014 перигастральных, периинтестинальных образований не выявлено. Легочная ткань — с обеих сторон в легких диффузный пневмосклероз, что позволило предположить до операции стадию II, T3NxM0.
19.11.2014 Лапаротомия, гастрэктомия с расширенной лимфаденкэктомией. При макроскопическом исследовании в удаленном желудке обнаружена опухоль до 6 см в диаметре по малой кривизне, инфильтративно язвенного типа, увеличенные лимфоузлы вдоль левых желудочных сосудов (до 10).
По данным патоморфологического исследования, после операции № 88480-483/14 G2 аденокарцинома с изъязвлением инвазией всей толщи стенки желудка и подлежащей жировой ткани; 88494-503 в 1 из 10 лимфоузлов-метастаз аденокарциномы.
Таким образом, степень распространения процесса, согласно классификации TNM, соответствовала T3N1M0.
Результаты оценки копийности целевых генов и параметров ИГХ в биоптате у данной пациентки: rCNFKB1=0,95 и rCHER2 = 2,6; уровень экспрессии в ядрах опухолевых клеток белка KI67игх = 59,5 и позитивная экспрессия HER2игх (+++), находились в границах прогностического критерия развития метастазов.
2) Больная П., дата рождения 20.05.1960 г., госпитализирована в отделении абдоминальной онкологии №1 РНИОИ 30.06.2015 г. с верифицированным диагнозом рак желудка. ФГДС 17.06.2015 рак антрального отдела желудка, гистологическое исследование № 3284 малодифференцированная аденокарцинома. КТ брюшной полости и забрюшинного пространства 23.06.2015 КТ-признаки диффузных изменений паренхимы печени по типу стеа- тоза, хронического холецистита, густой желчи в полости желчного пузыря, хронического панкреатита, признаков метастатического поражения не выявлено, что позволило предположить до операции стадию II, T3NxM0.
02.07.2015 была выполнена операция: дистальная субтотальная резекция желудка по Бильрот 2 с расширенной лимфаденэктомией. При макроскопическом исследовании в удаленной части желудка обнаружена опухоль в выходном отделе до 6 см в диаметре, инфильтративно- язвенного типа, на разрезе — белесоватого цвета, в большом и малом сальнике увеличенных лимфоузлов не выявлено. По данным патоморфологического исследования после операции №53119-121/15 G2-3 аденокарцинома с инвазией в клетчатку, 53122-7/15 метастазов опухоли в лимфоузлах нет. Таким образом, степень распространения процесса, согласно классификации TNM соответствовала T4aN0M0.
Результаты оценки копийности целевых генов и параметров ИГХ в биоптате у данной пациентки: rCNFKB1 =0,65 и rCHER2 = 1,0; уровень экспрессии в ядрах опухолевых клеток белка Ki 67игх = 26,2 и экспрессия HER2игх негативная (-), находились в границах прогностического критерия отсутствия развития метастазов.
Обсуждение
Одной из основных задач исследования CNV в геноме является выявление онкогенов, которые вызывают функциональные нарушения в клетке, способствующие её малигнизации. Согласно литературным данным охарактеризованы изменения копийности множества генов в опухолях различного происхождения. Оценки встречаемости изменения копийности одного и того же гена часто значительно разнятся. Так, приводимые частоты амплификации онкогена HER2, ассоциированной, как правило, с плохим исходом, варьируются от 6 до 23% от числа исследованных случаев рака желудка [9]. Вклад в эту вариативность могут вносить как методы исследования, так и популяционная принадлежность пациентов. Например, в двух недавних работах, оценивавших копийность онкосупрессора APC в образцах РЖ методом PCR-qRT, относительно высокая частота уменьшения копийности гена (25,9%) была определена группой Fang et al. [21] для китайской популяции (n=141), тогда как в работе Tsai et al. [22] для пациентов этнических тайванцев и китайцев (n=110) этот показатель составил всего 3,6%, тем не менее, коррелируя с риском развития злокачественной опухоли (p=0,026).
В работе не было обнаружено образцов опухолей с аберрантными rC генов APC и GKN1, что может быть обусловлено как популяционными особенностями нашей группы пациентов, недостаточной численностью выборки для обнаружения достаточно редких событий, так и ограничениями при формировании групп сравнения (отбирали опухоли с инвазией всех слоев желудка — Т3-4).
Ранее обсуждалось снижение числа копий мтДНК, оцениваемое по rC локуса HV2, в различных гистологических типах рака желудка относительно нормальных клеток и по мере потери дифференцировки опухолевыми клетками [5]. Тенденция снижения числа копий митохондриальных генов, как отражение известного эффекта Варбурга — перехода малигнизированных клеток в режим преимущественного использования гликолиза (анаэробный режим) [23], отражена и в настоящем исследовании, однако данный маркер не дискриминировал опухоли с наличием и отсутствием метастазов в регионарные лимфоузлы.
Во многих исследованиях сообщалось о значительном увеличении числа копий гена С-МУС в процессе канцерогенеза [24], в том числе была показана тесная связь этого события с глубиной метастазов в лимфатических узлах и инвазией опухоли желудка [1]. Для гена POU5F1B с ещё не вполне описанными функциями была продемонстрирована ассоциация увеличения числа копий и, как следствие, избыточной экспрессии при раке желудка, что, в свою очередь, коррелирует с ростом опухоли [25]. Биологическое значение активации ядерного факторакаппа-B (NF-kappa B) в неопластических образованиях желудка человека неясно. Тем не менее, была выявлена связь активации NF-kappaB с канцерогенезом, агрессивностью опухоли желудка и инфекцией H.pylori с повышенной экспрессией MMP-9, IL-1beta и IL-8 [26].
В целом, выявленные частоты проявления аберрантных CNV в злокачественных опухолях желудка T3-4N0- 3M0 согласуются в большинстве случаев с данными более ранних исследований.
Особую роль при развитии рака желудка играет онкоген HER2, кодирующий тирозинкиназный рецептор. Повышенная экспрессия его белкового продукта стала критерием в молекулярной классификации рака желудка [27]. Кроме того, амплификация гена HER2 ассоциирована, как правило, с плохим исходом [9]. Отметим также значительно различающиеся оценки по частоте встречаемости амплификации HER2 в разных работах, которые варьируют от 6% до 23% от числа исследованных случаев рака желудка [9]. В нашем исследовании распределение частот амплификации локуса HER2 по выделенным группам аденокарцином желудка продемонстрировало тенденцию к ассоциации этого показателя с регионарным метастазированием (P=0,071), так как в T3-4N1-3M0 группе аберрантное состояние этого маркера встречалось чаще. Поэтому характер распределения аберрантных показателей rC гена HER2 в образцах опухоли, позволил повысить статистическую значимость дискриминации T3- 4N1-3M0 группы при использовании в тесте нескольких локусов, что обсуждено ниже.
Исследование экспрессии белка HER2 продемонстрировало повышенную частоту встречаемости гиперэкспрессии в аденокарциномах с метастазами. Анализ данных ИГХ и rC этого локуса выявил статистически значимую положительную корреляцию (R=+0,828 при P<0,01). Таким образом, в большинстве случаев (80%) амплификация генетического локуса HER2 сопровождалась повышением экспрессии кодируемого им белка HER2.
Патологические изменения апоптоза в малигнизированных клетках играют важную роль в накоплении генетических клеточных повреждений, ответственных за развитие опухолевой прогрессии. При этом опухолевые клетки получают возможность выживать без наличия экзогенных факторов роста, становятся устойчивыми к гипоксии, активизируют пролиферативные процессы, в них нарушается дифференцировка, клетки стимулируют ангиогенез, приобретают клеточную подвижность и инвазивный рост. Нарушения апоптоза активируют метастазирование, позволяя отдельным эпителиальным клеткам выживать вне связи с внеклеточным матриксом. Таким образом, патология апоптоза является фундаментальной причиной возникновения злокачественных опухолей.
Ключевыми белками, участвующими в управлении апоптозом, являются белки семейства bcl-2 и супрессор опухолевого роста р53.
В норме ген р53 осуществляет защиту генома. Нарушения процессов апоптоза наступают в том случае, если ген р53 теряет свои функции. Это может произойти в условиях патологии, когда в результате мутации гена p53 образуется его мутантный аналог — mt p53. Мутация p53 приводит к нарушению внутриклеточных механизмов регуляции клеточного цикла и не дает реализоваться апоптозу, чем способствует опухолевому росту [28]. Белок p53 постоянно синтезируется в клетках, но является короткоживущим белком. Мутации гена p53 ведут к “сверхэкспрессии” этого белка, которые иммуногистохимическим путем выявляются с помощью анти-p53 антител. Мутированный ген р53 является ранним маркером процессов малигнизации и опухолевой прогрессии [17]. Проведенное исследование выявило наличие достоверных различий экспрессии опухолевыми клетками р53 среди исследуемых групп. Наиболее значимые показатели экспрессии данного маркера получены в группе с метастазами, что в 2,1 раз превосходило данный показатель в группе без метастазов (р<0,05).
Анти-апоптозный онкоген bcl-2 является независимым прогностическим и предсказательным признаком, ведущим геном, определяющим механизм клеточной смерти, подавляя апоптоз. Этот ген кодирует образование белка, накапливающегося в митохондриях, что при иммуногистохимической реакции находит отражение в пятнистой окраске цитоплазмы. Основным механизмом действия bcl-2 считается инактивация проапоптотических гомологов семейства bcl-2 путем димеризации с ними и, как следствие, подавление выхода из митохондрий цитохрома С, необходимого для активации каспаз [29]. В группе с метастазами было выявлено преобладание положительно окрашенных клеток к маркеру bcl-2 в 1,2 раза. Однако разница между группами была статистически не достоверна (р>0,05).
Универсальным маркером для оценки клеточного цикла является белок Ki-67, по экспрессии которого можно исследовать пролиферативную активность клеток. Антитела к Ki-67 выявляют пролиферирующие клетки, находящиеся в разных фазах цикла. Это наиболее надежный и четкий маркер пролиферации [17].
Среднее значение экспрессии Ki-67 в группе без метастазов было ниже на 34,3%, по сравнению с экспрессией данного маркера в группе с метастазами, разница значений статистически достоверна (р<0,05). Проведенное ИГХ (исследование пролиферативного потенциала опухолей исследуемых групп) выявило преобладание опухолей с низкой пролиферативной активностью в группе без метастазов в 4 раза по сравнению с группой с метастазами. Умеренная и высокая пролиферативная активность встречалась чаще у больных в группе с метастазами в 1,7 раз и 1,2 раза соответственно.
Заключение
Проведенное исследование показало, что относительная копийность исследованных генетических локусов в опухолях желудка разных N-типов изменяется неодинаково. Были выявлены характерные для аденокарцином T3-4N1-3M0 набор и частота аберрантных rC — амплификация онкогенов NFKB и HER2. Этот паттерн, характерный для аденокарцином T3-4N1-3M0, может рассматриваться как неблагоприятный прогностический признак в отношении формирования метастазов в регионарных лимфатических узлах. В большинстве случаев (80%) амплификация генетического локуса HER2 сопровождается повышением экспрессии белка HER2 (P<0,01), что подтверждает валидность использованной экспериментальной модели.
В результате исследования пролиферативного потенциала опухолей исследуемых групп выявлено преобладание опухолей с низкой пролиферативной активностью в группе без метастазов в 4 раза, по сравнению с группой с метастазами. По результатам исследования сформирован алгоритм прогнозирования развития метастазов при аденокарциноме желудка.
Список литературы
1. Wang X, Liu Y, Shao D, Qian Z, Dong Z, Sun Y et al. Recurrent amplification of MYC and TNFRSF11B in 8q24 is associated with poor survival in patients with gastric cancer. Gastric Cancer. 2016;19(1):116-27.
2. Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2015 году (заболеваемость и смертность). - Москва, 2017
3. Dicken BJ, Bigam DL, Cass C, Mackey JR, Joy AA, Hamilton SM. Gastric Adenocarcinoma: Review and Considerations for Future Directions. Annals of Surgery. 2005;241(1):27-39. doi:10.1097/01.sla.0000149300.28588.23
4. Takuji G, Yanagisawa A, Sasako M, Ono H, Nakanishi Y, Shimoda T, Kato Y. Incidence in lymph node metastasis from early gastric cancer: estimation with a large number of cases at two large centers. Gastric Cancer. 2000; 3: 219-225.
5. Кит О.И., Водолажский Д.И., Кутилин Д.С., Гудуева Е.Н. Изменение копийности генетических локусов при раке желудка// Молекулярная биология. - 2015. - Т. 49, № 4. - С. 658-666.
6. Кит О.И., Водолажский Д.И., Кутилин Д.С., Татимов М.З., Гудуева Е.Н., Маслов А.А. Изменение копийности генетических локусов – предиктивный маркер метастазов у больных раком желудка // Современные проблемы науки и образования. – 2015. – № 6. Доступно по: https://science-education.ru/ru/article/view?id=22967 (Ссылка активна на 14.12.2017)
7. Andrews J, Kennette W, Pilon J, Hodgson A, Tuck AB, Chambers AF, Rodenhiser DI. Multi-Platform Whole-Genome Microarray Analyses Refine the Epigenetic Signature of Breast Cancer Metastasis with Gene Expression and Copy Number. PLoS One. 2010; 5 (1). Available from: http:// journals.plos.org/plosone/article?id=10.1371/ journal.pone.0008665. Accessed on December 14, 2017.
8. Kim S, Lee J, Hong ME, Do I.-G., Kang SY., Ha SY et al. High-Throughput Sequencing and Copy Number Variation Detection Using Formalin Fixed Embedded Tissue in Metastatic Gastric Cancer. PLoS One. 2014; 9(11): e111693.
9. Liang L, Fang J-Y, Xu J. Gastric cancer and gene copy number variation: emerging cancer drivers for targeted therapy. Oncogene. 2015, 1-8.
10. Deng N, Goh LK, Wang H, Das K, Tao J, Tan IB et al. A comprehensive survey of genomic alterations in gastric cancer reveals systematic patterns of molecular exclusivity and co-occurrence among distinct therapeutic targets. Gut. 2012; 61:673-684
11. Harari D, Yarden Y. Molecular mechanisms underlying ErbB2/HER2 action in breast cancer. Oncogene. 2000;19(53):6102-14.
12. McCormick Matthews LH, Noble F, Tod J, Jaynes E, Harris S, Primrose JN et al. Systematic review and meta-analysis of immunohistochemical prognostic biomarkers in resected oesophageal adenocarcinoma. British Journal of Cancer. 2015;113(1):107-118.
13. Tan C, Qian X, Guan Z, Yang B, Ge Y, Wang F, Cai J. Potential biomarkers for esophageal cancer. Springerplus. 2016; 5: 467.
14. Song Y, Huang J, Wang JW. Relationship between HER2/neu gene amplification and protein expression and prognosis in patients with advanced gastric carcinoma. Chin J Cancer. 2010; 29(1):76-81.
15. Zhang XL, Yang YS, Xu DP, Qu JH, Guo MZ, Gong Y, Huang J. Comparative study on overexpression of HER2/neu and HER3 in gastric cancer. World J Surg. 2009;33(10):2112-8.
16. Sittel C, Ruiz S, Kvasnicka HM, Volling P, Jungehülsing M, Eckel HE. Prognostic relevance of proliferation marker Ki-67 (MIB 1), PCNA and p53 in combined surgically and radiologically treated cancers of the oropharynx and mouth cavity. Laryngo-rhino-otologie. 2000; 79 (2): 86-92.
17. Петров С.В., Райхлин Н.Т. Руководство по иммуногистохимической диагностике опухолей человека. - Казань: Татмедиа, 2012. - 623 с
18. Staudt LM. Oncogenic activation of NF-kappaB. Cold Spring Harb Perspect Biol. 2010; 2(6):a000109. doi: 10.1101/cshperspect.a000109. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2869521/. Accessed on December 14, 2017.
19. Корниенко И.В., Водолажский Д.И., Вейко В.П., Щербаков В.В., Иванов П.Л. Подготовка биологического материала для молекулярно-генетических идентификационных исследований при массовом поступлении неопознанных тел. -Ростов-на-Дону: ООО «Ростиздат», 2001.
20. Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 2001; (25): 402-408/
21. Fang Z, Xiong Y, Li J, Liu L, Zhang W, Zhang C et al. APC gene deletions in gastric adenocarcinomas in a Chinese population: a correlation with tumour progression. Clin Transl Oncol. 2012; 14: 60-65.
22. Tsai PC, Huang SW, Tsai HL, Ma CJ, Hou MF, Yang LP et al. The association between DNA copy number aberrations at chromosome 5q22 and gastric cancer. PLoS One. 2014; 9(9):e106624.
23. Scatena R. Mitochondria and cancer: a growing role in apoptosis, cancer cell metabolism and dedifferentiation. Adv Exp Med Biol. 2012; 942:287-308.
24. Sonoda A, Mukaisho K, Nakayama T, Diem VT, Hattori T, Andoh A et al. Genetic lineages of undifferentiated-type gastric carcinomas analysed by unsupervised clustering of genomic DNA microarray data. BMC Med Genomics. 2013; 6: 25. doi: 10.1186/1755-8794-6-25
25. Hayashi H, Arao T, Togashi Y, Kato H, Fujita Y, De Velasco MA et al. The OCT4 pseudogene POU5F1B is amplified and promotes an aggressive phenotype in gastric cancer. Oncogene. 2015; 34: 199-208.
26. Wu C-S, Chen M-F, Lee I-L, Tung S-Y. Predictive Role of Nuclear Factor-κB Activity in Gastric Cancer: A Promising Adjuvant Approach WithCaffeic Acid Phenethyl Ester. Journal of Clinical Gastroenterology. 2007; 41(10):894-900.
27. Chia N-Y, Tan P. Molecular classification of gastric cancer. Ann Oncol. 2016; 27 (5):763-769.
28. Чумаков П.М. Белок р53 и его универсальные функции в многоклеточном организме //Успехи биологической химии. - 2007. - Т. 47,. - С. 3-52.
29. Райхлин Н.Т., Райхлин А.Н. Регуляция апоптоза в физиологических условиях и в опухолях// Вопросы онкологии. - 2002. - Т.48 (2). - С.159-71.
Об авторах
О. И. КитРоссия
член-корр. РАН, д.м.н., профессор, генеральный директор
Д. С. Кутилин
Россия
к.б.н., с.н.с. лаборатории молекулярной онкологии,SPIN-код: 8382-4460, AuthorID: 794680, Scopus Author ID: 55328886800
М. З. Татимов
Россия
аспирант
А. А. Маслов
Россия
доктор медицинских наук, профессор, главный врач
Е. М. Франциянц
Россия
д.б.н., профессор, заместитель генерального директора по науке
Д. И. Водолажский
Россия
к.б.н., руководитель лаборатории молекулярной онкологии
Рецензия
Для цитирования:
Кит О.И., Кутилин Д.С., Татимов М.З., Маслов А.А., Франциянц Е.М., Водолажский Д.И. Предиктивная диагностика метастатического поражения лимфоузлов у больных аденокарциномой желудка. Медицинский вестник Юга России. 2018;9(1):51-62. https://doi.org/10.21886/2219-8075-2018-9-1-51-62
For citation:
Kit O.I., Kutilin D.S., Tatimov M.Z., Maslov A.A., Frantsiyants E.M., Vodolazhsky D.I. Predictive diagnostics of lymph nodes metastatic lesion in patients with gastric adenocarcinoma. Medical Herald of the South of Russia. 2018;9(1):51-62. (In Russ.) https://doi.org/10.21886/2219-8075-2018-9-1-51-62







































