Перейти к:
Возможные маркеры ожирения, связанные с микробиомом кишечника
https://doi.org/10.21886/2219-8075-2025-16-3-67-74
Аннотация
Цель: изучить особенности содержания некоторых видов микроорганизмов в толстой кишке методом метагеномного секвенирования у пациентов с ожирением и у здоровых людей с нормальной массой тела.
Материалы и методы: обследованы 265 человек (44 мужчин и 221 женщина, средний возраст — 47,1 ± 4,8 года). Сформированы две клинические группы: здоровые с нормальной массой тела (n = 129) и пациенты с ожирением (n = 136). Оценка состава микробиома кишечника выполнена путём метагеномного анализа. Из образцов кала выделяли ДНК и проводили секвенирование вариабельного участка v3–v4 гена 16S рРНК.
Результаты: выявлены статистически значимые (p < 0,05) различия количественных и качественных показателей некоторых видов микроорганизмов в толстой кишке у здоровых людей без ожирения и у пациентов с ожирением. У пациентов с ожирением повышено количество P. copri. и снижено количество F. prausnitzii, B. adolescentis и B. longum.
Выводы: полученные результаты продемонстрировали определённые видовые различия в микробиоме кишечника у здоровых лиц и у пациентов с ожирением.
Для цитирования:
Ганенко Л.А., Волкова Н.И., Шестопалов А.В., Набока Ю.Л., Зибарев А.Л. Возможные маркеры ожирения, связанные с микробиомом кишечника. Медицинский вестник Юга России. 2025;16(3):67-74. https://doi.org/10.21886/2219-8075-2025-16-3-67-74
For citation:
Ganenko L.A., Volkova N.I., Shestopalov A.V., Naboka Yu.L., Zibarev A.L. Potential markers of obesity linked to the gut microbiome. Medical Herald of the South of Russia. 2025;16(3):67-74. (In Russ.) https://doi.org/10.21886/2219-8075-2025-16-3-67-74
Введение
Ожирение — это сложное нарушение обмена веществ, вызванное различными генетическими и негенетическими факторами. Распространённость данной патологии ежегодно увеличивается. Прогнозируется, что к 2030 г. число людей с ожирением во всём мире достигнет 1,12 миллиарда [1]. Ожирение проявляется не только изменениями внешнего вида, оно также связано с нарушениями липидного и углеводного обменов, хроническим воспалением и повышенным риском неинфекционных заболеваний, в первую очередь сердечно-сосудистых, сахарного диабета 2 типа и некоторых видов рака [2]. Этиология ожирения на сегодняшний день является важным направлением исследований. Недостаточное понимание патогенеза остается серьёзным препятствием к успешному лечению данного заболевания. Глобальная эпидемия ожирения стимулировала усилия учёных по выявлению новых факторов, влияющих на энергетический баланс. Несмотря на то, что пребиотики, пробиотики и антибиотики десятилетиями использовались в качестве модуляторов роста в экспериментах на животных, только недавно внимание исследователей привлекла взаимосвязь между составом кишечного микробиома, его изменением и ожирением. Появляется всё больше доказательств того, что дисбаланс микробиома/микробиоты кишечника может быть фактором, приводящим к ожирению [3][4]. Изменения в таксономическом составе микробиома кишечника способствуют более интенсивному извлечению калорий из пищи, снижению секреции гормонов, подавляющих аппетит (глюкагоноподобный пептид 1 типа (GLP-1), PYY и лептин) и чувства насыщения, а также нарушению целостности кишечного барьера, что приводит к проникновению эндотоксинов (липополисахаридов) в кровяное русло и воспалению, что в совокупности способствует развитию ожирения [5]. В макроорганизме человека обитает около 100 триллионов штаммов микроорганизмов, включающих более 10 000 видов, которые поддерживают симбиотические отношения с макроорганизмом. У взрослого человека микробиом кишечника в основном представлен двумя филумами: 79,4% Bacillota и 16,9% Bacteroidota, а также небольшим количеством Actinomycetota (2,5%), Pseudomonadota (1%) и Verrucomicrobiota (0,1%) бактерий [6]. Это эволюционное мутуалистическое партнёрство между макроорганизмом и микробиомом обеспечивает подавление условно-патогенных микроорганизмов, поддержание целостности эпителия кишечника, регуляцию иммунной функции, а также влияет на метаболизм макроорганизма путём выработки метаболически активных веществ, таких как короткоцепочечные жирные кислоты, метаболиты желчных кислот и различных витаминов [7]. Есть данные о том, что изменение разнообразия микробиома кишечника и количества определенных микробных таксонов связано с ожирением и метаболическими нарушениями. В настоящее время не обнаружено универсального микроорганизма, приводящего к развитию ожирения, но в различных исследованиях наблюдались ассоциации индекса массы тела (ИМТ) с некоторыми видами бактерий, включая E.coli, A.muciniphila, F.prausnitzii и L.reutery и др. Так, для E.coli выявлена обратная связь с ожирением, а для L.reutery — положительная, в то время как F. prausnitzii и A. muciniphila менее распространены у пациентов с ожирением [8][9]. Однако результаты большинства исследований по изучению взаимосвязи микробиома кишечника с ожирением разнонаправлены и противоречивы. Но, несмотря на это, большинство исследователей, занимающихся данной проблемой, приходит к консенсусу о перспективах использования микробиома кишечника в качестве терапевтической мишени для лечения ожирения. Таким образом, дальнейшее изучение взаимосвязи между конкретными бактериями и ожирением, может быть использовано для профилактики и лечения данного заболевания в будущем.
Цель исследования — изучить особенности таксономического состава микробиома кишечника на уровне некоторых бактериальных видов у пациентов с ожирением и у здоровых людей с нормальной массой тела.
Материалы и методы
Когортное исследование проведено на базе ФГБОУ ВО РостГМУ МЗ РФ, ФГАОУ ВО «Казанский (Приволжский) федеральный университет» и Центра цифровой и трансляционной биомедицины ООО «Центр молекулярного здоровья», одобрено ЛНЭК ФГБОУ ВО РостГМУ (протокол № 20/19 от 12.12.2019). С целью уменьшения воздействия климатических, этнографических факторов и особенностей пищевого рациона на микробиоту кишечника в работу были включены жители одной территории (Ростовская область). В исследование вошли 265 человек (221 (83,4%) женщина, 44 (16,6%) мужчины), средний возраст обследуемых — 47,1±4,8 лет. Критерии включения: подписанное информированное согласие на участие в исследовании, ИМТ≥18,5кг/м², возраст старше 18 лет, отсутствие в анамнезе использования антибиотиков, пребиотиков и пробиотиков за 3 месяца до начала исследования. Критерии исключения: беременность, депрессия, соматические заболевания тяжёлой степени, бариатрические операции, патология желудочно-кишечного тракта. В первую (контрольную) группу были включены 129 человек: 114 (88,3%) женщин, 15 (11,6%) мужчин, средний возраст обследуемых — 39,6±4,2 года, средний показатель ИМТ — 20,8±2,1 кг/м², ОТ — 74±5,8 см. Во вторую группу вошли 136 пациентов с ожирением: 28 (20,6%) мужчин, 108 (79,4%) женщин, средний возраст — 54,6±4,7 года, среднее значение ИМТ — 33,8±3,36 кг/м², ОТ — 99,7±7,3 см. Все вошедшие в исследование были осмотрены, у них собрали жалобы и анамнез, а также определены рост, масса тела и окружность талии (ОТ). ИМТ рассчитывали по рекомендациям экспертов ВОЗ (2003). Значение окружности талии определяли сантиметровой лентой на уровне середины расстояния между рёберными дугами и гребнями подвздошных костей. Ручным тонометром по стандартной методике Н.С. Короткова выполняли измерение артериального давления. Определение состояние углеводного обмена включало исследование глюкозы плазмы натощак (ГПН), иммунореактивного инсулина и расчёт индекса инсулинорезистентности (глюкоза натощак (ммоль/л) × инсулин натощак (Ед/л)/22,5). С целью исключения дислипидемии всем обследуемым определялся уровень холестерина липопротеидов низкой (ХС ЛПНП), липопротеидов высокой плотности (ХС ЛПВП) и общего холестерина (ОХС), а также триглицеридов (ТГ) в сыворотке крови. Уровень инсулина исследовался на анализаторе «Mag pix» («BioRad») с использованием набора «Milli plex: Human Adipokine Magnetic Bead Panel 2». На спектрофотометре «Hitachi U-2900» с наборами реагентов «Ольвекс Диагностикум» проводили биохимические исследования. Образцы фекалий получали согласно рекомендациям1. Композиционный состав кишечного микробиома выполняли в условиях Междисциплинарного центра коллективного пользования КФУ путем метагеномного анализа. Из образцов фекалий ДНК макроорганизмов выделяли с использованием набора «QIAamp DNA stool mini kit» («Qiagen»). На платформе «Illumina MiSeq» проводили секвенирование вариабельного участка v3–v4 гена 16S рРНК. Программой «QIIME v.1.9.1» с использованием референсной базы данных «Greengenes v.13.8» с 97%-ным порогом сходства между последовательностями были проанализированы выявленные последовательности генов 16S рРНК. Относительная представленность бактериальных таксонов в общем пуле ридов указана в долях (от 0 до 1), которые были рассчитаны на основе количества картированных ридов для каждого таксона. В R-версии программы «RStudio v.3.2» выполняли статистические расчеты. С помощью теста Шапиро-Уилка проведена проверка данных на нормальность распределения. Для количественных показателей рассчитаны средние ± средние квадратические отклонения; медиана и квартили (25%, 75%), минимальные и максимальные значения в выборке. Сравнение средних уровней в группах проводилось с помощью теста Манна-Уитни, частот (%) — с помощью точного теста Фишера. Сравнение частот обнаружения микроорганизмов, верифицированных в толстой кишке, в группах проводилось с помощью точного теста Фишера с поправкой на множественные сравнения по Холму. Сравнение медиан количественных характеристик изучаемых микроорганизмов, верифицированных в толстой кишке, в группах проведено с помощью теста Крускала-Уоллиса (попарные апостериорные сравнения — по методу Неменьи). При р<0,05 различия признавали статистически значимыми. Работа написана по материалам диссертации «Фенотипы ожирения и их связь с микробиомом кишечника и эндокринной функцией жировой ткани»
Результаты
Обследованные (n=265) были разделены на две группы: I группа (n=129) — контрольная, II группа (n=136) — пациенты с ожирением. Средний возраст лиц контрольной группы был значимо меньше (p<0,05) аналогичного показателя у пациентов с ожирением. Между группами статистически значимые различия выявлены для ОТ, ИМТ и артериального давления с повышением их значений во II группе. Помимо этого, у пациентов с ожирением уровень ГПН, инсулина, индекса HOMA-IR и значение ТГ были выше (p=0,007, p=0,001, р=0,001, р=0,02 соответственно) по сравнению со здоровыми лицами. При этом во II группе уровень ХС ЛПВП был ниже по сравнению с обследуемыми контрольной группы. По уровню ОХС (р=0,40) и ХС ЛПНП (р=0,20) обе группы были сопоставимы. Сравнение клинико-лабораторных показателей пациентов I и II групп представлено в табице. 1.
Таблица / Table 1
Клинико-лабораторные показатели обследуемых I и II групп
Clinical and laboratory parameters of subjects of groups I and II
Показатели Descriptor | Группа / Group I (n=129) | Группа / Group II (n=136) | Р |
Возраст, лет Age | 39,6±4,2 | 49,8±3,9 | <0,001 |
Индекс массы тела, кг/м² BMI | 19,8 [ 18,4;22] | 33,8 [ 31;36] | <0,0001 |
Окружность талии (ж), см WC | 73 [ 68;74,5] | 90 [ 96;105] | <0,0001 |
Окружность талии (м), см WC | 91 [ 86; 92,5] | 102 [ 98;107] | <0,006 |
САД, мм рт. ст. SBP | 100 [ 90;115] | 130 [ 120;145] | <0,0001 |
ДАД, мм рт. ст. DBP | 65 [ 60;70] | 80 [ 75;90] | <0,0001 |
ГПН, ммоль/л FPG, mmol/l | 5,06 [ 4,25; 5,2] | 5,66 [ 5,04;7,29] | 0,007 |
HOMA – IR | 1,86 [ 1,47;2,82] | 11,7 [ 5,08;19,3] | 0,001 |
ОХС, ммоль/л Total-C, mmol/l | 4,63 [ 4,41;5,81] | 5,42 [ 4,56;6,23] | 0,40 |
ХС ЛПНП, ммоль/л LDL-C, mmol/l | 2,7 [ 2,3; 3,01] | 3,18 [ 2,39;3,73] | 0,20 |
ХС ЛПВП, ммоль/л HDL-C mmol/l | 1,94 [ 1,5; 2,34] | 1,29 [ 1,15;1,44] | 0,05 |
ТГ, ммоль/л TAG, mmol/l | 0,83 [ 0,47;1,23] | 1,61 [ 1,25;2,5] | 0,02 |
Инсулин, пг/мл Insulin | 262 [ 133,6;418,2] | 390 [ 170,02;678,78] | 0,001 |
Примечание: САД — систолическое артериальное давление, ДАД — диастолическое артериальное давление, ГПН — глюкоза плазмы натощак, HOMA-IR — индекс инсулинорезистентности, ОХС — общий холестерин, ХС ЛПНП — липопротеины высокой плотности, ХС ЛПВП – липопротеины высокой плотности, ТГ – триглицериды.
Note: BMI — body mass index, WC — waist circumference, SBP — systolic blood pressure, DBP — diastolic blood pressure, FPG — fasting plasma glucose, HOMA — insulin resistance index, Total-C — total cholesterol, LDL-C — high-density lipoprotein, HDL-C — high-density lipoprotein, TAG — triglycerides.
При сравнении частот обнаружения отдельных видов микроорганизмов (рис. 1) выявлено, что Faecalibacterium prausnitzii регистрировали у 100,0% обследуемых обеих групп. Также в микробиоме кишечника преобладали такие виды, как Prevotella copri (98,0% в I группе, 100,0% во II группе), Bifidobacterium adolescentis (92,0% в I группе, 97,0% во II группе) и Akkermansia muciniphila (79,0% в I группе, 84,0% во II группе). Частоты обнаружения Lactobacillus reuteri (р=0,04) и Lactobacillus ruminis *(р=0,04) статистически значимо были повышены у пациентов с ожирением.
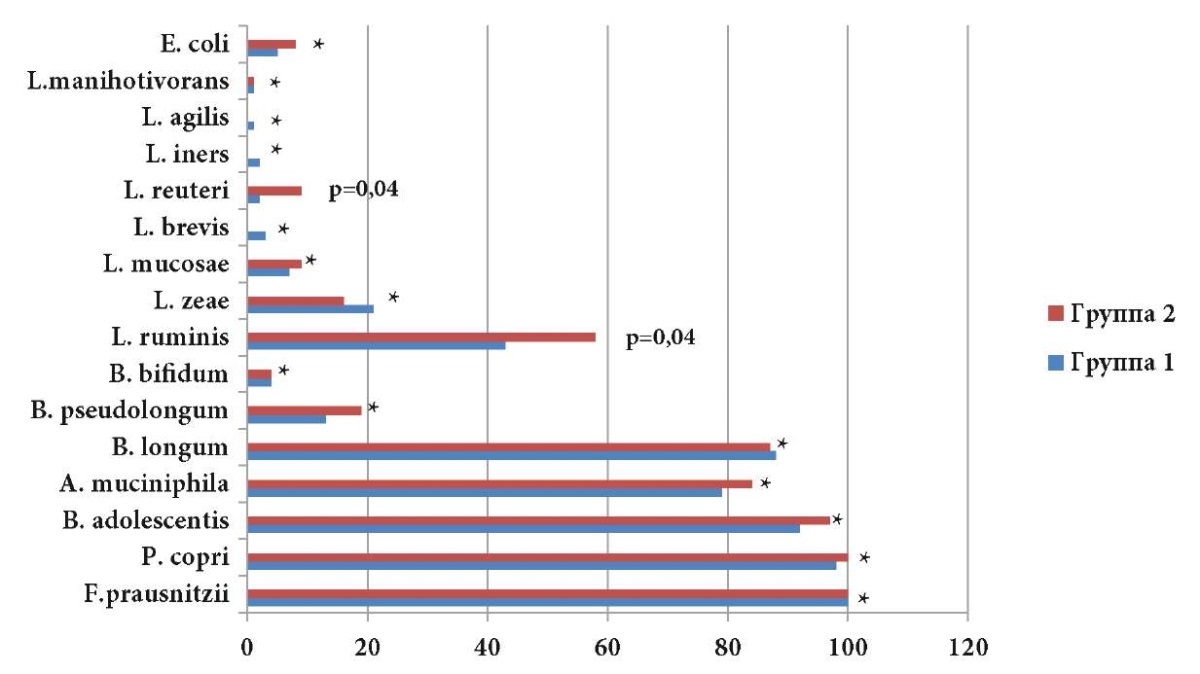
Рисунок 1. Частоты обнаружения отдельных видов бактерий в кишечнике у обследуемых I и II групп.
Figure 1. Frequencies of detection of individual types of bacteria in the intestines of subjects in groups I and II.
Примечание: * р>0,05; сравнение частот осуществлялось с помощью точного теста Фишера, «-» — нет вариаций для вычисления p.
Note: * p>0,05; frequency comparisons were performed using Fisher's exact test, “-” — no variations for p calculation.
Анализ количественных показателей (табл. 2) выявил значимые отличия для 4 видов микроорганизмов, а именно: для F. prausnitzii, P. сopri, B. adolescentis, B. longum. У пациентов с ожирением в кишечном микробиоме были снижены показатели у F. prausnitzii (р=0,02), B. adolescentis (р=0,002) и B. longum (р <0,0001), но повышены у P. сopri (р=0,02).
Таблица / Table 2
Количественные показатели отдельных видов бактерий в кишечнике у обследуемых I и II групп
Quantitative indicators of individual types of bacteria in the intestines of subjects of groups I and II
Микроорганизмы Microorganisms | Количественные показатели Quantitative indicators | ||
Группа / Group I (n=129) | Группа / Group II (n=136) | Р | |
F. prausnitzii | 0,075 [ 0,057; 0,11] | 0,067 [ 0,044; 0,099] | 0,02 |
P. copri | 0,027 [ 0,0019; 0,17] | 0,03 [ 0,0053; 0,24] | 0,02 |
A. muciniphila | 0,0013 [ 0,00021; 0,0059] | 0,00059 [ 0,0002; 0,0083] | 0,9 |
B. adolescentis | 0,0026 [ 0,00082; 0,012] | 0,0013 [ 0,00053; 0,0032] | 0,002 |
B. longum | 0,0024 [ 0,0005; 0,01] | 0,00055 [ 0,00023; 0,002] | <0,0001 |
B. pseudolongum | 0,000073 [ 0,00007; 0,0012] | 0,000076 [ 0,00007; 0,00041] | 1,0 |
B. bifidum | 0,000069 [ 0,000069; 0,000071] | 0,00072 [ 0,000071; 0,000074] | 0,4 |
L. ruminis | 0,00021 [ 0,000072; 0,00048] | 0,00014 [ 0,000071; 0,00035] | 0,9 |
L. zeae | 0,00014 [ 0,00007; 0,00029] | 0,00014 [ 0,00007; 0,00048] | 0,7 |
L. mucosae | 0,000071 [ 0,00007; 0,0002] | 0,000072 [ 0,000071; 0,000074] | 1,0 |
L. brevis | 0,00014 [ 0,000069; 0,00021] | 0 | - |
L. reuteri | 0,000074 [ 0,000071; 0,056] | 0,00027 [ 0,000069; 0,00035] | 0,9 |
L. iners | 0,00015 [ 0,000067; 0,00033] | 0 | - |
L. agilis | 0,00015 [ 0,00015; 0,00015] | 0 | - |
L. manihotivorans | 0,00014 [ 0,00014; 0,00014] | 0,00014 [ 0,00014; 0,00014] | 1,0 |
E. coli | 0,0001 [ 0,000069; 0,00014] | 0,00011 [ 0,000069; 0,00021] | 0,8 |
Примечание: сравнение количественных показателей осуществлялось с помощью теста Манна-Уитни.
Note: comparison of quantitative indicators was performed using the Mann-Whitney test.
Таким образом, полученные результаты продемонстрировали определённые видовые отличия в микробиоме кишечника у здоровых лиц и у пациентов с ожирением.
Обсуждение
При анализе отдельных видов микроорганизмов у здоровых лиц и пациентов с ожирением во всех случаях в микробиоме кишечника были обнаружены F. prausnitzii, также преобладали виды A. muciniphila, B. adolescentis и P. copri. Были выявлены качественные и количественные различия отдельных видовых паттернов бактерий в обследуемых группах. Так, по признаку частот обнаружения значимые отличия выявлены для L. reuteri и L. ruminis, которые чаще регистрировали у пациентов с ожирением. Что согласуется с результатами других исследователей [10]. Анализ количественных показателей показал значимые отличия для 4 видов (B. adolescentis, B. longum, P. сopri, F. prausnitzii). У пациентов с ожирением в микробиоме кишечника были снижены B. adolescentis (р=0,002), B. longum (р<0,0001), F. prausnitzii (р=0,02) и повышены P. сopri (р=0,02) по сравнению с аналогичными показателями обследуемых контрольной группы. По данным литературы, F. prausnitzii (филум Bacillota) оказывает противовоспалительное действие на желудочно-кишечный тракт путем продукции бутирата и подавления уровня провоспалительных цитокинов, поэтому уменьшение количества данного вида бактерий в микробиоме кишечника может быть опосредованно связано с состоянием ожирения [11][12]. Более низкое содержание F. prausnitzii в микробиоме кишечника пациентов с ожирением, обнаруженное в данной работе, согласуется с результатами других авторов [13][14]. Однако есть исследования, которые не выявили разницы в содержании F. prausnitzii при ожирении и нормальной массе тела [15]. Более низкий уровень B. adolescentis и B. longum, относящихся к филуму Bacillota, у пациентов с ожирением также был описан некоторыми исследователями [16]. В частности, Torres-Fuentes С. et al. предположили, что основные механизмы влияния бифидобактерий на снижение массы тела человека могут быть связаны с уменьшением содержания орексигенного гормона грелина, поскольку было обнаружено, что B. longum ослабляет грелинергическую передачу сигналов in vitro [17]. Противоположные результаты были получены в отношении количества Р. copri, уровень которого в нашем исследовании у пациентов с ожирением был статистически значимо выше по сравнению со здоровыми лицами без ожирения, что также было обнаружено и в других работах [18]. Есть данные, что транскриптоны толстой кишки, жировой ткани и мышц у мышей, колонизированных P. copri, сопровождались активацией хронической воспалительной реакции макроорганизма через сигнальные пути TLR4 и mTOR и значительным увеличением экспрессии генов, связанных с липогенезом и накоплением жира, но ослаблением экспрессии генов, связанных с липолизом [10][19]. В нашем исследовании отсутствовали статистически значимые различия в содержании A. muciniphila у пациентов с ожирением и у здоровых лиц без ожирения. При этом большинство имеющихся на сегодняшний день данных выявило обратную корреляцию между уровнем A. muciniphila и ИМТ [20]. Механизмы, с помощью которых A. muciniphila может влиять на массу тела, полностью не изучены. A. muciniphila — муциндеградирующая бактерия, относится к филуму Verrucomicrobiota, обеспечивая целостность кишечного барьера и сохранения таксономического состава микробиома кишечника в состоянии эубиоза, что способствует удержанию нормальной массы тела [21]. Также есть данные, что A. muciniphila способна усиливать термогенез и секрецию глюкагоноподобного пептида-1 и снижать экспрессию белков, участвующих в дифференцировке адипоцитов, а также экспрессию генов переносчиков глюкозы и фруктозы в тощей кишке, тем самым снижая всасывание углеводов [22][23]. Помимо этого, в одном из исследований было выявлено, что у пациентов, перенесших бариатрическую операцию (шунтирование желудка по методу Ру-эн-У) наблюдалось увеличение количества A. muciniphila наряду с улучшением антропометрических и клинических показателей, таких как снижение ИМТ, а также повышение уровня GLP-1 [20].
Увеличение количества лактобактерий, относящихся к филуму Bacillota, обычно, связывают с ожирением [24]. Среди бактерий этого рода Lactobacillus reuteri [5] коррелирует с более высоким ИМТ, что было выявлено и в нашем исследовании. Однако некоторые виды лактобактерий (Lactobacillus paracasei и Lactobacillus plantarum), наоборот, способствуют снижению массы тела благодаря выработки бактериоцинов, которые препятствуют росту патогенов, вызывающих дисбиоз [25]. Эти данные свидетельствует о том, что бактерии даже одного и того же вида могут оказывать противоположные эффекты на энергетический гомеостаз. Многочисленные исследования, в которых сравнивался микробиом кишечника у пациентов с ожирением и у здоровых лиц, выявили значительные изменения в его составе не только на уровне отдельных видов бактерий, но и на уровне филумов. При ожирении, по данным большинства исследований, наблюдается уменьшение количества бактерий типа Bacteroidota и увеличение количества бактерий типа Bacillota [10]. Так, соотношение Bacillota/Bacteroidota было значительно выше в группе с ожирением и более чем в два раза превышало значение в группе обследуемых без ожирения. Однако другие авторы выявили обратную зависимость, то есть более низкий уровень Bacteroidota и более высокий — Actinomycetota без существенной разницы в Bacillota у пациентов с ожирением [26], в то время как в других исследованиях не удалось выявить корреляцию между ИМТ и соотношением Bacillota/Bacteroidota [27]. Считается, что повышенное соотношение Bacillota/Bacteroidota у людей с ожирением приводит к более эффективному гидролизу углеводов в кишечнике и увеличению количества получаемых калорий из продуктов питания [28]. По результатам нашего исследования, у пациентов с ожирением для филума Bacteroidota регистрировали статистически значимо более высокий уровень (p<0,05), а для Bacillota и Actinomycetota — более низкий (p<0,05) [29]. Наличие расхождений в результатах проведённых исследований может быть вызвано множеством факторов, такими как методы, используемые для анализа микробиома кишечника, разной конструкцией праймеров и разными методами выделения ДНК отличаться характеристиками исследуемой популяции (особенности пищевого рациона, пол, географическое расположение, этническая принадлежность и сезон). Поскольку микробиом кишечника подвержен влиянию различных факторов внешней и внутренней среды и трудно контролировать все элементы, влияющие на его состав, что, безусловно, усложняет изучение микробиома кишечника при ожирении. Тем не менее, результаты большинства исследований, нашего в том числе, показывают, что при ожирении формируется особый состав микробиома кишечника, отличный от микробиома здоровых лиц без ожирения.
Заключение
Эффективное лечение ожирения по-прежнему остаётся важной социальной и медицинской потребностью. Имеющиеся на сегодняшний день данные подтверждают предположение о том, что микробиом кишечника является ещё одним важным фактором в и без того в сложном и длинном списке причин, влияющих на развитие ожирения. На данный момент общепризнанным является тот факт, что ожирение не вызывается каким-то одним видом бактерий, но определяется нарушением экологического баланса микробиома кишечника. Однако степень влияния микробиома кишечника на увеличение массы тела у людей до сих пор не определена, что требует дальнейшего изучения. Результаты данного исследования свидетельствуют о том, что в микробиоме кишечника при ожирении наблюдаются некоторые видовые отличия, что связано с повышенным уровнем P. сopriи и сниженным уровнем F. prausnitzii, B. adolescentis и B. longum.
1. Методики клинических лабораторных исследований: справочное пособие: в 3 т. Т. 3: Клиническая микробиология. Бактериологические исследования. Микологические исследования. Паразитологические исследования. Инфекционная иммунодиагностика. Молекулярные исследования в диагностике инфекционных заболеваний / под ред. В.В. Меньшикова. – Москва: Лабора, 2009
Список литературы
1. Liu BN, Liu XT, Liang ZH, Wang JH. Gut microbiota in obesity. World J Gastroenterol. 2021;27(25):3837-3850. https://doi.org/10.3748/wjg.v27.i25.3837
2. Fishman B, Zloof Y, Orr O, Tsur AM, Furer A, et al. The opposing trends of body mass index and blood pressure during 1977-2020; nationwide registry of 2.8 million male and female adolescents. Cardiovasc Diabetol. 2021;20(1):242. https://doi.org/10.1186/s12933-021-01433-0
3. Mishra S, Jain S, Agadzi B, Yadav H. A Cascade of Microbiota-Leaky Gut-Inflammation- Is it a Key Player in Metabolic Disorders? Curr Obes Rep. 2025;14(1):32. https://doi.org/10.1007/s13679-025-00624-0
4. Aron-Wisnewsky J, Warmbrunn MV, Nieuwdorp M, Clément K. Metabolism and Metabolic Disorders and the Microbiome: The Intestinal Microbiota Associated With Obesity, Lipid Metabolism, and Metabolic Health-Pathophysiology and Therapeutic Strategies. Gastroenterology. 2021;160(2):573-599. https://doi.org/10.1053/j.gastro.2020.10.057
5. Crovesy L, Masterson D, Rosado EL. Profile of the gut microbiota of adults with obesity: a systematic review. Eur J Clin Nutr. 2020;74(9):1251-1262. https://doi.org/10.1038/s41430-020-0607-6
6. Iacob S, Iacob DG, Luminos LM. Intestinal Microbiota as a Host Defense Mechanism to Infectious Threats. Front Microbiol. 2019;9:3328. https://doi.org/10.3389/fmicb.2018.03328
7. Cheng Z, Zhang L, Yang L, Chu H. The critical role of gut microbiota in obesity. Front Endocrinol (Lausanne). 2022;13:1025706. https://doi.org/10.3389/fendo.2022.1025706
8. Kobyliak N, Falalyeyeva T, Kyriachenko Y, Tseyslyer Y, Kovalchuk O, et al. Akkermansia muciniphila as a novel powerful bacterial player in the treatment of metabolic disorders. Minerva Endocrinol (Torino). 2022;47(2):242-252. https://doi.org/10.23736/S2724-6507.22.03752-6
9. Ussar S, Fujisaka S, Kahn CR. Interactions between host genetics and gut microbiome in diabetes and metabolic syndrome. Mol Metab. 2016;5(9):795-803. https://doi.org/10.1016/j.molmet.2016.07.004
10. Brandão I, Martins MJ, Monteiro R. Metabolically Healthy Obesity-Heterogeneity in Definitions and Unconventional Factors. Metabolites. 2020;10(2):48. https://doi.org/10.3390/metabo10020048
11. Biondi G, Marrano N, Borrelli A, Rella M, Palma G, et al. Adipose Tissue Secretion Pattern Influences β-Cell Wellness in the Transition from Obesity to Type 2 Diabetes. Int J Mol Sci. 2022;23(10):5522. https://doi.org/10.3390/ijms23105522
12. Blüher M. Metabolically Healthy Obesity. Endocr Rev. 2020;41(3):bnaa004. https://doi.org/10.1210/endrev/bnaa004
13. Bakir-Gungor B, Bulut O, Jabeer A, Nalbantoglu OU, Yousef M. Discovering Potential Taxonomic Biomarkers of Type 2 Diabetes From Human Gut Microbiota via Different Feature Selection Methods. Front Microbiol. 2021;12:628426. https://doi.org/10.3389/fmicb.2021.628426
14. Ronan V, Yeasin R, Claud EC. Childhood Development and the Microbiome-The Intestinal Microbiota in Maintenance of Health and Development of Disease During Childhood Development. Gastroenterology. 2021;160(2):495-506. https://doi.org/10.1053/j.gastro.2020.08.065
15. Feng J, Tang H, Li M, Pang X, Wang L, Zhang M, Zhao Y, Zhang X, Shen J. The abundance of fecal Faecalibacterium prausnitzii in relation to obesity and gender in Chinese adults. Arch Microbiol. 2014;196(1):73-77. https://doi.org/10.1007/s00203-013-0942-2
16. Stephens RW, Arhire L, Covasa M. Gut Microbiota: From Microorganisms to Metabolic Organ Influencing Obesity. Obesity (Silver Spring). 2018;26(5):801-809. https://doi.org/10.1002/oby.22179
17. Schellekens H, Torres-Fuentes C, van de Wouw M, Long-Smith CM, Mitchell A, et al. Bifidobacterium longum counters the effects of obesity: Partial successful translation from rodent to human. EBioMedicine. 2021;63:103176. https://doi.org/10.1016/j.ebiom.2020.103176
18. Stanislawski MA, Dabelea D, Lange LA, Wagner BD, Lozupone CA. Gut microbiota phenotypes of obesity. NPJ Biofilms Microbiomes. 2019;5(1):18. https://doi.org/10.1038/s41522-019-0091-8
19. Chen C, Fang S, Wei H, He M, Fu H, et al. Prevotella copri increases fat accumulation in pigs fed with formula diets. Microbiome. 2021;9(1):175. https://doi.org/10.1186/s40168-021-01110-0
20. Rodrigues VF, Elias-Oliveira J, Pereira ÍS, Pereira JA, Barbosa SC, et al. Akkermansia muciniphila and Gut Immune System: A Good Friendship That Attenuates Inflammatory Bowel Disease, Obesity, and Diabetes. Front Immunol. 2022;13:934695. https://doi.org/10.3389/fimmu.2022.934695
21. Cani PD, Van Hul M. Gut microbiota in overweight and obesity: crosstalk with adipose tissue. Nat Rev Gastroenterol Hepatol. 2024;21(3):164-183. https://doi.org/10.1038/s41575-023-00867-z
22. Yoon HS, Cho CH, Yun MS, Jang SJ, You HJ, Kim JH, Han D, Cha KH, Moon SH, Lee K, Kim YJ, Lee SJ, Nam TW, Ko G. Akkermansia muciniphila secretes a glucagon-like peptide-1-inducing protein that improves glucose homeostasis and ameliorates metabolic disease in mice. Nat Microbiol. 2021;6(5):563-573. https://doi.org/10.1038/s41564-021-00880-5
23. Lee JS, Song WS, Lim JW, Choi TR, Jo SH, et al. An integrative multiomics approach to characterize anti-adipogenic and anti-lipogenic effects of Akkermansia muciniphila in adipocytes. Biotechnol J. 2022;17(2):e2100397. https://doi.org/10.1002/biot.202100397
24. Martemucci G, Khalil M, Di Luca A, Abdallah H, D’Alessandro AG. Comprehensive Strategies for Metabolic Syndrome: How Nutrition, Dietary Polyphenols, Physical Activity, and Lifestyle Modifications Address Diabesity, Cardiovascular Diseases, and Neurodegenerative Conditions. Metabolites. 2024;14(6):327. https://doi.org/10.3390/metabo14060327
25. Million M, Maraninchi M, Henry M, Armougom F, Richet H, et al. Obesity-associated gut microbiota is enriched in Lactobacillus reuteri and depleted in Bifidobacterium animalis and Methanobrevibacter smithii. Int J Obes (Lond). 2012;36(6):817-25. Retraction in: Int J Obes (Lond). 2024;48(10):1516. https://doi.org/10.1038/ijo.2011.153
26. Hur HJ, Wu X, Yang HJ, Kim MJ, Lee KH, et al. Beneficial Effects of a Low-Glycemic Diet on Serum Metabolites and Gut Microbiota in Obese Women With Prevotella and Bacteriodes Enterotypes: A Randomized Clinical Trial. Front Nutr. 2022;9:861880. https://doi.org/10.3389/fnut.2022.861880
27. Muheyati D, Han J, Lv M, Jielili M, Jing Z, et al. Composition of gut microbiota in obese and normal-weight Uygur adults and its association with adipocyte-related factors. Sci Rep. 2024;14(1):24649. https://doi.org/10.1038/s41598-024-76351-8
28. Palmas V, Pisanu S, Madau V, Casula E, Deledda A, et al. Gut microbiota markers associated with obesity and overweight in Italian adults. Sci Rep. 2021;11(1):5532. https://doi.org/10.1038/s41598-021-84928-w
29. Гапонов А.М., Волкова Н.И., Ганенко Л.А., Набока Ю.Л., Маркелова М.И., и др. Особенности микробиома толстой кишки у пациентов с ожирением при его различных фенотипах (оригинальная статья). Журнал микробиологии, эпидемиологии и иммунобиологии. 2021;98(2):144-155. https://doi.org/10.36233/0372-9311-66
Об авторах
Л. А. ГаненкоРоссия
Ганенко Лилия Александровна, к.м.н., доцент кафедры внутренних болезней № 3
Ростов-на-Дону
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Н. И. Волкова
Россия
Волкова Наталья Ивановна, д.м.н., проф., заведующая кафедрой внутренних болезней № 3
Ростов-на-Дону
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
А. В. Шестопалов
Россия
Александр Вячеславович Шестопалов, д.м.н., проф., зам. директора Центра цифровой и трансляционной биомедицины «Центр молекулярного здоровья»; директор управления последипломного образования, ординатуры, аспирантуры НМИЦ ДГОИ им. Дмитрия Рогачева
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Ю. Л. Набока
Россия
Набока Юлия Лазаревна, д.м.н., проф., заведующая кафедрой микробиологии и вирусологии № 1
Ростов-на-Дону
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
А. Л. Зибарев
Россия
Зибарев Александр Леонидович, ассистент кафедры внутренних болезней № 3
Ростов-на-Дону
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Рецензия
Для цитирования:
Ганенко Л.А., Волкова Н.И., Шестопалов А.В., Набока Ю.Л., Зибарев А.Л. Возможные маркеры ожирения, связанные с микробиомом кишечника. Медицинский вестник Юга России. 2025;16(3):67-74. https://doi.org/10.21886/2219-8075-2025-16-3-67-74
For citation:
Ganenko L.A., Volkova N.I., Shestopalov A.V., Naboka Yu.L., Zibarev A.L. Potential markers of obesity linked to the gut microbiome. Medical Herald of the South of Russia. 2025;16(3):67-74. (In Russ.) https://doi.org/10.21886/2219-8075-2025-16-3-67-74







































