Перейти к:
Особенности формирования гибридного гуморального иммунитета к SARS-CoV-2
https://doi.org/10.21886/2219-8075-2025-16-2-117-122
Аннотация
Цель: оценка динамики изменения содержания специфических антител у лиц, перенёсших COVID-19 в анамнезе и вакцинированных синтетическими пептидами SARS-CoV-2. Материалы и методы: обследованы 40 человек, перенёсших СOVID-19, и затем иммунизированных синтетическими пептидами SARS-CoV-2. Методы: ИФА диагностика специфических антител к S и N белку SARS-CoV-2 и статистический. Результаты: при COVID-19 в постинфекционном периоде отмечается выработка специфических к S-белку IgG на протяжении года с момента выздоровления. Вакцинация переболевших лиц пептидными антигенами приводит к усилению синтеза IgG не только к S, но и N-белку коронавируса, со стабильной тенденцией к росту содержания антител на протяжении 3 месяцев наблюдений. Выводы: гуморальный постинфекционный иммунитет характеризуется преимущественной выработкой IgG к S-белку SARS-CoV-2, которые сохраняются в течение года с момента выздоровления, в то время как гибридный иммунитет способствует наряду с выработкой антител к S-белку преимущественному синтезу Ig G к N белку SARA-CoV-2.
Для цитирования:
Сизякина Л.П., Закурская В.Я. Особенности формирования гибридного гуморального иммунитета к SARS-CoV-2. Медицинский вестник Юга России. 2025;16(2):117-122. https://doi.org/10.21886/2219-8075-2025-16-2-117-122
For citation:
Sizyakina L.P., Zakurskaya V.Ya. Features of the formation of hybrid humoral immunity to SARS-CoV-2. Medical Herald of the South of Russia. 2025;16(2):117-122. (In Russ.) https://doi.org/10.21886/2219-8075-2025-16-2-117-122
Введение
Новая коронавирусная инфекция за три года пандемии продемонстрировала всю степень угрозы человечеству, которую могут нести в себе такие патогены, как SARS-CoV-2. По официальным данным, пандемия унесла жизни свыше 6,8 миллионов человек, что делает её одной из самых смертоносных в истории1. В общей сложности за данный период было выявлено около 676 млн случаев заражения SARS-CoV-2 (8,4% населения Земли), однако истинная распространённость, вероятно, больше, так как не все случаи были официально зарегистрированы и подтверждены2. Несмотря на накопленный за прошедший период опыт и полученные знания о патогенезе, диагностике и методах терапии данного заболевания, COVID-19 сохраняет свою актуальность для системы здравоохранения Российской Федерации и других стран2. На сегодняшний день ведущим механизмом защиты населения от SARS-CoV-2 является коллективный иммунитет, определяемый наличием 50–85% населения иммунизированного либо путём естественного заражения COVID-19, либо путем вакцинации [1].
Долгое время спорным вопросом был постинфекционный иммунитет к SARS-CoV-2, в особенности его длительность и эффективность. Множество работ посвящено вопросу сохранности антител [2—4]. Чаще всего упоминается о серопозитивности переболевших COVID-19 в течение 6–12 месяцев после выздоровления. Однако вопрос актуальных сроков вакцинации здоровых и ревакцинации переболевших лиц по-прежнему остаётся открытым. На сегодняшний день в Российской Федерации применяется 10 вакцин различных типов3. Это векторные, пептидные, рекомбинантные и цельновирионные вакцины. Безусловно, различные подходы в технологии производства вакцины обусловливают различия в развитии поствакцинального иммунитета. различия заключаются не только в возможных нежелательных явлениях [5], их частоте и тяжести [6][7], но и в эффективности сформировавшегося противовирусного ответа. Таким образом, существует необходимость в более глубоком исследовании эффективности и безопасности различных типов вакцин, для выработки дальнейших профилактических мероприятий среди населения.
Другим важным вопросом остаётся вакцинация уже переболевших СOVID-19 лиц. Термин «гибридный иммунитет» всё чаще встречается в литературе и подразумевает под собой сочетание постинфекционного и поствакцинального иммунных ответов [8][9]. Ведутся споры относительно целесообразности такой вакцинации и сроков её проведения. Основным критерием напряжённости иммунитета на сегодняшний день выступает выработка специфических антител к патогену и их сохранность на определенном «защитном» уровне.
Цель исследования — оценка динамики изменения содержания специфических антител у лиц, перенёсших COVID-19 в анамнезе и вакцинированных синтетическими пептидами SARS-CoV-2.
Материалы и методы
В исследование были включены 40 человек, перенёсших инфекцию COVID-19 в анамнезе, и затем вакцинированных синтетическими пептидами SARS-CoV-2. Средний возраст обследованных лиц составил 42±10,4 года. По гендерному признаку пациенты распределились следующим образом: мужчин — 13; женщин — 27. Клиническое исследование носило открытый, проспективный характер и проводилось в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г., WMA Declaration of Helsinki – Ethical Principles for Medical Research Involving Human Subjects (2013), «Правилами надлежащей клинической практики в Российской Федерации», утверждёнными Приказом Минздрава России от 1.04.2016 г. № 200н. Каждый пациент подписывал добровольное информированное согласие на участие в исследовании. После перенесённой инфекции COVID-19 оценивалось содержание специфических антител к SARS-CoV-2 на 1-м, 3-м, 6-м и 12-м месяце с момента выздоровления. В дальнейшем при снижении уровня специфических антител ниже порогового значения (КП<4) всем пациентам проводилась двухэтапная иммунизация синтетическими пептидами SARS-CoV-2, разработанная ФБУН «Государственный научный центр вирусологии и биотехнологии «Вектор» Роспотребнадзора». Интервал между двумя введениями (V1 и V2) составлял 21 сутки. Наблюдение за динамикой формирования гибридного иммунитета осуществлялось на следующих контрольных точках: за сутки до вакцинации, через 21 день после введения второй дозы и через 3 месяца с момента вакцинации. Определение в сыворотке крови специфических IgG к S-белку (Spike-protein) SARS-CoV-2 проводилось полуколичественно с помощью метода твердофазного иммуноферментного анализа на тест-системах «Вектор-Бест». Результаты исследуемых образцов вычислялись в коэффициенте позитивности (КП) по формуле: КП = ОПобр./ОПкрит. Результат анализа считался положительным, если КП образца ≥ 1,2; отрицательным, если КП образца <0,8; пограничным, если 0,8≤ КПобразца <1,2. Дополнительно пациентам количественно определяли антитела класса IgG к N-белку SARS-CoV-2 методом иммуноферментного анализа в сыворотке крови на тест-системе, разработанной и произведённой ФБУН НИИ эпидемиологии и микробиологии им. Пастера. Концентрация антител выражалась в условных единицах в мл буферного раствора (у.е./мл) и оценивалась следующим образом: образцы, у которых рассчитанная концентрация ниже 100 у.е./мл (предел количественного определения) считается отрицательной, концентрация выше 100 у.е./мл оценивается как положительная. При этом концентрация свыше 3000 у.е./мл оценивается как очень высокий уровень наличия специфических IgG, концентрация в диапазоне 3000–1501 у.е./мл оценивается как высокий уровень, концентрация в диапазоне 1500–751 у.е./мл — как средний уровень, концентрация в диапазоне 750–187 у.е./мл — низкий уровень, концентрация в диапазоне 186–100 у.е./мл — как очень низкий уровень.
Статистическая обработка данных проведена с использованием программы STATISTICA 10 (StatSoft Inc., США). Описательную статистику количественных признаков представляли в виде центральной тенденции медианы и межквартильного размаха (25-й и 75-й процентили), представлено в тексте как Ме [LQ; UQ]. Попарное сравнение медиан в группах осуществляли с помощью теста Mann H.B., Whitney D.R. Сравнение общей динамики изменений внутри группы рассчитана с помощью U-критерия Фридмана. Различия признавались статистически значимыми на уровне р <0,05.
Результаты
При оценке напряжённости постинфекционного иммунитета было отмечено динамическое снижение содержания IgG к S-белку SARS-CoV-2 на протяжении года наблюдений (табл. 1). Однако к 12-му месяцу достоверно сохранялась серпозитивность у большинства испытуемых. При оценке динамики антител к ядерному белку статистически значимых изменений выявлено не было. Уровень IgG к N-белку был ниже порогового значения на большинстве контрольных точек исследования и не продемонстрировал явной тенденции у переболевших лиц. Даже через месяц после выздоровления содержание IgG к N-белку не превышало предел количественного определения.
Таблица 1 / Table 1
Динамическая характеристика специфических антител к различным антигенам SARS-CoV-2 у лиц, переболевших СOVID-19
Dynamic characteristics of specific antibodies to various SARS-CoV-2 antigens in individuals who have recovered from COVID-19
|
Показатель Index |
1 месяц 1 month |
3 месяца 3 months |
6 месяцев 6 months |
12 месяцев 12 months |
Значение Р P value |
|
IgG к S-белку, КП IgG to S-protein, PR |
16,69 [ 10,71; 17,46] |
15,8 [ 5,67; 17] |
8,53 [ 2,36; 15,05] |
3,7 [ 1,04; 8,4] |
*p˂0,01 |
|
IgG к N-белку, у.е./мл IgG to N-protein, u.u./ml |
84,9 [ 32,8; 184] |
65,2 [ 27,5; 178,6] |
137,6 [ 64,4;351,45] |
47,5 [ 35,87;82,27] |
p>0,05 |
Примечание: * статистическая значимость различий (p˂0,05) рассчитана с помощью U-критерия Фридмана.
Note: * statistical significance of differences (p˂0.05) was calculated using the Friedman U test.
Вторым этапом исследования стала иммунизация ранее переболевших COVID-19 лиц пептидными антигенами SARS-CoV-2. Перед иммунизацией определялось исходное содержание специфических IgG к ядерному и спайковому антигенам (табл. 2). Через 21 день после вакцинации содержание их достоверно возрастало, тенденция сохранялась на протяжении 3 месяцев наблюдений после вакцинации. Нарастание титра антител к S-белку составило 2,6 раз к 3 месяцу, в то время как IgG к N-белку увеличились в 9,7 раз за аналогичный срок.
Таблица / Table 2
Динамическая характеристика специфических антител к различным антигенам SARS-CoV-2 у лиц, переболевших СOVID-19 и вакцинированных пептидной вакциной
Dynamic characteristics of specific antibodies to various SARS-CoV-2 antigens in individuals who have recovered from COVID-19 and were vaccinated with a peptide vaccine
|
Показатель Index |
До вакцинации Before vaccination |
Через 21 день после вакцинации 21 days after vaccination |
Через 3 месяца после вакцинации 3 months after vaccination |
Значение Р P value |
|
IgG к S-белку, КП IgG to S-protein, PR |
1,98 [ 0,99; 2,69] |
3,76 [ 1,09; 5,2] |
5,24 [ 2,91; 8,32] |
*p˂0,01 |
|
IgG к N-белку, у.е./мл IgG to N-protein, u.u./ml |
51,25 [ 25,89; 108,6] |
396,15 [ 191,6; 662,7] |
496,85 [ 181,2; 1088] |
*p˂0,01 |
Примечание: * статистическая значимость различий (p˂0,05) рассчитана с помощью U-критерия Фридмана.
Note: * statistical significance of differences (p˂0.05) was calculated using the Friedman U test.
Полученные результаты в двух группах было интересно сравнить в одинаковых контрольных точках (1 и 3 месяца). Попарное сравнение продемонстрировало, что при иммунизации пептидными антигенами содержание IgG к S-белку SARS-CoV-2 значительно ниже, чем в группе переболевших лиц, однако тенденция их динамического изменения разнонаправлена (рис. 1). В поствакцинальном периоде при формировании гибридного иммунитета отмечается рост, в то время как у переболевших снижение концентрации.
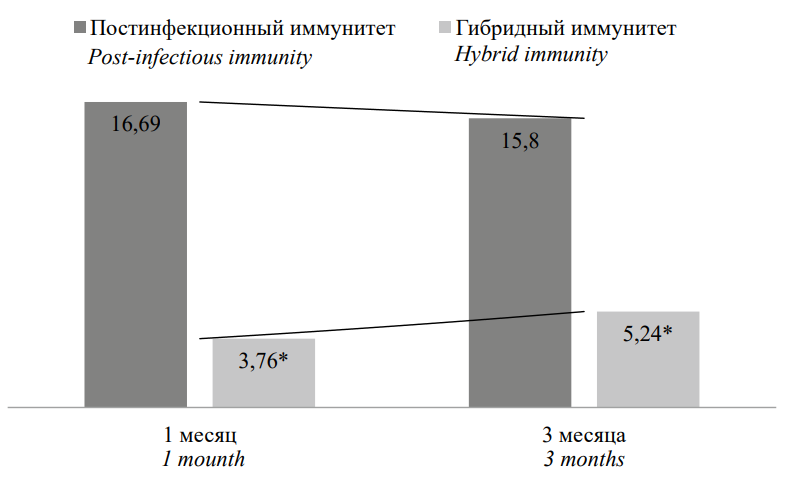
Рисунок 1. Сравнительная характеристика содержания IgG к S-белку, КП
Примечание: * статистическая значимость различий (p˂0,05) рассчитана с помощью критерия Mann H.B., Whitney D.R.
Figure 1. Comparative characteristics of IgG content to S-protein, PR
Note: * statistical significance of differences (p˂0.05) was calculated using the Mann H.B., Whitney D.R test.
Аналогичный анализ содержания IgG к N-белку продемонстрировал противоположный результат, а именно в группе лиц с гибридным иммунитетом отмечен значимый рост концентрации антител в отличие от отрицательных результатов в группе переболевших лиц (рис. 2). При этом тенденция к росту содержания IgG к ядерному белку также наблюдалась в первой группе.
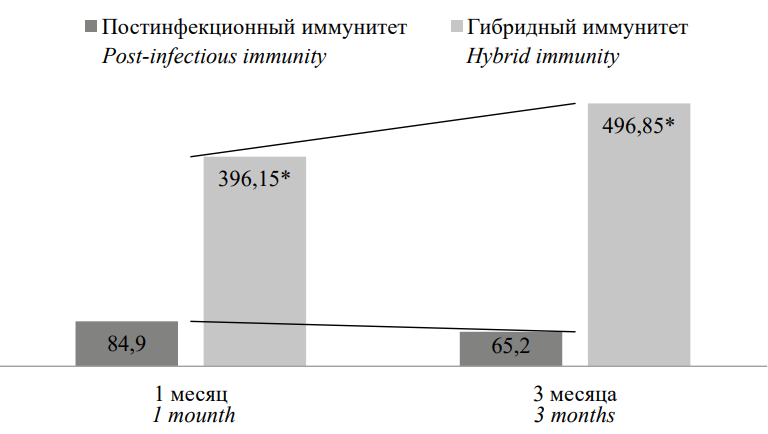
Рисунок 2. Сравнительная характеристика содержания IgG к N-белку, у.е./мл
Примечание: * статистическая значимость различий (p˂0,05) рассчитана с помощью критерия Mann H.B., Whitney D.R.
Figure 2. Comparative characteristics of IgG content to N-protein, u.u./ml
Note: * statistical significance of differences (p˂0.05) was calculated using the Mann H.B., Whitney D.R test.
Обсуждение
Несмотря на сохраняющиеся противоречия в отношении роли гуморального иммунного ответа при COVID-19, особенно в условиях высокой изменчивости вируса [10], содержание специфических антител по-прежнему активно применяется в реальной клинической практике для решения целого ряда задач. В первую очередь для ретроспективной детекции факта перенесённой инфекции. Другими, не менее важными целями являются оценка напряжённости противоинфекционного иммунитета и решение вопроса о необходимости вакцинации [11]. Полученные результаты демонстрируют, что к 12-му месяцу с момента выздоровления от СOVID-19 сохраняется специфический антительный ответ, однако концентрация IgG низкая и требует вакцинации. Это согласуется с рядом ранее проведённых исследований и опровергает необходимость специфической профилактики новой коронавирусной инфекции раньше, чем через год после выздоровления [12, 13]. Важным наблюдением оказались отсутствие либо низкая концентрация специфических IgG к ядерному белку коронавируса. Известно, что N-белок преимущественно индуцирует Т-клеточный специфический иммунный ответ, а стимуляция гуморальных механизмов защиты не является ведущей для данного протеина [14]. Поэтому отсутствие антител к нему в данном случае не позволяет сделать однозначного заключения на предмет напряженности клеточного иммунного ответа и требует дальнейших исследований. Важным этапом исследования явилось наблюдение за формированием гибридного иммунитета при вакцинации пептидной вакциной. Полученные результаты продемонстрировали меньшую силу гуморального ответа на спайковый белок и при этом выраженный антительный ответ на ядерный белок. Подобные различия могут быть объяснены наличием в доступной для иммунных клеток форме пептидных N-антигенов SARS-CoV-2. В тоже время вакцина содержит пептиды с наиболее консервативными участками S-белка, но не полноценной его структурой, что сказывается на выраженности демонстрируемого гуморального ответа. Подобные особенности петидной вакцины вероятно способствуют и лучшему Т-клеточному специфическому иммунному ответу на SARS-CoV-2. Известно, что долгосрочная иммунологическая память к другим известным коронавирусным инфекциям (MERS, SARS-CoV) определялась именно специфическими Т-лимфоцитами, которые определялись в крови переболевших даже спустя 10 лет после выздоровления [18][19]. Кроме того, тенденция синтеза антител была противоположна постинфекционному периоду. К 3 месяцу наблюдений детектировался уверенный рост содержания специфических IgG у лиц с «гибридным иммунитетом», в то время как у переболевших лиц уже отмечалась слабая тенденция к снижению.
Заключение
Постинфекционный гуморальный иммунитет к SARS-CoV-2 сохраняется в течение 12 месяцев с момента выздоровления и характеризуется преимущественным синтезом специфических антител к S-белку вируса. При вакцинации пептидными антигенами SARS-CoV-2 лиц, ранее перенёсших COVID-19, гибридный иммунитет формируется преимущественно за счёт усиления синтеза специфических IgG к N-белку коронавируса, что косвенно может сигнализировать и о накоплении большего числа специфических к SARS-CoV-2 Т-лимфоцитов, обеспечивающих долгосрочную защиту от вируса.
1. Информационный центр Университета Джона Хопкинса. https://coronavirus.jhu.edu/map.html
2. Эпидемиологические данные ВОЗ по COVID-19. https://www.who.int/ru/15-09-2023
3. https:// вакцина.стопкоронавиурс.рф
Список литературы
1. Mohamed K, Rzymski P, Islam MS, Makuku R, Mushtaq A,et al. COVID-19 vaccinations: The unknowns, challenges, and hopes. J Med Virol. 2022;94(4):1336-1349. https://doi.org/10.1002/jmv.27487
2. Юнусова М.А., Луценко Е.С., Цапкова Н.Н., Бражников А.Ю., Салтыкова Т.С., Юдина В.С. Длительность сохранения IgG антител к новой коронавирусной инфекции COVID-19. Эпидемиология и Вакцинопрофилактика. 2022;21(5):14-20. https://doi.org/10.31631/2073-3046-2022-21-5-14-20
3. Новикова Е.А., Петрова А.Г., Москалева Е.В., Ваняркина А.С., Рычкова Л.В. Ретроспектива международных серологических исследований по формированию и динамике гуморального иммунного ответа к SARS-CoV-2: от 2020 к 2021. Acta Biomedica Scientifica. 2021;6(2):47-57. https://doi.org/10.29413/ABS.2021-6.2.5
4. Zhao J, Yuan Q, Wang H, Liu W, Liao X, et al. Antibody Responses to SARS-CoV-2 in Patients With Novel Coronavirus Disease 2019. Clin Infect Dis. 2020;71(16):2027-2034. https://doi.org/10.1093/cid/ciaa344
5. Yonker LM, Swank Z, Bartsch YC, Burns MD, Kane A, et al. Circulating Spike Protein Detected in Post-COVID-19 mRNA Vaccine Myocarditis. Circulation. 2023;147(11):867-876. https://doi.org/10.1161/CIRCULATIONAHA.122.061025
6. Zaçe D, La Gatta E, Petrella L, Di Pietro ML. The impact of COVID-19 vaccines on fertility-A systematic review and meta-analysis. Vaccine. 2022;40(42):6023-6034. https://doi.org/10.1016/j.vaccine.2022.09.019
7. Lai CC, Chen IT, Chao CM, Lee PI, Ko WC, Hsueh PR. COVID-19 vaccines: concerns beyond protective efficacy and safety. Expert Rev Vaccines. 2021;20(8):1013-1025. https://doi.org/10.1080/14760584.2021.1949293
8. Сизякина Л.П., Андреева И.И., Харитонова М.В., Зайцева Н.С., Любимов Д.С., и др. Механизмы формирования гибридного иммунитета у лиц, переболевших COVID-19 и вакцинированных пептидными антигенами SARSCoV-2. Медицинская иммунология. 2022;24(3):629-640. https://doi.org/10.15789/1563-0625-MOF-2490
9. Сизякина Л.П., Андреева И.И., Харитонова М.В., Зайцева Н.С., Любимов Д.С., и др. Фенотипы поствакцинального иммунитета при использовании вакцины “ЭпиВакКорона” у лиц, перенесших COVID-19. Медицинская иммунология. 2022;24(2):367-378. https://doi.org/10.15789/1563-0625-PVI-2457
10. Yaugel-Novoa M, Bourlet T, Paul S. Role of the humoral immune response during COVID-19: guilty or not guilty? Mucosal Immunol. 2022;15(6):1170-1180. https://doi.org/10.1038/s41385-022-00569-w
11. Zhang Z, Mateus J, Coelho CH, Dan JM, Moderbacher CR, et al. Humoral and cellular immune memory to four COVID-19 vaccines. Cell. 2022;185(14):2434-2451.e17. https://doi.org/10.1016/j.cell.2022.05.022
12. Семенова Е.В., Павлюк В.В., Уварова М.А., Иванов А.В. Особенности гуморального иммунитета после перенесенного Covid-19. Медицинская иммунология. 2022;24(2):337-350. https://doi.org/10.15789/1563-0625-FOH-2452
13. Топтыгина А.П., Семикина Е.Л., Закиров Р.Ш., Афридонова З.Э. Сопоставление гуморального и клеточного иммунитета у переболевших COVID-19. Инфекция и иммунитет. 2022;12(3):495-504. https://doi.org/10.15789/2220-7619-COT-1809
14. Bai Z, Cao Y, Liu W, Li J. The SARS-CoV-2 Nucleocapsid Protein and Its Role in Viral Structure, Biological Functions, and a Potential Target for Drug or Vaccine Mitigation. Viruses. 2021;13(6):1115. https://doi.org/10.3390/v13061115
Об авторах
Л. П. СизякинаРоссия
Сизякина Людмила Петровна, д.м.н., проф., заведующая кафедрой клинической иммунологии и аллергологии
Ростов-на-Дону
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
В. Я. Закурская
Россия
Закурская Вита Яковлевна, ассистент кафедры клинической иммунологии и аллергологии
Ростов-на-Дону
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Рецензия
Для цитирования:
Сизякина Л.П., Закурская В.Я. Особенности формирования гибридного гуморального иммунитета к SARS-CoV-2. Медицинский вестник Юга России. 2025;16(2):117-122. https://doi.org/10.21886/2219-8075-2025-16-2-117-122
For citation:
Sizyakina L.P., Zakurskaya V.Ya. Features of the formation of hybrid humoral immunity to SARS-CoV-2. Medical Herald of the South of Russia. 2025;16(2):117-122. (In Russ.) https://doi.org/10.21886/2219-8075-2025-16-2-117-122
JATS XML







































