Перейти к:
Полиморфизмы генов интерферона γ и рецептора NKG2D в прогнозировании вертикальной передачи коинфекции ВИЧ/ВГС
https://doi.org/10.21886/2219-8075-2023-14-4-44-57
Аннотация
Цель: исследовать однонуклеотидные полиморфизмы аллели rs2430561 гена ИФНγ и аллели rs2617160 гена NKG2D в качестве потенциальных факторов риска внутриутробного инфицирования детей, рождённых матерью, коинфицированной ВИЧ/ВГС.
Материалы и методы: обследованы 65 пар «мать-ребенок», разделённых на 4 группы в зависимости от инфицирования ребенка (инфицирован ВИЧ/ВГС, инфицирован только ВИЧ или только ВГС, не инфицирован). Методы: мультиплексная полимеразная цепная реакция (ПЦР), ПЦР для определения вирусной нагрузки ВИЧ и ВГС, проточная цитофлуориметрия для иммунологических исследований, статистический анализ.
Результаты: однонуклеотидный полиморфизм гена ИФНγ по аллельному варианту rs2430561 при определении у матери прогностического значения не имел. В то же время при регистрации генотипов ТТ и АТ однонуклеотидного полиморфизма этого гена у ребенка, он сочетался с вероятностью инфицирования ребенка ВИЧ/ВГС, ВИЧ или ВГС в зависимости от величин вирусной нагрузки ВИЧ и ВГС в крови матери в разные триместры беременности. Наличие у матери генотипов АА и АТ аллели rs2617160 гена NKG2D имел прогностическое значение как способствующее инфицированию ребенка ВИЧ/ВГС или только ВИЧ. Было отмечено, что в механизмы перинатальной передачи вирусов был включен определённый уровень падения абсолютного числа CD4+ лимфоцитов в крови женщины во втором и третьем триместрах беременности.
Вывод: наличие генотипов АА и АТ аллели rs2617160 гена NKG2D у женщины, коинфицированной ВИЧ/ВГС, позволяет прогнозировать риск инфицирования ребенка не только в ходе беременности, но и на этапе её планирования.
Ключевые слова
Для цитирования:
Хаматова А.А., Балмасова И.П., Чеботарева Т.А. Полиморфизмы генов интерферона γ и рецептора NKG2D в прогнозировании вертикальной передачи коинфекции ВИЧ/ВГС. Медицинский вестник Юга России. 2023;14(4):44-57. https://doi.org/10.21886/2219-8075-2023-14-4-44-57
For citation:
Khamatova A.A., Balmasova I.P., Chebotareva T.A. Polymorphisms of interferon γ and NKG2D receptor genes in predicting vertical transmission of HIV/HCV coinfection. Medical Herald of the South of Russia. 2023;14(4):44-57. (In Russ.) https://doi.org/10.21886/2219-8075-2023-14-4-44-57
Введение
Инфекции, вызванные вирусом иммунодефицита человека (ВИЧ) и вирусом гепатита С (ВГС), остаются одной из основных глобальных проблем мирового здравоохранения. По данным 2017 г., 2,3 млн человек, живущих с ВИЧ, были одновременно инфицированы ВГС [1]. Особое внимание исследователей данного направления приковано к проблеме коинфекции ВИЧ/ВГС среди женщин фертильного возраста [2][3].
Данные мета-анализа, включающего более 900 источников из различных стран мира, выявили, что в среднем для общей популяции ВИЧ-инфицированных лиц доля заражённых ещё и ВГС беременных женщин составляет 2,4% [4]. В соответствии с современными методическими подходами для определения риска вертикальной передачи ВГС у коинфицированных женщин необходимо учитывать вирусную нагрузку ВГС и ВИЧ-статус, что же касается ВИЧ, то назначение высокоактивной антиретровирусной терапии и низкая вирусная нагрузка являются важными прогностическими факторами снижения вертикальной передачи этого вируса в последние годы [5]. По данным некоторых авторов, доля детей, рождённых от матерей с коинфекцией ВИЧ/ВГС и инфицированных ВГС, в развитых странах составляет 5,2% [6].
В настоящее время широко обсуждается роль плаценты как эпидемического фактора риска вертикальной передачи ВИЧ и ВГС в условиях коморбидности [7]. Дело в том, что 15–35% случаев перинатальной передачи вируса приходится на трансплацентарный путь передачи вируса (то есть внутриутробное, антенатальное заражение), 50–75% случаев на заражение во время родов и 10–20% — при грудном вскармливании [8].
С точки зрения значения трансплацентарной передачи возбудителей особого внимания заслуживает оценка иммунного фактора у женщин, тем более что ВИЧ и в меньшей степени ВГС относятся к категории вирусов, способных проявлять иммунотропное действие [9][10]. Более того, психоактивные вещества, злоупотребление которыми является частым спутником заражения ВИЧ и ВГС, также подавляют иммунные реакции и могут влиять на вирусный патогенез [11].
Что касается иммунного механизма, имеющего наибольшее значение при трансплацентарной передаче вирусов, то особого внимания заслуживает популяция таких клеток врождённого иммунитета, как натуральные киллеры. В женских репродуктивных органах, в частности в матке (мНК)\ (а при беременности — в децидуальной оболочке (дНК)) эти лимфоциты формируют пул тканерезидентных натуральных киллеров, обладающих отличительными признаками. Это связано с особенностями реакции иммунной системы на развитие беременности, так как плод обладает полуаллогенностью для матери, а беременность должна включать механизмы, предотвращающие его отторжение [12].
Основными функциями дНК является контроль врастания трофобласта в децидуальную оболочку с помощью цитотоксических эффектов этих клеток [13], а также выработка цитокинов, факторов роста, ангиогенных и других факторов. которые предопределяют неоангиогенез, ремоделирование тканей и развитие плаценты. Было показано также значение высокого уровня ИФНγ, продуцируемого дНК, в формировании устойчивости плода к заражению вирусами [14].
Подобная роль тканерезидентных натуральных киллеров с локализацией в децидуальной оболочке матки при гестационном процессе, определяющая состояние интерфейса «мать-плод», пока оказалась за рамками внимания исследователей. В то же время современный уровень научных знаний по данной проблеме значительно пополнился сведениями, позволяющими предполагать значение этого иммунного механизма как в поддержании физиологического течения беременности, так и в клеточной иммунной защите плода от возможности инфицирования [15].
Одним из рецепторов активации натуральных киллеров, в том числе в составе децидульной оболочки матки при беременности, является рецептор NKG2D, лигандами которого в этом случае служат стрессиндуцированные молекулы трофобласта и плаценты, особенно в случае их атаки вирусами. При этом основным секреторным продуктом дНК служит ИФНγ [16].
В настоящее время в литературе есть сведения о том, что полиморфизм гена NKG2D влияет на предрасположение к инфекционным заболеваниям, раку и аутоиммунным расстройствам [17], а полиморфизм аллельного варианта rs2617160 (генотип TT) гена NKG2D — единственный маркер и независимый фактор, связанный с восприимчивостью к хроническому гепатиту В. Лица с генотипом ТТ rs2617160 могут характеризоваться значительным снижением естественной цитотоксической активности при элиминации вируса гепатита В (ВГВ) по сравнению с носителями генотипов ТА или АА, что способствует персистенции вируса и приводит к хронической ВГВ-инфекции [18].
Установлено также, что полиморфизм аллельного варианта rs2430561 может влиять на экспрессию гена ИФНγ [19], а наличие аллелей T и A на уровне положения +874 от места начала трансляции, как было отмечено в начале XXI в., связано с высокой и низкой выработкой ИФНγ соответственно [20]. Полиморфизмы в некодирующих областях ИФНγ связаны с аутоиммунными нарушениями [21], хроническими инфекционными заболеваниями [22], в том числе с риском хронического течения вирусных гепатитов В и С [23][24].
Оценку значения указанных однонуклеотидных полиморфизмов в трансплацентарной передаче коинфекции ВИЧ/ВГС от матери к ребёнку в доступной научной литературе обнаружить не удалось.
Цель исследования — изучение однонуклеотидных полиморфизмов аллели rs2430561 гена ИФНγ и аллели rs2617160 гена NKG2D в качестве потенциальных факторов риска внутриутробного инфицирования детей, рождённых матерью, коинфицированной ВИЧ/ВГС.
Материалы и методы
В исследование вошли 65 пар «мама-ребенок», находящихся на учёте в поликлиническом и амбулаторно-поликлиническом педиатрическом отделениях Московского Городского Центра профилактики и борьбы со СПИДом (МГЦ СПИД) Государственного бюджетного учреждения здравоохранения города Москвы «Инфекционная клиническая больница №2 Департамента здравоохранения города Москвы» за период с 2004 по 2021 гг.
Все женщины, находящиеся под клиническим наблюдением в соответствии с принципами Хельсинкской Декларации были предупреждены об участии в исследовании и подписали информированное добровольное согласие.
Возраст матерей — от 17 до 49 лет, возраст детей — от 6 месяцев до 18 лет. Все матери без исключения были коинфицированы ВИЧ/ВГС, ВИЧ-инфекция находилась на стадии 3-4В. Вошедшие в исследование пары «мама-ребёнок» были распределены в соответствии с перинатальной передачей вирусов ребенку на 4 группы:
- группа 1 (пары «мама-ребёнок» с перинатальным инфицированием ребенка ВИЧ и ВГС) — 9 пар (14%);
- группа 2 (пары «мама-ребёнок» с перинатальным инфицированием ребенка ВИЧ) — 12 пар (18%);
- группа 3 (пары «мама-ребёнок» с перинатальным инфицированием ребенка ВГС) — 17 пар (26%);
- группа 4 (пары «мама-ребёнок» с неокончательным тестом у ребенка на ВИЧ и отсутствием ВГС) — 27 пар (42%).
Зависимость от приёма инъекционных психоактивных препаратов (в том числе в анамнезе) в каждой группе проявляли от 21% до 31% женщин.
Исследование носило проспективно-ретроспективный характер. Протокол исследования представлен на рисунке 1.
Всем мамам и их детям проводилось определение однонуклеотидных полиморфизмов генов ИФНγ и NKG2D методом мультиплексной полимеразной цепной реакции (ПЦР). ПЦР осуществлялась на базе ПЦР-анализатора «Abbott m2000rt» (Abbott Molecular Inc., USA) и автоматизированной станции пробоподготовки и выделения нуклеиновых кислот и белков «QI Asymphony SP» (QIAGEN GmbH, Германия) в соответствии с инструкцией по применению приборов.
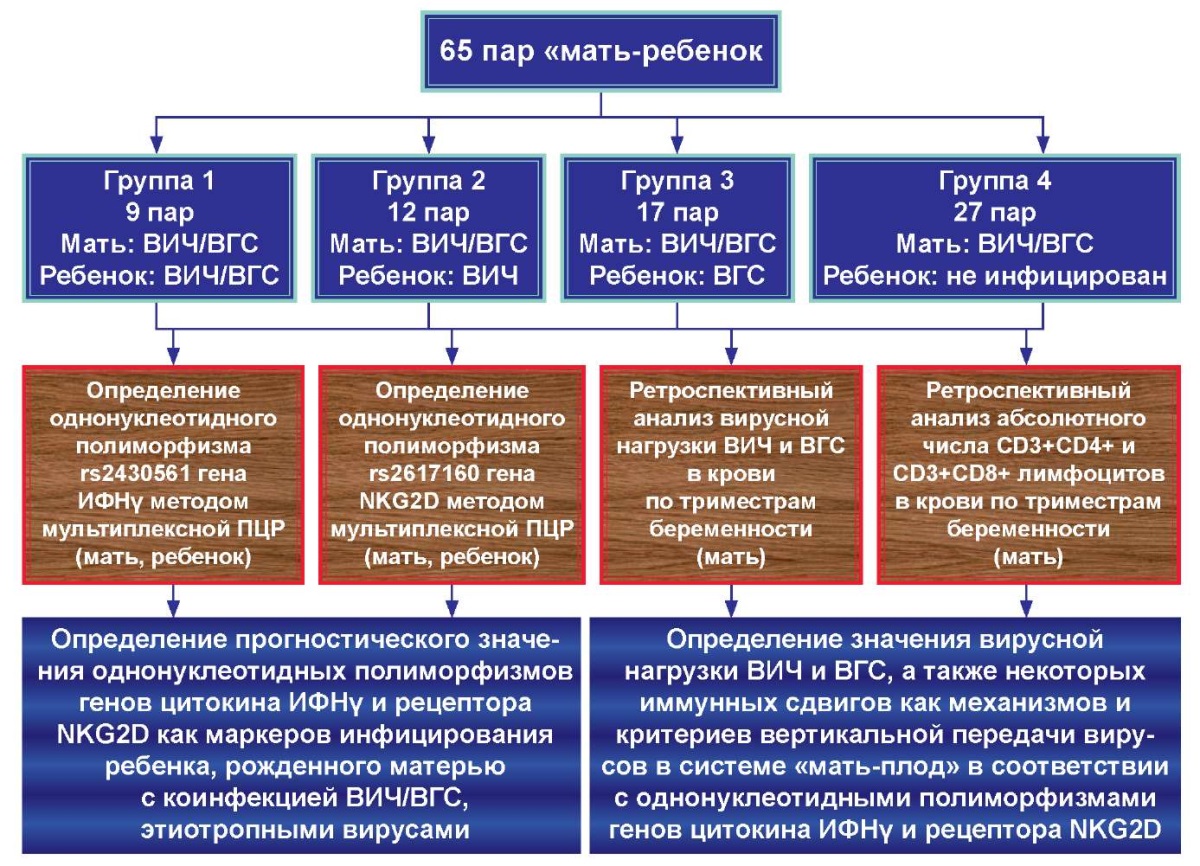
Рисунок 1. Протокол выполнения исследований.
Figure 1. Study protocol.
На преаналитическом этапе проводили забор венозной крови в пробирки с калиевой солью этилендиаминтетрауксусной кислоты (ЭДТА) для предотвращения коагуляции, после перемешивания отбирали 250 мкл цельной крови в промаркированные пробирки и отмывали фракцию лейкоцитарных клеток с помощью реагента «ГЕМОЛИТИК» (РУ № ФСР 2010/09505 от 09.04.19, ООО «АмплиСенс»). Полученную суспензию клеток использовали для выделения тотальной ДНК с помощью набора реагентов «АмплиПрайм ДНК-сорб-В» (РУ № ФСР 2009/05220 от 05.03.2019 г., ООО «НекстБио»).
После выделения ДНК проводили исследование на наличие однонуклеотидных полиморфизмов методом мультиплексной ПЦР. Для определения полиморфизмов в гене NKG2D использовали набор реагентов «TaqMan» производства Applied Biosystems, а для генотипирования полиморфных маркеров в гене IFNg — набор реагентов «rs2430561 гена IFNG» производства ТестГен (серия: 202111-411).
В работе анализировались ретроспективные данные карт амбулаторного наблюдения матерей в каждом триместре беременности по выявлению у них вирусной нагрузки ВИЧ и ВГС методом ПЦР, а также по результатам иммунологического исследования методом проточной цитофлуориметрии с определением абсолютного числа лимфоцитов с фенотипами CD3+CD4+ (Т-хелперов) и CD3+CD8+ (цитотоксических Т-лимфоцитов, ЦТЛ) и вычислением иммунорегуляторного индекса (ИРИ) как соотношения этих клеток (СD3+CD4+/CD3+CD8+).
Cтатистическая обработка данных выполнялась на основе пакета статистических программ SPSS (версия 23). Для статистической обработки частотных данных использовался однофакторный дисперсионный анализ (ONE WAY ANOVA), устанавливающий с помощью критерия Фишера однородность или гетерогенность распределения частоты встречаемости признака в сравниваемых группах. Вирусологические и иммунологические данные анализировались на основе определения их 95%-ных доверительных интервалов числовых значений показателей и их статистического сравнения с использованием критерия χ2 при р<0,05.
Результаты
Результаты исследования представительства различных вариантов однонуклеотидного полиморфизма аллельного варианта rs2430561 гена ИФНγ как у матери, так и у ребенка, представлены в таблице 1.
Как показывают данные таблицы 1, определение прогностического значения однонуклеотидного полиморфизма одной из аллелей гена ИФНγ показало неоднозначные результаты. Так, межгрупповые сопоставления частоты встречаемости этого полиморфизма у беременных женщин, коинфицированных ВИЧ/ВГС, выявили отсутствие влияния данного фактора на перинатальное инфицирование ребенка. В то же время тот же однонуклеотидный полиморфизм у ребенка оказался значимым при развитии перинатального инфицирования ВИЧ или ВГС, в том числе двумя вирусами одновременно.
Так, инфицирование ребенка ВИЧ, а также ВИЧ/ВГС оказалось взаимосвязано с частотой встречаемости полиморфизма аллели rs2430561 гена ИФНγ. У инфицированных детей вариант АА регистрировался статистически значимо реже, чем у детей, рождённых здоровыми. Встречаемость варианта АТ у инфицированных детей в обеих группах была выше. Примерно у четверти детей, инфицированных ВИЧ, регистрировался вариант ТТ, не встречающийся у здоровых детей, в связи с чем наличие этого варианта предположительно можно отнести к факторам риска перинатального инфицирования ВИЧ.
Аналогичный анализ с использованием сравнительной статистики показал, что в группе детей, инфицированных ВГС, вариант АА также регистрировался реже, чем у здоровых детей, вариант ТТ не регистрировался вообще ни в одной из групп сравнения, а вариант АТ отмечался в 2,2 чаще в группе детей, инфицированных ВГС, и, предположительно, может служить неспецифическим маркером инфицирования этим вирусом.
Таблица / Table 1
Соотношение частоты встречаемости
различных однонуклеотидных полиморфизмов аллели rs2430561 гена ИФНγ
в разных группах «мать-ребёнок»
Correlation of the frequency
of various single nucleotide polymorphisms in the IFN-γ gene variant rs2430561
in different mother-child groups
Группа «мать – ребенок» “Mother – child” group | Вариант полиморфизма (чел./%) Polimorphism variant (pers./%) | ONE WAY ANOVA | |||
АА | АТ | ТТ | F | p | |
Однонуклеотидный полиморфизм у матери, перинатальное заражение ребенка ВИЧ/ВГС Single nucleotide polymorphism in the mother, HIV/HCV perinatal infection of the child | |||||
Группа 1 – Мать: ВИЧ/ВГС; ребенок: ВИЧ/ВГС Group 1 – Mother:HIV/HCV; child:HIV/HCV | - | 6 чел. 67% | 3 чел. 33% | 3,795 | 0,060 |
Группа 4 – Мать: ВИЧ/ВГС; Ребенок: здоров Group 4 – Mother: HIV/HCV; child: healthy | 12 чел. 44% | 9 чел. 33% | 6 чел. 23% | ||
Однонуклеотидный полиморфизм у матери, перинатальное заражение ребенка ВИЧ Single nucleotide polymorphism in the mother, HIV perinatal infection of the child | |||||
Группа 2 – Мать: ВИЧ/ВГС; Ребенок: ВИЧ Group 2 – Mother: HIV/HCV; child: HIV | 6 чел. 50% | 6 чел. 50% | - | 1,206 | 0,279 |
Группа 4 – Мать: ВИЧ/ВГС; - Ребенок: здоров Group 4 – Mother: HIV/HCV; child: healthy | 12 чел. 44% | 9 чел. 33% | 6 чел. 23% | ||
Однонуклеотидный полиморфизм у матери, перинатальное заражение ребенка ВГС Single nucleotide polymorphism in the mother, HCV perinatal infection of the child | |||||
Группа 3 – Мать: ВИЧ/ВГС; Ребенок: ВГС Group 3 – Mother: HIV/HCV; child: HCV | 11 чел. 65% | 3 чел. 17,5% | 3 чел. 17,5% | 1,005 | 0,322 |
Группа 4 – Мать: ВИЧ/ВГС - Ребенок: здоров Group 4 – Mother: HIV/HCV; child: healthy | 12 чел. 44% | 9 чел. 33% | 6 чел. 23% | ||
Однонуклеотидный полиморфизм у ребенка, перинатальное заражение ребенка ВИЧ/ВГС Single nucleotide polymorphism in the сhild, HIV/HCV perinatal infection of the child | |||||
Группа 1 – Мать: ВИЧ/ВГС; Ребенок: ВИЧ/ВГС Group 1 – Mother:HIV/HCV; child:HIV/HCV 1 | 3 чел. 33% | 6 чел. 67% | - | 6,188 | 0,023* |
Группа 4 –Мать: ВИЧ/ВГС; Ребенок: здоров Group 4 – Mother: HIV/HCV; child: healthy | 18 чел. 67% | 9 чел. 33% | - | ||
Однонуклеотидный полиморфизм у ребенка, перинатальное заражение ребенка ВИЧ Single nucleotide polymorphism in the сhild, HIV perinatal infection of the child | |||||
Группа 2 – Мать: ВИЧ/ВГС; Ребенок: ВИЧ Group 2 – Mother: HIV/HCV; child: HIV | 3 чел. 25% | 6 чел. 50% | 3 чел. 25% | 11,385 | 0,002* |
Группа 4 – Мать: ВИЧ/ВГС; Ребенок: здоров Group 4 – Mother: HIV/HCV; child: healthy | 18 чел. 67% | 9 чел. 33% | - | ||
Однонуклеотидный полиморфизм у ребенка, перинатальное заражение ребенка ВГС Single nucleotide polymorphism in the сhild, HCV perinatal infection of the child | |||||
Группа 3 – Мать: ВИЧ/ВГС; Ребенок: ВГС Group 3 – Mother: HIV/HCV; child: HCV | 5 чел. 29% | 12 чел. 71% | - | 7,281 | 0,015* |
Группа 4 – Мать: ВИЧ/ВГС; Ребенок: здоров Group 4 – Mother: HIV/HCV; child: healthy | 18 чел. 67% | 9 чел. 33% | - | ||
Примечание: F — критерий Фишера распределения данных по группам,
р — вероятность различий в распределении данных по критерию Фишера в группах,
* — статистическая значимость межгрупповых различий при р<0,05.
Note: F – Fisher criterion,
p – the probability of differences in data distribution according to Fisher riterion,
* – statistical significance of intergroup differences at p<0.05
Далее у матери и ребенка исследовались однонуклеотидные полиморфизмы аллели rs2617160 гена NKG2D путём сравнения данных по группам исследования, в которых ребенок был инфицирован (группы 1, 2, 3), с группой 4, не содержащей перинатально инфицированных детей. Результаты этого исследования представлены в таблице 2.
Таблица / Table 2
Соотношение частоты встречаемости
различных однонуклеотидных полиморфизмов аллели rs2617160 гена NKG2D
в разных группах «мать-ребёнок»
Correlation of the frequency
of various single nucleotide polymorphisms in the NKG2D gene variant rs2617160
in different mother-child groups
Группа «мать – ребенок» “Mother – child” group | Вариант полиморфизма (чел./%) Polimorphism variant (pers./%) | ONE WAY ANOVA | |||
АА | АТ | ТТ | F | p | |
Однонуклеотидный полиморфизм у матери, перинатальное заражение ребенка ВИЧ/ВГС Single nucleotide polymorphism in the mother, HIV/HCV perinatal infection of the child | |||||
Группа 1 – Мать: ВИЧ/ВГС; ребенок: ВИЧ/ВГС Group 1 – Mother:HIV/HCV; child:HIV/HCV | 3 чел. 33% | 6 чел. 67% | - | 7,286 | 0,011* |
Группа 4 – Мать: ВИЧ/ВГС; Ребенок: здоров Group 4 – Mother: HIV/HCV; child: healthy | - | 12 чел. 50% | 12 чел. 50% | ||
Однонуклеотидный полиморфизм у матери, перинатальное заражение ребенка ВИЧ Single nucleotide polymorphism in the mother, HIV perinatal infection of the child | |||||
Группа 2 – Мать: ВИЧ/ВГС; Ребенок: ВИЧ Group 2 – Mother: HIV/HCV; child: HIV | 6 чел. 50% | 3 чел. 25% | 3 чел. 25% | 5,165 | 0,029* |
Группа 4 – Мать: ВИЧ/ВГС; Ребенок: здоров Group 4 – Mother: HIV/HCV; child: healthy | - | 12 чел. 50% | 12 чел. 50% | ||
Однонуклеотидный полиморфизм у матери, перинатальное заражение ребенка ВГС Single nucleotide polymorphism in the mother, HCV perinatal infection of the child | |||||
Группа 3 – Мать: ВИЧ/ВГС; Ребенок: ВГС Group 3 – Mother: HIV/HCV; child: HCV | - | 8 чел. 47% | 9 чел. 53% | 1,038 | 0,314 |
Группа 4 – Мать: ВИЧ/ВГС; Ребенок: здоров Group 4 – Mother: HIV/HCV; child: healthy | - | 12 чел. 50% | 12 чел. 50% | ||
Однонуклеотидный полиморфизм у ребенка, перинатальное заражение ребенка ВИЧ/ВГС Single nucleotide polymorphism in the сhild, HIV/HCV perinatal infection of the child | |||||
Группа 1 – Мать: ВИЧ/ВГС; Ребенок: ВИЧ/ВГС Group 1 – Mother:HIV/HCV; child:HIV/HCV | 3 чел. 33% | 6 чел. 67% | - | 9,466 | 0,004* |
Группа 4 –Мать: ВИЧ/ВГС; Ребенок: здоров Group 4 – Mother: HIV/HCV; child: healthy | 3 чел. 11% | 9 чел. 33% | 15 чел. 56% | ||
Однонуклеотидный полиморфизм у ребенка, перинатальное заражение ребенка ВИЧ Single nucleotide polymorphism in the сhild, HIV perinatal infection of the child | |||||
Группа 2 – Мать: ВИЧ/ВГС; Ребенок: ВИЧ Group 2 – Mother: HIV/HCV; child: HIV | 6 чел. 50% | - | 6 чел. 50% | 2,462 | 0,125 |
Группа 4 – Мать: ВИЧ/ВГС; Ребенок: здоров Group 4 – Mother: HIV/HCV; child: healthy | 3 чел. 11% | 9 чел. 33% | 15 чел. 56% | ||
Однонуклеотидный полиморфизм у ребенка, перинатальное заражение ребенка ВГС Single nucleotide polymorphism in the сhild, HCV perinatal infection of the child | |||||
Группа 3 – Мать: ВИЧ/ВГС; Ребенок: ВГС Group 3 – Mother: HIV/HCV; child: HCV | 3 чел. 18% | 6 чел. 35% | 8 чел. 47% | 0,446 | 0,508 |
Группа 4 – Мать: ВИЧ/ВГС; Ребенок: здоров Group 4 – Mother: HIV/HCV; child: healthy | 3 чел. 11% | 9 чел. 33% | 15 чел. 56% | ||
Примечание: F — критерий Фишера распределения данных по группам,
р — вероятность различий в распределении данных по критерию Фишера в группах,
* — статистическая значимость межгрупповых различий при р<0,05.
Note: F – Fisher criterion,
p – the probability of differences in data distribution according to Fisher criterion,
* – statistical significance of intergroup differences at p<0.05
Как следует из таблицы, есть основание предполагать взаимосвязь между вариантом однонуклеотидного полиморфизма аллельного варианта rs2617160 гена NKG2D и перинатальным инфицированием ребенка ВИЧ и/или ВГС при наличии у матери коинфекции ВИЧ/ВГС. Указанный полиморфизм имеет значение как со стороны матери, так и ребёнка.
Так, однофакторный дисперсионный анализ выявил взаимосвязь между однонуклеотидным полиморфизмом аллели rs2617160 гена NKG2D у матери и перинатальным инфицированием ребенка одновременно ВИЧ и ВГС, а также только ВИЧ. При этом вариант АА регистрировался только у матерей с коинфекцией ВИЧ/ВГС, дети которых оказались перинатально инфицированными, а частота его встречаемости — примерно треть женщин группы 1 и половина женщин группы 2, находившихся под наблюдением. Остальные женщины являлись носителями варианта АТ, частота встречаемости которого статистически значимо не отличалась от таковой в группе 4, в которой рождались здоровые дети. Вариант ТТ регистрировался только в группе 4.
Наличие генотипов АТ и, в меньшей степени, АА аллели rs2617160 гена NKG2D было характерно и для детей, перинатально коинфицированных ВИЧ/ВГС, хотя прогностического значения этот факт не имел.
Таким образом, перинатальное инфицирование ребенка ВИЧ (изолированно или одновременно с ВГС) было связано с наличием у матери, коинфицированной ВИЧ/ВГС, однонуклеотидного полиморфизма в виде генотипов АТ или АА аллели rs2617160 гена NKG2D, что предположительно можно интерпретировать как возможность предсказать риск инфицирования ребенка ВИЧ или ВИЧ/ВГС ещё до наступления беременности.

Рисунок 2. Взаимосвязь между полиморфизмами генов ИФНγ и NKG2D
и перинатальным инфицированием ребенка ВИЧ и ВГС.
Figure 2. The relationship between IFNγ and NKG2D genes polymorphisms
and perinatal child infection with HIV and HCV.
Cуммарная схема взаимосвязи исследованных полиморфизмов с возможностью инфицирования ребенка ВИЧ и ВГС представлена на рисунке 2. Как иллюстрирует рисунок, исследованный полиморфизм гена ИФНγ имеет значение только при обнаружении у ребенка, то есть по существу прогностической значимостью без инвазивного способа забора проб для исследования не обладает. Полиморфизм гена NKG2D с этой точки зрения более перспективен, поскольку обладает информативностью при обнаружении как у матери, так и у ребенка, что требует в дальнейшем подтверждения на популяционном уровне.
Для расшифровки основных механизмов, определяющих прогностическую значимость указанных полиморфизмов для внутриутробного инфицирования плода, в крови матерей в составе групп исследования в каждом триместре анализировались вирусная нагрузка ВИЧ и ВГС, а также абсолютное содержание субпопуляций Т-хелперов (CD3+CD4+) и цитотоксических Т-лимфоцитов (ЦТЛ, CD3+CD8+), вычислялся иммунорегуляторный индекс (cоотношение CD3+CD4+/СD3+CD8+).
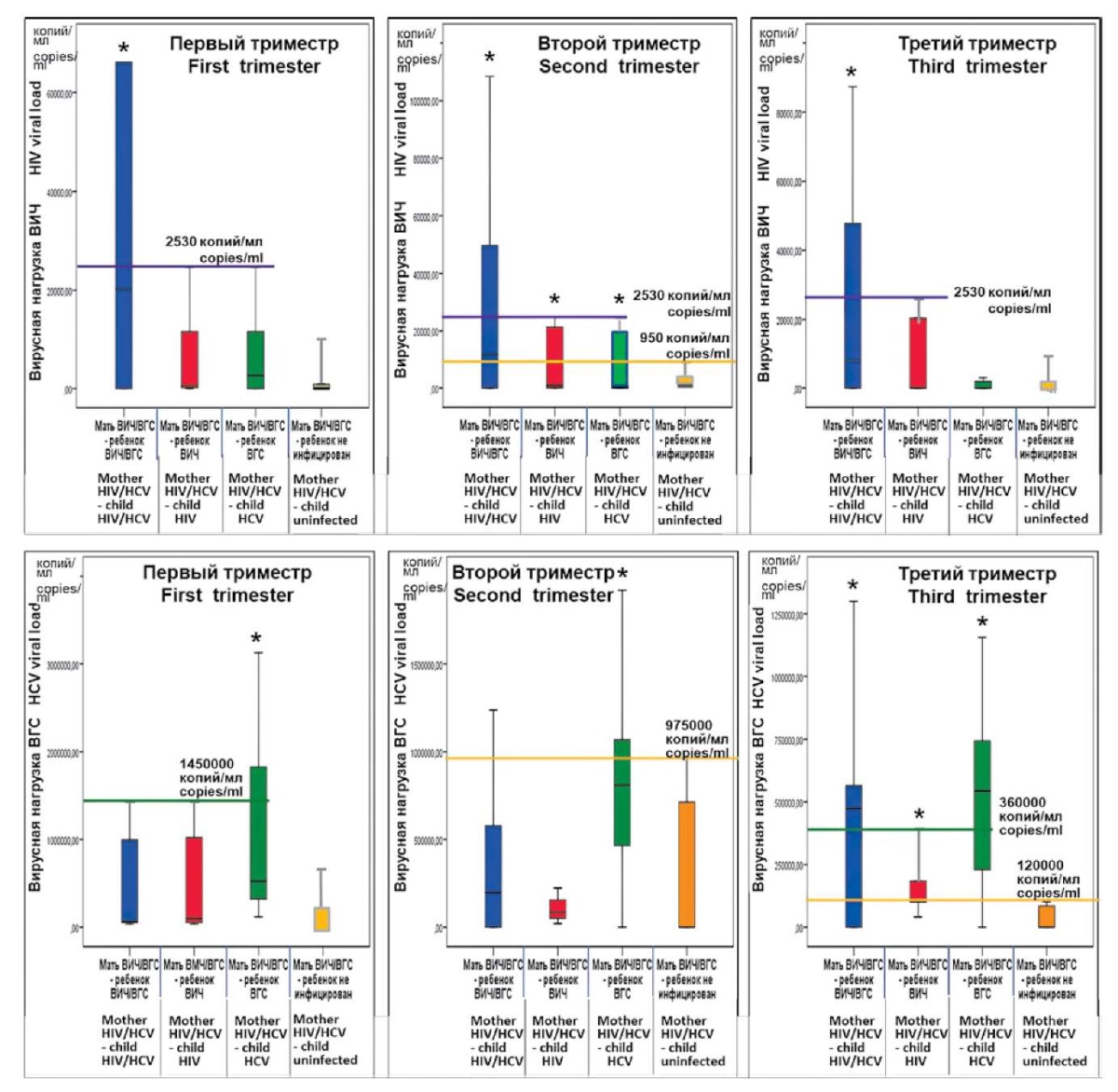
Рисунок 3. 95%-ные доверительные интервалы
вирусной нагрузки ВИЧ (верхний ряд) и ВГС (нижний ряд)
в разные триместры беременности у женщин групп исследования
(* — статистическая значимость отличия от группы контроля 4).
Figure 3. 95% confidence intervals
of HIV (top row) and HCV (bottom row) viral loads
in different pregnancy trimesters in women of the study groups
(* — statistical significance of the difference from control group 4).
Результаты определения вирусной нагрузки ВИЧ и ВГС в крови беременных женщин разных групп исследования в виде 95%-ных доверительных интервалов показателей представлены на рисунке 3.
Как показывают данные таблицы, вирусная нагрузка ВИЧ или ВГС у беременных женщин с коинфекцией ВИЧ/ВГС в принципе может иметь прогностическое значение, которое проявлялось по разному у каждого вируса и зависело от триместра беременности.
Вирусная нагрузка ВИЧ во втором триместре беременности выявляла статистически значимые различия этого показателя в группах, в которых ребенок был перинатально инфицирован ВИЧ, ВГС или обоими вирусами (группы 1–3), от группы 4, в которой вертикальной передачи вирусов от матери не происходило. Это позволяет предполагать, что, используя показатели вирусной нагрузки ВИЧ во втором триместре беременности у женщины, коинфицированной ВИЧ/ВГС, можно определить риск инфицирования будущего ребёнка, если вирусная нагрузка ВИЧ была выше 950 копий/мл. В первом и третьем триместре при этом же критериальном значении вирусной нагрузки (>950 копий/мл) прогностическое значение этого показателя распространяется только на группу 1, в которой рождались дети, коинфицированные ВИЧ/ВГС.
Показатели вирусной нагрузки ВГС у коинфицированной женщины проявляли информативность с точки зрения перинатального инфицирования ребенка ВГС при превышении 620000 копий/мл в первом триместре беременности, выше 975000 копий/мл — во втором триместре, а при значениях выше 120000 копий/мл в третьем триместре беременности у ребенка был возможен любой вариант инфицирования.
Характеристика иммунологических данных (субпопуляций Т-лимфоцитов) в крови беременных женщин с коинфекцией ВИЧ/ВГС, разделенных по группам исследования, в виде 95%-ных доверительных интервалов показателей представлены на рисунке 4.
Основной особенностью значения иммунологических сдвигов у беременных женщин, коинфицированных ВИЧ/ВГС, в отношении способности спровоцировать внутриутробное инфицирование плода, является отсутствие межгрупповых различий по каждому показателю в первом триместре беременности.
Во втором триместре были зарегистрированы статистически значимые сдвиги со стороны всех трёх показателей. Так, отмечено снижение абсолютного числа СD3+CD4+ лимфоцитов (Т-хелперов) ниже 290 клеток × 109/л в группе 2, которое статистически значимо отличало эту группу с перинатальным инфицированием детей ВИЧ от группы 4 с отсутствием инфицирования. Указанное снижение отразилось и на статистически значимом падении величин иммунорегуляторных индексов ниже 0,27 в той же группе 2. В группе 3 (перинатальное инфицирование ребенка ВГС) во втором триместре беременности у женщин наблюдалось падение абсолютного числа цитотоксических Т-лимфоцитов (CD3+CD8+) ниже 680 клеток × 109/л.
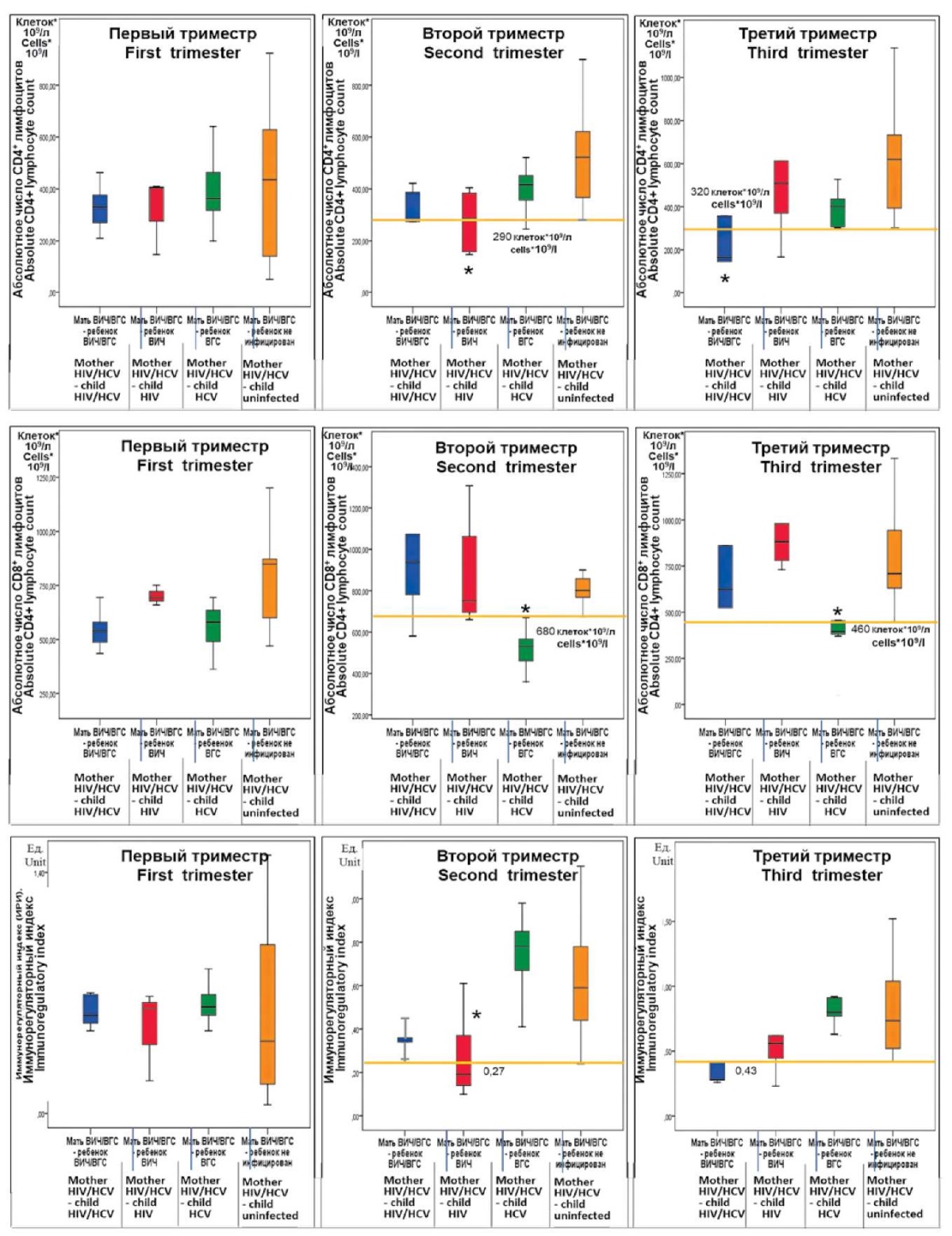
Рисунок 4. 95%-ные доверительные интервалы иммунологических показателей
в разные триместры беременности у женщин групп исследования
(* — статистическая значимость отличия от группы контроля 4).
Figure 4. 95% confidence intervals of immunological parameters
in different pregnancy trimesters in women of the study groups
(* — statistical significance of difference from control group 4).
В третьем триместре беременности иммунологические отклонения от контроля были несколько иными по изменениям в разных группах. C3+CD4+ Т-лимфоциты при значениях ниже 320 клеток × 109/л, как и иммунорегуляторный индекс ниже 0,43, соответствовали группе 1, в которой наблюдалось перинатальное инфицирование ребенка ВИЧ/ВГС. Падение абсолютного числа СD3+CD8+ цитотоксических Т-лимфоцитов ниже 480 клеток × 109/л регистрировалось в группе 3, в которой дети были инфицированы ВГС.
Таким образом, у матерей, коинфицированных ВИЧ/ВГС наблюдались различные изменения как вирусной нагрузки ВИЧ и ВГС, так и иммунологических показателей, которые значительно различались между собой в группах исследования и по-разному проявлялись по триместрам беременности.
Суммируя полученные данные можно предположить, что в перинатальном инфицировании ребенка имеет значение не только состояние организма матери, о чём свидетельствуют сдвиги со стороны иммунологических показателей, по-разному влияющие на характер инфицирования в разных группах, но и состояние интерфейса «мать-плод» (плаценты), как и, возможно, состояние организма плода, способных противодействовать переходу вирусных возбудителей от матери к плоду в соответствии с уровнем вирусной нагрузки разных возбудителей.
В соответствии с высказанными предположениями были проведены параллели между однонуклеотидными полиморфизмами генов ИФНγ и NKG2D и установленными сдвигами со стороны вирусной нагрузки ВИЧ и ВГС в первом случае и иммунологическими показателями — во втором (рис. 5).

Рисунок 5. Соответствие полиморфизмов генов ИФНγ у ребенка и NKG2D у матери
вирусологическим и иммунологическим показателям беременных женщин.
Figure 5. Correspondence of polymorphisms
in IFN-γ gene in the child and NKG2D gene in the mother
to the virological and immunological parameters of pregnant women.
Как было показано выше, однонуклеотидный полиморфизм гена ИФНγ по аллельному варианту rs2430561, который рассматривался в контексте прогнозирования риска рождения инфицированного ребенка матерью, коинфицированной ВИЧ/ВГС, при определении у беременной женщины прогностического значения не имел. В то же время у ребенка наличие такого однонуклеотидного полиморфизма сочеталось с возможностью инфицирования. Как уже отмечено, прогностического значения этот факт не имел, поскольку определение этого признака во время беременности потребовало бы инвазивного вмешательства, что могло бы способствовать заражению плода. Однако, с точки зрения расшифровки механизма заражения ребенка от инфицированной матери, это представляет определённый интерес. Иммунологические показатели матери как фактор риска заражения в данном случае не рассматривались, поскольку клеточные элементы иммунных систем матери и плода функционируют раздельно и разграничены плацентарным барьером, хотя влияние иммунного фактора на вирусную нагрузку ВИЧ и ВГС, несомненно, сказывается, но опосредованно. С нашей точки зрения, исследование собственно вирусной нагрузки ВИЧ и ВГС в крови матери, учитывая способность этих вирусов к вертикальной передаче, в данном случае было целесообразно.
Как следует из рисунка 4, коинфицирование ребенка ВИЧ/ВГС при наличии у него генотипов ТТ и АТ аллели rs2430561 гена ИФНγ становилось высоко вероятным, если у матери, коинфицированной ВИЧ/ВГС, вирусная нагрузка ВИЧ на протяжении всей беременности составляла не менее 2530 копий/мл, вирусная нагрузка ВГС в первом триместре превышала 1450000 копий/мл, а в третьем триместре была более 120000 копий/мл.
Риск инфицирования ребенка ВИЧ при наличии того же варианта однонуклеотидного полиморфизма ассоциировался с другими условиями: вирусная нагрузка ВИЧ у матери более 950 копий/мл во втором триместре беременности и вирусная нагрузка ВГС более 120000 копий/мл в третьем триместре. В этой ситуации интересным является факт, что для инфицирования ВИЧ требовалась не только определенная нагрузка этого вируса в крови матери во второй трети развития гестационного процесса, но и определенный уровень присутствия в крови коинфицирующего вируса гепатита С на более поздних этапах беременности.
Риск инфицирования ВГС при наличии у ребенка генотипов ТТ и АТ аллели rs2430561 гена ИФНγ в наших исследованиях был отмечен на фоне вирусной нагрузки ВИЧ выше 950 копий/мл во втором триместре, а также вирусной нагрузки ВГС выше 975000 копий/мл во втором триместре и выше 360000 копий/мл в третьем триместре.
Что касается прогностического значения однонуклеотидного полиморфизма аллельного варианта rs2617160 гена NKG2D, то в случае его подтверждения на уровне популяционных исследований эти данные заслуживают широкого внедрения в клиническую практику, поскольку регистрация у женщины репродуктивного возраста с коинфекцией ВИЧ/ВГС генотипов АА и АТ аллели rs2617160 гена NKG2D, позволяет отнести её в группу риска по возможности инфицирования ребенка либо ВИЧ, либо ВИЧ/ВГС. Иммунологическими признаками риска в данном случае служат абсолютное число CD3+CD4+ лимфоцитов, а также величина ИРИ в крови беременной женщины. Так, число CD3+CD4+ лимфоцитов меньше 290 клеток*109/л и ИРИ менее 0,27 во втором триместре беременности создают угрозу инфицирования ребенка ВИЧ, а число CD3+CD4+ лимфоцитов меньше 320 клеток*109/л и ИРИ менее 0,43 в третьем триместре — вероятность инфицирования ребенка ВИЧ/ВГС. Полученные данные оригинальны и перспективны с позиций определения указанной группы риска не только в ходе беременности, но и на этапе её планирования только по результатам определения однонуклеотидного полиморфизма аллельного варианта rs2617160 гена NKG2D.
Обсуждение
Полученные данные свидетельствуют о прогностическом значении однонуклеотидных полимофизмов гена NKG2D, отражающего отчасти состояние процессов активации натуральных киллеров в организме беременных женщин, коинфицированных ВИЧ/ВГС. В результате удалось подтвердить рабочую гипотезу, что по состоянию этой важной популяции лимфоцитов врождённого иммунитета, играющих значительную роль в формировании плаценты как интерфейса в системе «мать-плод», можно косвенно судить о состоянии барьера для проникновения вирусных возбудителей в организм ребенка. Кроме этого, было показано значение для инфицирования ребенка вирусной нагрузки ВИЧ и ВГС, а также степень падения числа CD3+CD4+ лимфоцитов как клеток, преимущественно поражаемых ВИЧ, в крови беременной женщины.
Целый ряд из отмеченных феноменов нуждается в интерпретации, что сделать на основе имеющихся в литературе противоречивых данных не совсем просто. Особенно это касается фактов инфицирования ребенка ВИЧ или ВГС на фоне роста вирусной нагрузки не одного из этих вирусов, а одновременно обоих возбудителей.
В современной литературе имеются сведения о том, что ВИЧ в значительной степени увеличивает скорость вертикальной передачи ВГС. Доказательства влияния ВГС на прогрессирование ВИЧ-инфекции менее убедительны: есть ссылки на ряд исследований, показывающих, что коинфекция ВГC снижает эффективность комбинированной антиретровирусной терапии [25]. Поскольку в нашем случае беременные женщины получали антиретровирусную терапию, это может быть одним из объяснений установленному факту инфицирования ребенка ВИЧ при повышенной вирусной нагрузке ВГС.
Что касается необходимости повышения вирусной нагрузки ВИЧ, наряду с ВГС, при инфицировании ребенка последним патогеном, то есть сведения, противоречащие этому факту, о том, что риск вертикальной передачи ВГС был связан с высоким уровнем РНК ВГС у матери, но не с нагрузкой ВИЧ [26]. Наряду с этим есть данные, что частота передачи вируса гепатита С от женщин с коинфекцией ВИЧ/ВГС снижается при хорошем контроле вирусной нагрузки ВИЧ [27]. Все эти сведения были получены исследователями без учёта наличия полиморфизма гена ИФНγ у инфицированных детей, что лишний раз доказывает значение установленного нами факта и перспективность его дальнейшего изучения.
Данные по прогностическому значению полиморфизма гена NKG2D у беременных женщин, коинфицированных ВИЧ/ВГС, с перспективой инфицирования ребенка имеют большую определенность, особенно по части выявленного соответствия этого полиморфизма степени снижения содержания в крови CD3+CD4+ лимфоцитов. В литературе есть сведения по значению падения числа этих клеток (ниже 350) для вертикальной передачи возбудителя [28, 29]. Дискуссионным является вопрос о том, почему при наличии у беременной женщины с коинфекцией ВИЧ/ВГС этого полиморфизма регистрируется инфицирование ребенка ВИЧ/ВГС или только ВИЧ, но не ВГС. В то же время при анализе иммунологических данных вне их связи с полиморфизмом гена NKG2D, было отмечено что инфицирование ребенка ВГС возможно при условии снижения в организме беременной женщины цитотоксических Т-лимфоцитов (CD3+CD8+). В доступной литературе мы не нашли сведений, объясняющих этот феномен. Можно предположить, что контроль ВГС могут осуществлять как ЦТЛ, осуществляющие противовирусный адаптивный иммунный ответ, так и натуральные киллеры как клетки врожденного иммунитета. Падение числа или функциональной активности одной из этих клеточных категорий нарушает их соотношение, что проявляется падением контроля над репродукцией ВГС.
Выводы
- Определение однонуклеотидного полиморфизма гена ИФНγ по аллельному варианту rs2430561 у беременной женщины прогностического значения не имеет.
- Однонуклеотидный полиморфизм гена ИФНγ по аллельному варианту rs2430561 при регистрации генотипов ТТ и АТ у ребенка сочетается с вероятностью его инфицирования: (1) ВИЧ/ВГС, если вирусная нагрузка ВИЧ у матери на протяжении всей беременности составляет не менее 2530 копий/мл, вирусная нагрузка ВГС в первом триместре превышает 1450000 копий/мл, а в третьем триместре — более 120000 копий/мл; (2) ВИЧ, если вирусная нагрузка ВИЧ у матери более 950 копий/мл во втором триместре беременности, а вирусная нагрузка ВГС более 120000 копий/мл в третьем триместре; (3) ВГС, если вирусная нагрузка ВИЧ у матери выше 950 копий/мл во втором триместре, а вирусная нагрузка ВГС выше 975000 копий/мл во втором триместре и выше 360000 копий/мл в третьем триместре.
- Регистрация у беременной женщины генотипов АА и АТ однонуклеотидного полиморфизма аллельного варианта rs2617160 гена NKG2D позволяет отнести её в группу риска по возможности инфицирования ребенка либо ВИЧ, либо ВИЧ/ВГС.
- Регистрация у беременной женщины генотипов АА и АТ однонуклеотидного полиморфизма аллельного варианта rs2617160 гена NKG2D сопряжена с внутриутробным инфицированием ребенка: (1) ВИЧ, если абсолютное число CD3+CD4+ лимфоцитов у матери меньше 290 клеток*109/л, а иммунорегуляторный индекс — менее 0,27 во втором триместре беременности; (2) ВИЧ/ВГС, если абсолютное число CD3+CD4+ лимфоцитов у матери меньше 320 клеток*109/л, а иммунорегуляторный индекс — менее 0,43 в третьем триместре беременности.
- Наличие полиморфизма генов ИФНγ и NKG2D влияет на механизмы развития иммунного ответа и уровень вирусной нагрузки при коинфекции ВИЧ и ВГС у беременной женщины, что определяет риск перинатального инфицирования ребенка.
Список литературы
1. Abiodun OE, Adebimpe O, Ndako JA, Oludoun O, Aladeitan B, Adeniyi M. Mathematical modeling of HIV-HCV coinfection model: Impact of parameters on reproduction number. F1000Res. 2022;11:1153. https://doi.org/10.12688/f1000research.124555.2
2. Ястребова Е.Б., Гутова Л.В. Дети, рожденные с ВИЧ: проблемы развития и возможности для здоровой жизни. ВИЧ-инфекция и иммуносупрессии. 2016;8(4):94.
3. Baroncelli S, Pirillo MF, Amici R, Tamburrini E, Genovese O, et al. HCV-HIV coinfected pregnant women: data from a multicentre study in Italy. Infection. 2016;44(2):235-42. https://doi.org/10.1007/s15010-015-0852-0
4. Platt L, Easterbrook P, Gower E, McDonald B, Sabin K, et al. Prevalence and burden of HCV co-infection in people living with HIV: a global systematic review and meta-analysis. Lancet Infect Dis. 2016;16(7):797-808. https://doi.org/10.1016/S1473-3099(15)00485-5
5. Cimpoca B, Panaitescu AM, Gica N, Veduta A, Ciobanu A. Risk of vertical transmission of chronic viral infections after invasive prenatal procedures. Ginekol Pol. 2022. Epub ahead of print. PMID: 35072256. https://doi.org/10.5603/GP.a2021.0196
6. Dieye NL, Varol M, Zorich SC, Millen AE, Yu KOA, Gómez-Duarte OG. Retrospective analysis of vertical Hepatitis C exposure and infection in children in Western New York. BMC Gastroenterol. 2023;23(1):242. https://doi.org/10.1186/s12876-023-02871-8
7. Обоскалова Т.А., Прохорова О.В., Воронцова А.В. ВИЧ-инфекция и беременность: учебное пособие. Екатеринбург: УГМУ; 2019.
8. Ниаури Д.А., Колобов А.В., Цинзерлинг В.А., Гзгзян А.М., Джемлиханова Л.Х., и др. Плацента человека как эпидемический фактор риска вертикальной передачи ВИЧ в условиях коморбидности. ВИЧ-инфекция и иммуносупрессии. 2016;8(4):7-16.
9. Milligan C, Slyker JA, Overbaugh J. The Role of Immune Responses in HIV Mother-to-Child Transmission. Adv Virus Res. 2018;100:19-40. https://doi.org/10.1016/bs.aivir.2017.10.001
10. Stuart JD, Salinas E, Grakoui A. Immune system control of hepatitis C virus infection. Curr Opin Virol. 2021;46:36-44. https://doi.org/10.1016/j.coviro.2020.10.002
11. Blackard JT, Sherman KE. Drugs of Abuse and Their Impact on Viral Pathogenesis. Viruses. 2021;13(12):2387. https://doi.org/10.3390/v13122387
12. Vacca P, Vitale C, Munari E, Cassatella MA, Mingari MC, Moretta L. Human Innate Lymphoid Cells: Their Functional and Cellular Interactions in Decidua. Front Immunol. 2018;9:1897. https://doi.org/10.3389/fimmu.2018.01897
13. Vento-Tormo R, Efremova M, Botting RA, Turco MY, Vento-Tormo M, et al. Single-cell reconstruction of the early maternal-fetal interface in humans. Nature. 2018;563(7731):347-353. https://doi.org/10.1038/s41586-018-0698-6
14. Zhang L, Wang HR, Shao YZ, Yan M, Fu T, et al. [Effect of IFN-γ and IL-12 expressions on intrauterine transmission in HBsAg-positive parturientsin late pregnancy]. Zhonghua Liu Xing Bing Xue Za Zhi. 2019;40(9):1077-1083. (In Chinese). https://doi.org/10.3760/cma.j.issn.0254-6450.2019.09.011
15. Gamliel M, Goldman-Wohl D, Isaacson B, Gur C, et al. Trained Memory of Human Uterine NK Cells Enhances Their Function in Subsequent Pregnancies. Immunity. 2018;48(5):951-962.e5. https://doi.org/10.1016/j.immuni.2018.03.030
16. Хаматова А.А., Чеботарева Т.А., Балмасова И.П. Тканерезидентные натуральные киллеры: особенности функционирования в матке и децидуальной оболочке. Иммунология. 2021;42(5):574-580.
17. Mariaselvam CM, Tamouza R, Krishnamoorthy R, Charron D, Misra DP, et al. Association of NKG2D gene variants with susceptibility and severity of rheumatoid arthritis. Clin Exp Immunol. 2017;187(3):369-375. https://doi.org/10.1111/cei.12891
18. Ma J, Guo X, Wu X, Li J, Zhu X, et al. Association of NKG2D genetic polymorphism with susceptibility to chronic hepatitis B in a Han Chinese population. J Med Virol. 2010;82(9):1501-7. https://doi.org/10.1002/jmv.21855
19. Schena FP, Cerullo G, Torres DD, Scolari F, Foramitti M, et al. Role of interferon-gamma gene polymorphisms in susceptibility to IgA nephropathy: a family-based association study. Eur J Hum Genet. 2006;14(4):488-96. https://doi.org/10.1038/sj.ejhg.5201591
20. Pravica V, Perrey C, Stevens A, Lee JH, Hutchinson IV. A single nucleotide polymorphism in the first intron of the human IFN-gamma gene: absolute correlation with a polymorphic CA microsatellite marker of high IFN-gamma production. Hum Immunol. 2000;61(9):863-6. https://doi.org/10.1016/s0198-8859(00)00167-1
21. Sarangi S, Nahak SK, Padhi S, Pradhan B, Nayak N, et al. Interferon-gamma (IFN-γ) intronic variant (rs2430561) is a risk factor for systemic lupus erythematosus: Observation from a meta-analysis. Lupus. 2023;32(2):284-294. https://doi.org/10.1177/09612033221146700
22. Areeshi MY, Mandal RK, Dar SA, Jawed A, Wahid M, et al. IFN-γ +874 A>T (rs2430561) gene polymorphism and risk of pulmonary tuberculosis: a meta-analysis. Arch Med Sci. 2019;17(1):177-188. https://doi.org/10.5114/aoms.2019.88481
23. Dondeti MF, Abdelkhalek MS, El-Din Elezawy HM, Alsanie WF, Raafat BM, et al. Association between interferon-gamma (IFN-γ) gene polymorphisms (+874A/T and +2109A/G), and susceptibility to hepatitis B viral infection (HBV). J Appl Biomed. 2022;20(1):37-43. https://doi.org/10.32725/jab.2022.001
24. Börekçi G, Çetinkaya A, Kandemir Ö, Bekalp Yılmaz İ, Orekici Temel G, Aras N. TNF-α, IL-12A, IL-12B ve IFN-γ Gen Polimorfizmleri ile Kronik Hepatit C Arasındaki İlişkinin Araştırılması [Investigation of the Relationship Between TNF-α, IL-12A, IL-12B and IFN-γ Gene Polymorphisms and Chronic Hepatitis C]. Mikrobiyol Bul. 2020;54(2):279-290. (In Turkish). https://doi.org/10.5578/mb.69332
25. Puoti M, Prestini K, Putzolu V, Zanini B, Baiguera C, et al. HIV/HCV co-infection: natural history. J Biol Regul Homeost Agents. 2003;17(2):144-6. PMID: 14518713.
26. Ngo-Giang-Huong N, Jourdain G, Sirirungsi W, Decker L, Khamduang W, et al. Human immunodeficiency virushepatitis C virus co-infection in pregnant women and perinatal transmission to infants in Thailand. Int J Infect Dis. 2010;14(7):e602-7. https://doi.org/10.1016/j.ijid.2009.09.002
27. Checa Cabot CA, Stoszek SK, Quarleri J, Losso MH, Ivalo S, et al. Mother-to-Child Transmission of Hepatitis C Virus (HCV) Among HIV/HCV-Coinfected Women. J Pediatric Infect Dis Soc. 2013;2(2):126-35. https://doi.org/10.1093/jpids/pis091
28. Wu M, Yan Y, Zou S, Wu S, Feng L, et al. Adverse pregnancy outcomes among pregnant women living with HIV in Hubei province, China: prevalence and risk factors. AIDS Care. 2023;35(3):351-358. https://doi.org/10.1080/09540121.2022.2039358
29. Tariku MK. Determinants of mother to child HIV transmission (HIV MTCT); a case control study in governmental health centers of East Gojjam Zone, Northwest Ethiopia, 2019. Reprod Health. 2022;19(1):195. https://doi.org/10.1186/s12978-022-01501-y
Об авторах
А. А. ХаматоваРоссия
Агунда Ахсарбековна Хаматова – врач-педиатр амбулаторно-поликлинического педиатрического отделения
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
И. П. Балмасова
Россия
Ирина Петровна Балмасова – д.м.н., профессор, ведущий научный сотрудник лаборатории молекулярно-биологических исследований
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Т. А. Чеботарева
Россия
Чеботарева Татьяна Александровна – д.м.н. профессор, профессор кафедры детских инфекционных болезней
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Рецензия
Для цитирования:
Хаматова А.А., Балмасова И.П., Чеботарева Т.А. Полиморфизмы генов интерферона γ и рецептора NKG2D в прогнозировании вертикальной передачи коинфекции ВИЧ/ВГС. Медицинский вестник Юга России. 2023;14(4):44-57. https://doi.org/10.21886/2219-8075-2023-14-4-44-57
For citation:
Khamatova A.A., Balmasova I.P., Chebotareva T.A. Polymorphisms of interferon γ and NKG2D receptor genes in predicting vertical transmission of HIV/HCV coinfection. Medical Herald of the South of Russia. 2023;14(4):44-57. (In Russ.) https://doi.org/10.21886/2219-8075-2023-14-4-44-57







































