Перейти к:
Трудности диагностики миофибробластической опухоли лёгкого у ребёнка
https://doi.org/10.21886/2219-8075-2023-14-3-41-45
Аннотация
Воспалительная миофибробластная опухоль (ВМО) — редкое новообразование мезенхимальной природы с промежуточным биологическим потенциалом. Опухоль состоит из дифференцированных миофибробластных веретенообразных клеток. Частота встречаемости ВМО среди первичных новообразований легких составляет до 1%. Данный вид опухоли является самым распространённым типом первичных опухолей лёгких у детей. ВМО могут встречаться как в детском, так и во взрослом возрасте. ВМО обнаруживается в мягких тканях брюшной полости, в органах малого таза, гортани, молочной железе, тканях головы и шеи. Диагностируется также и внеорганная локализация (забрюшинное пространство, средостение). ВМО лёгких часто не имеют клинических проявлений, а в случае их наличия имеет неспецифические симптомы, такие как кашель, кровохарканье, одышку, гипертермию, боли в грудной клетке. ВМО ранее рассматривались как новообразование с доброкачественным течением, однако эти опухоли имеют склонность к местным рецидивам и отдаленному метастазированию. В статье приведены данные в отношении распространённости, клинических проявлений и лечения ВМО, а также собственное клиническое наблюдение течения данного заболевания у ребенка 8 лет.
Для цитирования:
Белых Н.А., Захарова А.В., Пизнюр И.В., Аникеева Н.А., Стежкина Е.В., Деева Ю.В. Трудности диагностики миофибробластической опухоли лёгкого у ребёнка. Медицинский вестник Юга России. 2023;14(3):41-45. https://doi.org/10.21886/2219-8075-2023-14-3-41-45
For citation:
Belykh N.A., Zakharova A.V., Piznyur I.V., Anikeeva N.A., Styazhkina E.V., Deeva Yu.V. Difficulties in diagnosing a myofibroblastic lung tumor in a child. Medical Herald of the South of Russia. 2023;14(3):41-45. (In Russ.) https://doi.org/10.21886/2219-8075-2023-14-3-41-45
Введение
Воспалительная миофибробластическая опухоль (ВМО) — это редкий вид новообразования с характерной гетерогенностью гистологической картины. В основе развития ВМО лежат также молекулярно-генетические изменения [1].
Данный вид опухоли может возникнуть в любом возрасте, но чаще встречается у детей и молодых людей [2]. Распространённость данной патологии в мире колеблется от 0,04% до 0,7% независимо от расы. Соотношение мужчин и женщин составляет 1:3 [3][4].
ВМО состоит из дифференцированных миофибробластных веретенообразных клеток с многочисленными плазматическими клетками и/или инфильтратами лимфоцитов [2][5].
Согласно классификации опухолей мягких тканей, предложенной Всемирной организацией здравоохранения (2020), данная опухоль относится к группе фибробластических/ миофибробластических опухолей [6].
История изучения заболевания берёт свое начало в XX в., когда H. Brunn et al. в 1939 г. впервые описали воспалительную псевдоопухоль грудной клетки. Термин «воспалительные псевдоопухоли» предложили W. Umiker и L. Iverson в 1954 г. для описания опухоли лёгкого, схожей по отдельным клинико-диагностическим характеристикам со злокачественными новообразованиями. Позднее, в 1955 г., J.D. Lane et al. ввели термин «плазматическая гранулема», основываясь на гистологической картине опухоли, схожей с воспалительной псевдоопухолью, но характеризующейся преобладанием плазматических клеток [2]. В 1990 г. J.M. Meis и F.M. Enzinger описали новообразование, схожее по гистологической картине с воспалительной псевдоопухолью, но имеющее более агрессивное клиническое течение, и назвали её воспалительной фибросаркомой. В 1994 г. ВМО был определена как новообразование, состоящее из веретенообразных клеток, характеризующихся миофибробластами и большим количеством ассоциированных воспалительных клеток, а в 1995 г. C.M. Сoffin et al. впервые ввели термин «ВМО». В своём исследовании они представили данные 84 пациентов с ВМО экстрапульмонарной локализации, имеющей схожие клиническую и гистологическую картины с воспалительной фибросаркомой. При этом ни в одном случае не было выявлено отдаленных метастазов, а частота рецидивов заболевания была несколько ниже опубликованных ранее данных (25 %) [1][7].
Однако на сегодняшний день точная этиология и патогенез ВМО остаются неясными. Основными факторами, приводящими к развитию данной неоплазии, являются воспаление, травма, хирургическое вмешательство, аутоиммунный процесс, различные бактериальные и вирусные инфекции, в частности, вызванные микобактериями, коринобактериями, вирусамм гепатита В, Эпштейна-Барра, папилломы человека. Кроме того, имеются данные о связи ВМО с хромосомными перестройками в локусе 2p23, расположенном на коротком плече 2-й хромосомы, рядом с геном, кодирующим киназу анапластической лимфомы (anaplastic lymphoma kinase, АLK). ALK представляет собой тирозинкиназу рецепторного типа, которая является драйвером онкогенеза в результате транслокации генов, при анапластической крупноклеточной лимфоме, раке легкого и ВМО. На сегодня известно более 21 гена-партнера, участвующего в патогенезе ВМО, при этом каждый год спектр этих генов обновляется [1][3].
Клинические проявления ВМО тесно связаны с участком первичных очагов и могут сопровождаться общими симптомами, такими как боль и лихорадка. Легочная ВМО может манифестировать болью в груди и одышкой. При этом проявления клинических симптомов не зависят от размера и массы опухоли [5][8].
Результаты различных методов визуализации ВМО варьируются. На рентгенографии ВМО могут представляться в виде нескольких образований в одной анатомической области. Изображение может варьироваться от инфильтрата до чётко очерченного образования, с различными пропорциями воспалительных и фиброзных компонентов. При компьютерной томографии может отмечаться дефицит контраста в фиброзном компоненте новообразования. МРТ-визуализация может показывать низкую интенсивность сигнала из-за фиброза, наряду с ограниченной диффузией.
При лабораторной диагностике ВМО может отмечаться лейкоцитоз нейтрофильного характера, повышение уровня С-реактивного белка и скорости оседания эритроцитов (СОЭ) [3].
Стандартом терапии ВМО является хирургическая резекция. При невозможности проведения полной резекции применяют лучевую, гормональную или молекулярную таргетную лекарственную терапию.
Открытие слияний АLK у пациентов с немелкоклеточной карциномой лёгкого способствовало клинической разработке ингибиторов АЛК, включая молекулярно-таргертный препарат кризотиниб, появившийся в последние годы, который продемонстрировал высокую эффективность [3][9].
ВМО обладает невысоким метастатическим потенциалом и имеет склонность к рецидивам, частота которых зависит от локализации процесса и варьируется в пределах от < 2% (для лёгочной локализации) и до 37% (при внелёгочной локализации).
К наиболее частым зонам метастазирования относятся лимфатические узлы, лёгкие, кости. Поэтому для предотвращения рецидива необходимо длительное наблюдение за пациентом [10].
Описание клинического случая
Пациентка Н., 2014 г. р., славянской национальности. Девочка от 4-й беременности, протекавшей на фоне угрозы прерывания в 1 и 2 триместрах, роды — 3-е, срочные самопроизвольные. Масса тела при рождении — 3620 г, длина тела — 55 см, окружность головы — 36 см, окружность груди – 35 см, оценка по шкале Апгар — 8/9 баллов. Ребенок был выписан из роддома на 5-е сутки в удовлетворительном состоянии. Период новорождённости протекал без особенностей.
Девочка росла и развивалась соответственно возрасту, находилась на грудном вскармливании до 6 месяцев, привита по календарю. Перенесённые заболевания: ветряная оспа в возрасте 3 лет, ОРВИ — 2–3 раза в год. Аллергологический и генеалогический анамнез не отягощены.
Обратились в инфекционное отделение ГБУ РО «Городская клиническая больница N°11» г. Рязани 05.11.2020 г. с жалобами на субфебрильную температуру тела, одышку. При поступлении общее состояние оценено как среднетяжёлое, температура тела — 37,5°C. Имеет место малопродуктивный кашель, гиперемия ротоглотки. В легких аускультативно — дыхание жёсткое, сухие свистящие хрипы, выдох удлинён, ЧД — 46 в минуту, SpO2 — 95%. Предварительный диагноз — «Внебольничная пневмония».
В анализах крови отсутствовали признаки анемии, отмечался лейкоцитоз до 15,3 ×109/л, нейтрофилёз — до 93%, ускорение СОЭ до 25 мм/ч.
В анализе мочи — без патологии.
По данным ИФА АТ к M. pneumoniae IgM — положительно, IgG — положительно, к Chl. рneumoniae IgM — отрицательно, IgG — отрицательно. На рентгенограмме органов грудной клетки от 05.11.2020 г. слева в проекции Ⅰ-го сегмента и нижнемедиальном отделе определяется инфильтрация легочной ткани. Заключение: левосторонняя сегментарная пневмония (рис. 1).
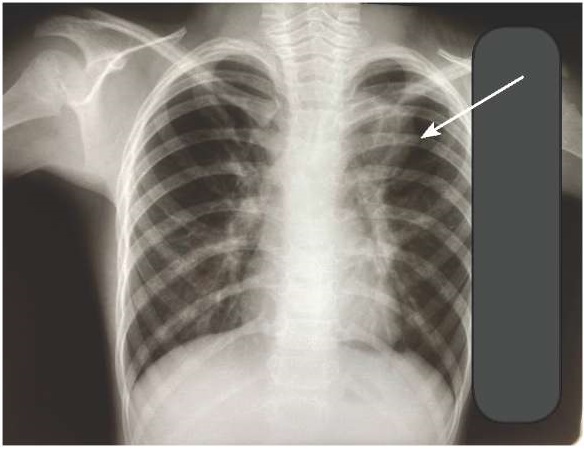
Рисунок 1. Рентгенограмма органов грудной клетки при госпитализации
Figure 1. Chest X-ray during hospitalization
На фоне проведённой антибактериальной и симптоматической терапии симптомы интоксикации и бронхообструкции были купированы. На контрольной рентгенограмме органов грудной клетки (13.11.2020 г.) инфильтрация отсутствует, в верхней доле слева затемнение с чёткими контурами. На компьютерной томографии органов грудной клетки (23.11.2020 г.) слева в верхней доле определяется образование с четкими ровными контурами изоденсивной плотности с вхождением и обрывом верхнедолевого бронха, трахея смещена вправо, инфильтрации нет. Заключение: КТ-данные бронхогенной кисты.
Девочка для дообследования была переведена в отделение пульмонологии РОДКБ им. Н.В. Дмитриевой г. Рязани с диагнозом «Внебольничная пневмония, сегментарная, левосторонняя, верхнедолевая, острое течение, ДН 1 степени на фоне микоплазменной инфекции. Бронхогенная киста верхней доли левого лёгкого?».
При дальнейшем обследовании на рентгенограмме органов грудной клетки (от 25.11.2020 г.) слева в верхней доле определялось дополнительное образование гомогенной структуры с чёткими контурами, прилегающее к верхнему средостению и левому корню. Левый корень уплотнён.
Результаты компьютерной томографии с внутривенным контрастированием (27.11.2020 г.): КТ-картина дополнительного кистозно-солидного образования в проекции верхней доли левого лёгкого. Размеры лимфатических узлов средостения в пределах нормальных величин. При спирометрии отмечается умеренное снижение проходимости по мелким бронхам.
При УЗИ органов брюшной полости и малого таза (08.12.20), щитовидной железы (25.11.20) патологии не выявлено. Результаты бронхоскопии (25.11.20) также отвергли эндобронхиальную патологию. Диаскинтест (04.12.20) отрицательный.
МРТ органов грудной клетки с контрастным усилением (10.12.2020 г.) выявила признаки объёмного солидного образования в левом гемитораксе.
Результаты исследования уровня опухолевых маркеров: альфа-фетопротеин — менее 1,66 МЕ/мл (норма — от 0 до 5,5 МЕ/мл), NSE (нейро-специфическая енолаза) — 27,6 нг/мл (норма не более 17 нг/мл), b — хорионический гонадотропин человека общий, < 1,20 (норма — 0–5 мЕд/мл).
Для дальнейшего обследования девочка направлена в РДКБ им Пирогова г. Москвы.
При поступлении (26.01.21) общие анализы крови и мочи были в пределах формально-нормативных.
Рентгенограмма органов грудной клетки от 27.01.2021 г.: в проекции SⅠ-Ⅱ верхней доли левого лёгкого определяется вытянутой формы образование (45×25×43 мм), с интенсивными включениями, с чётким контуром, прилежит и очевидно тесно связано с корнем левого лёгкого, с реакцией костальной плевры и деформацией интерстиция.
При мультиспиральной компьютерной томографии от 28.01.2021 г. солидное новообразование SⅠⅡ-Ⅰ верхней доли левого лёгкого, доходящее или исходящее из корня, прежними размерами (33,5×24×45,7 мм) неправильной вытянутой формы (+ 36-39-42 HU), тесно спаянное с сегментарными бронхами SⅠ-Ⅱ-ⅠⅡ.
На УЗИ органов брюшной полости и малого таза патологии не выявлено.
Ребенку 4 февраля 2021 г. была проведена верхнедолевая туморлобэктомия слева. При гистологическом исследовании выявлено следующее: на разрезе к корню лёгкого прилежит плотный, белесоватый очаг с четкими границами размером 3×2,5×1,2 см.
Результаты иммуногистохимического исследования: клетки опухоли позитивны к антителам SMA, фокально Desmin, S100, негативны реакции с анти-РСК, PR, ALK (p80), EMA, CD34, TTFI, TRK и ROS1. Заключение: описанные патологические изменения соответствуют воспалительной миофибробластической опухоли.
Клинический диагноз — «Воспалительная миофибробластическая опухоль верхней доли левого лёгкого, состояние после удаления верхней доли левого лёгкого с опухолью».
В августе 2021 г. девочка находилась на плановом обследовании в пульмонологическом отделении РОДКБ им. Н.В. Дмитриевой г. Рязани. По результатам лабораторного обследования патологии не выявлено. При компьютерной томографии органов грудной клетки (от 10.08.2021 г.) данных о наличии свежих очаговых и инфильтративных изменений нет. На УЗИ органов брюшной полости и малого таза (от 10.08.2021 г.) патологии не выявлено.
Девочка в настоящее время жалоб не предъявляет. Находится под динамическим наблюдением педиатра и пульмонолога.
Выводы
Воспалительная миофибробластическая опухоль — это редкое заболевание, которое может скрываться под различными клиническими масками, что затрудняет диагностику данной патологии.
Список литературы
1. Suleymanova A.M., Kachanov D.Yu., Imyanitov E.N., Roshchin V.Yu., Shamanskaya T.V., Varfolomeeva S.R. Inflammatory myofibroblastic tumors in children: literature review. Russian Journal of Pediatric Hematology and Oncology. 2020;7(2):64-77. (In Russ.) https://doi.org/10.21682/2311-1267-2020-7-2-64-77
2. Korolczuk A, Jarosz P, Jasielski P, Mitura P, Bar K. Inflammatory myofibroblastic tumor of the kidney in patient with nephron-sparing surgery. Case report and review of the literature. Indian J Pathol Microbiol. 2022;65(1):176-180. https://doi.org/10.4103/ijpm.ijpm_11_21
3. Gros L, Dei Tos AP, Jones RL, Digklia A. Inflammatory Myofibroblastic Tumour: State of the Art. Cancers (Basel). 2022;14(15):3662. https://doi.org/10.3390/cancers14153662
4. Lopukhova VA, Tarasenko IV, Shestavina NV, Ilyin MYu. Tendencies of primary morbidity and mortality of population of the Kursk region from malignant neoplasms. Science of the young (Eruditio Juvenium). 2020;8(2):202-7. https://doi.org/10.23888/HMJ202082202-207
5. Shi P, Zhang L, Shi H, Wu Y. Inflammatory Myofibroblastic Tumor in the Thyroid Gland: A Retrospective Case Series Study and Literature Review. Oncol Res Treat. 2022;45(6):353-365. https://doi.org/10.1159/000524489
6. Sbaraglia M, Bellan E, Dei Tos AP. The 2020 WHO Classification of Soft Tissue Tumours: news and perspectives. Pathologica. 2021;113(2):70-84. https://doi.org/10.32074/1591-951X-213
7. Chen C, Huang M, He H, Wu S, Liu M, et al. Inflammatory Myofibroblastic Tumor of the Urinary Bladder: An 11-Year Retrospective Study From a Single Center. Front Med (Lausanne). 2022;9:831952. https://doi.org/10.3389/fmed.2022.831952
8. Park JW, Han SH, Kim DK. [Inflammatory Myofibroblastic Tumor Misdiagnosed as Intrahepatic Cholangiocarcinoma]. Korean J Gastroenterol. 2022;79(1):41-44. (In Korean). https://doi.org/10.4166/kjg.2021.146
9. Wu S, Jian F. A Case Report of Inflammatory Myofibroblastic Tumor of the Sphenoidal Sinus. Ear Nose Throat J. 2021:1455613211065990. Epub ahead of print. PMID: 34933588. https://doi.org/10.1177/01455613211065990
10. Shustova S.A., Miroshkina T.A. Protective mechanisms of lungs. I.P. Pavlov Russian Medical Biological Herald. 2020;28(4):567-577. https://doi.org/10.23888/PAVLOVJ2020284567-577
Об авторах
Н. А. БелыхРоссия
Белых Наталья Анатольевна – доктор медицинских наук, заведующий кафедрой поликлинической педиатрии с курсом педиатрии ФДПО.
Рязань
Конфликт интересов:
Нет
А. В. Захарова
Россия
Захарова Анастасия Владиславовна – студент.
Рязань
Конфликт интересов:
Нет
И. В. Пизнюр
Россия
Пизнюр Инна Владимировна - ассистент кафедры факультетской и поликлинической педиатрии с курсом педиатрии ФДПО.
Рязань
Конфликт интересов:
Нет
Н. А. Аникеева
Россия
Аникеева Наталья Александровна - кандидат медицинских наук, доцент кафедры факультетской и поликлинической педиатрии с курсом педиатрии ФДПО.
Рязань
Конфликт интересов:
Нет
Е. В. Стежкина
Россия
Стежкина Елена Викторовна - кандидат медицинских наук, доцент кафедры факультетской и поликлинической педиатрии с курсом педиатрии.
Рязань
Конфликт интересов:
Нет
Ю. В. Деева
Россия
Деева Юлия Витальевна - ассистент кафедры факультетской и поликлинической педиатрии с курсом педиатрии ФДПО.
Рязань
Конфликт интересов:
Нет
Рецензия
Для цитирования:
Белых Н.А., Захарова А.В., Пизнюр И.В., Аникеева Н.А., Стежкина Е.В., Деева Ю.В. Трудности диагностики миофибробластической опухоли лёгкого у ребёнка. Медицинский вестник Юга России. 2023;14(3):41-45. https://doi.org/10.21886/2219-8075-2023-14-3-41-45
For citation:
Belykh N.A., Zakharova A.V., Piznyur I.V., Anikeeva N.A., Styazhkina E.V., Deeva Yu.V. Difficulties in diagnosing a myofibroblastic lung tumor in a child. Medical Herald of the South of Russia. 2023;14(3):41-45. (In Russ.) https://doi.org/10.21886/2219-8075-2023-14-3-41-45
JATS XML







































