Перейти к:
Абнормальная кишечная микробиота и нарушение инкретинового эффекта как причины развития сахарного диабета 2 типа
https://doi.org/10.21886/2219-8075-2022-13-1-24-42
Аннотация
В настоящее время установлено, что кишечная микробиота является одним из 11 звеньев патогенеза сахарного диабета 2 типа. Дело в том, что при нарушении состава кишечной микробиоты и изменении концентрации её активных метаболитов нарушаются процессы синтеза и секреции инкретиновых гормонов, нарушается гомеостаз углеводов и жиров в организме, изменяются процессы центральной регуляции аппетита, развивается хроническое воспаление и инсулинорезистентность периферических тканей. В данном обзоре обсуждаются возможные пути нарушения синтеза инкретиновых гормонов и инкретинового эффекта у пациентов с сахарным диабетом 2 типа через призму кишечной микробиоты и её активных метаболитов и рассматриваются возможные пути коррекции измененного состава кишечной микробиоты препаратами инкретинового ряда. Поиск литературы проводился по базам данных Scopus, PubMed, Web of Science.
Ключевые слова
Для цитирования:
Демидова Т.Ю., Лобанова К.Г., Короткова Т.Н., Харчилава Л.Д. Абнормальная кишечная микробиота и нарушение инкретинового эффекта как причины развития сахарного диабета 2 типа. Медицинский вестник Юга России. 2022;13(1):24-42. https://doi.org/10.21886/2219-8075-2022-13-1-24-42
For citation:
Demidova T.Y., Lobanova K.G., Korotkova T.N., Kharchilava L.D. Abnormal gut microbiota and impaired incretin effect as a cause of type 2 diabetes mellitus. Medical Herald of the South of Russia. 2022;13(1):24-42. (In Russ.) https://doi.org/10.21886/2219-8075-2022-13-1-24-42
Введение
Кишечная микробиота (КМ) — это совокупность микроорганизмов, обитающих в желудочно-кишечном тракте (ЖКТ). В зависимости от происхождения, общности генотипа и выполняемых функций КМ классифицируется на 12 типов, 709 родов и 2172 вида [1]. К основным типам КМ относят Firmicutes, Bacteroidetes, Actinobacteria, Proteobacteria, Fusobacteria и Verrumicrobia. При этом распространенность Firmicutes достигает 60–80%, Bacteroidetes — 20–30%, Actinobacteria — 10%, Proteobacteria, Fusobacteria и Verrumicrobia — менее 1% [2]. Наиболее часто представленными родами бактерий в кишечнике метаболически здорового человека являются Bacteroides, Prevotella, Ruminococcus, Escherichia, Enterococcus, Clostridium, Faecalibacterium, Coprococcus, Roseburia, Bifidobacterium, Lactobacillus и некоторые другие [3]. Несмотря на то, что основная таксономическая единица КМ — вид, в настоящее время имеются трудности в идентификации бактерий на видовом уровне. Дело в том, что в качестве определения таксономического состава КМ как правило используется 16-рРНК секвенирование метагенома человека. Данный метод базируется на сравнении полученных в результате исследования нуклеотидных последовательностей с эталонными базами данных, наиболее распространенными из которых являются SILVA, GreenGenes и RDP. Важно, что таксономическая классификация кишечных бактерий динамически обновляется и дополняется. При этом нередко одни представители КМ мигрируют из одного рода в другой, так как отсутствуют четкие критерии гомологии нуклеотидной последовательности бактерий на уровне вида. Это затрудняет идентификацию бактерий на видовом уровне. Поэтому наиболее часто при оценке функциональных возможностей КМ ориентируются на представленность тех или иных родов бактерий в образцах стула [4][5].
Свои функции КМ осуществляет за счет активных метаболитов, к которым относят серотонин, индол, вторичные жёлчные кислоты (ВЖК), сероводород (H2S) и короткоцепочечные жирные кислоты (КЦЖК) [2]. Важно отметить, что КМ выполняет не только пищеварительную функцию. Она также контролирует процессы дифференцировки, роста и апоптозаколоноцитов, обеспечивает защиту кишечного эпителия от эндотоксинов и патогенных микроорганизмов посредством активации синтеза ряда интерлейкинов (ИЛ), таких как ИЛ-10, ИЛ-8 и ИЛ-22, обеспечивает непроницаемость кишечного барьера для провоспалительных молекул и липополисахаридов (ЛПС) грамотрицательных бактерий, влияет на образование витаминов группы В и витамин К, обеспечивает деконьюгацию жёлчных кислот, регулирует аппетит через систему «кишечник-мозг-периферия». Немаловажными функциями КМ являются активация синтеза инкретиновых гормонов и участие в гомеостазе углеводов и липидов в организме [4].
Инкретиновые гормоны — это гормоны ЖКТ, синтезирующиеся энтероэндокринными клетками (ЭЭК) и стимулирующие выработку инсулина. К классическим представителям инкретиновых гормонов относят глюкозозависимый инсулинотропный полипептид (ГИП), вырабатываемый К-клетками, и глюкагоноподобный пептид-1 (ГПП-1), вырабатываемый L-клетками кишечника [6]. Как ГИП, так и ГПП-1 связываются со своими рецепторами на поверхности β-клеток поджелудочной железы (ПЖЖ) и стимулируют высвобождение инсулина. Оба гормона инактивируются ферментом дипептидилпептидаза-4 (ДПП-4), который образуется в щеточной каемке энтероцитов и эндотелиальных клеток кишечника [7].
Помимо инсулинотропного действия инкретиновые гормоны обладают рядом других эффектов. На уровне ПЖЖ ГИП и ГПП-1 стимулируют пролиферацию и ингибируют апоптоз β-клеток. К отличительным эффектам ГПП-1 относят подавление секреции глюкагона в то время, как ГИП стимулирует высвобождение данного гормона α-клетками ПЖЖ [8]. По отношению к липидному обмену известно, что ГИП в отличие от ГПП-1 способен усиливать кровоток в жировой ткани, подавлять липолиз и стимулировать липогенез [9]. Напротив, действие ГПП-1 ассоциировано со снижением веса через афферентные волокна n.vagus и замедление опорожнения желудка, а также за счет увеличения экспрессии гена анорексигенного проопиомеланокортина и угнетения синтеза грелина и других пептидов ответственных за чувство голода (нейропептида NPY и агаути-пептид) [10][11]. Более того, действие ГПП-1 связано с ингибированием активности ренин-ангиотензин-альдостероновой системы, натрийурезом и вазодилятацией, что определяет кардиопротективные и нефропротективные эффекты данного гормона. Также ГПП-1 и ГИП способны усиливать пролиферацию нейрональной ткани, тем самым осуществляя нейропротекцию и способствуя улучшению памяти. Отличительной особенностью ГИП является участие в процессах формирования костной ткани за счет увеличения активности остеобластов и ингибирования функциональной способности остеокластов [9][12]. Сравнительная характеристика ГПП-1 и ГИП представлена в табл. 1.
Таблица / Table 1
Сравнительная характеристика ГПП-1 и ГИП [9][12]
Comparative characteristics of GLP-1 and GIP [9][12]
|
Признак / Feature |
ГПП-1 / GLP-1 |
ГИП / GIP |
|
Биохимическая структура Biochemical structure |
Амидированный пептидиз 30 аминокислот Amidated 30 Amino Acid Peptide |
Неамидированный пептид из 42 аминокислот Неамидированный пептид из 42 аминокислот |
|
Выработка Production |
L-клетки, расположенные в дистальном отделе тонкой кишки и в толстой кишке L-cells located in the distal small intestine and in the colon |
К-клетки, расположенные в ДПК и проксимальном отделе тонкой кишки K-cells located in the duodenum and proximal small intestine |
|
Деградация Degradation |
Ферментом ДПП-4 DPP-4 enzyme |
Ферментом ДПП-4 DPP-4 enzyme |
|
Период полувыведения Half-life elimination |
1-2 мин 1-2 minutes |
7 мин 7 minutes |
|
Секреция инсулина |
↑ |
↑ |
|
Контроль процессов пролиферации и апоптоза β-клеток Control of the processes of proliferation and apoptosis of β-cells |
+ |
+ |
|
Секреция глюкагона Glucagon secretion |
↓ |
↑ |
|
Панкреатическая секреция соматостатина Pancreatic secretion of somatostatin |
↑ |
Вероятно, ↑ |
|
Усиление кровотока в жировой ткани Increased blood flow in adipose tissue |
- |
+ |
|
Подавление липолиза и активация липогенеза Suppression of lipolysis and activation of lipogenesis |
- |
+ |
|
Усиление депонирования липидов в подкожно-жировой клетчатке Enhancing the deposition of lipids in the subcutaneous fat |
- |
+ |
|
Активация афферентных волокон n.vagus Activation of n.vagus afferent fibers |
+ |
- |
|
Замедление опорожнения желудка Slower gastric emptying |
+ |
- |
|
Синтез желудочного и панкреатического соков Synthesisofgastricandpancreaticjuices |
↓ |
- |
|
Синтез грелина Ghrelin synthesis |
+ |
- |
|
Контроль центральной регуляции аппетита Control of central regulation of appetite |
+ |
Вероятно, + |
|
Синтез агаути-пептида Agauti peptide synthesis |
↓ |
Неизвестно |
|
Синтез нейропаптида NPY Synthesis of neuropaptide NPY |
↓ |
Неизвестно |
|
Снижение аппетита Decreased appetite |
+ |
- |
|
Масса тела Body mass |
↓ |
Вероятно, ↑ |
|
Нейропротекция Neuroprotection |
+ |
Вероятно, + |
|
Снижение активации РААС Decreased RAAS activation |
+ |
- |
|
Вазодилятация Vasodilation |
+ |
- |
|
Натрийурез Natriuresis |
+ |
- |
|
Кардиопротекция Cardioprotection |
+ |
- |
|
Нефропротекция Nephroprotection |
+ |
- |
|
Активность остеобластов Osteoblast activity |
- |
↑ |
|
Активность остеокластов Osteoclast activity |
- |
↓ |
Сокращения: ДПК — двенадцатиперстная кишка; РААС — ренин-ангиотензин-альдостероновая система.
Notes: "+" — has an effect; "-" — has no effect; ↑ — increase; ↓ — decrease.
Abbreviations: RAAS — renin-angiotensin-aldosterone system.
Важно, что КМ влияет на синтез как ГПП-1, так и ГИП посредством взаимодействия активных метаболитов, в первую очередь КЦЖК с рецепторами GPR43 (рецептор свободных жирных кислот 3 типа или FFAR3) и GPR41(рецептор свободных жирных кислот 2 типа или FFAR2), расположенными на поверхности ЭЭК кишечника [13].
Инкретиновый эффект как механизм контроля гликемии
Впервые в 1960-е гг. ряд исследователей независимо друг от друга предположили возможное влияние ЖКТ на гомеостаз углеводов после получения результатов о том, что пероральная нагрузка глюкозой по сравнению с внутривенной была ассоциирована с большим повышением уровня инсулина. Позже, в 1973 г., Джон Браун выделил биоактивный пептид из дуоденальной слизи свиньи, описал биохимическую структуру и установил его влияние на секрецию инсулина. Важной особенностью являлось то, что данная молекула увеличивала секрецию инсулина только на фоне сопутствующей гипергликемии, в связи с чем этот гормон был назван «ГИП». Затем в середине 1980-х гг. был выделен еще один гормон кишечника, который проявлял глюкагоноподобную реактивность и образовывался из проглюкагона, в связи с чем был назван «глюкагоном кишечника». Однако при детальном изучении химической структуры данного пептида с помощью секвенирования генов было выявлено две молекулы со схожей химической структурой, которым было присвоено название «ГПП-1» и «ГПП-2». Позже было установлено, что именно ГПП-1 обладал инсулинотропным эффектом и способностью подавлять секрецию глюкагона [14]. В 1986 г. Nauck M.A. и соавт. подтвердили ранее опубликованные данные о том, что пероральное и внутривенное введение глюкозы ассоциировано с одинаковой гипергликемиии, однако бóльшей секрецией инсулина при пероральной нагрузке глюкозой. Результатом данной работы было заключение о влиянии инкретиновых гормонов на поспрандиальный уровень гликемии, а «кишечный» механизм, посредством которого активировался синтез инсулина, был назван «инкретиновым эффектом» [15]. В настоящее время четко показано, что инкретиновый эффект описывает процесс стимуляции пероральной глюкозой синтеза ГПП-1 и ГИП, результатом которого является усиление секреторной активности β-клеток ПЖЖ. Важно, что внутривенное введение глюкозы не связано с увеличением плазменной концентрации инкретиновых гормонов и ассоциировано с более низким уровнем инсулина в крови [16].
У здоровых людей до 70% секретируемого поспрандиального инсулина осуществляется за счет инкретинового эффекта, другими словами, за счет действия инкретинов (ГПП-1 и ГИП). Секреция ГПП-1 осуществляется при захвате глюкозы натрий- глюкозным котранспортером 1 типа (НГЛТ-1) и увеличении концентрации ионов натрия в L-клетках, что опосредует деполяризацию клеточной мембраны и приводит к открытию кальциевых каналов и экзоцитозу везикул, содержащих ГПП-1 [17]. Важно, что аминокислоты (триптофан и фенилаланин) и КЦЖК также усиливают синтез ГПП-1. Однако в данном случае синтез гормона сопряжен с другими типами рецепторов на L-клетках: с GPR-142 для аминокислот [18] и с GPR43 и GPR41 для КЦЖК [19]. В настоящее время внутриклеточный путь синтеза и секреции ГПП-1 после связывания аминокислот со своими рецепторами не изучен [18]. При взаимодействии КЦЖК с GPR43 рецептором происходит активация Gq и Gi-пути. При связывании КЦЖК с GPR41 активируется только Gi-путь. После запуска Gi-пути ингибируется аденилатциклаза, что приводит к снижению цАМФ, увеличению ионов Са в клетке и синтезу ГПП-1. Инициирование Gq-пути приводит к активации фосфолипазы С и стимуляции образования трифосфатинозитола, повышающего уровень внутриклеточного Са, что приводит к запуску процесса экзоцитоза везикул, содержащих ГПП-1 [20].
Подобно L-клеткам, K-клетки также в составе клеточной мембраны имеют НГЛТ-1. Совместная абсорбция глюкозы и натрия, сопряженная с работой данных транспортеров, приводит к высвобождению ГИП через механизм, связанный с повышением внутриклеточного Са [21]. Более того, К-клетки на поверхности своей мембраны имеют рецепторы GPR43 и GPR41, активация которых запускает процессы секреции ГИП [22].
Важно, что секреция инкретиновых гормонов зависит от состава потребляемой пищи. Так, в исследовании, проведенном C.Herrmann и соавт., было выявлено, что пероральное введение глюкозы приводило к двухфазному высвобождению ГПП-1. Ранняя фаза секреции гормона начиналась через несколько минут после приема глюкозы и достигала пика через 30 мин., в то время как вторая фаза секреции достигала пика спустя 60 мин. после нагрузки глюкозой. Аналогичным образом отмечалось двухфазное высвобождение ГИП с пиком секреции через 5 и 45 мин. после пероральной нагрузки глюкозой. Параллельно увеличению уровня ГПП-1, и ГИП уже через 15 мин. после нагрузки глюкозой отмечалось увеличение концентрации инсулина в крови, что объяснялось развитием инкретинового эффекта. Также в данном исследовании прием жиров растительного происхождения (67 г кукурузного масла) был ассоциирован с продолжительным (> 120 мин) повышением уровня ГПП-1 в плазме, а прием 100 г галактозы и 25 г аминокислот приводил к увеличению концентрации ГПП-1 через 5 мин. после еды, с двумя пиками через 15 и 30 мин. Уровень ГИП на фоне данных пищевых нагрузок не изучался. Повышение уровня ГПП-1 на фоне приема жиров и аминокислот имело прямую зависимость с концентрацией инсулина в крови. Динамика глюкагона в крови не изучалась [23]. Однако другие исследования подтверждают, что повышение уровня ГПП-1 ассоциировано с прогрессивным снижением уровня глюкагона [24], а увеличение в крови ГИП – с увеличением концентрации глюкагона в крови [25]. Таким образом, в настоящее время определена роль как ГПП-1, так и ГИП в стимуляции секреции инсулина, а также выявлены стимулирующие эффекты ГИП и ингибирующие эффекты ГПП-1 в отношении секреции глюкагона.
Инкретиновый эффект ГПП-1 и ГИП осуществляется при взаимодействии данных гормонов со своими рецепторами, связанными с G-белком и расположенными на β-клетках ПЖЖ. При этом образуется внутриклеточная аденилатциклаза, которая в свою очередь активирует протеинкиназу А и обменный белок EPAK (цАМФ-связывающий протеин), активируемый цАМФ. В дальнейшем протеинкиназа А и EPAK способствуют транспорту ионов Са внутрь клетки посредством блокады калиевых каналов. Более того, EPAK стимулирует высвобождение эндогенного Са из эндоплазматического ретикулума. Повышение уровня Са в β-клетке ПЖЖ усиливает экзоцитоз и деградацию инсулиновых везикул, что приводит к секреции инсулина [9][26].
Также важно отметить роль инкретиновых гормонов в секреции глюкагона. При связывании ГИП со своим рецептором (GIPR) на α-клетках ПЖЖ в условиях гипо- и эугликемии за счет повышения внутриклеточной цАМФ, активации пути цАМФ/протеинкиназы А и повышения внутриклеточного Са, инициируется секреция глюкагона [27]. Напротив, эффекты ГПП-1 ассоциированы со снижением концентрации глюкагона в крови. Heer и соавт. была выдвинута гипотеза о том, что снижение секреции глюкагона ассоциировано с эффектами соматостатина, синтез которого увеличивается при связывании ГПП-1 со своим рецептором (GLP1R) на дельта-клетках ПЖЖ. Действительно инфузии высокоселективного антагониста рецепторов к соматостатину 2 типа полностью предотвращали ГПП-1 индуцированное ингибирование секреции глюкагона, в то время как инфузиимоноклональными антителами к соматостатину приводили к снижению уровня глюкагона в крови [27].
Нарушение инкретинового эффекта при сахарном диабете 2 типа
Точный механизм, в результате которого у пациентов с сахарным диабетом 2 типа (СД2) нарушается инкретиновый эффект, неизвестен. Однако можно предположить, что снижение синтеза инсулина у пациентов с хронической гипергликемией обусловлено либо изменением характера синтеза и секреции ГПП-1 и ГИП в ответ на потребляемые углеводы, белки и жиры, либо нарушением рецепторного взаимодействия данных гормонов со своими рецепторами на органах-мишенях, в том числе, наβ-клетках ПЖЖ [16].
В ходе изучения и сравнения уровня инкретиновых гормонов у лиц с СД2 по сравнению со здоровыми добровольцами были получены разрозненные результаты. Так, в ряде исследований было показано, что у лиц с предиабетом и СД2 секреция ГПП-1 снижалась на 20-30% [18][28–30]. При этом уровень ГПП-1 коррелировал с уровнем инсулина в крови [29][30]. Однако в других работах было продемонстрировано, что характер секреции ГПП-1 не различался между здоровыми пациентами и пациентами с СД2 [31][32]. Аналогично, по данным большинства исследований, не отмечалось каких-либо отличий в концентрации уровня ГИП у пациентов с нарушениями углеводного обмена по сравнению со здоровыми добровольцами на фоне пероральной нагрузки глюкозой [31][33][34][35]. С другой стороны, некоторые исследования демонстрировали как повышение [36], так и понижение [37] уровня ГИП у пациентов с предиабетом и СД2 по сравнению с лицами без углеводных нарушений. Возможно, противоречивые результаты касаемо характера изменения инкретиновых гормонов у пациентов с хронической гипергликемией частично могут объясняться разным индексом массы тела (ИМТ), выраженностью декомпенсации углеводного обмена и стажем СД2 пациентов, включенных в исследования.
В связи с наличием разрозненных данных касаемо концентрации инкретиновых гормонов у пациентов с СД2 вероятно нужно ориентироваться не столько на изолированный уровень ГИП и ГПП-1 в крови, сколько на динамику секреции и пики секреции данных гормонов. Так, по данным Tura и соавт., если у метаболически здоровых пациентов отмечалось резкое повышение уровня инкретинов сразу после орального глюкозотолерантного теста (ОГТТ) с пиком концентрации через 30 мин. и длительностью плато до 130 мин., то у пациентов с нарушенной толерантностью к глюкозе выявлялось более плавное повышение инкретинов в крови с пиковой концентрацией через 40 мин. и постепенным снижением уровня гормонов через 60 мин. после нагрузки глюкозой. Среди пациентов с СД2, несмотря на исходную, более высокую концентрацию инкретинов в крови, достоверно значимого повышения уровня инкретинов после ОГТТ не наблюдалось. При этом была выявлена прямая зависимость между уровнями инкретинов и гликемией во всех трех исследовательских группах, что говорит о нарушении инкретинового эффекта среди пациентов с СД2 [30].
Учитывая тот факт, что в литературе имеются данные о том, что характер секреции инкретиновых гормонов у пациентов с СД2 не обличается от здоровых [29][32][35][37][38], существуют 2 основные гипотезы о нарушении рецепторного ответа наинкретины на уровне β-клетки. Первая теория объясняет нарушение инкретинового эффекта у пациентов с СД2 уменьшением β-клеточной массы ПЖЖ, в связи с чем физиологическое повышение инкретиновых гормонов после приема пищи не способно увеличить продукцию инсулина. Другая точка зрения предполагает наличие рецепторных дефектов, а именно специфическое снижение экспрессии рецепторов ГИП/ГПП-1 или компонентов пострецепторной передачи сигнала данных гормонов у пациентов с СД2. Несмотря на существующие концепции, в настоящее время ни одна из них не была научно доказана или опровергнута [16]. Таким образом, несмотря на накопленные данные вопрос о патогенетических механизмах, нарушения инкретинового эффекта у пациентов с углеводными нарушениями в настоящее время остается открытым.
Влияние кишечной микробиоты на синтез инкретиновых гормонов
В настоящее время установлено, что КМ за счет своих посредников контролирует синтез ряда гормонов, таких как ГПП-1, ГПП-2, ГИП, пептида тирозин-тирозин (PYY), серотонина, холецистокинина, инсулина и др. [13]. С целью понимания патофизиологии развития углеводных нарушений более важной является оценка влияния КМ на синтез инкретиновых гормонов и инсулина.
Наибольший интерес в отношении синтеза инкретиновых гормонов представляют КЦЖК, так как они являются основными активными метаболитами КМ. КЦЖК образуются в процессе сахаролитической ферментации неперевариваемых углеводов (крахмал, инулин, целлюлоза, пектин, пшеничные и овсяные отруби) до образования пропионата, бутирата и ацетата [38]. Несмотря на то, что в настоящее время имеется ограниченное количество данных о роли конкретных представителей КМ в производстве КЦЖК, известно, что Bacteroidesuniformis, Bacteroidesvulgatus, Prevotellacopri, Roseburiainulinivorans, Eubacteriumhallii, Blautiaobeum, Coprococcuscatus, Akkermansiamuciniphila ассоциированы с продукцией пропионата [38][40]; Eubacteriumrectale, R.inulinivorans, Roseburiaintestinalis, Coprococcuseutactus, C.catus, Faecalibacteriumprausnitzii, Eubacteriumbiforme влияют на образование бутирата [38], а некоторые бактерии из типа Bacteroidetes и Bifidobacterium, принадлежащие к типу Actinobacteria, а также A.muciniphila из типа Verrucomicrobia связаны с образованием ацетата [39]. КЦЖК участвуют в контроле процессов пролиферации, дифференцировки и апоптозаколоноцитов, контролируют проницаемость кишечного барьера, обладают противовоспалительным потенциалом по отношению к эпителиальным клеткам кишечника [39]. Однако немаловажными свойствами КЦЖК являются их способности контролировать кишечный глюконеогенез, метаболизм углеводов и липидов, синтез инкретиновых гормонов и инсулина при связывании со своими рецепторами GPR41 и GPR43, расположенными на поверхности ЭЭК кишечника, печени, белой жировой ткани, скелетных мышц, β-клеток и α-клеток ПЖЖ [2, 39].
Несмотря на то, что все представители КЦЖК могут взаимодействовать с GPR41 и GPR43, наибольшим сродством по отношению к GPR41 обладают пропионат и бутират, к GPR43 — пропионат и ацетат [41]. Важно, что на поверхности L-клеток, вырабатывающих ГПП-1, K-клеток, секретирующих ГИП и -клеток, продуцирующих инсулин, экспрессируются как GPR41, так и GPR43 [42]. Таким образом, логично предположить, что все КЦЖК ассоциированы с синтезом инкретиновых гормонов и инсулина. Однако, по данным исследования Hua и соавт., связывание бутирата и пропионата с GPR41 не оказывало влияния на синтез ГПП-1 [7]. При этом после стимуляции пропионатом более низкая секреция ГПП-1 и РУУ наблюдалась среди мышей с отсутствием GPR43 на поверхности L-клеток [43], в связи с чем можно предположить ведущую роль GPR43 в контроле секреции ГПП-1. В отношении ГИП известно, что у мышей, получающих в качестве источника энергии мальтозу, отмечалось повышение его синтеза посредством связывания КЦЖК с GPR43. При этом увеличения концентрации в крови ГИП после связывания КЦЖК с GPR41 не отмечалось, что подтверждает ранее выдвинутое предположение о ведущей роли GPR43 в синтезе инкретинов [44]. Следовательно, можно сделать вывод о том, что на синтез ГПП-1 и ГИП преимущественно влияют пропионат и ацетат, так как они обладают большим сродством к рецептору GPR43. Однако в настоящее время имеются противоречивые данные о роли пропионата, ацетата и бутирата в синтезе инкретиновых гормонов. Так, в исследовании Psichas A. и соавт., проведенном на мышах, введение пропионата в ободочную кишку было ассоциировано с увеличением уровня ГПП-1 как в яремной, так и в воротной вене [43]. Однако, по данным Christiansen C.B. и соавт., на синтез ГПП-1 преимущественно влияли бутират и ацетат, в то время как пропионат действия на секрецию ГПП-1 не оказывал [45]. Ряд других исследований также подтверждали роль бутирата в синтезе инкретиновых гормонов за счет активации GPR43, что приводило к G-белок ассоциированному каскаду внутриклеточных реакций, направленных на повышение ионов кальция в L-клетках [46-48]. Таким образом, в настоящее время можно предположить, что бутират-зависимая активация GPR43ассоциирована с синтезом инкретиновых гормонов, в то время как эффекты ацетата и пропионатана на синтез ГПП-1 и ГИП еще предстоит выяснить.
Еще одним активным метаболитом КМ является Н2S. Н2S синтезируется как бактериями, которые участвуют в катаболизме цистеина (Fusobacterium, Clostridium, Escherichia, Salmonella, Klebsiella,Streptococcus, Desulfovibrio и Enterobacter), так и сульфатредуцирующими бактериями, такими как Desulfovibrio, Desulfobacter, Desulfobulbus и Desulfotomaculum. При этом доминантным родом является Desulfovibrio, который включает D.piger и D.desulfuricans [49].
H2S — это биоактивный газ, который играет регулирующую роль в моторике ЖКТ, секреции и абсорбции клеток кишечника, пролиферации и дифференцировке колоноцитов [50]. Более того, имеются данные, что Н2S влияя на L-клетки, может потенциировать синтез ГПП-1 [50][51]. В исследовании, проведенном Pichette J. и соавт., было показано, что через 4 недели кормления мышей пребиотиком хондроитинсульфатом на фоне обогащения КМ сульфатредуцирующими бактериями, в особенности D.Piger., отмечалось увеличение концентрации ГПП-1 в крови. Более того, в ходе данного исследования было обнаружено, что H2S-зависимая стимуляция секреции ГПП-1происходила за счет фосфолирирования митоген-активируемой протеинкиназы (путь p38 MAPK) и активации экзоцитоза ГПП-1, депонирующегося в L-клетках [52]. В настоящее время неизвестно, посредством активации каких клеточных рецепторов H2S регулирует процесс секреции инкретиновых гормонов, более того остается не до конца изучен механизм высвобождения ГПП-1 через путь p38 MAPK, однако полученные данные являются триггером изучения роли H2S в инкретиновом эффекте.
Также в процессе жизнедеятельности КМ, при бактериальном распаде триптофана образуется индол. Основными представителями КМ, ассоциированными с синтезом индола, являются Lactobacillus, Bifidobacteriumlongum, Bacteroidesfragilis, Parabacteroidesdistasonis, Clostridiumbartlettii, E. hallii [53]. Индол и его производные (индол-3-пропионат и индол-3-альдегид) участвуют в контроле барьерной функции кишечника, влияют на синтез противовоспалительных цитокинов (ИЛ-22), осуществляя иммунную функцию и защищая кишечный эпителий от патогенных микроорганизмов. Более того, индол является сигнальной молекулой для L-клеток, контролирующих синтез ГПП-1 [53]. Так, по данным Chimerel и соавт., кратковременное повышение концентрации индола в просвете кишечника ассоциировано с ингибированием K + каналов, расположенных на мембране L-клеток, и увеличением длительности потенциала действия, что в свою очередь опосредует усиленный транспорт ионов Ca2+ в клетку и стимулирует секрецию ГПП-1. С другой стороны, длительное воздействие индола на L-клетки замедляет выработку АТФ, блокируя НАДН-дегидрогеназу в митохондриях, что приводит к длительному и выраженному снижению секреции ГПП-1. Вероятнее всего оба этих процесса действуют параллельно друг другу, поддерживая ГПП-1 на определенном уровне [54].
Более того, имеются данные о влиянии ВЖК (дезоксихолевой и литохолевой) на синтез инкретинов. ВЖК образуются в толстом кишечнике за счет деконьюгации первичных жёлчных кислот (ПЖК) родами Clostridium, Bacteroides, Lactobacillus, Bifidobacterium и Enterococcus, относящимися к трем основным типам бактерий (Firmicutes, Bacteroidetes и Actinobacteria) [55]. Образованные ВЖК дают эффект при связывании с рецептором желчных кислот 5 типа (TGR5) и с рецептором фарнезоида X (FXR) [56]. Предположительно, активация TGR5 связана с индукцией цАМФ-зависимого повышения уровня кальция в L-клетках и увеличения секреции ГПП-1 [57][58][59], в то время как активация FXR ассоциирована со снижением уровня ГПП-1вкрови [60]. Так, по данным Trabelsi и соавт., на примере трансгенных мышей VENUS, которые экспрессировали репортерные гены FXR только в клетках, продуцирующих проглюкагон, показали, что активация FXR связана со снижением продукции и секреции ГПП-1 L-клетками за счет нарушения транскрипции гена проглюкагона (предшественник ГПП-1) и ингибирования процессов гликолиза и продукции АТФ в L-клетках кишечника [61]. Таким образом, активность TGR5 и FXR ассоциирована с разными эффектами по отношению к продукции и секреции инкретиновых гормонов. Важно, что наибольшей афинностью к FXR обладает хенодезоксихолевая кислота, которая является неконьюгированной ПЖК, тогда как наибольшим сродством с TGR5 обладают ВЖК (литохолевая и дезоксихолевая) [56], в связи с чем можно предположить, что концентрация ВЖК в толстом кишечнике напрямую связана с секрецией ГПП-1 и гомеостазом глюкозы в организме.
Роль кишечной микробиоты в нарушении синтеза инкретинов у пациентов с СД2
Изменение состава КМ у пациентов с СД2возникает в результате уменьшения альфа-разнообразия и дисбаланса кишечных бактерий на родовом и видовом уровнях, что в свою очередь приводит к уменьшению синтеза КЦЖК, индола, Н2S, ВЖК, участвующих в активации синтеза и секреции инкретиновых гормонов [62].
Важно отметить, что активные метаболиты КМ образуются в кишечнике под действием таких бактерий, как Bifidobacterium, Bacteroides, Faecalibacterium, Akkermansia, Roseburia, Prevotella, Ruminococus, Lactobacillus, Clostridium, Eubacterium, Desulfovibrio, Enterobacter, Coprococcus, Eubacterium, Streptococcus, Fusobacterium [38-40][49][53][55], которые, по данным большинства исследований, снижаются у пациентов с СД2 [44][63][64]. Так, по данным Zhang и соавт., у пациентов с СД2 по сравнению со здоровыми отмечается снижение представленности A.muciniphila, F.prausnitzii, Bacteroides [44]. В исследовании Sedighi и соавт. Bifidobacteria значительно реже встречаются среди пациентов с СД2 по сравнению со здоровыми добровольцами [63]. Gurung и соавт. обобщили данные 42 исследований, оценивающих состав КМ у пациентов с СД2, и выявили, что такие роды бактерий, как Bifidobacterium, Bacteroides, Faecalibacterium, Akkermansia, Roseburia и некоторые штаммы Lactobacillus отрицательно связаны с риском развития СД2, в то время как роды Ruminococcus, Fusobacterium и Blautia положительно ассоциированы с развитием углеводных нарушений [2].
Действительно, такие бактерии, как Bifidobacterium, Bacteroides, Faecalibacterium, Akkermansia, Roseburia и Lactobacillus принимают активное участие в образовании КЦЖК, способствуют деконьюгации жёлчных кислот в толстом кишечнике до образования ВЖК, контролируют процесс образования индола из триптофана, что определяет их возможность косвенно участвовать в синтезе инкретиновых гормонов [53][55]. Более того, перечисленные выше роды бактерий также участвуют в поддержании непроницаемости кишечного барьера для эндотоксинов и ЛПС, синтезируют противовоспалительные цитокины, поддерживают процессы дифференцировки и роста клеток кишечного эпителия, тем самым снижая риск развития системного воспаления, также являющегося триггером развития углеводных нарушений [2][65][66]. Напротив, у пациентов с СД2 на фоне повышения Fusobacterium nucleatum и Ruminococcus gnavus, резко увеличивается продукция провоспалительных цитокинов (ИЛ-1, ИЛ-6 и ФНО-α). Одновременно с гиперпродукцией провоспалительных белков у пациентов с СД2 нарушается проницаемость кишечного барьера. Совокупность этих двух факторов приводит к тому, что ИЛ-1, ИЛ-6, ФНО-α и ЛПС попадают в кровоток, приводя к развитию слабо выраженного системного воспаления [2]. Можно предположить, что провоспалительный потенциал у пациентов с углеводными нарушениями, который возникает при дисбалансе про- и противовоспалительных цитокинов, а также при снижении защитных механизмов КЦЖК по отношению к эпителиальным клеткам кишечника, предопределяет распространение воспалительного процесса не только за пределы кишечника, но и на L-клетки и К-клетки кишечника, приводя к их дисфункции и снижению продукции и синтеза ГПП-1 и ГИП, соответственно.
Важно, что у пациентов с углеводными нарушениями наблюдаются как изменения в составе КМ, так и снижение концентрации инкретиновых гормонов в крови, что в совокупности с другими патогенетическими путями (хроническое воспаление, дисфункция β-клеток ПЖЖ, инсулинорезистентность и др.) определяют риск развития СД2. Сравнение влияния КМ на углеводный обмен метаболически здорового человека и пациента с СД2 представлено на рис. 1.
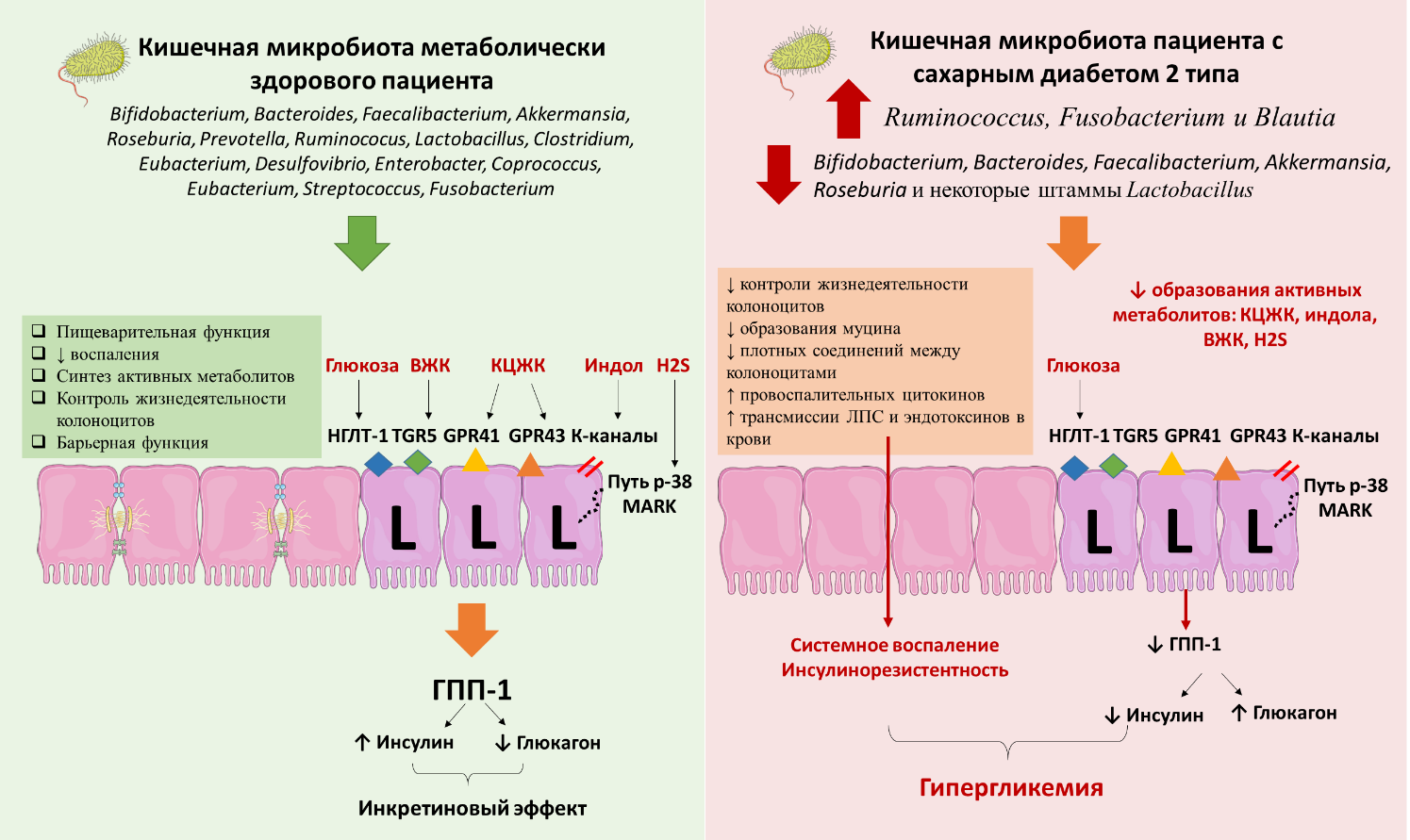
Рисунок 1. Сравнение влияния КМ на углеводный обмен метаболически здорового человека и пациента с СД2 [2][39-41][45][50][54][56][64][65].
Figure 1. Comparison of the effect of CM on carbohydrate metabolism in a metabolically healthy person and a patient with T2DM [2][39-41][45][50][54][56][64][65].
Инкретиновая терапия в лечении СД2: модуляция кишечной микробиоты
Приоритетность инкретиновой терапии у пациентов с СД2 объясняется патогенетической обоснованностью: при СД2 отмечается выраженное снижение инкретинового эффекта. По данным большинства опубликованных исследований, применение агонистов рецепторов ГПП-1 (арГПП-1) и ингибиторов ДПП-4 (иДПП-4) у пациентов с СД2 связано не только с нормализацией уровня гликемии, но и с изменением состава КМ (табл.2).
Таблица /Table 2
Модуляция кишечной микробиоты на фоне лечения препаратами инкретинового ряда
Modulation of intestinal microbiota during treatment with incretin drugs
|
Исследование/ Research |
Группа исследования / Study group |
Исследуемый препарат / Study drug |
Длительность лечения / Duration of treatment |
Изменение состава КМ / Change of Gutmicrobiota |
|
1. Olivares и соавт.[67] |
МышиC57BL / 6J с ожирением, вызванным диетой с избыточным содержанием жиров и углеводов, C57BL / 6J mice with obesity caused by a diet high in fat and carbohydrates, n = 27 |
Вилдаглиптин/Vildagliptin |
8 недель 8 weeks |
↑: Lactobacillus SPP ↓: Oscillibacter spp,
|
|
2. Zhang и соавт.[68] |
Крысы Цукера с СД2 были разделены на 4 группы в зависимости от получаемой терапии, n=32 Zucker rats with T2DM were divided into 4 groups depending on the therapy received, n = 32 |
I группа: 0,9% NaCl, (n=8) II группа: Метформин, (n=8) III группа: Ситаглиптин, (n=8) IV группа: Акарбоза, (n=8) I group: 0.9% NaCl, (n = 8) II group : Metformin, (n = 8) III group: Sitagliptin, (n = 8) IV group: Acarbose, (n = 8) |
4 недели/4 weeks |
Терапия Метформином и ситаглиптином/Metformin and sitagliptin therapy ↑:Lactobacillus Терапия акарбозой/Acarbose therapy: ↑:Ruminococcus, Bifidobacterium
|
|
3. ZhangQ и соавт.[69] |
Крысы Sprague-Dawleyc СД2, возникшим на фоне диеты с избыточным содержанием жиров, n=24 Sprague-Dawleyc rats T2DM on a high-fat diet n = 24 |
Вилдаглиптин / Vildagliptin |
12 недель / 12 weeks |
↑:Streptococcus; Bacteroides ↓: Oscillibacter, Ruminiclostridium_6, Anaerotruncus,Eubacterium_coprostanoligenes_group, Ruminococcace, Kurthia,Christensenellaceae_R_7_group,Prevotellaceae |
|
4. Zhang и соавт. [70] |
Крысы Sprague-Dawley с ожирением и СД2, индуцированным диетой с избыточным содержанием жиров и углеводов, n=15 Obese Sprague-Dawley rats with T2DM induced by a diet high in fat and carbohydrates, n = 15 |
Ситаглиптин / Sitagliptin |
12 недель / 12 weeks |
↑: Roseburia ↓: Blautia |
|
5. Paul M. Ryan PhD и соавт. [71]
|
Мыши C57BL / 6, которые в течение 24 нед. получали корм с избыточным содержанием жиров. В течениепоследних 12 нед. Животные получали ССТ, n=42 Mice C57BL / 6, which for 24 weeks. received food with an excess of fat. During the last 12 weeks. animals received CCT, n = 42 |
I группа: Метформин, (n=21) II группа: аналог вилдаглиптина - PKF-275-055, (n=21) I group: Metformin, (n = 21) II group: analogue of vildagliptin - PKF-275-055, (n = 21) |
12 недель / 12 weeks
|
Метформин / Metformin: ↑:Akkermansia, Parabacteroides, Christensenella PKF-275-055: ↑: Ruminococcus, Dorea |
|
6. Zhao L. и соавт. [72] |
Крысы с индуцированным диетой СД2 и ожирением, n=32 Rats with diet-induced type 2 diabetes and obesity, n = 32 |
Лираглутид / Liraglutid |
12 недель /12 weeks |
↑:Clostridia ↓: вид Bacteroides
|
|
7. Qian Zhang и соавт. [73] |
Крысы с индуцированным диетой СД2 и ожирением, n=36 Rats with diet-induced type 2 diabetes and obesity, n = 36
|
I группа: контроль, (n=18) II группа: Лираглутид (n=18) I group: control, (n = 18) II group: Liraglutide (n = 18) |
12 недель / 12 weeks |
Терапия лираглутидом / Liraglutid therapy: ↑:Bacteroides_acidifaciens и Lachnoclostridium ↓:Prevotella и Ruminococcaceae |
|
8. Qian Liu и соавт. [74]
|
Мыши с индуцированным диетой СД2, n=40 Mice with diet-induced type 2 diabetes, n = 40 |
Лираглутид / Liraglutid |
4 недели / 4 weeks |
↑: Akkermansia, Romboutsia, norank_f_Bacteroidales_S24-7_group ↓: Klebsiella1, Anaerotruncus, Bacteroides, Lachnospiraceae_UCG-001, Lachnospiraceae_NK4A136_group |
|
9. Moreira и соавт.[75] |
Мыши с индуцированным диетой СД2, n=17 Diet-induced T2DM mice, n = 17
|
Лираглутид / Liraglutid |
12 недель/12 weeks
|
↑:Akkermansia muciniphila ↓: Proteobacteria |
|
10. WangLи соавт. [76] |
Мыши с нормогликемией и гипергликемией, n=57. Mice with normoglycemia and hyperglycemia, n = 57.
|
n=9 — нормогликемия, контроль/normoglycemia, control n=10 — нормогликемия + саксаглиптин / normoglycemia + saxagliptin n=10 — нормогликемия + лираглутид /normoglycemia + liraglutide n=9 — гипергликеми, контроль / hyperglycemia, control n=9 — гипергликемия + саксаглиптин / hyperglycemia + saxagliptin n=9 –—гипергликемия + лираглутид / hyperglycemia + liraglutide |
8 недель/8 weeks |
Изменения в составе КМ на фоне терапии лираглутидом мышей с гипергликеемией по сравнению с нормогликемией/Changes in BM composition during liraglutide therapy in mice with hyperglycemia versus normoglycemia: ↑: Turicibacter, Blautia, Lactobacillus. ↓: Erysipelotrichaceae Incertae Sedis, Marvinbryantia, Roseburia, Candidatus Arthomitus, Parabacteroides ИзменениявсоставеКМнафонетерапиисаксаглиптиноммышейсгипергликеемиейпосравнениюснормогликемией/Changes in BM composition during saxagliptin therapy in mice with hyperglycemia versus normoglycemia: ↑:Turicibacter, Lactobacillus, Allobaculum ↓:Candidatus Arthromitus |
|
11. Sandra Mrozinska и соавт.[77] |
Пациенты с СД2, n=19. Пациенты с MODY-3, n=5 Patients with type 2 diabetes, n = 19. Patients with MODY-3, n = 5 |
I группа: Линаглиптин, n=9 II группа: препараты сульфонилмочевины, n=15 I group: Linagliptin, n = 9 II group: sulfonylurea preparations, n = 15
|
4 недели/4 weeks |
Изменения состава КМ на фоне терапии линаглиптином и препаратами сульфонилмочевины не наблюдалось / No changes in gut microbiota composition were observed during therapy with linagliptin or sulfonylureas |
|
12. ZhangWan и соавт. [78] |
Пациенты с СД2, n=37. Patients with type 2 diabetes, n = 37
|
I группа: Метформин, n=18 II группа: Лираглутид, n=19 I group: Metformin, n = 18 II group: Liraglutide, n = 19 |
6 недель / 6 weeks |
Метформин / Metformin: ↑: Sutterella, Dorea
Лираглутид / Liraglutide ↑: Akkermansia и неизвестный род семейства Christensenellaceae / Akkermansia and unknowngenus Christensenellaceae |
|
13. Shang и соавт. [79] |
Пациенты с СД2, n=40 Patients with type 2 diabetes, n = 40 |
Лираглутид / Liraglutide |
4 месяца / 4 momths |
↑:Collinsella, Akkermansia и Clostridium на уровне рода/at the genus level; ↓: Clostridium на уровне семейства/at the family level |
|
14. Smits и соавт. [80] |
Пациенты с СД2, ранее получавшие метформин или препараты сульфанилмочевины в течение как минимум 3 мес., которые были переведены на соответствующую терапию, n=51 Patients with type 2 diabetes who previously received metformin or sulfonylureas for at least 3 months who were transferred to appropriate therapy, n = 51 |
I группа: плацебо, n=17 II группа: Лираглутид, n=17 III группа: Ситаглиптин, n=17
I group: placebo, n = 17 II group: Liraglutide, n = 17 III group: Sitagliptin, n = 17 |
12 недель / 12 weeks |
Изменений состава КМ по сравнению с группой плацебо на фоне терапии ситаглиптином или лираглутидом выявлено не было
Изменений состава КМ по сравнению с группой плацебо на фоне терапии ситаглиптином или лираглутидом выявлено не было |
Note: ↓ — decrease in the presence of bacteria in stool samples; ↑ — increase in the presence of bacteria in stool samples.
Обращает на себя внимание закономерность повышения Lactobaccilus [67][68][76] и A. Muciniphila [74][75][78][79] как на фоне терапии иДПП-4, так и на фоне терапии арГПП-1.Несомненно, увеличение представленности данных бактерий способствует улучшению метаболических эффектов КМ. Так, действие отдельных штаммов Lactobaccilus сосредоточено на ферментации сложных углеводов до образования КЦЖК и ВЖК, снижении инсулинорезистентности периферических тканей за счет увеличения экспрессии переносчиков глюкозы 4 типа (GLUT-4), снижении активности альфа-гликозидаз [2][66][81]. В свою очередь деятельность A.muciniphila сосредоточена на защите кишечного эпителия за счет продукции муцина и ГПП-2, поддержании непроницаемости кишечного барьера, образовании КЦЖК и окислении жирных кислот [2][65]. Также Lactobaccilus и A.muciniphila косвенно связаны с функциональной активностью L-клеток и К-клеток кишечника и синтезом инкретиновых гормонов за счет эффектов КЦЖК, ВЖК и индола [2][53][55].
Таким образом, терапия иДПП-4 и арГПП-1 возможно ассоциирована с улучшением состава КМ за счет увеличения концентрации бактерий, продуцирующих активные метаболиты, эффекты которых в свою очередь направлены на предотвращение развития системного метаболического воспаления и поддержание синтеза инкретиновых гормонов. Однако стоит отметить, что в настоящее время в литературе имеется ограниченное количество исследований, оценивающих модификацию КМ на фоне терапии препаратами инкретинового ряда. Более того, имеющиеся исследования в большинстве своем проведены на лабораторных животных или характеризуются малой выборкой пациентов, в связи с чем сложно судить о закономерностях в изменении состава КМ на фоне проводимого лечения. Тем не менее полученные данные побуждают к проведению дальнейших исследований, направленных не только на оценку характера изменения КМ на фоне проводимого лечения, но и на изучение эффективности и безопасности ССТ, в том числе, препаратов инкретинового ряда, в зависимости от исходного состава КМ. Данные результаты, возможно, позволят определить индивидуальный подход к пациентам с углеводными нарушениями в зависимости от состава КМ и разработать предсказательную модель эффективности и безопасности основных групп сахароснижающих препаратов (ССП).
Заключение
Абнормальная КМ и снижение инкретинового эффекта являются звеньями патогенеза СД2. Однако точные механизмы, посредством которых развиваются нарушения выработки ГПП-1, ГИП и инсулина у пациентов с измененной КМ, в настоящее время не до конца известны. Можно предположить, что более детальное изучение патофизиологических аспектов влияния КМ и её активных метаболитов на продукцию инкретиновых гормонов позволит в будущем разработать новые подходы к стартовой терапии СД2 и внедрить новые классы препаратов, действие которых будет ассоциировано с активацией рецепторов, с которыми связываются активные метаболиты КМ на поверхности L-клеток и K-клеток кишечника. Примером таких препаратов могут служить агонисты рецепторов TGR5, так как при активации данных рецепторов ВЖК гипотетически должна увеличиваться секреция ГПП-1. Таким образом, необходимы дальнейшие исследования, посвященные изучению патогенетических путей развития нарушений инкретинового эффекта у пациентов с измененным составом КМ на фоне углеводных нарушений, исследования, направленные на оценку эффективности и безопасности ССТ в зависимости от исходного состава КМ, исследования, характеризующие динамику изменений КМ в зависимости от получаемой ССТ и исследования, направленные на изучение взаимодействий активных метаболитов КМ со своими рецепторами на ЭЭК, что могло бы в будущем позволить разработать новые группы ССП.
Список литературы
1. . Th ursby E, Juge N. Introduction to the human gut microbiota. Biochem J. 2017;474(11):1823-1836. DOI: 10.1042/BCJ20160510.
2. Gurung M, Li Z, You H, Rodrigues R, Jump DB, et al. Role of gut microbiota in type 2 diabetes pathophysiology. EBioMedicine. 2020;51:102590. DOI: 10.1016/j.ebiom.2019.11.051.
3. Lloyd-Price J, Abu-Ali G, Huttenhower C. Th e healthy human microbiome. Genome Med. 2016;8(1):51. DOI: 10.1186/s13073-016-0307-y
4. Кожевников А.А., Раскина К.В., Мартынова Е.Ю., Тяхт А.В., Перфильев А.В., и др. Кишечная микробиота: современные представления о видовом составе, функциях и методах исследования. РМЖ. 2017;25(17):1244-1247. eLIBRARY ID: 30397484
5. Schmidt TS, Matias Rodrigues JF, von Mering C. Ecological consistency of SSU rRNA-based operational taxonomic units at a global scale. PLoS Comput Biol. 2014;10(4):e1003594. DOI: 10.1371/journal.pcbi.1003594
6. Sternini C, Anselmi L, Rozengurt E. Enteroendocrine cells: a site of ‘taste’ in gastrointestinal chemosensing. Curr Opin Endocrinol Diabetes Obes. 2008;15(1):73-8. DOI: 10.1097/MED.0b013e3282f43a73
7. Müller TD, Finan B, Bloom SR, D’Alessio D, Drucker DJ, et al. Glucagon-like peptide 1 (GLP-1). Mol Metab. 2019;30:72-130. DOI: 10.1016/j.molmet.2019.09.010
8. D’Alessio D. Is GLP-1 a hormone: Whether and When? J Diabetes Investig. 2016;7 Suppl 1(Suppl 1):50-5. DOI: 10.1111/jdi.12466
9. Holst JJ. Th e incretin system in healthy humans: Th e role of GIP and GLP-1. Metabolism. 2019;96:46-55. DOI: 10.1016/j.metabol.2019.04.014.
10. Howick K, Griffi n BT, Cryan JF, Schellekens H. From Belly to Brain: Targeting the Ghrelin Receptor in Appetite and Food Intake Regulation. Int J Mol Sci. 2017;18(2):273. DOI: 10.3390/ijms18020273
11. Тихоненко Е.В., Цой У.А., Васильева Е.Ю., Бабенко А.Ю. Характеристики пищевого поведения и уровень гормонов, регулирующих аппетит, у пациентов с сахарным диабетом 2 типа и индексом массы тела выше 35 кг/м2. Ожирение и метаболизм. 2018;15(1):30-38. DOI: 10.14341/omet2018130-38
12. Цыганкова О.В., Веретюк В.В., Аметов А.С. Инкретины сегодня: множественные эффекты и терапевтический потенциал. Сахарный диабет. 2019;22(1):70-78. DOI: 10.14341/DM9841
13. Демидова Т.Ю., Лобанова К.Г., Ойноткинова О.Ш. Кишечная микробиота как эндокринный орган. Ожирение и метаболизм. 2020;17(3):299-306. DOI: 10.14341/omet12457
14. Rehfeld JF. Th e Origin and Understanding of the Incretin Concept. Front Endocrinol (Lausanne). 2018;9:387. DOI: 10.3389/fendo.2018.00387
15. Nauck MA, Homberger E, Siegel EG, Allen RC, Eaton RP, et al. Incretin eff ects of increasing glucose loads in man calculated from venous insulin and C-peptide responses. J Clin Endocrinol Metab. 1986;63(2):492-8. DOI: 10.1210/jcem-63-2-492
16. Nauck MA, Quast DR, Wefers J, Pfeiff er AFH. Th e evolving story of incretins (GIP and GLP-1) in metabolic and cardiovascular disease: A pathophysiological update. Diabetes Obes Metab. 2021;23 Suppl 3:5-29. DOI: 10.1111/dom.14496
17. Smith NK, Hackett TA, Galli A, Flynn CR. GLP-1: Molecular mechanisms and outcomes of a complex signaling system. Neurochem Int. 2019;128:94-105. DOI: 10.1016/j.neuint.2019.04.010
18. Pala L, Ciani S, Dicembrini I, Bardini G, Cresci B, et al. Relationship between GLP-1 levels and dipeptidyl peptidase-4 activity in diff erent glucose tolerance conditions. Diabet Med. 2010;27(6):691-5. DOI: 10.1111/j.1464-5491.2010.03010.x
19. Rask E, Olsson T, Söderberg S, Holst Jj Jj, Tura A, et al. Insulin secretion and incretin hormones aft er oral glucose in nonobese subjects with impaired glucose tolerance. Metabolism. 2004;53(5):624-31. DOI: 10.1016/j.metabol.2003.11.011
20. Kimura I, Ichimura A, Ohue-Kitano R, Igarashi M. Free Fatty Acid Receptors in Health and Disease. Physiol Rev. 2020;100(1):171-210. DOI: 10.1152/physrev.00041.2018
21. Röder PV, Geillinger KE, Zietek TS, Th orens B, Koepsell H, Daniel H. Th e role of SGLT1 and GLUT2 in intestinal glucose transport and sensing. PLoS One. 2014;9(2):e89977. DOI: 10.1371/journal.pone.0089977
22. Tazoe H, Otomo Y, Karaki S, Kato I, Fukami Y, et al. Expression of short-chain fatty acid receptor GPR41 in the human colon. Biomed Res. 2009;30(3):149-56. DOI: 10.2220biomedres.30.149
23. Herrmann C, Göke R, Richter G, Fehmann HC, Arnold R, Göke B. Glucagon-like peptide-1 and glucose-dependent insulinreleasing polypeptide plasma levels in response to nutrients. Digestion. 1995;56(2):117-26. DOI: 10.1159/000201231
24. Ramracheya R, Chapman C, Chibalina M, Dou H, Miranda C, et al. GLP-1 suppresses glucagon secretion in human pancreatic alpha-cells by inhibition of P/Q-type Ca2+ channels. Physiol Rep. 2018;6(17):e13852. DOI: 10.14814/phy2.13852
25. El K, Gray SM, Capozzi ME, Knuth ER, Jin E, et al. GIP mediates the incretin eff ect and glucose tolerance by dual actions on α cells and β cells. Sci Adv. 2021;7(11):eabf1948. DOI: 10.1126/sciadv.abf1948
26. Reed J, Bain S, Kanamarlapudi V. Recent advances in understanding the role of glucagon-like peptide 1. F1000Res. 2020;9:F1000 Faculty Rev-239. DOI: 10.12688/f1000research.20602.1
27. de Heer J, Rasmussen C, Coy DH, Holst JJ. Glucagon-like peptide-1, but not glucose-dependent insulinotropic peptide, inhibits glucagon secretion via somatostatin (receptor subtype 2) in the perfused rat pancreas. Diabetologia. 2008;51(12):2263-70. DOI: 10.1007/s00125-008-1149-y
28. Ahrén B, Carr RD, Deacon CF. Incretin hormone secretion over the day. Vitam Horm. 2010;84:203-20. DOI: 10.1016/B978-0-12-381517-0.00007-2
29. Tura A, Bagger JI, Ferrannini E, Holst JJ, Knop FK, et al. Impaired beta cell sensitivity to incretins in type 2 diabetes is insuffi ciently compensated by higher incretin response. Nutr Metab Cardiovasc Dis. 2017;27(12):1123-1129. DOI: 10.1016/j.numecd.2017.10.006
30. Tura A, Muscelli E, Gastaldelli A, Ferrannini E, Mari A. Altered pattern of the incretin eff ect as assessed by modelling in individuals with glucose tolerance ranging from normal to diabetic. Diabetologia. 2014;57(6):1199-203. DOI: 10.1007/s00125-014-3219-7
31. Knop FK, Vilsbøll T, Madsbad S, Holst JJ, Krarup T. Inappropriate suppression of glucagon during OGTT but not during isoglycaemic i.v. glucose infusion contributes to the reduced incretin eff ect in type 2 diabetes mellitus. Diabetologia. 2007;50(4):797-805. doi: 10.1007/s00125-006-0566-z
32. Kozawa J, Okita K, Imagawa A, Iwahashi H, Holst JJ, et al. Similar incretin secretion in obese and non-obese Japanese subjects with type 2 diabetes. Biochem Biophys Res Commun. 2010;393(3):410-3. DOI: 10.1016/j.bbrc.2010.01.134
33. Laakso M, Zilinskaite J, Hansen T, Boesgaard TW, Vänttinen M, et al. Insulin sensitivity, insulin release and glucagonlike peptide-1 levels in persons with impaired fasting glucose and/or impaired glucose tolerance in the EUGENE2 study. Diabetologia. 2008;51(3):502-11. DOI: 10.1007/s00125-007-0899-2
34. Oh TJ, Kim MY, Shin JY, Lee JC, Kim S, et al. Th e incretin eff ect in Korean subjects with normal glucose tolerance or type 2 diabetes. Clin Endocrinol (Oxf). 2014;80(2):221-7. DOI: 10.1111/cen.12167
35. Yabe D, Kuroe A, Watanabe K, Iwasaki M, Hamasaki A, et al. Early phase glucagon and insulin secretory abnormalities, but not incretin secretion, are similarly responsible for hyperglycemia aft er ingestion of nutrients. J Diabetes Complications. 2015;29(3):413-21. DOI: 10.1016/j.jdiacomp.2014.12.010
36. Th eodorakis MJ, Carlson O, Muller DC, Egan JM. Elevated plasma glucose-dependent insulinotropic polypeptide associates with hyperinsulinemia in impaired glucose tolerance. Diabetes Care. 2004;27(7):1692-8. DOI: 10.2337/diacare.27.7.1692
37. Faerch K, Vaag A, Holst JJ, Glümer C, Pedersen O, BorchJohnsen K. Impaired fasting glycaemia vs impaired glucose tolerance: similar impairment of pancreatic alpha and beta cell function but diff erential roles of incretin hormones and insulin action. Diabetologia. 2008;51(5):853-61. DOI: 10.1007/s00125-008-0951-x
38. Louis P, Flint HJ. Formation of propionate and butyrate by the human colonic microbiota. Environ Microbiol. 2017;19(1):2941. DOI: 10.1111/1462-2920.13589
39. Parada Venegas D, De la Fuente MK, Landskron G, González MJ, Quera R, et al. Short Chain Fatty Acids (SCFAs)-Mediated Gut Epithelial and Immune Regulation and Its Relevance for Infl ammatory Bowel Diseases. Front Immunol. 2019;10:277. DOI: 10.3389/fimmu.2019.00277. Erratum in: Front Immunol. 2019;10:1486.
40. Reichardt N, Duncan SH, Young P, Belenguer A, McWilliam Leitch C, et al. Phylogenetic distribution of three pathways for propionate production within the human gut microbiota. ISME J. 2014;8(6):1323-35. DOI: 10.1038/ismej.2014.14. Erratum in: ISME J. 2014;8(6):1352.
41. Bilotta AJ, Cong Y. Gut microbiota metabolite regulation of host defenses at mucosal surfaces: implication in precision medicine. Precis Clin Med. 2019;2(2):110-119. DOI: 10.1093/pcmedi/pbz008
42. Mishra SP, Karunakar P, Taraphder S, Yadav H. Free Fatty Acid Receptors 2 and 3 as Microbial Metabolite Sensors to Shape Host Health: Pharmacophysiological View. Biomedicines. 2020;8(6):154. DOI: 10.3390/biomedicines8060154
43. Psichas A, Sleeth ML, Murphy KG, Brooks L, Bewick GA, et al. Th e short chain fatty acid propionate stimulates GLP-1 and PYY secretion via free fatty acid receptor 2 in rodents. Int J Obes (Lond). 2015;39(3):424-9. DOI: 10.1038/ijo.2014.153
44. Lee EY, Zhang X, Miyamoto J, Kimura I, Taknaka T, et al. Gut carbohydrate inhibits GIP secretion via a microbiota/SCFA/ FFAR3 pathway. J Endocrinol. 2018;239(3):267-276. DOI: 10.1530/JOE-18-0241
45. Christiansen CB, Gabe MBN, Svendsen B, Dragsted LO, Rosenkilde MM, Holst JJ. Th e impact of short-chain fatty acids on GLP-1 and PYY secretion from the isolated perfused rat colon. Am J Physiol Gastrointest Liver Physiol. 2018;315(1):G53-G65. DOI: 10.1152/ajpgi.00346.2017
46. Gérard C, Vidal H. Impact of Gut Microbiota on Host Glycemic Control. Front Endocrinol (Lausanne). 2019;10:29. DOI: 10.3389/fendo.2019.00029
47. Tolhurst G, Heff ron H, Lam YS, Parker HE, Habib AM, et al. Short-chain fatty acids stimulate glucagon-like peptide-1 secretion via the G-protein-coupled receptor FFAR2. Diabetes. 2012;61(2):364-71. DOI: 10.2337/db11-1019
48. Gao Z, Yin J, Zhang J, Ward RE, Martin RJ, et al. Butyrate improves insulin sensitivity and increases energy expenditure in mice. Diabetes. 2009;58(7):1509-17. DOI: 10.2337/db08-1637
49. Blachier F, Andriamihaja M, Larraufi e P, Ahn E, Lan A, Kim E. Production of hydrogen sulfi de by the intestinal microbiota and epithelial cells and consequences for the colonic and rectal mucosa. Am J Physiol Gastrointest Liver Physiol. 2021;320(2):G125-G135. DOI: 10.1152/ajpgi.00261.2020. Erratum in: Am J Physiol Gastrointest Liver Physiol. 2021;320(4):G484.
50. Xiao A, Liu C, Li J. The Role of H2S in the Gastrointestinal Tract and Microbiota. Adv Exp Med Biol. 2021;1315:67-98.: 10.1007/978-981-16-0991-6_4
51. Verbeure W, van Goor H, Mori H, van Beek AP, Tack J, van Dijk PR. Th e Role of Gasotransmitters in Gut Peptide Actions. Front Pharmacol. 2021;12:720703. DOI: 10.3389/fphar.2021.720703
52. Pichette J, Fynn-Sackey N, Gagnon J. Hydrogen Sulfi de and Sulfate Prebiotic Stimulates the Secretion of GLP1 and Improves Glycemia in Male Mice. Endocrinology. 2017;158(10):3416-3425. DOI: 10.1210/en.2017-00391
53. Zhang LS, Davies SS. Microbial metabolism of dietary components to bioactive metabolites: opportunities for new therapeutic interventions. Genome Med. 2016;8(1):46. DOI: 10.1186/s13073-016-0296-x
54. Chimerel C, Emery E, Summers DK, Keyser U, Gribble FM, Reimann F. Bacterial metabolite indole modulates incretin secretion from intestinal enteroendocrine L cells. Cell Rep. 2014;9(4):1202-8. DOI: 10.1016/j.celrep.2014.10.032
55. Winston JA, Th eriot CM. Diversifi cation of host bile acids by members of the gut microbiota. Gut Microbes. 2020;11(2):158171. DOI: 10.1080/19490976.2019.1674124
56. Xie C, Huang W, Young RL, Jones KL, Horowitz M, et al. Role of Bile Acids in the Regulation of Food Intake, and Th eir Dysregulation in Metabolic Disease. Nutrients. 2021;13(4):1104. DOI: 10.3390/nu13041104
57. Ma Q, Li Y, Li P, Wang M, Wang J, et al. Research progress in the relationship between type 2 diabetes mellitus and intestinal fl ora. Biomed Pharmacother. 2019;117:109138. DOI: 10.1016/j.biopha.2019.109138
58. Kaska L, Sledzinski T, Chomiczewska A, Dettlaff -Pokora A, Swierczynski J. Improved glucose metabolism following bariatric surgery is associated with increased circulating bile acid concentrations and remodeling of the gut microbiome. World J Gastroenterol. 2016;22(39):8698-8719. DOI: 10.3748/wjg.v22.i39.8698
59. Parker HE, Wallis K, le Roux CW, Wong KY, Reimann F, Gribble FM. Molecular mechanisms underlying bile acidstimulated glucagon-like peptide-1 secretion. Br J Pharmacol. 2012;165(2):414-23. DOI: 10.1111/j.1476-5381.2011.01561.x
60. Li P, Zhu L, Yang X, Li W, Sun X, et al. Farnesoid X receptor interacts with cAMP response element binding protein to modulate glucagon-like peptide-1 (7-36) amide secretion by intestinal L cell. J Cell Physiol. 2019;234(8):12839-12846. DOI: 10.1002/jcp.27940
61. Trabelsi MS, Daoudi M, Prawitt J, Ducastel S, Touche V, et al. Farnesoid X receptor inhibits glucagon-like peptide-1 production by enteroendocrine L cells. Nat Commun. 2015;6:7629. DOI: 10.1038/ncomms8629
62. Cunningham AL, Stephens JW, Harris DA. Gut microbiota infl uence in type 2 diabetes mellitus (T2DM). Gut Pathog. 2021;13(1):50. DOI: 10.1186/s13099-021-00446-0
63. Sedighi M, Razavi S, Navab-Moghadam F, Khamseh ME, Alaei-Shahmiri F, et al. Comparison of gut microbiota in adult patients with type 2 diabetes and healthy individuals. Microb Pathog. 2017;111:362-369. DOI: 10.1016/j.micpath.2017.08.038
64. Zhao L, Lou H, Peng Y, Chen S, Zhang Y, Li X. Comprehensive relationships between gut microbiome and faecal metabolome in individuals with type 2 diabetes and its complications. Endocrine. 2019;66(3):526-537. DOI: 10.1007/s12020-019-02103-8
65. Pascale A, Marchesi N, Govoni S, Coppola A, Gazzaruso C. Th e role of gut microbiota in obesity, diabetes mellitus, and eff ect of metformin: new insights into old diseases. Curr Opin Pharmacol. 2019;49:1-5. DOI: 10.1016/j.coph.2019.03.011
66. Gu Y, Wang X, Li J, Zhang Y, Zhong H, et al. Analyses of gut microbiota and plasma bile acids enable stratifi cation of patients for antidiabetic treatment. Nat Commun. 2017;8(1):1785. DOI: 10.1038/s41467-017-01682-2
67. Olivares M, Neyrinck AM, Pötgens SA, Beaumont M, Salazar N, et al. Th e DPP-4 inhibitor vildagliptin impacts the gut microbiota and prevents disruption of intestinal homeostasis induced by a Western diet in mice. Diabetologia. 2018;61(8):1838-1848. DOI: 10.1007/s00125-018-4647-6
68. Zhang M, Feng R, Yang M, Qian C, Wang Z, et al. Eff ects of metformin, acarbose, and sitagliptin monotherapy on gut microbiota in Zucker diabetic fatty rats. BMJ Open Diabetes Res Care. 2019;7(1):e000717. DOI: 10.1136/bmjdrc-2019-000717
69. Zhang Q, Xiao X, Li M, Yu M, Ping F, et al. Vildagliptin increases butyrate-producing bacteria in the gut of diabetic rats. PLoS One. 2017;12(10):e0184735. DOI: 10.1371/journal.pone.0184735
70. Yan X, Feng B, Li P, Tang Z, Wang L. Microfl ora Disturbance during Progression of Glucose Intolerance and Eff ect of Sitagliptin: An Animal Study. J Diabetes Res. 2016;2016:2093171. DOI: 10.1155/2016/2093171
71. Ryan PM, Patterson E, Carafa I, Mandal R, Wishart DS, et al. Metformin and Dipeptidyl Peptidase-4 Inhibitor Diff erentially Modulate the Intestinal Microbiota and Plasma Metabolome of Metabolically Dysfunctional Mice. Can J Diabetes. 2020;44(2):146-155.e2. DOI: 10.1016/j.jcjd.2019.05.008
72. Zhao L, Chen Y, Xia F, Abudukerimu B, Zhang W, et al. A Glucagon-Like Peptide-1 Receptor Agonist Lowers Weight by Modulating the Structure of Gut Microbiota. Front Endocrinol (Lausanne). 2018;9:233. DOI: 10.3389/fendo.2018.00233
73. Zhang Q, Xiao X, Zheng J, Li M, Yu M, et al. Featured article: Structure moderation of gut microbiota in liraglutide-treated diabetic male rats. Exp Biol Med (Maywood). 2018;243(1):3444. DOI: 10.1177/1535370217743765
74. Liu Q, Cai BY, Zhu LX, Xin X, Wang X, et al. Liraglutide modulates gut microbiome and attenuates nonalcoholic fatty liver in db/db mice. Life Sci. 2020;261:118457. DOI: 10.1016/j.lfs.2020.118457
75. Moreira GV, Azevedo FF, Ribeiro LM, Santos A, Guadagnini D, et al. Liraglutide modulates gut microbiota and reduces NAFLD in obese mice. J Nutr Biochem. 2018;62:143-154. DOI: 10.1016/j.jnutbio.2018.07.009
76. Wang L, Li P, Tang Z, Yan X, Feng B. Structural modulation of the gut microbiota and the relationship with body weight: compared evaluation of liraglutide and saxagliptin treatment. Sci Rep. 2016;6:33251. DOI: 10.1038/srep33251
77. Mrozinska S., Gosiewski T., Sroka-Oleksiak A., Szopa M, Bulanda M., et al. Th e eff ect of linagliptin treatment on gut microbiota in patients with HNF1A-MODY or type 2 diabetes — a preliminary cohort study. Clinical Diabetology. 2019;8(6):263-270. DOI: 10.5603/DK.2019.0024
78. Wang Z, Saha S, Van Horn S, Th omas E, Traini C, Sathe G, et al. Gut microbiome diff erences between metformin- and liraglutide-treated T2DM subjects. Endocrinol Diabetes Metab. 2017;1(1):e00009. DOI: 10.1002/edm2.9
79. Shang J, Liu F, Zhang B, Dong K, Lu M, et al. Liraglutideinduced structural modulation of the gut microbiota in patients with type 2 diabetes mellitus. PeerJ. 2021;9:e11128. DOI: 10.7717/peerj.11128
80. Smits MM, Fluitman KS, Herrema H, Davids M, Kramer MHH, et al. Liraglutide and sitagliptin have no eff ect on intestinal microbiota composition: A 12-week randomized placebocontrolled trial in adults with type 2 diabetes. Diabetes Metab. 2021;47(5):101223. DOI: 10.1016/j.diabet.2021.101223
81. Allin KH, Nielsen T, Pedersen O. Mechanisms in endocrinology: Gut microbiota in patients with type 2 diabetes mellitus. Eur J Endocrinol. 2015;172(4):R167-77. DOI: 10.1530/EJE-14-0874
Об авторах
Т. Ю. ДемидоваРоссия
Демидова Татьяна Юльевна - доктор медицинских наук, профессор, зав. кафедрой эндокринологии лечебного факультета.
Москва
Конфликт интересов:
нет
К. Г. Лобанова
Россия
Лобанова Кристина Геннадьевна - ассистент кафедры эндокринологии лечебного факультета.
Москва
Конфликт интересов:
нет
Т. Н. Короткова
Россия
Короткова Татьяна Николаевна - заведующий лабораторией клинической биохимии, иммунологии и аллергологии.
Москва
Конфликт интересов:
нет
Л. Д. Харчилава
Россия
Харчилава Лия Джаникоевна - клинический ординатор кафедры эндокринологии лечебного факультета.
Москва
Конфликт интересов:
нет
Рецензия
Для цитирования:
Демидова Т.Ю., Лобанова К.Г., Короткова Т.Н., Харчилава Л.Д. Абнормальная кишечная микробиота и нарушение инкретинового эффекта как причины развития сахарного диабета 2 типа. Медицинский вестник Юга России. 2022;13(1):24-42. https://doi.org/10.21886/2219-8075-2022-13-1-24-42
For citation:
Demidova T.Y., Lobanova K.G., Korotkova T.N., Kharchilava L.D. Abnormal gut microbiota and impaired incretin effect as a cause of type 2 diabetes mellitus. Medical Herald of the South of Russia. 2022;13(1):24-42. (In Russ.) https://doi.org/10.21886/2219-8075-2022-13-1-24-42







































