Перейти к:
Сосудистые аномалии, визуализированные при мультиспиральной компьютерной томографии органов брюшной полости, - случайные находки или непосредственные причины возникновения болевого синдрома? (тематический обзор)
https://doi.org/10.21886/2219-8075-2021-12-4-34-45
Аннотация
Патология ветвей брюшной аорты может вызывать абдоминальную ишемию, прогрессирующие патологические изменения органов брюшной полости на этом фоне и хронический болевой синдром. Причины возникновения хронического абдоминального синдрома ишемического характера можно разделить на атеросклеротические и «неатеросклеротические». Атеросклероз непарных ветвей брюшной аорты подразумевает стеноз или окклюзию артериального сосуда. Другие причины включают фиброзно-мышечную дисплазию, васкулиты (Такаясу, сегментарный артериальный медиолиз) и синдром внешней компрессии чревного ствола. Эти синдромы (патогенез некоторых из них остается спорным) приводят к возникновению неспецифических жалоб, таких как боли в животе, потеря веса и т.д. Цифровая субтракционная ангиография или дуплексное ультразвуковое исследование могут предоставить гемодинамическую информацию в случаях сосудистой патологии этой области. Однако спиральная компьютерная томография во многих случаях является методом первого выбора, так как позволяет проводить комплексную оценку состояния сосудов и связанных с ней морфологических изменений внутренних органов. Структурные изменения, сопровождающие эти синдромы, могут также встречаться у пациентов, которые проходят обследование по другим причинам. Однако диагностику этих синдромов не следует проводить исключительно на основании результатов визуализации, следует сопоставлять выявленные находки с клиникой, что подразумевает тесный контакт лучевого диагноста и клинициста.
Ключевые слова
Для цитирования:
Арутюнова Н.К., Арасланова Л.В., Рябченко В.А., Писаренко Е.А., Тер-Ананьянц Е.И. Сосудистые аномалии, визуализированные при мультиспиральной компьютерной томографии органов брюшной полости, - случайные находки или непосредственные причины возникновения болевого синдрома? (тематический обзор). Медицинский вестник Юга России. 2021;12(4):34-45. https://doi.org/10.21886/2219-8075-2021-12-4-34-45
For citation:
Arutiunova N.K., Araslanova L.V., Riabchenko V.A., Pisarenko E.A., Ter-Ananiants E.I. Vascular abnormalities visualized by multislice computed tomography of the abdomen: accidental findings or immediate causes of pain syndrome? (topic review). Medical Herald of the South of Russia. 2021;12(4):34-45. (In Russ.) https://doi.org/10.21886/2219-8075-2021-12-4-34-45
Введение
Синдром хронической абдоминальной ишемии (СХАИ), клинически проявляющийся порой неспецифическими жалобами на абдоминальную боль, возникающую после еды, потерю веса, адаптирующий режим питания пациентов, при дальнейшем развитии может прогрессировать в острую мезентериальную ишемию — довольно опасное и часто смертельное осложнение. Тем не менее СХАИ остаётся недооцененной, часто недиагностированной и недолеченной болезнью, в основном из-за отсутствия соответствующей осведомленности в медицинском сообществе. Увеличение продолжительности жизни, частоты сердечно-сосудистых заболеваний среди пожилого населения, метаболических нарушений, вероятно, будут способствовать увеличению частоты СХАИ. Современные возможности лучевой диагностики, расширение показаний к исследованию увеличили вероятность более ранней и максимально точной диагностики заболевания и шансы на успешный исход лечения.
Цель обзора — осветить состояние проблемы СХМИ и современных возможностей лучевой диагностики, мультиспиральной компьютерной томографии с внутривенным болюсным контрастированием (МСКТ с БУ) или мультиспиральной компьютерной ангиографии (МСКТ-А) для выработки междисциплинарных алгоритмов мониторинга данной группы пациентов, а также сопоставить данные о наиболее изученных аномалиях сосудов брюшной полости с их клинической картиной, анатомией и патогенезом, определить основные паттерны в помощь врачам лучевой диагностики, а также терапевтам, гастроэнтерологам, сосудистым хирургам и врачам общей практики и подчеркнуть ключевые моменты для эффективного взаимодействия лучевого диагноста и врачей других специальностей при работе с данной группой пациентов.
Методы
Систематический обзор опубликованных исследований выполнялся в соответствии со стандартными рекомендациями. Поиск литературы в электронных базах данных проводился преимущественно в течение последних десяти лет по англоязычным и русскоязычным публикациям, включая системы PubMed, Google scholar, Google books, Ciberleninka. Поиск проводился, согласно вопросам, отвечающим цели исследования. Поисковые запросы в англоязычной версии включали сhronic mesenteric ischemia, multiclice spiral computed tomography angiography, atherosclerosis, fibromuscular dysplasia, vasculitis, median arcuate ligament syndrome, в русскоязычных системах — синдром хронической абдоминальной ишемии, мультиспиральная компьютерно-томографическая ангиография, атеросклероз, фиброзно-мышечная дисплазия, васкулиты, синдром внешней компрессии чревного ствола. Отбор статей проводился по четырём направлениям, таким как атеросклероз непарных ветвей брюшной аорты, фиброзно-мышечная дисплазия, васкулиты, синдром внешней компрессии чревного ствола. Перед включением статьи были проверены на предмет методологической обоснованности.
Сложности диагностики СХАИ связаны с неспецифическим характером симптомов, таких как боль в животе, потеря массы, нарушение стула, тошнота и других [1].
Выбирая оптимальный метод диагностики СХАИ, следует подчеркнуть, что широко используемое ультразвуковое исследование, помимо визуализации паренхиматозных органов, позволяет также определить кровоток в сосудах, однако его применение ограничено в случаях, похожих на ишемическую сосудистую патологию брюшной полости, так как оно не даёт возможность оценить коллатеральный кровоток, состояние паренхиматозных органов в условиях болюсного контрастирования, состояние стенки кишечника [1][2].
МСКТ с БУ или МСКТ-А признаны методами визуализации первой линии из-за её скорости, широкой доступности и способности диагностировать альтернативные причины боли в животе [3].
Техника исследования будет варьироваться в зависимости от выбранного протокола.
Описание данного метода исследования
Пациент получает 500–800 мл перорального контрастного вещества (воды) для контрастирования желудка и тонкой кишки. В локтевую вену (18–20G) с помощью инжектора вводят 100–120 мл йод-содержащего контраста со скоростью 4–5 мл/сек. для адекватной оценки артериальной и венозной систем. Артериальную фазу (через 25–30 секунд после введения контрастного вещества) изображения получают от уровня выше чревного ствола до уровня общих подвздошных артерий, фазу воротной вены (через 60–70 сек. после введения контрастного вещества), получают от уровня выше диафрагмы до уровня ниже уровня лобкового сочленения [4][5].
Сбор и анализ данных изображения анализируются на специальной рабочей станции, используя двухмерные (2D) многоплоскостные изображения, а также проекцию максимальной интенсивности (MIP) и объемный рендеринг (VR) для 3D-изображений сосудов [6][7].
Интерпретация изображения МСКТ-А оценивается на предмет наличия стеноза или окклюзии артерии. Например, окклюзия сосуда определяется как полное отсутствие контрастирования просвета, гемодинамически значимый стеноз сосудов определяется как уменьшение диаметра просвета >50%, гемодинамически незначимый стеноз определяется как уменьшение диаметра просвета <50% [6].
Есть и другая точка зрения. У пациентов с симптомами абдоминальной ишемии с поражением одного сосуда чревного ствола или верхней брыжеечной артерии стеноз ≥70% может считаться значимым. У симптомных пациентов с обширным поражением верхней брыжеечной артерии и ее ветвей стеноз ≥50% может считаться значимым [8].
К наиболее распространенным вторичным признакам ишемии на компьютерно-томографических изображениях относятся утолщение стенки кишечника, очаговое отсутствие контрастирование стенок кишечника, дилатация кишечника, асцит, пневматоз кишечника, свободный газ в брюшной полости, инфаркт паренхиматозных органов [8]. Общими противопоказаниями для проведения МСКТ с БУ относятся беременность предыдущие тяжелые реакции на контрастные вещества клаустрофобия, отсутствие контакта с пациентом [7][9][10].
Прямого сравнения методов визуализации МСКТ с БУ и магнитно-резонансной томографии (МРТ) для брыжеечных сосудов не публиковалось, но для почечных артерий было показано превосходство МСКТ-А над МРТ-ангиографией с контрастным усилением [9]. Чувствительность МСКТ-ангиографии для диагностики мезентериальной ишемии 100%, специфичность 95–100% [1].
Основные причины СХАИ
Хронический ишемический абдоминальный синдром включает ишемию вследствие стеноза или окклюзии сосуда, васкулиты (эндоартериит Такаясу, сегментарный артериальный медиолиз (САМ)), синдром компрессии чревного ствола [11].
Основная причина возникновения боли — ишемия внутренних органов вследствие как прямого ишемического воздействия с последующим высвобождением медиаторов боли, так и «синдрома обкрадывания», с сопутствующими патогенетическими механизмами возникновения боли [12][13].
Атеросклеротические изменения брыжеечных артерий
Наиболее частой причиной хронической ишемии кишечника является атеросклеротическая окклюзия или тяжелый стеноз брыжеечных артерий. Стеноз >50% присутствует у 18% пациентов старше 65 лет, однако только часть из них имеют симптомы [14].
Примерно у 50% пациентов c атеросклеротическим поражением периферических сосудов или сосудов сердца определяется поражение непарных ветвей брюшной аорты [15]. Так по данным G. Krishnamurthy et al. у 20,4% пациентов с ишемической болезнью сердца при ангиографии выявляются клинически значимые стенозы двух и более мезентериальных артерий [16]. Частота атеросклероза ветвей брюшной аорты у пациентов с атеросклерозом артерий нижних конечностей оценена в небольшом количестве работ, по некоторым данным она достигает 60–100% и коррелирует с выраженностью стеноза в обоих сосудистых бассейнах [17][18].
Симптомы чаще возникают после еды, что связано с усилением кровотока и определяются классической клинической триадой, состоящей из постпрандиальной абдоминальной боли, потери веса и отказа от пищи, которая присутствует почти у половины пациентов с хронической ишемией брыжейки [19][20]. Три основные непарные артерии, которые отходят от брюшной аорты, — чревный ствол, верхняя брыжеечная артерия (ВБА) и нижняя брыжеечная артерия (НБА). Поскольку коллатеральное кровообращение присутствует на нескольких уровнях, пациенты могут не испытывать симптомов даже при стенозах в нескольких артериях одновременно. Когда ВБА окклюзирована, панкреатодуоденальные артерии снабжают кишечник через печеночные и гастродуоденальные артерии, при окклюзии чревного ствола и ВБА кровоснабжение тонкого кишечника происходит из бассейна НБА через левую колическую ветвь. Симптомы обычно возникают при стенозе и/или окклюзии двух или более сосудов, хотя существуют и исключения из этого правила [21][22].
Диагностика при КТ-ангиографии обычно не вызывает затруднений. Чаще атеросклеротические отложения локализуются в устье чревного ствола и верхней брыжеечной артерии [22].
Клинический пример из архива авторов представлен на рис. 1.
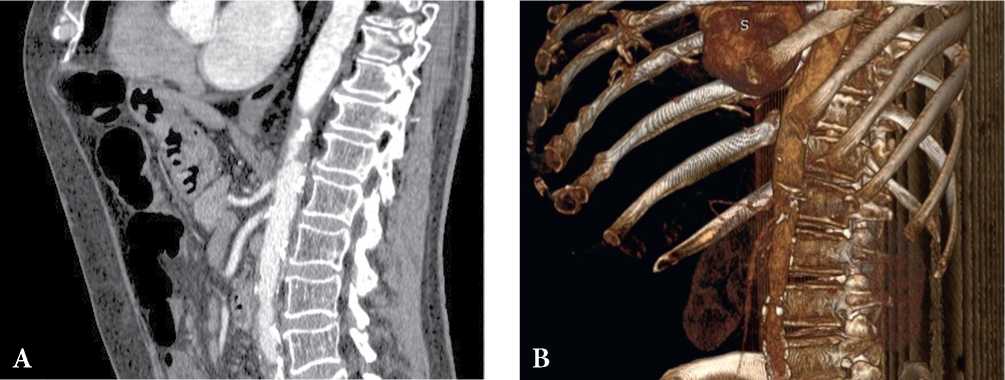
Рисунок 1. КТ-признаки атеросклеротического стеноза чревного ствола и верхней брыжеечной артерии. Пациент, 64 лет, боли в животе, неустойчивый стул. Стеноз чревного ствола до 60%, стеноз верхней брыжеечной артерии до 60% (A, B). Данные из архива авторов.
Figure 1. СТ findings are consistent with atherosclerotic stenosis of the celiac trunk and superior mesenteric artery. Patient, 64 years old, abdominal pain, diarrhea. Сeliac trunk stenosis up to 60%, superior mesenteric artery stenosis up to 60% (A, B). The authors' archive data.
Фиброзно-мышечная дисплазия
К неатеросклеротическим причинам структурных изменений сосудистой стенки относится фиброзно-мышечная дисплазия (ФМД) — редкая, но хорошо известная причина хронической ишемии брыжейки [23].
ФМД представляет собой гетерогенную группу сосудистых поражений, характеризующихся идиопатической, невоспалительной и неатеросклеротической ангиопатиями артерий малых и средних размеров [23][24]. Распространённость данного заболевания неизвестна. Чаще всего встречается у молодых женщин в возрасте от 30 до 50 лет [25][26].
ФМД может протекать бессимптомно. При наличии симптомов таковые чаще связаны с патологией почечных артерий (гипертензия или недостаточность из-за стеноза почечной артерии) вследствие поражения сонной и позвоночной артерий (пульсирующий шум в ушах, транзиторная ишемическая атака, инсульт), поражения коронарной артерии (стенокардия, инфаркт [26][27][28]. Выраженные клинические проявления ишемии брыжейки, инфаркт брыжейки, возникают редко, из-за развития коллатерального кровоснабжения [28].
Структурные изменения стенки связаны с фиброзным или фиброзно-мышечным её утолщением. Может быть поражен любой слой стенки сосуда — интима, медиа или адвентиция, без признаков воспаления [25][26][29][30].
Наиболее часто, в 90–95% случаев, поражается медиа. В результате развивается стеноз артерии, чаще — на коротком протяжении, с участками расширения (небольшие аневризмы). Реже возникает равномерный стеноз стенки сосуда. ФМД «ослабляет» стенку сосуда, что предрасполагает к формированию расслоений [26][31].
Может поражать любую артерию среднего калибра, чаще характеризуется двухсторонней локализацией (например, при поражении почечных артерий) с вовлечением нескольких артерий. Осложнения — самопроизвольное расслоение, дистальная эмболизация (тромба, образовавшегося при аневризме), кровоизлияние. Золотым стандартом диагностики ФМД остаётся цифровая субтракционная ангиографии, поскольку позволяет визуализировать небольшие или периферические поражения. Характерным признаком, особенно у более распространенного медиального подтипа, является чередование стенозов и дилатаций, вызывающих формирование рентгенологического симптома «нити бус». Реже, при интимальном и адвентициальном типах, имеется очаговый концентрический стеноз протяжённых сегментов или дивертикулярное выпячивание. Преимуществом применения МСКТ и МРТ является возможность оценить ишемическое повреждение органов брюшной полости [28][31][32].
Типичные ангиографические признаки включают сосудистые петли, веретенообразную сосудистую эктазию, симптом «нити бус», стенозы. На рис. 2 приведен пример картины ФМД из архива авторов.
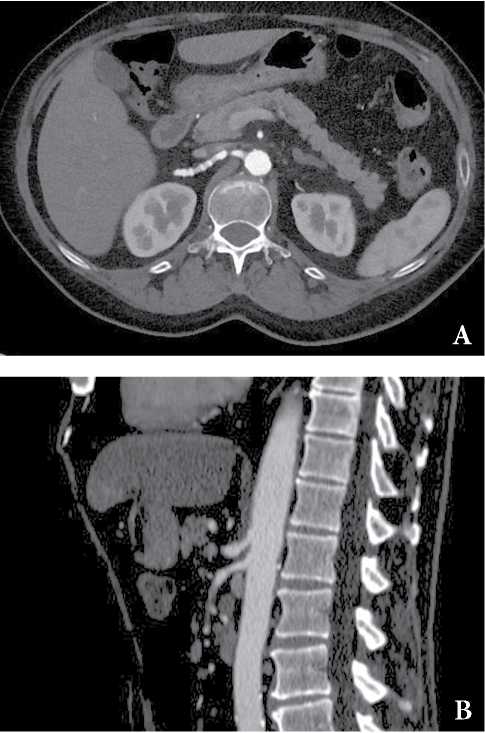
Рисунок 2. КТ-картина фиброзно-мышечной дисплазии (ФМД) с вовлечением почечных артерии, аневризмой чревного ствола (A) и стенозом верхней брыжеечной артерии (B) у пациента 65 лет с признаками абдоминальной ишемии. Данные из архива авторов.
Figure 2. СТ findings are consistent with fibromuscular dysplasia (FMD) renal arteries (A), celiac trunk aneurysm and stenosis of the superior mesenteric artery in a 65-year-old patient with symptoms (B). The authors' archive data.
Дифференциальный диагноз при визуализации включает атеросклероз, обычно в начале или в проксимальной части артерии — васкулиты, повышенное СОЭ +/- лихорадка, травматическое ятрогенное повреждение сосудов (вероятен сегментарный артериальный медиолиз) [26][28][31].
Артериит Такаясу
Среди васкулитов и заболеваний соединительной ткани наиболее частым состоянием, вызывающим хроническую абдоминальную ишемию является артериит Такаясу [33]. Артериит Такаясу (АТ), также известный как идиопатическая артериопатия, представляет собой гранулематозный васкулит крупных сосудов, который преимущественно поражает аорту и её основные ветви, также могут вовлекаться легочные и коронарные артерии [34][35]. Точная причина неизвестна, однако считается, что эта патология похожа на гигантоклеточный артериит. Среди больных преобладают женщины (<50 лет). Типичный возраст манифестации симптомов 15–30 лет. Некоторые исследователи отмечают факты географического совпадения случаев туберкулеза и артериита Такаясу, что предполагает наличие связи между ними. Возможно, туберкулез вызывает иммуноопосредованную реакцию крупных сосудов. Эта гипотеза, тем не менее, остается спорной [34].
Классификация артериита Такаясу (Numano) [36]:
- Тип I — поражение только ветвей дуги аорты.
- Тип Iiа — поражение восходящего отдела и/или дуги аорты. Ветви дуги аорты также могут быть поражены. Остальная часть аорты не поражена.
- Тип Iib — поражение нисходящего отдела грудной аорты с/без поражения восходящего отдела и дуги аорты или ее ветвей. Брюшная аорта не поражена.
- Тип III — поражение нисходящего отдела грудной аорты, брюшной аорты и/или почечных артерий. Восходящий отдел и дуга аорты с ее ветвями не поражены.
- Тип IV — поражение только брюшной аорты и/или почечных артерий.
- Тип V — генерализованный тип, сочетание признаков других типов.
Поражение коронарных и лёгочных артерий должно обозначаться в виде С(+) или Р(+) соответственно.
Клиническая картина включает разнообразные ишемические симптомы из-за стеноза или тромбообразования. Начальные проявления обычно манифестируют с недомогания, лихорадки, ночного потоотделения, потери веса и артралгии. Часто возникает анемия с повышенными маркерами воспаления. Эта фаза постепенно проходит с началом хронической фазы, которая характеризуется воспалительными и облитерирующими изменениями в аорте и ее ветвях. Периферический пульс часто снижается или отсутствует, что дало ему альтернативное название «болезнь без пульса».
КТ-картина представляет равномерное, протяжённое утолщение стенки, в активной острой фазе может присутствовать усиленное контрастирование стенок, стенозы, окклюзии основных ветвей аорты, аневризматическая дилатация аорты или ее ветвей формирование псевдоаневризмы [37][38][39].
На рисунке 3 приведен пример КТ-картины артериита Такаясу.
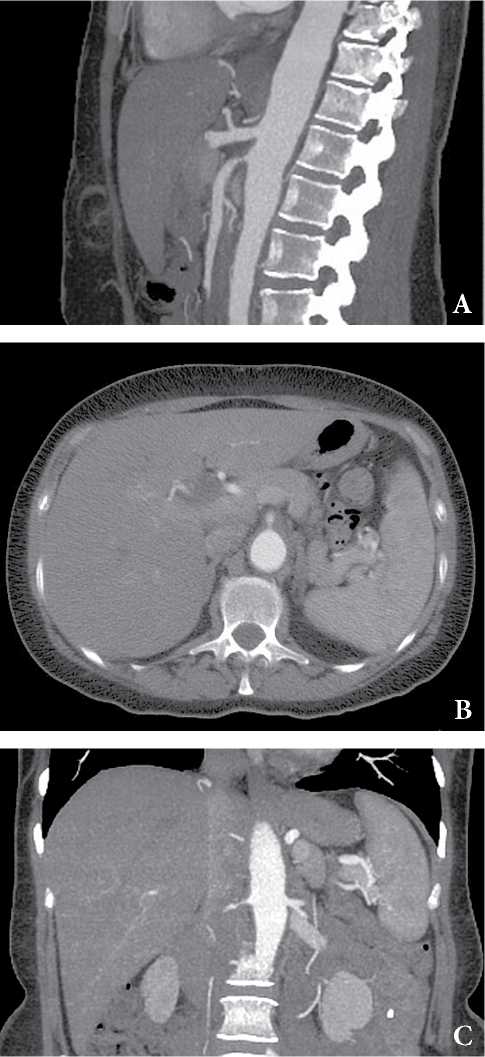
Рисунок 3. КТ-признаки артериита Такаясу. Пациентка, 37лет, перемежающаяся боль в животе. Признаки утолщения стенки грудной и брюшной аорты (A), стеноз до 60% ВБА (A, B) и правой почечной артерии (C). Случай любезно предоставлен доктором Мэтью Лукисом, Radiopaedia.org, rID: 52141.
Figure 3. СТ-findings are consistent with Takayasu arteritis. Fimale, 50 y.o. Intermittent abdomen pain. Wall thickening of the abdominal aorta, approximatly 60% stenosis of the superior mesenteric artery (A) and right renal artery (C). Case courtesy of Dr Matthew Lukies, Radiopaedia.org, rID: 52141.
Артериальный сегментарный медиолиз
К группе редких васкулитов, приводящих к хронической абдоминальной ишемии, относится также сегментарный артериальный медиолиз (САМ) — редкая артериопатия [9]. Основным гистологическим процессом САМ является лизис гладкой мускулатуры артериальной стенки, что приводит к интрамуральному кровоизлиянию, мешковидным или расслаивающим аневризмам, тромбозу и кровоизлиянию [40][41].
САМ чаще всего поражает ветви среднего размера верхней брыжеечной артерии. Этиология неизвестна, но наблюдалась связь с эпизодами сужения внутренних сосудов (например, шок, гипоксия, недавняя обширная операция, инфузия вазопрессоров) [40][42][43]. Существует некоторое гистологическое сходство с ФМД, которая является дифференциальным диагнозом, но клинические признаки и распределение поражения обычно характерны.
В последнее время количество случаев увеличилось благодаря более широкому использованию компьютерной томографической ангиографии и повышению осведомленности в радиологическом сообществе. Заболеваемость может достигать 1 на 100 000 в год [40][43].
Типичны боли в животе, вздутие, в тяжёлых случаях шок, падение гематокрита. У пациентов среднего возраста с нетравматическим спонтанным брыжеечным кровоизлиянием сегментарный артериальный медиолиз является наиболее вероятной первопричиной. Смертность в острых случаях составляет 50% [43].
КТ-картина характеризуется веретенообразными аневризмами, стенозами, расслоениями и окклюзиями артерий. Характерна последовательность аневризм и стенозов, вид «нити бус», распределение имеет тенденцию избегать бифуркаций [42].
Пример представлен на рисунке 4.
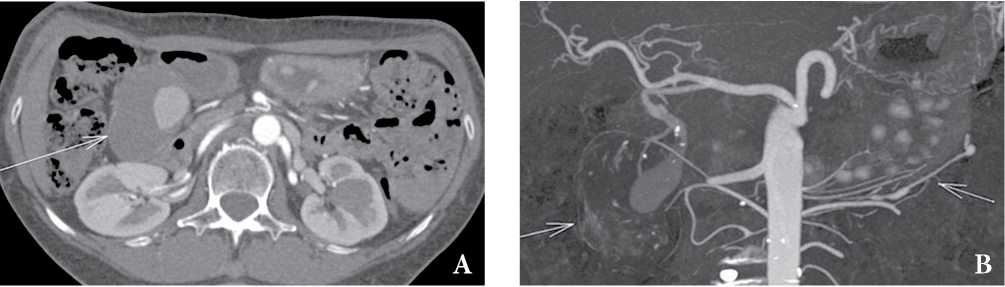
Рисунок 4. Сегментарный артериальный медиолиз, женщина 64 лет. КТ-ангиограмма показывает большую аневризму гастродуоденальной артерии (A, B, длинная стрелка) и симптом “нити бус” (B, короткая стрелка). Случай любезно предоставлен доктором Томасом Сноу, Radiopaedia.org, rID: 30333
Figure 4. Segmental arterial mediolisis. CT aortogram shows large gastroduodenal artery aneurysm (A, B, long arrows) and string-of-beads appearance of left gastroepiploic artery (B, short arrow). Case courtesy of Dr Thomas Snow, Radiopaedia.org, rID: 30333
Синдром срединной дугообразной связки
К причинам внешнего воздействия на сосуды брюшной полости, вызывающего симптомы абдоминальной ишемии, относится синдром срединной дугообразной связки (синдром Данбара, или синдром Харджола-Марабле), который характеризуется внешней компрессией чревного ствола сухожилием ножек диафрагмы [44]. Существуют разногласия по поводу того, что считать заболеванием, а что — вариантной анатомией, так как данную аномалию можно обнаружить у бессимптомных пациентов [45, 46].
У 10–24% обследованных связка может проходить кпереди от артерии; у некоторых из них связка приводит к сдавлению ЧС, нарушая кровоток и провоцируя симптомы [47]. Выраженная компрессия развивается примерно у 1% пациентов и сохраняется во время вдоха [48]. Чаще встречается у женщин (средний возраст — 30–50 лет), у худых пациентов [46]. Клинически проявляется хронической болью в животе, особенно после приема пищи, боль носит позиционный характер, усиливается в положении лежа на спине, на высоте выдоха, также может присутствовать тошнота/рвота, потеря веса [46].
Предполагается, что этиология боли в животе является ишемической из-за нарушения кровотока, вызванного сдавлением. Альтернативно был предложен вклад нейропатического компонента, связанного с воздействием на чревное сплетение [46].
КТ-картина компрессии чревного ствола включает очаговое сужение верхней части проксимального отдела чревного ствола, образуя крючковидный или J-образный вид, признаки развития коллатералей, отсутствие сопутствующего атеросклероза. При КТ-ангиографии дополнительно оценивают постстенотическую дилатацию, ветви чревного ствола (гастродуоденальная и общая печеночная артерия), утолщение средней дугообразной связки. Толщина средней дугообразной связки более 4 мм считается аномальной [46].
Фаза дыхания часто оказывает значительное влияние на степень сужения чревного ствола. Чаще всего стеноз усиливается в конце выдоха и уменьшается в конце вдоха. Поэтому рекомендуется визуализировать во время конечного вдоха, чтобы уменьшить вероятность обнаружения клинически незначительного сужения (ложноположительного) [49][50]. Примеры компрессионного стеноза чревного стола, а также сочетанной сосудистой патологии из архива авторов приведены на рис. 5 и 6.
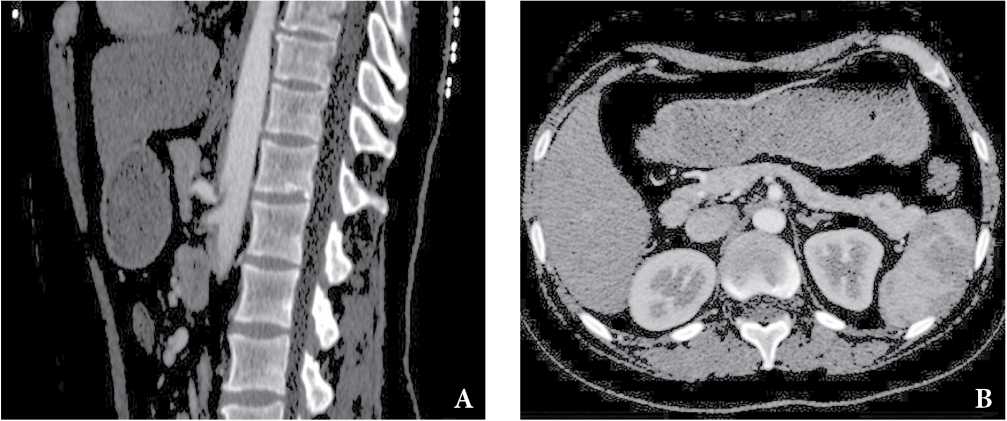
Рисунок 5. КТ-признаки компресcии чревного ствола дугообразной связкой. Пациентка, 38 лет, хронические абдоминальные боли до 8–9 баллов, согласно визуальной аналоговой шкале (ВАШ). Стеноз чревного ствола до 75% в устье, характерный изгиб чревного ствола в виде «крючка», постстенотическая дилатация (A), срединная дугообразная связка, сдавливающая основание чревного ствола (B).
Figure 5. СТ findings are consistent with median arcuate ligament syndrome. a 38-year-old woman with chronic abdominal pain up to 8-9 points accessed by VAS. Stenosis of the celiac trunk up to 75% at the orifice, characteristic bending of the celiac trunk in the form of a “hook”, post-stenotic dilatation (A), median arcuate ligament, compressing the base of the celiac trunk
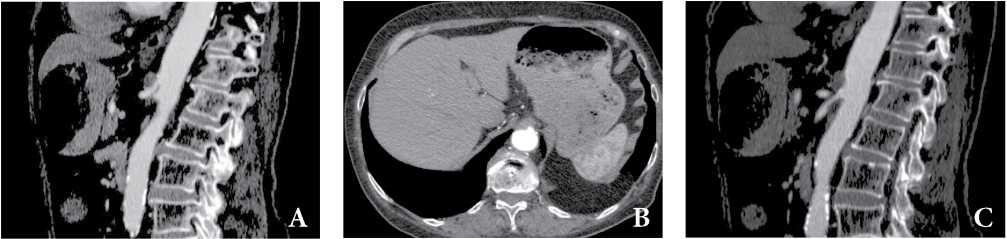
Рисунок 6. КТ-признаки сочетанной патологии компресcии чревного ствола дугообразной связкой и атеросклероз ветвей брюшной аорты. Пациентка, 68 лет, хронические абдоминальные боли, в последнее время отмечает усиление боли после еды, похудание, отсутствие аппетита. Стеноз чревного ствола до 50% в устье, характерный изгиб чревного ствола в виде «крючка» с наличием кпереди от изгиба утолщенной дугообразной связки (A, B), срединная дугообразная связка, сдавливающая основание чревного ствола (B), стеноз ВБА в проксимальном сегменте за счет мягкой циркулярной атеросклеротической бляшки (С).
Figure 6. СТ findings are consistent with CT signs of combined pathology of compression of the celiac trunk by the arcuate ligament and atherosclerosis of the branches of the abdominal aorta. A 68-year-old female patient with chronic abdominal pain has recently noted an increase in pain after eating, weight loss, and a lack of appetite. Celiac trunk stenosis up to 50% at the orifice, characteristic bend of the celiac trunk in the form of a “hook” with the presence of a thickened arcuate ligament anterior to the bend (A, B), median arcuate ligament, compressing the base of the celiac trunk (B), SMA stenosis in the proximal segment behind account of a soft circular atherosclerotic plaque (C).
Заключение
МСКТ с болюсным усилением или МСКТ-ангиография является предпочтительным методом для диагностики структурных изменений при болевом синдроме и подозрении на хроническую абдоминальную ишемию, так как позволяет детально оценить состояние сосудов, а также изменения внутренних органов постишемического характера.
При неспецифических жалобах со стороны желудочно-кишечного тракта в виде хронического болевого синдрома после еды, похудания и других при отсутствии чёткой причинно-следственной связи с патологией внутренних органов следует в том числе исключить синдром хронической абдоминальной ишемии.
Клиницистам следует обсуждать диагностическую тактику с врачами лучевой диагностики для выбора оптимального метода исследования.
Распространённой причиной окклюзивной формы абдоминальной ишемии у пациентов старше 65 лет является атеросклеротические изменения непарных ветвей аорты. Чаще симптомы возникают при поражении двух и более ветвей.
При наличии у пациента жалоб, характерных для ишемического болевого синдрома и подтвержденного атеросклеротического поражения коронарных артерий и артерий нижних конечностей, следует помнить о высокой вероятности окклюзивного поражения ветвей брюшной аорты.
К редким причинам неатеросклеротических поражений сосудов, приводящих к абдоминальной ишемии, относятся васкулиты (Такаясу, сегментарны артериальный медиализ) и ФМД.
При наличии у пациента жалоб, характерных для ишемического абдоминального синдрома, в сочетании с характерным поражением почечных артерий и непарных ветвей брюшной аорты следует исключить ФМД.
При наличии в анамнезе у пациента с признаками хронической абдоминальной ишемии объёмных оперативных вмешательств, сопровождавшихся шоком, гипоксией, введением вазопрессоров необходимо исключить в том числе срединный артериальный медиолиз.
При наличии у молодых пациентов с подозрением на абдоминальную ишемию болей в животе в том числе позиционного характера наряду с характерным сужением проксимального сегмента чревного ствола и гипертрофией сухожилия ножек диафрагмы можно думать о наличии синдрома срединной дугообразной связки.
Список литературы
1. Terlouw LG, Moelker A, Abrahamsen J, Acosta S, Bakker OJ, et al. European guidelines on chronic mesenteric ischaemia — joint United European Gastroenterology, European Association for Gastroenterology, Endoscopy and Nutrition, European Society of Gastrointestinal and Abdominal Radiology, Netherlands Association of Hepatogastroenterologists, Hellenic Society of Gastroenterology, Cardiovascular and Interventional Radiological Society of Europe, and Dutch Mesenteric Ischemia Study group clinical guidelines on the diagnosis and treatment of patients with chronic mesenteric ischaemia. United European Gastroenterol J. 2020; 8(4):371-395. DOI: 10.1177/2050640620916681.
2. Yaghmai V, Brandwein W. Abdominal Computed Tomography Angiography. 2014. In: Richard M. Gore, Marc S. Levine. Textbook of Gastrointestinal Radiology. 2021. ISBN: 9780323640824
3. Schieda N, Fasih N, Shabana W. Triphasic CT in the diagnosis of acute mesenteric ischaemia. Eur Radiol. 2013; 23(7):1891-900. DOI: 10.1007/s00330-013-2797-y.
4. Kirkpatrick ID, Kroeker MA, Greenberg HM. Biphasic CT with mesenteric CT angiography in the evaluation of acute mesenteric ischemia: initial experience. Radiology. 2003; 229(1):91-8. DOI: 10.1148/radiol.2291020991.
5. Laghi A, Ferrari R, Mangiapane F, Trenna S, Marin D, Passariello R. CT Angiography of Splanchnic Vessels. In: Chapman A.H. (eds) Radiology and Imaging of the Colon. Medical Radiology (Diagnostic Imaging). Springer, Berlin, Heidelberg; 2004. DOI: 10.1007/978-3-642-18834-3_22.
6. Cademartiri F, Raaijmakers RH, Kuiper JW, van Dijk LC, Pattynama PM, Krestin GP. Multi-detector row CT angiography in patients with abdominal angina. Radiographics. 2004; 24(4):969-84. DOI: 10.1148/rg.244035166.
7. Baert A, Passariello R. Multidetector-Row CT Angiography. Springer Science & Business Media; 2006. ISBN:3540269843.
8. Winston CB, Lee NA, Jarnagin WR, Teitcher J, DeMatteo RP, et al. CT angiography for delineation of celiac and superior mesenteric artery variants in patients undergoing hepatobiliary and pancreatic surgery. AJR Am J Roentgenol. 2007; 189(1):W13-9. DOI: 10.2214/AJR.04.1374.
9. Shih MC, Hagspiel KD. CTA and MRA in mesenteric ischemia: part 1, Role in diagnosis and differential diagnosis. AJR Am J Roentgenol. 2007; 188(2):452-61. DOI: 10.2214/AJR.05.1167.
10. Курочкин С.В., Зидиханов Д.И. Компьютерно-томографическая ангиография в диагностике коарктации аорты. Комплексные проблемы сердечно-сосудистых заболеваний. 2017; 6(4):169-175. DOI: 10.17802/2306-1278-2017-6-4-169-175.
11. Furukawa A, Kanasaki S, Kono N, Wakamiya M, Tanaka T, et al. CT diagnosis of acute mesenteric ischemia from various causes. AJR Am J Roentgenol. 2009; 192(2):408-16. DOI: 10.2214/AJR.08.1138. PMID: 19155403.
12. Patel R, Waheed A, Costanza M. Chronic Mesenteric Ischemia. 2021 Jul 17. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2021. PMID: 28613499.
13. Johnston KW, Lindsay TF, Walker PM, Kalman PG. Mesenteric arterial bypass grafts: early and late results and suggested surgical approach for chronic and acute mesenteric ischemia. Surgery. 1995; 118(1):1-7. DOI: 10.1016/s0039-6060(05)80002-9.
14. Mensink PB, Moons LM, Kuipers EJ. Chronic gastrointestinal ischaemia: shifting paradigms. Gut. 2011; 60(5):722-37. DOI: 10.1136/gut.2009.199695.
15. Fitzpatrick LA, Rivers-Bowerman MD, Thipphavong S, Clarke SE, Rowe JA, Costa AF. Pearls, Pitfalls, and Conditions that Mimic Mesenteric Ischemia at CT. Radiographics. 2020; 40(2):545-561. DOI: 10.1148/rg.2020190122.
16. Krishnamurthy G, Menon A, Kannan K, Prakash S, Rajendran A, Philips D. Coronary artery disease and mesenteric artery stenosis — Two sides of the same coin? — Long term prospective analysis. Intractable Rare Dis Res. 2019; 8(4):245-251. DOI: 10.5582/irdr.2019.01087.
17. Cai H, Fu F, Wang Y, Li J, Cao J, et al. [Correlation between the stenosis degree of aorto-iliac artery and superior mesenteric artery in patients with lower extremity atherosclerotic occlusive disease by CT angiography]. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue. 2018; 30(7):635-639. (In Chinese). DOI: 10.3760/cma.j.issn.2095-4352.2018.07.004.
18. Долгушина А.И., Шапошник И.И., Селянина А.А., Кузнецова А.С., Генкель В.В. Хроническая мезентериальная ишемия: современное состояние проблемы. Экспериментальная и клиническая гастроэнтерология. 2020;(6):166- 172. DOI: 10.31146/1682-8658-ecg-178-6-166-172.
19. Chang JB, Stein TA. Mesenteric ischemia: acute and chronic. Ann Vasc Surg. 2003; 17(3):323-8. DOI: 10.1007/s10016-001-0249-7.
20. Hagspiel KD, Angle JF, Spinosa DJ, Matsumoto AH. Mesenteric ischemia: angiography and endovascular interventions. In: Longo W, Peterson GJ, Jacobs DL, eds. Intestinal ischemia disorders: pathophysiology and management. St. Louis, MO: Quality Medical Publishing; 1999.
21. Ruehm SG, Weishaupt D, Debatin JF. Contrast-enhanced MR angiography in patients with aortic occlusion (Leriche syndrome). J Magn Reson Imaging. 2000; 11(4):401- 10. DOI: 10.1002(sici)1522-2586(200004)11:4<401::aidjmri8>3.0.co;2-h.
22. Bhatti AA, Chugtai A, Haslam P, Talbot D, Rix DA, Soomro NA. Prospective study comparing three-dimensional computed tomography and magnetic resonance imaging for evaluating the renal vascular anatomy in potential living renal donors. BJU Int. 2005; 96(7):1105-8. DOI: 10.1111/j.1464-410X.2005.05809.x.
23. Plouin PF, Perdu J, La Batide-Alanore A, Boutouyrie P, Gimenez-Roqueplo AP, Jeunemaitre X. Fibromuscular dysplasia. Orphanet J Rare Dis. 2007; 2:28. DOI: 10.1186/1750-1172-2-28.
24. Willoteaux S, Faivre-Pierret M, Moranne O, Lions C, Bruzzi J, et al. Fibromuscular dysplasia of the main renal arteries: comparison of contrast-enhanced MR angiography with digital subtraction angiography. Radiology. 2006; 241(3):922-9. DOI: 10.1148/radiol.2413050149.
25. Furie DM, Tien RD. Fibromuscular dysplasia of arteries of the head and neck: imaging findings. AJR Am J Roentgenol. 1994; 162(5):1205-9. DOI: 10.2214/ajr.162.5.8166011.
26. Varennes L, Tahon F, Kastler A, Grand S, Thony F, et al. Fibromuscular dysplasia: what the radiologist should know: a pictorial review. Insights Imaging. 2015; 6(3):295-307. DOI: 10.1007/s13244-015-0382-4.
27. Michelis KC, Olin JW, Kadian-Dodov D, d’Escamard V, Kovacic JC. Coronary artery manifestations of fibromuscular dysplasia. J Am Coll Cardiol. 2014; 64(10):1033-46. DOI: 10.1016/j.jacc.2014.07.014.
28. Olin JW, Sealove BA. Diagnosis, management, and future developments of fibromuscular dysplasia. J Vasc Surg. 2011; 53(3):826-36.e1. DOI: 10.1016/j.jvs.2010.10.066.
29. Willoteaux S, Faivre-Pierret M, Moranne O, Lions C, Bruzzi J, et al. Fibromuscular dysplasia of the main renal arteries: comparison of contrast-enhanced MR angiography with digital subtraction angiography. Radiology. 2006; 241(3):922-9. DOI: 10.1148/radiol.2413050149.
30. Plouin PF, Perdu J, La Batide-Alanore A, Boutouyrie P, Gimenez-Roqueplo AP, Jeunemaitre X. Fibromuscular dysplasia. Orphanet J Rare Dis. 2007; 2:28. DOI: 10.1186/1750-1172-2-28.
31. Rubin GD, Rofsky NM. CT And MR Angiography Comprehensive Vascular Assessment. USA: Lippincott Williams & Wilkins; 2008. ISBN:078174525X
32. Jahnlova D, Veselka J. Fibromuscular Dysplasia of Renal and Carotid Arteries. Int J Angiol. 2015; 24(3):241-3. DOI: 10.1055/s-0034-1396931.
33. Mehta R, Deepak, John A, Shine, Raj, Balakrishnan. Takayasu arteritis presenting as chronic mesenteric ischemia. Indian J Gastroenterol. 2004; 23(2):73-4. PMID: 15176543.
34. Mehta R, Deepak, John A, Shine, Raj, Balakrishnan. Takayasu arteritis presenting as chronic mesenteric ischemia. Indian J Gastroenterol. 2004; 23(2):73-4. PMID: 15176543.
35. Yang J, Peng M, Shi J, Zheng W, Yu X. Pulmonary artery involvement in Takayasu’s arteritis: diagnosis before pulmonary hypertension. BMC Pulm Med. 2019; 198(1):225. DOI: 10.1186/s12890-019-0983-7.
36. Nastri MV, Baptista LP, Baroni RH, Blasbalg R, de Avila LF, et al. Gadolinium-enhanced three-dimensional MR angiography of Takayasu arteritis. Radiographics. 2004; 24(3):773-86. DOI: 10.1148/rg.243035096.
37. Broncano J, Vargas D, Bhalla S, Cummings KW, Raptis CA, Luna A. CT and MR Imaging of Cardiothoracic Vasculitis. Radiographics. 2018; 38(4):997-1021. DOI: 10.1148/rg.2018170136.
38. Sueyoshi E, Sakamoto I, Uetani M. MRI of Takayasu’s arteritis: typical appearances and complications. AJR Am J Roentgenol. 2006; 187(6):W569-75. DOI: 10.2214/AJR.05.1093.
39. Gotway MB, Araoz PA, Macedo TA, Stanson AW, Higgins CB, et al. Imaging findings in Takayasu’s arteritis. AJR Am J Roentgenol. 2005; 184(6):1945-50. DOI: 10.2214/ajr.184.6.01841945.
40. Chao CP. Segmental arterial mediolysis. Semin Intervent Radiol. 2009; 26(3):224-32. DOI: 10.1055/s-0029-1225666.
41. Michael M, Widmer U, Wildermuth S, Barghorn A, Duewell S, Pfammatter T. Segmental arterial mediolysis: CTA findings at presentation and follow-up. AJR Am J Roentgenol. 2006; 187(6):1463-9. DOI: 10.2214/AJR.05.0281.
42. Hur JH, Chun EJ, Kwag HJ, Yoo JY, Kim HY, et al. CT Features of Vasculitides Based on the 2012 International Chapel Hill Consensus Conference Revised Classification. Korean J Radiol. 2017; 18(5):786-798. DOI: 10.3348/kjr.2017.18.5.786.
43. Slavin RE. Segmental arterial mediolysis: course, sequelae, prognosis, and pathologic-radiologic correlation. Cardiovasc Pathol. 2009; 18(6):352-60. DOI: 10.1016/j.carpath.2008.09.001.
44. Hagspiel KD, Leung DA, Angle JF, Spinosa DJ, Pao DG, et al. MR angiography of the mesenteric vasculature. Radiol Clin North Am. 2002; 40(4):867-86. DOI: 10.1016/s0033-8389(02)00027-1.
45. Kopecky KK, Stine SB, Dalsing MC, Gottlieb K. Median arcuate ligament syndrome with multivessel involvement: diagnosis with spiral CT angiography. Abdom Imaging. 1997; 22(3):318-20. DOI: 10.1007/s002619900199.
46. Kim EN, Lamb K, Relles D, Moudgill N, DiMuzio PJ, Eisenberg JA. Median Arcuate Ligament Syndrome-Review of This Rare Disease. JAMA Surg. 2016; 151(5):471-7. DOI: 10.1001/jamasurg.2016.0002.
47. Lindner HH, Kemprud E. A clinicoanatomical study of the arcuate ligament of the diaphragm. Arch Surg. 1971; 103(5):600-5. DOI: 10.1001/archsurg.1971.01350110102016.
48. Cornell SH. Severe stenosis of the celiac artery. Analysis of patients with and without symptoms. Radiology. 1971; 99(2):311–316. DOI: 10.1148/99.2.311.
49. Fong JK, Poh AC, Tan AG, Taneja R. Imaging findings and clinical features of abdominal vascular compression syndromes. AJR Am J Roentgenol. 2014; 203(1):29-36. DOI: 10.2214/AJR.13.11598.
50. Sardar P, White CJ. Chronic mesenteric ischemia: Diagnosis and management. Prog Cardiovasc Dis. 2021; 65:71-75. DOI: 10.1016/j.pcad.2021.03.002.
Об авторах
Н. К. АрутюноваРоссия
Арутюнова Нина Кимовна, врач консультативного отдела
Ростов-на-Дону
Л. В. Арасланова
Россия
Арасланова Лариса Вакильевна, кандидат медицинских наук, заведующая отделением лучевой диагностики Областной консультативно-диагностический центр; доцент кафедры персонализированной и трансляционной медицины, Ростовский государственный медицинский университет
Ростов-на-Дону
SPIN-код 4859-0178
В. А. Рябченко
Россия
Рябченко Виктория Александровна, кандидат медицинских наук, врач отделения лучевой диагностики, Областной консультативнодиагностический центр; ассистент кафедры персонализированной и трансляционной медицины, Ростовский государственный медицинский университет
Ростов-на-Дону
SPIN-код 6558-8773
Е. А. Писаренко
Россия
Писаренко Елена Алексеевна, врач отделения лучевой диагностики
Ростов-на-Дону
Е. И. Тер-Ананьянц
Россия
Tер-Ананьянц Елена Ильинична, врач отделения лучевой диагностики
Ростов-на-Дону
Рецензия
Для цитирования:
Арутюнова Н.К., Арасланова Л.В., Рябченко В.А., Писаренко Е.А., Тер-Ананьянц Е.И. Сосудистые аномалии, визуализированные при мультиспиральной компьютерной томографии органов брюшной полости, - случайные находки или непосредственные причины возникновения болевого синдрома? (тематический обзор). Медицинский вестник Юга России. 2021;12(4):34-45. https://doi.org/10.21886/2219-8075-2021-12-4-34-45
For citation:
Arutiunova N.K., Araslanova L.V., Riabchenko V.A., Pisarenko E.A., Ter-Ananiants E.I. Vascular abnormalities visualized by multislice computed tomography of the abdomen: accidental findings or immediate causes of pain syndrome? (topic review). Medical Herald of the South of Russia. 2021;12(4):34-45. (In Russ.) https://doi.org/10.21886/2219-8075-2021-12-4-34-45







































