Перейти к:
Сравнительный анализ геномного разнообразия SARS-COV-2, циркулирующих на территориях ростовской области и республики крым в период с марта по июнь 2021 г.
https://doi.org/10.21886/2219-8075-2021-12-3-62-71
Аннотация
Цель: сравнительный анализ геномного разнообразия штаммов, циркулирующих на территориях Ростовской области и Республики Крым в период с марта по июнь 2021 г.
Материалы и методы: были секвенированы 194 образца, для 186 из них удалось установить геноварианты с использованием программы Pangolin. Для образцов, относящихся к альфа и дельта геновариантам, было проведено множественное выравнивание и построены дендрограммы.
Результаты: для территорий Ростовской области и Республики Крым с марта по июнь установлена смена преобладающих геновариантов. В весенний период на обеих исследуемых территориях выявлено увеличение доли вариантов альфа, а затем появление вариантов дельта, занявших доминирующее положение в июле.
Выводы: установлено, что альфа геноварианты какое-то время циркулировали на территории Ростовской области и накопили пул общих мутаций, а образцы, относящиеся к этой линии, обнаруженные в Крыму, демонстрируют сходство с вариантами, выявленными на территории Москвы и МО. В конце мая начинает выявляться геновариант дельта, который стремительно вытесняет другие линии на всех рассматриваемых в данном исследовании территориях.
Для цитирования:
Носков А.К., Подойницына О.А., Водопьянов А.С., Писанов Р.Р., Ковалев Е.В., Пеньковская Н.А., Слись С.С., Янович Е.Г., Кузнецова Д.А., Водопьянов С.О., Чемисова О.С. Сравнительный анализ геномного разнообразия SARS-COV-2, циркулирующих на территориях ростовской области и республики крым в период с марта по июнь 2021 г. Медицинский вестник Юга России. 2021;12(3):62-71. https://doi.org/10.21886/2219-8075-2021-12-3-62-71
For citation:
Noskov A.K., Podoynitsina O.A., Vodopianov A.S., Pisanov R.V., Kovalev E.V., Penkovskaya N.A., Slis S.S., Yanovich E.G., Kuznetsova D.A., Vodopianov S.O., Chemisova O.S. Comparative analysis of the genomic diversity of SARS-COV-2 circulating in the territories of the Rostov region and the republic of Crimea in the period from March to June 2021. Medical Herald of the South of Russia. 2021;12(3):62-71. (In Russ.) https://doi.org/10.21886/2219-8075-2021-12-3-62-71
Введение
Более полутора лет прошло с момента начала пандемии, вызванной SARS-CoV-2. К июню 2021 г. в мире насчитывалось более 173 млн подтверждённых случаев заболевания новой коронавирусной инфекцией, из которых более 3,7 млн были с летальным исходом1. Широкое развитие методов полногеномного секвенирования и создание общедоступных баз, содержащих данные о нуклеотидных последовательностях вирусов SARS-CoV-2, позволяет изучать особенности циркуляции отдельных клонов возбудителя на различных территориях [1][2][3].
Длина генома SARS-CoV-2 составляет около 30 тысяч пар оснований [4]. В его состав входят 14 открытых рамок считывания (ORF), кодирующих как неструктурные белки (NSP), ответственные за процессы репликации и сборки вирусов, так и структурные белки, включая спайк-белок (S), белок оболочки (Е), мембрану / матрицу (М) и нуклеокапсид (N), а также вспомогательные белки. Первая рамка считывания содержит приблизительно 65% вирусного генома и транслируется либо в полипептид pp1a (nsp 1–11), либо в полипептид pp1ab (nsp 1–16). Другие рамки кодируют структурные и вспомогательные белки. Белок S представляет собой трансмембранный белок, который облегчает связывание вирусной оболочки с рецепторами ангиотензинпревращающего фермента 2 (АПФ2, ACE2), экспрессирующимися на поверхности клеток-хозяев. С точки зрения патогенеза заболевания наиболее значимым компонентом генома коронавирусов является рецептор-связывающий домен (RBD), расположенный в гене спайк-белка вируса и отвечающий за связывание с рецептором клеток человека ACE2, участвуя таким образом в проникновении вируса внутрь клеток. Белок N участвует в репликации РНК, образовании вирионов и уклонении от иммунного ответа. Белок М является одним из наиболее консервативных в структуре белков вириона. Он способствует сборке вирусных частиц. Белок E является самым мелким компонентом в структуре SARS-CoV-2, который облегчает продукцию, созревание и высвобождение вирионов [5][6][7].
В настоящее время ВОЗ выделяет четыре линии SARSCoV-2, которые классифицируются как вызывающие беспокойство (Variants of Concern (VOCs)). В соответствии с номенклатурой PANGO к ним относятся линии B.1.1.7 («британский» геновариант), B.1.351 («Южноафриканский» геновариант), P.1 («бразильский» геновариант) и B.1.617.2 («индийский» геновариант). Им соответствуют обозначения ВОЗ, такие как альфа, бета, гамма и дельта [8]. Линия альфа, впервые идентифицированная в сентябре 2020 г., к апрелю 2021 г. занимала лидирующее положение среди всех определяемых вариантов. Вместе с тем, уже к июню она была вытеснена штаммами SARS-CoV-2, относящимися к линии Pango B.1.617.2, которая имеет индийское происхождение.
Варианты альфа, бета, гамма и дельта характеризуются определенными наборами мутаций в рецепторсвязывающем домене спайк-белка, которые влияют на связывание вирусной оболочки с рецепторами ACE2 [5][6] и могут быть ассоциированы с уклонением от иммунного ответа макроорганизма, что может обеспечивать таким штаммам эволюционное преимущество и способствовать их быстрому распространению. Появление новых линий SARS-CoV-2 с возможно измененными свойствами подчеркивает важность наблюдения за существующими вариантами.
Цель исследования – сравнительный анализ геномного разнообразия вариантов, циркулирующих на территориях Ростовской области и Республики Крым в период с марта по июнь 2021 г.
Задачи:Определить основные линии, выделяемые на территориях Ростовской области и Республики Крым в период с марта по июнь 2021 г.
Определить наличие / отсутствие на данных территориях «британских», «ЮАР», «бразильских» и «индийских» геновариантов.
Провести сравнительный анализ полученных нами данных с данными базы Gisaid по Москве, Московской области и Европе.
Сравнить нуклеотидные последовательности геновариантов, относящихся к линии В.1.1.7 и выявляемых на территории Ростовской области, а также на территории Республики Крым, с образцами, идентифицированными на территории Москвы и Московской области.
Сравнить нуклеотидные последовательности геновариантов, относящихся к линии В.1.617.2 и выявляемых на территории Ростовской области, а также на территории Республики Крым, с образцами, идентифицированными на территории Москвы и Московской области.
Материалы и методы
Для анализа использовали 203 образца биологического материала, наличие вируса SARS-CoV-2 в которых было подтверждено методом ПЦР. Для подтверждения наличия вируса использовали набор реагентов «АмплиСенс® Cov-Bat-FL». Выделение РНК проводили с использованием набора реагентов «АмплиСенс® РИБО-преп». Получение кДНК проводили с использованием набора «АмплиСенс® Реверта», для наработки специфических ампликонов применяли праймеры, предложенные консорциумом Artic. Cинтез праймеров проводили в ООО «НПФ Синтол» (г. Москва).
Протокол амплификации, предложенный консорциумом Artic, основан на фрагментарной амплификации генома вируса SARS-CoV-2 с использованием 98 пар праймеров, объединённых в два пула. Однако по сообщениям ряда авторов [9][10] одной из проблем при этом является формирование димеров праймеров, снижающих эффективность амплификации. В связи с этим мы пошли по пути увеличения числа пулов, разделив каждый из пулов еще на две равные группы. Визуальная оценка результатов электрофореза показала более выраженные целевые полосы (около 400 п.о.) и меньшую выраженность димеров праймеров (менее 100 п.о.) при использовании четырёх пулов по сравнению с двумя пулами праймеров, что способствовало лучшей наработке целевого продукта амплификации и давало впоследствии более полное покрытие генома. После амплификации с последующим секвенированием нам удалось получить 194 генома вируса, из них 193 – с покрытием более 90%. При этом для 64 образцов получено покрытие 100%.
Полимеразную цепную реакцию проводили в объеме 25 мкл в полистироловых микроцентрифужных пробирках на программируемом многоканальном термоциклере «Терцик» (ДНК-технология, г. Москва).
Инкубационная смесь для ПЦР содержала 20 мМ трис-НСl, рН 8,6; 7 мМ MgCI2, 10 мМ (NH4)2SO4, 0,5 мМ ЭДТА, 100 мкг/мл БСА, по 250 мкМ каждого из дезоксинуклеозидтрифосфатов, 15 нМ соответствующего праймера, 2 ед. Taq-полимеразы.
Детекцию ампликонов осуществляли в 1% агарозном геле длиной 10 см при напряжении 220 В.
Секвенирование проводили на приборе MiSeq Illumina, использовали набор nextera dna fl ex и картридж на 500 циклов2. Сборка геномов осуществлялась путём выравнивания на референсную последовательность штамма hCoV-19/Wuhan/WIV04/20193 с использованием программ minimap2 [11], samtools [12] и iVar [13].
Генетические линии определяли с помощью программы Pangolin4.
Множественное выравнивание производилось для всего генома и было реализовано с использованием программы mafft [14]. Построение филогенетических деревьев осуществляли с помощью FastTree [15]. Визуализацию проводили с помощью iTOL5. Для проведения сравнительного анализа использовали данные полногеномного секвенирования, полученные из базы данных GISAID [16].
Результаты
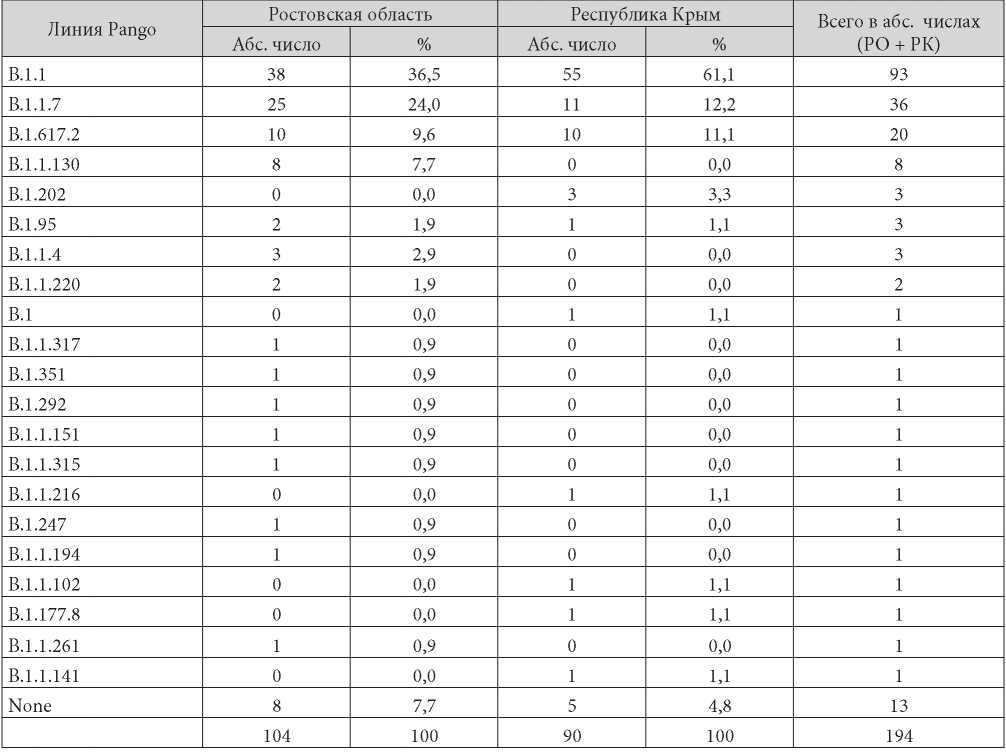
Количественная характеристика результатов определения геновариантов SARS-CoV-2 в исследуемых (с использованием программы Pangolin) образцах с территорий Ростовской области (РО) и Республики Крым (РК) отражена в табл. 1.
Динамичные результаты аналогичного содержания за этот же временной период с использованием данных по Москве и по странам Европы для последующего проведения сравнительного анализа представлены на рис. 1.
По итогам анализа геномов с использованием программы Pangolin установлено, что наибольшее число SARS-CoV-2, выявленных на территориях Ростовской области и Республики Крым за весь период исследований (март – июнь 2021), относятся к линии «B.1.1» (табл. 1).
Таблица / Table 1
Частота обнаружения геновариантов на территориях Ростовской области и Республики Крым в период с марта по июнь 2021 г.
The frequency detection of variants in the Rostov region and the Republic of Crimea territories from March to June 2021 period
По нашим данным эта группа геновариантов была наиболее широко представлена в марте (57,7% в Ростовской области и 81,8% в Республике Крым) и апреле (29,6% и 71,4% соответственно) 2021 г. (табл. 2). В последующие месяцы линия В.1.1. выявлялась с меньшей частотой, что являлось следствием увеличения количества изолятов других линий (рис. 1).
Таблица / Table 2
Частота встречаемости геновариантов VOC на территориях Ростовской области и Республики Крым, а также Москвы, МО и Европы
The frequency of occurrence of VOC variants in the Rostov region and the Republic of Crimea territories, as well as Moscow, the Moscow Region and Europe
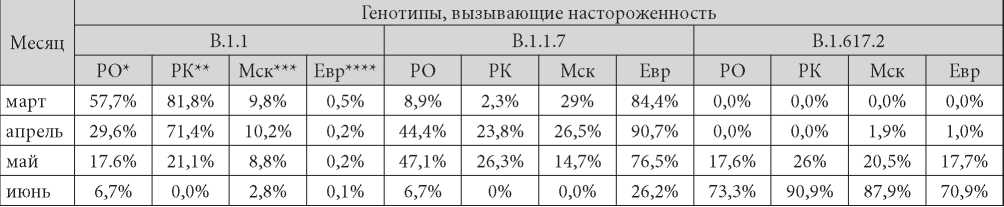
* Ростовская область; ** Республика Крым; *** Москва и Московская область; **** Страны Европы
Вытеснение В.1.1. происходило, в частности, за счёт стремительного увеличения на территории РФ геноварианта альфа, а также появления изолятов линии В.1.617.2. На графике (рис. 1) видно, что на территориях Ростовской области и Республики Крым изоляты линии альфа появляются в марте (частота обнаружения составляет 8,9% и 2,3% соответственно). При этом уже в мае в Ростовской области среди всех идентифицированных линий линия В.1.1.7 достигает 47,1%, а в Крыму эта величина составляет 26,3% (Таб. 2). В этот же период в Москве и Московской области впервые регистрировались изоляты линии дельта, количество которых с апреля по настоящее время (июнь 2021) продолжает расти. В Ростовской области и Республике Крым «британский» геновариант впервые был обнаружен в марте, и к маю частота выявления представителей этой линии достигла своих максимальных значений на обеих территориях (47,1% и 26,3% соответственно), а в июне их количество стремительно уменьшилось до 6,7% для Ростовской области и 0% для Республики Крым. Изоляты линии В.1.617.2 в Ростовской области и Республике Крым впервые появились в мае, а к июню их количество стремительно выросло (73% в РО и 91% в РК) (табл. 2) и до настоящего времени (июнь 2021 г.) эта линия занимает доминирующее положение (рис. 1).
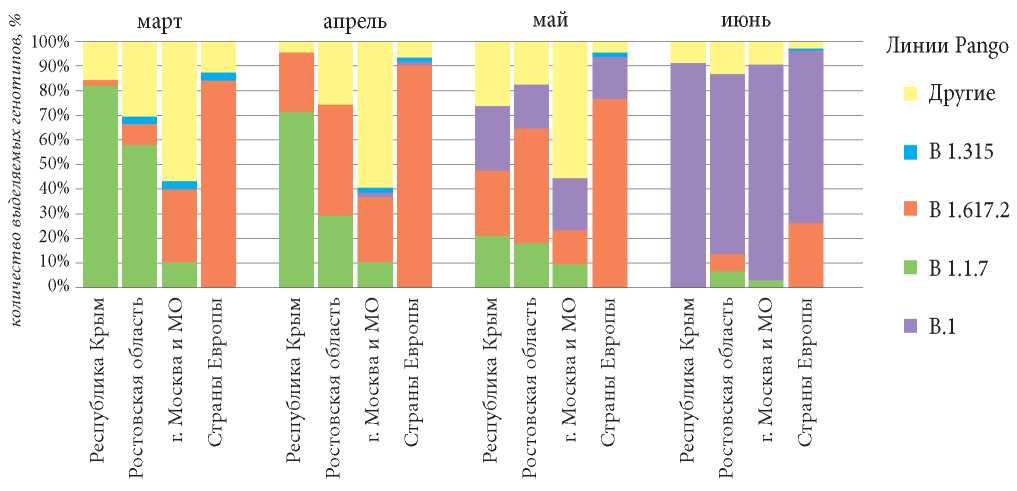
Рисунок 1. Линии Pango (в %), выделяемые на территориях Ростовской области и Республики Крым с марта по июнь 2021 г.
Figure 1. Pango lines (in%) allocated in the territories of the Rostov region and the Republic of Crimea from March to June 2021
Увеличение доли линии В.1.1.7 к апрелю 2021 г. с последующим её снижением в мае происходило и на территории Европы. В январе в базе Gisaid (данные базы Gisaid, не вошедшие в табл. 2) среди всех присутствующих на территории Европы геновариантов линия В.1.1.7 занимает 52.8%. К апрелю эта цифра выросла до 90,7%, а в мае снизилась до 76,5%. При этом «индийский» вариант в марте обнаруживался в странах Европы в количестве 0,01%, а уже к июню его доля составила 70,9% (табл. 2).
Для сравнения последовательностей альфа и дельта вариантов, циркулировавших на территориях Москвы и Московской области, а также Республики Крым и Ростовской области в период с мая по июнь 2021 г., были построены дендрограммы отдельно для каждой из генетических линий (рис. 2, 3).

Рисунок 2. Дендрограмма. Сравнение изолятов линии B.1.1.7, выявленных в Ростовской области (оранжевый цвет), Республике Крым (желтый цвет), в Москве и Московской области.
Figure 2. Dendrogram. Comparison of isolates of the B. 1.1.7 line detected in the Rostov region (orange color), the Republic of Crimea (yellow color), in Moscow and the Moscow region.

Рисунок 3. Дендрограмма. Сравнение образцов линии B.1.617.2, выявленных в Ростовской области (оранжевый цвет), Республике Крым (желтый цвет), а также в Москве и Московской области.
Figure 3. Dendrogram. Comparison of samples of the B. 1.617.2 line detected in the Rostov region (orange color), the Republic of Crimea (yellow color), as well as in Moscow and the Moscow region.
Обсуждение
При анализе полученных результатов было выявлено, что вытеснение В.1.1. происходило, в частности, за счёт увеличения на территории РФ геноварианта альфа, а также появления и последующего стремительного роста количества представителей линии В.1.617.2 (рис. 1). На территориях Ростовской области и Республики Крым изоляты линии альфа появляются в марте (частота обнаружения составляет 8,9% и 2,3% соответственно). Всего на указанных выше территориях обнаружено 36 изолятов, относящихся к варианту B.1.1.7 и 20 – относящихся к геноварианту дельта (табл. 1).
При сравнении полученных результатов с данными базы Gisaid, в соответствии с которыми линия В.1.1.7 выявляется на территории Москвы и Московской области в январе с частотой 16,3%, а далее доля обнаружения этих изолятов растёт, достигая к марту 29,0% (данные базы), можно видеть, что тенденция к повышению частоты обнаружения изолятов варианта альфа характерна также для территорий Ростовской области и Республики Крым, но с некоторым отставанием. По-видимому, это связано с тем, что, являясь экономическим и транспортным центром, столица обладает высокой интенсивностью миграционных процессов, как международных, так и внутригосударственных, способствующих распространению SARS-CoV-2 и росту заболеваемости COVID-19 в периферийных регионах страны. По данным базы Gisaid, максимальное количество «британских» геновариантов в Москве и Московской области было обнаружено в марте, а в апреле и далее наблюдалось постепенное уменьшение представителей этой линии (табл. 2).
Таким образом, в странах Европы, на территориях Москвы и МО, Ростовской области и Республики Крым с марта по июнь 2021 г. происходила смена доминирующих геновариантов. В начале весны растет частота обнаружения изолятов, относящихся к линии альфа, а затем геновариант дельта стремительно вытесняет другие линии на всех рассматриваемых в данном исследовании территориях, что, по нашему мнению, связано с его более высокой контагиозностью.
Сравнивая генетические последовательности «британских» изолятов, выявленных на территориях Ростовской области, Республики Крым, а также Москвы и МО, установлено, что подавляющее большинство изолятов линии В.1.1.7, выявленных в Ростовской области за рассматриваемый период, располагались на дендрограмме отдельным кластером. Только один изолят (N 312 Батайск 01.04.2021) не вошел в этот кластер, составив одну ветвь с изолятами Московской области. Полученные результаты свидетельствуют о внутренней циркуляции данного этиологического агента на территории области на фоне отсутствия случаев его заноса с других субъектов РФ и из-за рубежа или наличия единичных случаев завоза с других территорий без дальнейшего распространения среди населения РО (рис. 2).
Максимальное количество SA RS-CoV-2, принадлежащих к линии B.1.1.7 для Ростовской области и Республики Крым приходилось на май, а затем количество этих изолятов стремительно снизилось. Можно предположить, что в весенний период большую часть пассажиропотока составляют люди, перемещающиеся в рамках деловых поездок, поскольку сезон отпусков еще не наступил. В то же время изоляты линии альфа, полученные на территории Крыма, располагаются отдельными небольшими кластерами, что свидетельствует как о наличии в Крыму изолятов, некоторое время циркулирующих на данной территории, так и о множественных завозах на данную территорию из столичного региона.
Изоляты линии В.1.617.2 в Ростовской области и Республике Крым впервые отмечены в мае, а к июню их количество стремительно выросло (73% в РО и 91% в РК). Изоляты, появившиеся в Крыму в мае, расположены на дендрограмме в одном кластере, что может быть обусловлено завозом возбудителя с последующим локальным распространением (рис. 3). В июне происходит стремительное увеличение количества «индийских» геновариантов, что совпадает с начавшимся сезоном отпусков. Июньские изоляты линии дельта, выявленные в Крыму, а также часть майских изолятов этой линии, располагаются на дендрограмме либо отдельно в разных кластерах, образуя при этом общие ветви как с московскими, так и с изолятами, выявленными на территории Ростовской области, либо локально, что свидетельствует о постоянно происходящих заносах. С началом сезона отпусков увеличилась интенсивность распространения вируса среди восприимчивого населения. Вероятно, она будет продолжать нарастать до окончания туристического сезона.
Выводы
В период с марта по июнь 2021 г. на территориях Ростовской области и Республики Крым происходила постепенная смена доминирующих линий SARS-CoV-2 с преобладанием В.1.1 в марте, увеличением доли изолятов линии альфа в апреле и мае, а затем появление и стремительное увеличение дельта-изолятов к июню на обеих территориях. Единственный изолят линии В.1.315 был обнаружен на территории Ростовской области, а представители линии Р.1 обнаружены не были.
Сравнивая полученные данные с данными базы Gisaid, можно сделать вывод о том, что смена доминирующих геновариантов происходила как на территории Москвы и МО, так и на территории Европы, но в более ранние сроки. По видимому, основными воротами для ввоза новых линий на территорию России является столица, как основной логистический центр страны. А распространение изолятов вглубь территории, в основном, осуществляется с некоторой задержкой, что позволяет прогнозировать ситуацию в регионах.
«Британские» варианты, выявленные в Ростовской области, по видимому какое-то время циркулировали на этой территории и накопили пул общих мутаций, в то время как изоляты данной линии, выявленные в Крыму, демонстрировали сходство генома с различными изолятами, выявленными на территории Москвы и МО, что указывает на серию независимых завозов данных вирусов на территорию республики.
Большинство изолятов «индийского» варианта, идентифицированные в конце мая и начале июня в Крыму, отличаются от московских и, вероятно, какое-то время циркулировали на территории Крыма, в то время как В.1.617.2, изолированные в июне, а также изоляты, выявленные в Ростовской области, проявляют больше сходства с московскими.
Наблюдаемое в летний период распространение линии В.1.617.2 уже привело к росту заболеваемости. При условии несоблюдения населением мер личной и общественной безопасности, а также при несвоевременной вакцинации, вероятно, количество больных ещё может увеличиваться, достигнув пика в сентябре-октябре, когда завершится сезон отпусков и основная масса населения вернется в организованные коллективы по месту учебы и работы.
1. https://www.who.int/publications/m/item/weekly-epidemiologicalupdate-on-covid-19---1-june-2021
2. https://support.illumina.com/sequencing/sequencing_kits/nexteradna-flex-kit/documentation.html
3. GenBank Accession Number MN908947.3
4. https://github.com/cov-lineages/pangolin
5. https://itol.embl.de
Список литературы
1. Каптелова В.В., Сперанская А.С., Самойлов А.Е., Валдохина А.В., Буланенко В.П. и др. Мутации в геномах Sars-CoV-2 биологических образцов, полученных в конце марта – начале апреля, от пациентов города Москвы. // Всероссийская научно-практическая конференция с международным участием «Молекулярная диагностика и биобезопасность»; Октябрь 6-8, 2020; Москва. doi: 10.36233/978-5-9900432-9-9-147.
2. Косырева А.Н., Бакштановская И.В., Степанова Т.Ф., Шарухо Г.В., Летюшев А.Н., Степанова К.Б. Результаты выявления Sars-CoV-2 и других возбудителей внебольничных пневмоний методом ПЦР в Тюменской области в апреле – июле 2020 // Всероссийская научно-практическая конференция с международным участием «Молекулярная диагностика и биобезопасность»; Октябрь 6-8, 2020; Москва. doi: 10.36233/978-5-9900432-9-9-153
3. Nagy Á, Pongor S, Győrff y B. Diff erent mutations in SARSCoV-2 associate with severe and mild outcome. // Int J Antimicrob Agents. – 2021. T.57. – V.2. – P.106272. DOI: 10.1016/j.ijantimicag.2020.106272
4. Devika S., Soojin V. Yi. On the origin and evolution of SARSCoV-2. // Exp Mol Med. – 2021. – T.53. – V.4. – P.537 – 547. DOI: 10.1038/s12276-021-00604-z
5. Mousavizadeh L., Ghasemi S. Genotype and phenotype of COVID-19: Their roles in pathogenesis. // J Microbiol Immunol Infect. – 2021. – T.54. – V.2. – P.159–163. DOI: 10.1016/j.jmii.2020.03.022
6. Wong N.A., Saier M.H. The SARS-Coronavirus Infection Cycle: A Survey of Viral Membrane Proteins, Their Functional Interactions and Pathogenesis settings. // Int. J. Mol. Sci. – 2021. – T.22. – V.3. – P.1308; DOI: 10.3390/ijms22031308
7. Wang M., Zhao R., Gao L., Xue-Fei Gao, Wang D. et al. SARSCoV-2: Structure, Biology, and Structure-Based Therapeutics Development Front Cell. // Infect Microbiol. – 2020. – T.10. – P.587269. DOI: 10.3389/fcimb.2020.587269
8. Kannan S., Shaik Syed Ali P., Sheeza A. Evolving biothreat of variant SARS-CoV-2 – molecular properties, virulence and epidemiology. // Eur Rev Med Pharmacol Sci. – 2021. – T.25. – V.12. – P.4405-4412. DOI: 10.26355/eurrev_202106_26151.
9. Tyson JR, James P, Stoddart D, Sparks N, Wickenhagen A, et al. Improvements to the ARTIC multiplex PCR method for SARS-CoV-2 genome sequencing using nanopore. // bioRxiv [Preprint]. – 2020. – 4:2020.09.04.283077. DOI: 10.1101/2020.09.04.283077
10. Itokawa K., Sekizuka T., Hashino M., Tanaka R., Kuroda M. Disentangling primer interaction simproves SARS-CoV-2 genome sequencing by multiplex tiling PCR. // PLoS ONE. – 2020. – T.15. – V.9. – P.0239403. DOI: 10.1371/journal.pone.0239403
11. Li H. Minimap2: pairwise alignment for nucleotide sequences. // Bioinformatics. – 2018. – V.34. – P.3094-3100. DOI: 10.1093/bioinformatics/bty191
12. Li H., Handsaker B., Wysoker A., Fennell T., Ruan J., Homer N. et al. The Sequence alignment/map (SAM) format and SAMtools. // Bioinformatics. – 2009. – V.25. – N.16. – P.2078-2079. DOI: 10.1093/bioinformatics/btp352
13. Grubaugh N.D., Gangavarapu K., Quick J, Matteson N.L., De Jesus J.G. et al. An amplicon-based sequencing framework for accurately measuring intrahost virus diversity using PrimalSeq and iVar. // Genome Biol. – 2019. – V.8 DOI: 10.1186/s13059-018-1618-7
14. Katoh K., Misawa K., Kuma K., Miyata T. MAFFT: a novel method for rapid multiple sequence alignment based on fast Fourier transform. // Nucleic Acids Res. – 2002. – V.30. – P.3059 – 3066. DOI: 10.1093/nar/gkf436 14. Katoh K., Misawa K., Kuma K., Miyata T.) MAFFT: a novel method for rapid multiple sequence alignment based on fast Fourier transform. Nucleic Acids Res. 2002;30:3059-3066. DOI: 10.1093/nar/gkf436
15. Price M.N., Dehal P.S., Arkin A.P. FastTree 2 – Approximately Maximum-Likelihood Trees for Large Alignments. // PLoS ONE. – 2010. – V.5. – N.3. – P.9490. DOI: 10.1371/journal.pone.0009490
16. Elbe S., Buckland-Merrett G. Data, disease and diplomacy: GISAID’s innovative contribution to global health. // Global Challenges. – 2017. – V.1. – P.33-46. DOI: 10.1002/gch2.1018
Об авторах
А. К. НосковРоссия
Носков Алексей Кимович, к.м.н., директор
Ростов-на-Дону
О. А. Подойницына
Россия
Подойницына Оксана Андреевна, к.б.н., научный сотрудник лаборатории микробиологии холеры
Ростов-на-Дону
А. С. Водопьянов
Россия
Водопьянов Алексей Сергеевич, к.м.н., старший начный сотрудник лаборатории диагностики особо опасных инфекций
Ростов-на-Дону
Р. Р.В. Писанов
Россия
Писанов Руслан Вячеславович, к.б.н., и.о. заведующего лаборатории диагностики особо опасных инфекций
Ростов-на-Дону
Е. В. Ковалев
Россия
Ковалев Евгений Владимирович, руководитель Управления
Ростов-на-Дону
Н. А. Пеньковская
Россия
Пеньковская Наталья Александровна, руководитель, главный государственный санитарный врач по Республике Крым
и г.Севастополю
Симферополь
С. С. Слись
Россия
Слись Сергей Сергеевич, главный специалист-эксперт отдела эпидемиологического надзора
Ростов-на-Дону
Е. Г. Янович
Россия
Янович Евгения Григорьевна, к.м.н., младший научный сотрудник лаборатории эпидемиологии особо опасных инфекций
Ростов-на-Дону
Д. А. Кузнецова
Россия
Кузнецова Дарья Александровна, научный сотрудник лаборатории микробиологии чумы
Ростов-на-Дону
С. О. Водопьянов
Россия
Водопьянов Сергей Олегович, д.м.н., и.о. зав. лабораторией биохимии микробов
Ростов-на-Дону
О. С. Чемисова
Россия
Чемисова Ольга Сергеевна, к.б.н., и.о. зав. музея живых культур
Ростов-на-Дону
Рецензия
Для цитирования:
Носков А.К., Подойницына О.А., Водопьянов А.С., Писанов Р.Р., Ковалев Е.В., Пеньковская Н.А., Слись С.С., Янович Е.Г., Кузнецова Д.А., Водопьянов С.О., Чемисова О.С. Сравнительный анализ геномного разнообразия SARS-COV-2, циркулирующих на территориях ростовской области и республики крым в период с марта по июнь 2021 г. Медицинский вестник Юга России. 2021;12(3):62-71. https://doi.org/10.21886/2219-8075-2021-12-3-62-71
For citation:
Noskov A.K., Podoynitsina O.A., Vodopianov A.S., Pisanov R.V., Kovalev E.V., Penkovskaya N.A., Slis S.S., Yanovich E.G., Kuznetsova D.A., Vodopianov S.O., Chemisova O.S. Comparative analysis of the genomic diversity of SARS-COV-2 circulating in the territories of the Rostov region and the republic of Crimea in the period from March to June 2021. Medical Herald of the South of Russia. 2021;12(3):62-71. (In Russ.) https://doi.org/10.21886/2219-8075-2021-12-3-62-71







































