Перейти к:
Исследование структуры бесплодия и исходов программ ВРТ у пациенток позднего репродуктивного возраста
https://doi.org/10.21886/2219-8075-2022-13-2-59-71
Аннотация
Цель: сравнительное изучение структуры бесплодия и исходов программ ВРТ среди пациенток разных возрастных групп.
Материалы и методы: изучены истории болезни 180 пациенток с бесплодием: I группа ≥ 35 лет; II группа < 35 лет. Проведены лабораторные и ммуногистохимические исследования, оценены исходы ВРТ.
Результаты: в I группе определялся укороченный менструальный цикл по сравнению со II группой (27,15±3,39 дней vs 29,57±2,38 дней, p=0,001). Также в I группе чаще обнаруживались воспалительные заболевания (p=0,05), односторонняя тубэктомия в анамнезе (p=0,019); повышенные уровни ФСГ (9,73±2,43 vs 8,74±2,50), снижение концентрации ЛГ, прогестерона, АМГ (p<0,05). В клетках аспирата полости матки у пациенток I группы отмечалось повышенное содержание рецепторов к прогестерону и сниженная концентрация рецепторов к эстрогену (p<0,05). У пациенток I группы получали меньшее количество ооцитов (8,34±3,51 vs 10,78±4,37) и качественных эмбрионов к 5-му дню культивирования (82,7% vs 87,97%; p<0,05). Количество беременностей в I и II группах — 22,22% и 36,67% соответственно, живорождений — 14,44% и 27,78% (p<0,05). У родивших пациенток наблюдались повышенный уровень прогестерона, большая толщина эндометрия, большее количество ооцитов при трансвагинальной пункции и качественных эмбрионов.
Заключение: факторами, снижающими фертильность, служили генитальная патология, угнетение функции яичников, истощение фолликулярного резерва. Меньшее количество живорождений сопряжено с дефектами эмбрионального и имплантационного факторов.
Для цитирования:
Урюпина К.В., Куценко И.И., Кравцова Е.И., Лукошкина И.Н., Томина О.В., Каушанская Л.В. Исследование структуры бесплодия и исходов программ ВРТ у пациенток позднего репродуктивного возраста. Медицинский вестник Юга России. 2022;13(2):59-71. https://doi.org/10.21886/2219-8075-2022-13-2-59-71
For citation:
Uryupina K.V., Kutsenko I.I., Kravtsovа E.I., Lukoshkina I.N., Tomina O.V., Kaushanskaya L.V. Investigation of the infertility structure and outcomes of ART programs in patients of late reproductive age. Medical Herald of the South of Russia. 2022;13(2):59-71. (In Russ.) https://doi.org/10.21886/2219-8075-2022-13-2-59-71
Введение
Тенденцией последних десятилетий стало отодвигание деторождения на более поздний период времени [1], что порождает ряд проблем, связанных с прогрессирующим возрастным нарушением фертильности. Одной из причин данного явления может служить естественное уменьшение фолликулярного резерва, сопровождающегося снижением продукции антимюллерова гормона (АМГ), ингибина В, повышением концентрации ФСГ в фолликулиновую фазу [2][3]. Тем не менее, прогностическое значение указанных гормонов в отношении бесплодия не всегда подтверждается. Изучена связь маркеров овариального резерва (АМГ, ФСГ, ингибин В) с фертильностью пациенток в возрасте 30–44 лет, при этом не было выявлено связи между уменьшением резерва яичников и снижением фертильности [4]. В другом исследовании подтверждается прямая корреляционная связь между количеством антральных фолликулов, полученных стимулированием в длинном протоколе, с частотой клинической беременности: у женщин с 1–8 антральных фолликулов беременность наступала в 28,25% случаев, а при количестве антральных фолликулов >18 беременность диагностировали у 40,13% женщин [5].
Также одной из причин нарушения фертильности в старшем репродуктивном возрасте является отягощенный гинекологический анамнез. Инфекционные процессы и хронический эндометрит, несомненно, служат факторами риска бесплодия. Так, у 45% бесплодных пациенток в анамнезе был хронический эндометрит. К другим факторам риска относят повышенный индекс массы тела, стресс, курение обоих супругов [6]. У пациенток с эндометриозом вероятность зачатия даже с использованием ЭКО значительно снижается [7]. Наблюдающаяся при эндометриозе дисрегуляция гипоталамо-гипофизарно-яичниковой оси и воспалительная реакция, индуцированная эктопическими очагами эндометрия, формирует неблагоприятную микросреду фолликулов, что в конечном итоге снижает компетентность ооцитов и восприимчивость эндометрия [8]. Гиперпластические процессы эндометрия, внутриматочные спайки, подслизистые и интрамуральные миоматозные узлы и аденомиоз значительно осложняют имплантацию зародыша [9]. Онкологическая патология и связанная с ней терапия могут стать причиной снижения фертильности [10].
В значительном ряде случаев при сознательном откладывании беременности преодолеть возрастное снижение фертильности помогают вспомогательные репродуктивные технологии (ВРТ) и криоконсервация ооцитов. Однако даже в этом случае вероятность успеха значительно снижена по сравнению с пациентками в более молодых возрастных группах [11]. Перечисленные выше факты подчеркивают актуальность всестороннего изучения причин бесплодия у пациенток старшего репродуктивного возраста с целью повышения эффективности программ ВРТ у данного контингента.
Цель исследования — сравнительное изучение структуры бесплодия и исходов программ ВРТ среди пациенток разных возрастных групп.
Материалы и методы
Исследование проводилось на базе акушерско-гинекологической клиники репродукции «Эмбрио» (Сочи). Все участницы исследования (n=180) дали информированное согласие на исследование и публикацию его результатов.
Критерии включения в исследование — возраст 25–48 лет, продолжительность бесплодия не менее 3 лет, фертильная или субфертильная сперма супруга, нормальный кариотип у обоих супругов, сохранный менструальный цикл, отсутствие тяжелой соматической и онкологической патологии.
Изучены данные клинических и лабораторных и инструментальных методов, исследования в том числе содержание половых гормонов, уровень антимюллерова гормона (АМГ), маркеры инфекционных агентов, УЗИ малого таза, иммуногистохимическое исследование аспирата полости матки (пайпель-биопсия) с определением прогестероновых (PR) и эстрогеновых (ER) рецепторов, плазматических клеток, NK-клеток, LIF, оценка оогенеза и эмбриогенеза и анализ исходов процедур ВРТ.
Когорта пациенток были разделена на две равные возрастные группы. I группа — ≥35лет (38,78±3,31 лет), 90 человек, II группа — моложе 35 лет (29,5±2,60 лет), 90 человек. В дальнейшем в зависимости от примененного протокола ВРТ произведено разделение на подгруппы. Короткую схему (с использованием антагонистов гонадотропин-релизинггормона, ант-ГнРГ) получали 45 пациенток в I группе (IA) и 48 — во II (IIA). Длинную схему (назначали агонисты гонадотропин-релизинг гормона аГнРГ) получали 45 пациенток в I группе (IБ) и 42 — во II (IIБ).
Статистический анализ данных выполняли в программе SPSS. Разницу в значениях категориальных переменных оценивали посредством таблиц сопряженности с использованием критерия Хи-квадрат Пирсона. При оценке непрерывных переменных в случае нормального распределения применяли Т-критерий Стъюдента, для непараметрических данных — U-критерий Манна-Уитни. Пороговым значением значимости считали p=0,05.
Результаты
Продолжительность бесплодия для всей когорты составила 6,77±3,92 года. В I группе — 9,02±4,51 года, во II — 4,51±1,74 года (p<0,05), что представляется закономерным следствием возрастных различий между группами. Внутри каждой группы продолжительность бесплодия по подгруппам (в зависимости от протокола стимуляции) достоверно не различалась.
Возраст менархе статистически не различался между группами и составил 13,58±1,6 лет в I группе и 13,43±1,64 лет — во II. Длительность менструального цикла— в среднем 28,36±3,16 дней. Между группами наблюдались существенные различия в его продолжительности. Более короткая продолжительность менструального цикла наблюдалась среди пациенток в I группе (p=0,001), что может быть связано как с накопившейся с возрастом патологией, так и с падением продукции прогестерона желтым телом во второй фазе менструального цикла. Внутри каждой группы достоверных различий не наблюдалось, что подтверждает групповую однородность.
Между двумя возрастными группами выявлены достоверные различия (p<0,05) по частоте обнаружения первичного и вторичного бесплодия: в I группе вторичное бесплодие было диагностировано у 51 пациенток из 90, а во II — у 11 из 90. Вероятным объяснением такого распределение служит то, что частота патологии, приводящая к бесплодию, повышается с возрастом и пациентки в I группе могли быть ранее фертильными. Трубно-перитонеальный фактор бесплодия у пациенток I группы обнаруживался чаще, чем во II (p=0,063).
Такое распределение, вероятно, объясняется возрастным аккумулированием воспалительной патологии, которая может нарушать проходимость маточных труб. Для уточнения этого аспекта сравнили частоту генитальной патологии в обеих группах.
В I группе достоверно чаще наблюдалась реализация наследственных нарушений свертывания, препятствующих зачатию и беременности (36,6% vs 11,1%, p=0,001). Анализ частоты экстрагенитальной патологии не обнаружил статистически достоверной разницы между группами (р>0,05).
Итоговое число оперативных вмешательств у пациенток I группы было статистически значимо выше (p=0,009). Наиболее часто выполнялась односторонняя тубэктомия (p=0,019), что, вероятно, свидетельствует о наличии исходного провоспалительного фона.
Средние показатели гормонального профиля всех пациенток находились в пределах нормальных референсных интервалов. Однако наблюдалось статистически значимое возрастание уровня ФСГ у пациенток I группы, составившее 9,73±2,43 пг/мл против 8,74±2,50 пг/мл во II группе (p=0,008). Повышение уровня ФСГ может быть маркером тенденции к уменьшению фолликулярного резерва, что наблюдается у пациенток старших возрастных групп. Пониженные значения ЛГ в I группе 7,05±2,4 пг/мл против 8,01±2,1 у пациенток IIгруппы, (p=0,011) могут свидетельствовать о недостаточной стимуляции яичников со стороны гипофиза. Недостаток ЛГ или несвоевременный пик его концентрации может быть причиной неудач ВРТ. Выбранная схема прегравидарной подготовки достоверно не влияла на содержание ЛГ и ФСГ. Повышенные уровни пролактина могут замедлять созревание яйцеклеток и приводить к ановуляции, однако в когорте этот показатель в основном был в пределах нормальных значений (86-650 МЕ/л). Концентрация пролактина между группами и в зависимости от схем прегравидарной подготовки практически не отличалась и составила 193,57±60,46 пг/мл в Iгруппе и 208,22±96,88 пг/мл во IIгруппе, р>0,05. Уровень эстрадиола в периферической крови между возрастными группами и внутри групп статистически значимо не различался, составив 299,222±145,79 пг/мл в I группе и 287,64±142,75пг/мл — во II (р>0,05). Концентрация прогестерона в I группе составила (29,03±17,95 пг/мл) и была достоверно ниже (p<0,05), чем во IIгруппе (34,77±17,24), что на фоне сохраняющегося уровня эстрадиола свидетельствует об относительной гиперэстрогенемии у пациенток старшего репродуктивного возраста.
Антимюллеров гормон (АМГ) наряду с фолликулярным резервом и возрастом пациенток служит предиктором наступления беременности. В целом для когорты средний уровень АМГ равнялся 3,13±1,93 нг/мл, были выявлены достоверные различия между двумя группами. Пониженное значение АМГ у пациенток I группы (2,78±1,92 пг/мл) по сравнению с 3,48±1,89 пг/мл (II группа) может указывать на нарушение процесса созревания фолликулов, что в свою очередь снижает вероятность наступления беременности.
Измеренная при УЗ-исследовании толщина эндометрия в когорте в среднем равнялась 7,78±2,45 мм: 7,50±2,21 мм для I группы, 8,06±2,66 мм (p=0,125) — для II. Снижение толщины эндометрия в старшей возрастной группе подтверждает предположение о недостаточности пролиферативной фазы, что дополняется показанным выше снижением уровнем прогестерона в старшей группе. Снижение овариального резерва (определяемого по числу зрелых фолликулов на УЗИ) наблюдалось у 30 (33%) пациенток ≥35 лет и только у 3 (3,3%) пациенток до 35 лет (p<0,05), поскольку с возрастом пул фолликулярных клеток уменьшается.
При проведении пайпель-биопсии на 19–21 дни менструального цикла в I группе выявлены статистически значимо пониженные концентрации ER и повышенные концентрации PR в железистом эпителии и в стромальных клетках эндометрия по сравнению с аналогичными показателями во II группе. В крови пациенток I группы определяли немного более высокие уровни эстрогена и достоверно сниженные значения прогестерона по сравнению с концентрацией этих гормонов у пациенток второй группы. Повышенная концентрация рецепторов к прогестерону может быть компенсаторной реакцией на снижение его концентрации у пациенток ≥35 лет (табл. 1).
Таблица / Table 1
Концентрация (в баллах) эстрогеновых (ER) и прогестероновых (PR) рецепторов в железистом эпителии и стромальных клетках эндометрия
Concentration (in points) of estrogen (ER) and progesterone (PR) receptors in the glandular epithelium and stromal cells of the endometrium
|
Рецепторы и их локализация Receptors and their localization |
I группа / group |
II группа / group |
Вся когорта All cohort |
p |
|
ER в клетках железистого эпителия ER in the cells of the glandular epithelium |
112,12± 40,96 |
124,92± 41,39 |
118,52± 41,56 |
0,038 |
|
ER в клетках стромы ER in stromal cells |
121,72± 27,67 |
132,68± 30,30 |
127,2± 29,45 |
0,012 |
|
PR в клетках железистого эпителия PR in the cells of the glandular epithelium |
174,23± 30,23 |
160± 30,05 |
167,52± 30,80 |
0,003 |
|
PR в клетках стромы PR in stromal cells |
163,49± 30,57 |
138,96± 33,35 |
151,22± 34,19 |
0,001 |
В представленной ниже таблице показано содержание остальных маркеров эндометрия (табл. 2).
Таблица / Table 2
Маркеры бесплодия в эндометрии (в количестве клеток в поле зрения, экспрессирующих данный маркер)
Infertility markers in the endometrium (in the number of cells in the visual field expressing this marker)
|
Маркеры и их локализация Markers and their localization |
I группа / group |
II группа / group |
p |
|
HLA-DR (MHC II) |
18,23± 8,81 |
19,91± 8,40 |
0,217 |
|
CD56 (NK-клетки) CD56 (NK-cells) |
12,96± 5,03 |
14,34± 5,26 |
0,073 |
|
CD138 (плазмоциты) CD138 (plasma cells) |
2,07± 1,39 |
2,02± 0,76 |
0,837 |
|
LIF в железистом эпителии, % LIF in the glandular epithelium, % |
22± 7,59 |
26,1± 5,86 |
0,003 |
|
LIF в клетках стромы, % LIF in stromal cells, % |
21,3± 5,96 |
26,1± 3,00 |
0,003 |
Достоверных различий по большинству указанных показателей не наблюдалось. Уровень значимости, приближающийся к пороговому (p=0,073), определялся для уровня CD56 (NK-клетки), повышенное число которых свидетельствует о напряжении клеточного иммунитета преимущественно у пациенток во II группе. Повышение уровня NK-клеток сопряжено с бесплодием [12]. У пациенток I группы был статистически значимо снижен LIF как в железистом эпителии, так и в клетках стромы, что свидетельствует о сниженной способности эндометрия к имплантации.
В результате проведения 180 циклов стимуляции овуляции было получено 1721 ооцитов: 751 в I группе, 970 – во II. В I группе количество полученных ооцитов было достоверно меньше, составив 8,34±3,51 против 10,78±4,37 ооцита на одну индукцию во II группе (p<0,001), медианные значения составили 8 и 10 ооцитов на 1 пациентку соответственно (рис. 1).
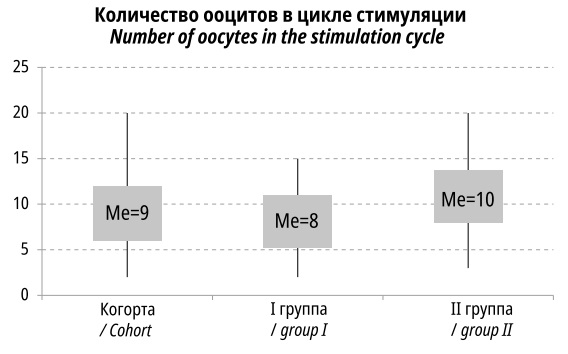
Рисунок 1. Количество ооцитов, полученных в цикле стимуляции овуляции (прямоугольник охватывает 25–75% персентили, верхние и нижние полюсы диаграмм отражают максимальные и минимальные значения)
Figure 1. The number of oocytes obtained in the ovulation stimulation cycle (the rectangle covers 25–75% of the percentile, the upper and lower poles of the diagrams reflect the maximum and minimum values)
Вероятным объяснением меньшего числа ооцитов в старшей возрастной группе является снижение овариального резерва, что согласуется с пониженным числом антральных фолликулов, о чем было сказано ранее.
Из 1721 ооцита, полученных в ходе индукции овуляции зрелыми и качественными, были признаны 1386 ооцита (80,5% от всех полученных), остальные были незрелыми (12,5%) или дегенеративными (7%) (рис. 2). Количество зрелых ооцитов в I группе составило 533, 853 — во II.
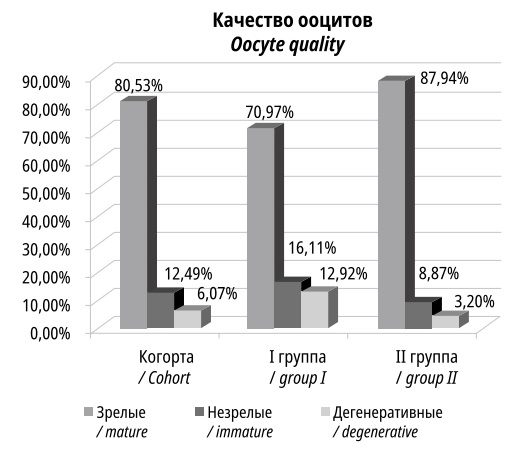
Рисунок 2. Число зрелых, незрелых и дегенеративных ооцитов
Figure 2. The number of mature, immature and degenerative oocytes
Снижение числа зрелых ооцитов в I группе может быть следствием недостаточной стимуляции со стороны гипофиза и возрастного угасания функции яичников. Для процедур ВРТ использовали зрелые ооциты хорошего качества.
1386 ооцитов было оплодотворено, из них было получено только 977 (70,5%) эмбрионов хорошего и удовлетворительного качества.
У пациенток 35 лет и старше число ооцитов, подходящих для оплодотворения, было ниже (4,11±1,43 против 6,74±2,92), чем во II группе (p<0,001). Медианные значения также существенно различались (рис. 3).
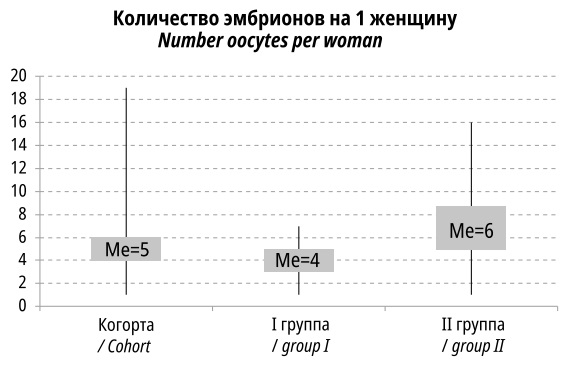
Рисунок 3. Количество оплодотворенных яйцеклеток на 1 пациентку
Figure 3. Number of fertilized eggs per woman
Различия в протоколах прегравидарной подготовки не проводили к достоверным различиям в числе полученных эмбрионов (табл. 3).
Таблица / Table 3
Количество полученных эмбрионов в подгруппах
Number of received embryos in subgroups
|
Показатели Indicators |
IA |
IБ |
IIA |
IIБ |
|
Общее количество Total amount |
186 |
184 |
333 |
274 |
|
Средн±SD Average±SD |
4,13±1,42 |
4,09±1,46 |
6,94±3,08 |
6,52±2,75 |
|
Медиана Median |
4 |
4 |
6 |
6 |
|
25%-персентиль 25%-persentile |
3 |
3 |
5 |
4,25 |
|
75%-персентиль 75%-persentile |
5 |
5 |
9 |
8 |
|
Min |
1 |
1 |
1 |
1 |
|
Max |
6 |
7 |
16 |
12 |
|
Значимость Significance |
P=0,607 |
P=0,636 |
||
Таким образом, до момента оплодотворения яйцеклеток не удалось выявить существенных различий, обусловленных протоколом стимуляции. Основные различия наблюдались только между разными возрастными группами.
На 3-и и 5-е сутки после оплодотворения проводилась ревизия качества эмбрионов (выполнялась эмбриологом). Окончательную оценку по Гарднеру проводили на 5-й день (табл. 4). Некачественные эмбрионы утилизировались.
Таблица / Table 4
Оценка качества эмбрионов по Гарднеру
Assessment of the quality of embryos according to Gardner
|
Количество эмбрионов Number of embryos |
Вся когорта All cohort |
I группа / group |
II группа / group |
|
|
Общее количество Total amount |
840 |
306 |
534 |
|
|
Средн±SD Average±SD |
4,51±1,05 |
4,32±0,98 |
4,69±1,09 |
|
|
Медиана Median |
5 |
4 |
5 |
|
|
25%-персентиль 25%-persentile |
4 |
4 |
4 |
|
|
75%-персентиль 75%-persentile |
5 |
5 |
6 |
|
|
Min |
3 |
3 |
3 |
|
|
Max |
6 |
6 |
6 |
|
|
Значимость Significance |
|
p=0,018 |
||
Note: significant differences are marked in bold (p <0,05)
Статистический анализ данных выявил существенное снижение качества эмбрионов (p=0,018) у пациенток I группы в старшем репродуктивном возрасте. Во II группе отмечалось более высокое качество эмбрионов.
На 5-е сутки в I группе осталось 306 эмбрионов, пригодных к эмбриопереносу, во II группе — 534 (p<0,001), что примерно соответствует распределению полученных ооцитов. По отношению к количеству качественных эмбрионов, полученных сразу после оплодотворения, содержание качественных эмбрионов к 5-му дню культивирования составило 85,98% (82,70% в I, 87,97% — во II (рис. 4). Свой вклад в утрату качественных эмбрионов могли внести анеуплоидии, частота которых увеличивается с возрастом пациентки.
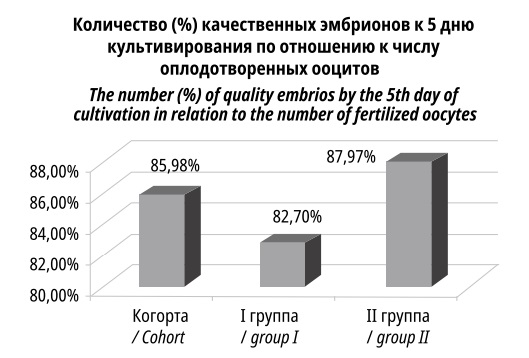
Рисунок 4. Отношение числа эмбрионов хорошего качества по отношению к числу оплодотворенных ооцитов
Figure 4. The ratio of the number of good quality embryos to the number of fertilized oocytes
Выбор протокола стимуляции не отразился на качестве эмбрионов (p=0,940). Таким образом качество полученных эмбрионов зависело в основном от возраста, а не от протокола стимуляции.
Из всей когорты у 53 (29,40%) пациенток по результатам УЗИ и лабораторных тестов была диагностирована беременность. В I группе беременность наступила в 20 (22,22%) случаях, во II — в 33 (36,67%) случаев (p=0,034). При этом не наблюдалось значительных расхождений в зависимости от протокола стимуляции (табл. 5).
Таблица / Table 5
Различие по частоте наступления беременности в зависимости от возраста (группы) и протокола стимуляции (подгруппы)
Difference in pregnancy rate depending on age (group) and stimulation protocol (subgroup)
|
_Когорта, % (n) Cohort, % (n) |
|
|||
|
Частота Frequency |
29,43% (53) |
|||
|
Группы Groups |
I (≥35 лет) I (≥35 years old) |
II(<35 лет) II (<35 years old) |
||
|
Частота Frequency |
22,22% (20) |
36,67% (33) |
||
|
P (Хи-кв.) P (Chi-square) |
p=0,034 |
|||
|
Подгруппы Subgroups |
IA |
IБ |
IIA |
IIБ |
|
Частота Frequency |
10% (9) |
12,22% (11) |
22,22% (20) |
14,44% (13) |
|
P (Chi-square) |
p=0,612 |
p=0,293 |
||
Note: significant differences are marked in bold (p <0,05)
Полученные результаты совпадают с описанным в литературе снижением фертильности у пациенток с возрастом, особенно в диапазоне 31–38 лет [13][14]. Также были проанализированы потенциальные предикторы наступления беременностидля всей когорты пациенток (табл. 6).
Таблица / Table 6
Распределение ряда параметров при наступлении и отсутствии беременности для всей когорты
Distribution of a number of parameters in the onset and absence of pregnancy for the whole cohort
|
Уровень Indicators |
Параметры Options |
(+) беременность (+) pregnancy |
(-) беременность (-) pregnancy |
P |
|
ФСГ FSH |
Средн.±SD |
9,41±1,91 |
9,16±2,72 |
0,626 |
|
Пролактин Prolactin |
Средн.±SD |
194,1±72,67 |
203,72±84,15 |
0,468 |
|
Прогестерон Progesterone |
Средн.±SD |
40,44±17,50 |
28,33±16,71 |
<0,001 |
|
Е2 |
Средн.±SD |
301,08±151,09 |
289,25±141,56 |
0,617 |
|
ЛГ LH |
Средн.±SD |
7,89±1,91 |
7,37±2,48 |
0,132 |
|
АМГ AMG |
Средн.±SD |
2,84±1,98 |
3,25±1,91 |
0,189 |
|
Толщина эндометрия Endometrial thickness |
Средн.±SD |
9,18±2,25 |
7,19±2,30 |
<0,001 |
|
Число ооцитов Oocyte count |
Средн.±SD |
11,21±4,33 |
8,87±3,86 |
0,001 |
|
Число эмбрионов к 5 дню Number of embryos by day 5 |
Средн.±SD |
5,60±3,27 |
4,28±2,24 |
0,023 |
Note: significant differences are marked in bold (p <0,05)
Как видно из данных, представленных в таблице, повышенная частота наступления беременности совпадает с более высокими уровнями прогестерона, большей толщиной эндометрия, повышенным числом ооцитов и эмбрионов к 5-му дню культивирования. Указанные параметры говорят о лучшей готовности эндометрия к имплантации и о повышенном качестве эмбрионов у пациенток с наступившей беременностью (табл. 6, 7).
Таблица / Table 7
Содержание гормонов в крови пациенток
The content of hormones in the blood of patients
|
Группы Groups |
I |
II |
||
|
Беременность Pregnancy |
(+) беременность (+) pregnancy |
(-) берем (-) pregnancy |
(+) берем (+) pregnancy |
(-) берем (-) pregnancy |
|
N |
20 |
70 |
33 |
57 |
|
ФСГ, M±SD FSH, M±SD |
10,09±1,74 |
9,63±2,59 |
8,99±1,92 |
8,60±2,79 |
|
p |
0,455 |
0,471 |
||
|
0,008 |
||||
|
Пролактин, M±SD Prolactin, M±SD |
206,5±53,14 |
189,87±62,24 |
186,59±82,16 |
220,74±103,07 |
|
p |
0,280 |
0,107 |
||
|
0,225 |
||||
|
Прогестерон, M±SD Progesterone, M±SD |
36,88±21,93 |
26,79±16,13 |
42,61±14,12 |
30,23±17,35 |
|
p |
0,067 |
<0,001 |
||
|
0,030 |
||||
|
Е2, M±SD |
335,55±169,42 |
288,84±137,92 |
280,19±137,34 |
289,75±147,15 |
|
p |
0,208 |
0,762 |
||
|
0,547 |
||||
Note: significant differences are marked in bold (p <0,05)
Хотя ФСГ (до протокола стимуляции) был повышен у пациенток с наступившей беременностью, это различие не было достоверным между беременными и небеременными, но имелись выявленные ранее повышенные уровни ФСГ в крови пациенток I группы. Различия в уровне прогестерона между беременными и небеременными были сильнее выражены во II группе (p<0,001 и p=0,067 соответственно) (табл. 8).
Таблица / Table 8
Параметры пациенток с разным исходом ВРТ
Parameters of patients with different ART outcomes
|
Группы Groups |
I |
II |
||
|
Беременность Pregnancy |
(+) беременность (+) pregnancy |
(-) беременность (-) pregnancy |
(+) беременность (+) pregnancy |
(-) беременность (-) pregnancy |
|
N |
20 |
70 |
33 |
57 |
|
ЛГ, M±SD LH, M±SD |
7,83±2,25 |
6,82±2,45 |
7,92±1,72 |
8,05±2,37 |
|
p |
0,085 |
0,882 |
||
|
0,011 |
||||
|
АМГ, M±SD AMG, M±SD |
1,74±1,32 |
3,07±1,97 |
3,51±2,02 |
3,46±1,82 |
|
p |
0,007 |
0,956 |
||
|
0,012 |
||||
|
Толщина эндометрия, M±SD Endometrial thickness, M±SD |
8,95±1,73 |
7,08±2,16 |
9,33±2,53 |
7,32±2,46 |
|
p |
0,001 |
<0,001 |
||
|
0,129 |
||||
|
Число ооцитов, M±SD Oocyte count, M±SD |
9,20±3,53 |
8,10±3,49 |
12,42±4,37 |
9,82±4,12 |
|
p |
0,225 |
0,004 |
||
|
<0,001 |
||||
|
Число эмбрионов к 5 дню, M±SD Number of embryos by day 5, M±SD |
3,55±1,36 |
3,36±1,60 |
6,85±3,47 |
5,40±2,40 |
|
p |
0,308 |
0,055 |
||
|
<0,001 |
||||
Note: significant differences are marked in bold (p<0,05)
Уровень АМГ у пациенток ≥35 лет с установленной беременностью оказался ниже, чем у небеременных. Это может быть связано с особенностью обследованной популяции, а также с тем, что анализ на АМГ выполнялся в циклах, предшествующих ВРТ. Во II группе достоверных различий по уровню АМГ не наблюдалось.
В обеих группах толщина эндометрия была достоверно выше у пациенток с наступившей беременностью, что отражает лучшую готовность слизистой матки к имплантации эмбриона. Во II группе число полученных ооцитов (p=0,004) и качественных эмбрионов к 5-му дню (p=0,055) лучше коррелировало с наступлением беременности, чем в I группе.
Во II группе число ооцитов и качественных эмбрионов к 5-му дню дробления было выше в случае наступления беременности. Возможно, структура бесплодия различается по возрастам, и в возрасте 35 лет и старше основными причинами нарушения служат состояния эндометрия и качество эмбрионов (повышается вероятность анеуплоидий), в более молодых возрастных группах исход ВРТ больше зависит от эффективности гаметогенеза и качества самого эмбриона. Не исключено, что в старшей возрастной группе частота бесплодия сильнее связана с рецептивностью эндометрия, нежели с качеством эмбрионов.
Из 180 обследованных пациенток у 38 (21,11%) были зарегистрированы живорождения (13 (14,44%) в I группе, у 25 (27,78%) (p=0,028) — во II). Таким образом, наблюдалось почти двукратное превышение числа живорождений во II группе. Внутри обеих групп не было достоверных различий в зависимости от протокола стимуляции (I — p=0,76; II — p=0,208).
Далее были рассмотрены возможные предикторы частоты живорождений (табл. 9).
Таблица / Table 9
Распределение уровня гормонов у родивших пациенток и остальной когорты
Distribution of parameters in women who gave birth and in the rest of the cohort
|
Уровень Indicators |
Параметры Options |
(+) роды (+) childbirth |
(-) роды (-) childbirth |
P |
|
ФСГ FSH |
Средн.±SD Average±SD |
9,34±1,67 |
9,21±2,69 |
0,707 |
|
Пролактин Prolactin |
Средн.±SD Average±SD |
187,67±72,19 |
204,43±82,90 |
0,258 |
|
Прогестерон Progesterone |
Средн.±SD Average±SD |
40,39±17,27 |
29,63±17,28 |
0,001 |
|
Е2 |
Средн.±SD Average±SD |
293,35±154,45 |
292,57±141,79 |
0,976 |
|
ЛГ LH |
Средн.±SD Average±SD |
8,20±1,77 |
7,35±2,44 |
0,035 |
|
АМГ AMG |
Средн.±SD Average±SD |
2,80±2,03 |
3,22±1,90 |
0,211 |
|
Толщина эндометрия Endometrial thickness |
Средн.±SD Average±SD |
10,21±1,44 |
7,13±2,25 |
<0,001 |
|
Число ооцитов Oocyte count |
Средн.±SD Average±SD |
12,61±3,50 |
8,75±3,92 |
<0,001 |
|
Число эмбрионов к 5-му дню Number of embryos by day 5 |
Средн.±SD Average±SD |
6,32±3,13 |
4,22±2,31 |
<0,001 |
Note: significant differences are marked in bold (p<0,05)
Полученные результаты в целом повторяют тенденции, обнаруженные при диагностированной беременности. У родивших пациенток определялись повышенные уровни прогестерона, ЛГ, диагностирован более толстый эндометрий, большее число ооцитов и эмбрионов к 5-му дню культивирования (табл. 10).
Таблица / Table 10
Значения ряда параметров у пациенток
Values of a number of parameters in patients
|
Группы Groups |
I |
II |
||
|
Беременность Pregnancy |
(+) роды |
(-) роды |
(+) роды |
(-) роды |
|
N |
13 |
77 |
25 |
65 |
|
ФСГ, M±SD FSH, M±SD |
9,91±2,00 |
9,70±2,50 |
9,04±1,42 |
8,62±2,81 |
|
p |
0,769 |
0,482 |
||
|
0,008 |
||||
|
Пролактин, M±SD Prolactin, M±SD |
207,46±52,24 |
191,22±61,73 |
177,38±79,67 |
220,08±100,78 |
|
p |
0,373 |
0,061 |
||
|
0,258 |
||||
|
Прогестерон, M±SD Progesterone, M±SD |
32,92±20,92 |
28,37±17,47 |
44,28±13,96 |
31,11±17,06 |
|
p |
0,401 |
0,001 |
||
|
0,001 |
||||
|
Е2, M±SD |
341,46±172,42 |
292,09±140,86 |
268,34±141,45 |
293,14±143,98 |
|
p |
0,261 |
0,464 |
||
|
0,976 |
||||
|
ЛГ, M±SD LH, M±SD |
8,28±1,79 |
6,84±2,47 |
8,16±1,80 |
7,95±2,28 |
|
p |
0,039 |
0,586 |
||
|
0,035 |
||||
|
АМГ, M±SD AMG, M±SD |
1,69±1,36 |
2,96±1,95 |
3,37±2,10 |
3,52±1,82 |
|
p |
0,032 |
0,669 |
||
|
0,211 |
||||
|
Толщина эндометрия, M±SD Endometrial thickness, M±SD |
9,85±1,28 |
7,10±2,09 |
10,39±1,50 |
7,16±2,45 |
|
p |
<0,001 |
<0,001 |
||
|
<0,001 |
||||
|
Число ооцитов, M±SD Oocyte count, M±SD |
10,85±3,34 |
7,92±3,37 |
13,52±3,28 |
9,72±4,30 |
|
p |
0,006 |
<0,001 |
||
|
<0,001 |
||||
|
Число эмбрионов к 5 дню, M±SD Number of embryos by day 5, M±SD |
4,08±1,32 |
3,29±1,55 |
7,52±3,16 |
5,32±2,57 |
|
p |
0,056 |
0,004 |
||
|
<0,001 |
||||
Note: significant differences are marked in bold (p<0,05)
Как и при анализе наступления беременности, частота живорождений, очевидно, совпадает с повышенными уровнями ЛГ, прогестерона, большей толщиной эндометрия, большим числом полученных ооцитов и эмбрионов к 5-му дню культивирования. Для значений пролактина, ФСГ и эстрадиола не было выявлено достоверных корреляций с исходом ВРТ.
Обсуждение
Проведенное исследование когорты из 180 пациенток с бесплодием в анамнезе позволило выявить ряд факторов, совпадающих с нарушением фертильности у пациенток ≥35 лет. По сравнению со II группой у них определялась большая продолжительность бесплодия (9,02±4,51 vs 4,51±1,74 лет) и повышенная частота вторичного бесплодия (28,3% vs 6,1%). У пациенток старше 34 лет чаще обнаруживались воспалительные и онкологические заболевания (полипы, миомы, сальпингоофориты, эндометриты), что сопровождалось высокой частотой диагностики спаечных процессов, обнаружения трубно-перитонеального фактора бесплодия и односторонних тубэктомий в анамнезе (p<0,05). В I группе продолжительность менструального цикла составляла 27,15±3,39 дней, во II — 29,57±2,38 (p=0,001), и это, вероятно, отражает возрастное снижение продукции прогестерона желтым телом.
Уровень ЛГ в I (старшей) группе был достоверно снижен, а концентрация ФСГ, напротив, повышена по сравнению с аналогичными параметрами во II группе. Низкая выработка ЛГ может приводить к недостаточной стимуляции яичников со стороны гипофиза, а повышенное содержание ФСГ скорее отражает снижение овариального резерва, прогрессирующего с возрастом. Вероятным маркером угнетения функции яичников служит низкий уровень прогестерона у пациенток ≥35 лет (29,03±17,95 vs 34,77±17,24) и пониженная концентрация АМГ (2,78±1,92 vs 3,48±1,89) по сравнению со значениями этих показателей во II группе. Толщина эндометрия в I группе была недостоверно снижена, составив 7,50±2,21 мм, а для II группы — 8,06±2,66 мм (p=0,125). Снижение овариального резерва (по данным УЗИ) определялось у 33% пациенток в I группе и только у 3,3% во II. В аспирате слизистой оболочки матки обнаружилось достоверное повышение концентрации рецепторов к прогестерону и снижение концентрации эстрогеновых рецепторов, а также снижения уровня LIF у пациенток I группы. Таким образом, лабораторные и инструментальные данные свидетельствуют о накопленной генитальной патологии, снижении овариального резерва и недостаточной готовности эндометрия к имплантации у пациенток старшей возрастной группы.
С данными о снижении овариального резерва и нарушением гормональной регуляции в I группе согласуется достоверно меньшее число ооцитов и эмбрионов хорошего качества (p<0,05), которые удалось получить на разных стадиях культивирования. Причем доля эмбрионов хорошего качества к 5-му дню интенсивнее снижалась в I группе, что может говорить о скрытых дефектах, наличие которых невозможно установить по одним только морфологическим признакам.
В I группе беременность наступила у 22,22% пациенток, число живорождений составило 14,44%, во II группе —36,67% и 27,78% соответственно. Причем протокол стимуляции не влиял на исходы ВРТ. Это подтверждает описанное в литературе прогрессирующее снижение фертильности у пациенток в диапазоне 31–38 лет [9][10]. Наиболее надежными предикторами благоприятного исхода ВРТ оказались повышенный уровень прогестерона, большая толщина эндометрия, большое число ооцитов, полученных при трансвагинальной пункции и количество качественных эмбрионов к 5-му дню культивирования. Повышенная толщина функционального слоя эндометрия, по-видимому, связана с большой концентрацией прогестерона во вторую фазу менструального цикла и соответствует лучшей рецептивности эндометрия. Конечный успех процедур ВРТ определяется большой совокупностью факторов, но с возрастом увеличивается роль эндокринной, воспалительной, онкологической патологий, способных влиять на женскую фертильность, а также наблюдаются дефекты эмбрионального фактора и имплантационного фактора эндометрия.
Выводы
Проведенное исследование структуры бесплодия у пациенток ≥35 лет и моложе 35 лет позволило сделать следующие выводы:
- Беременность у пациенток ≥35 лет в результате проведенных процедур ВРТ составила 22,22%, а частота живорождения — у 14,44%, что достоверно значимо ниже, чем у пациенток <35 лет, где беременность и живорождение наблюдались в 36,67% и 27,78% (p<0,05).
- У пациенток ≥35 лет отмечались более низкие уровни прогестерона, сопровождающиеся реактивным повышением содержания рецепторов к прогестерону в эндометрии.
- У пациенток ≥35 лет выявлено достоверно значимое снижение имплантационного фактора эндометрия обеспечиваемое LIF.
- Концентрация АМГ в крови пациенток в старшей возрастной группе была достоверно ниже, чем в младшей и составила 2,78±1,92 против 3,48±1,89 (p=0,012), свидетельствуя о снижении овариального резерва.
- У пациенток в группе ≥35 лет было получено достоверно меньшее количество зрелых ооцитов и качественных эмбрионов, чем у пациенток моложе 35 лет (p<0,05), что соответствует возрастному истощению фолликулярного резерва и снижению качества ооцитов;
- Благоприятные исходы ВРТ чаще отмечались у пациенток с большей величиной функционального слоя эндометрия, высокой концентрацией прогестерона, большим числом зрелых ооцитов и качественных эмбрионов (p<0,05).
Список литературы
1. Соловьева Т.В., Карасева А.С. Факторы детерминации позднего деторождения у женщин фертильного возраста в республике Мордовия. // Казанский социально-гуманитарный вестник. – 2018. – №4.– C.32-35. DOI: 10.24153/2079-5912-2018-9-4-32-35.
2. Broer S.L., van Disseldorp J., Broeze K.A., Dolleman M., Opmeer B.C., Bossuyt P., Eijkemans M.J.C., Mol B.W.J., Broekmans F.J.M. Added value of ovarian reserve testing on patient characteristics in the prediction of ovarian response and ongoing pregnancy: an individual patient data approach. // Hum. Reprod. Update. – 2013. – 19(1). – P.26-36. DOI: 10.1093/humupd/dms041.
3. Santoro N., Isaac B., Neal-Perry G., Adel T., Weingart L., Nussbaum A., Thakur S., Jinnai H., Khosla N., Barad D. Impaired folliculogenesis and ovulation in older reproductive aged women. // J. Clin. Endocrinol. Metab. – 2003. – 88(11). – P.5502-9. DOI: 10.1210/jc.2002-021839.
4. Steiner A.Z., Pritchard D., Stanczyk F.Z., Kesner J.S., Meadows J.W., Herring A.H., Baird D.D. Association Between Biomarkers of Ovarian Reserve and Infertility Among Older Women of Reproductive Age. // JAMA. – 2017. – 318(14). – P.1367-1376. DOI: 10.1001/jama.2017.14588.
5. Liao S., Xiong J., Tu H., Hu C., Pan W., Geng Y., Pan W., Lu T., Jin L. Prediction of in vitro fertilization outcome at different antral follicle count thresholds combined with female age, female cause of infertility, and ovarian response in a prospective cohort of 8269 women. // Medicine (Baltimore). – 2019. – 98(41). – P.e17470. DOI: 10.1097/MD.0000000000017470.
6. Bashiri A., Halper K.I., Orvieto R. Recurrent Implantation Failure-update overview on etiology, diagnosis, treatment and future directions. // Reprod. Biol. Endocrinol. – 2018. – 16(1). – P.121. DOI: 10.1186/s12958-018-0414-2.
7. Tanbo T., Fedorcsak P. Endometriosis-associated infertility: aspects of pathophysiological mechanisms and treatment options. // Acta Obstet. Gynecol. Scand. –2017. – 96(6).– P.659-667. DOI: 10.1111/aogs.13082.
8. Broi M.G.D., Ferriani R.A., Navarro P.A. Ethiopathogenic mechanisms of endometriosis-related infertility. // JBRA Assist. Reprod. – 2019. – 23(3). – P.273-280. DOI: 10.5935/1518-0557.20190029.
9. Vlahos N.F., Theodoridis T.D., Partsinevelos G.A.Myomas and Adenomyosis: Impact on Reproductive Outcome. // Biomed Res Int. – 2017. – 2017. – P.5926470. Published online 2017 Nov 6. DOI: 10.1155/2017/5926470.
10. Vuković P., Kasum M., Raguž J., Lonjak N., BilićKnežević S., Orešković I., BeketićOrešković L., Čehić E. Fertility preservation in young women with early-stage breast cancer. // ActaClin Croat. – 2019. – 58(1). – P.147-156. DOI: 10.20471/acc.2019.58.01.19.
11. Fritz R., Jindal S.J. Reproductive aging and elective fertility preservation. // Ovarian Res. – 2018. – 11(1). – P.66. DOI: 10.1186/s13048-018-0438-4.
12. Azargoon A., Mirrasouli Y., ShokrollahiBarough M., Barati M., Kokhaei P.The State of Peripheral Blood Natural Killer Cells and Cytotoxicity in Women with Recurrent Pregnancy Loss and Unexplained Infertility.// Int.J.Fertil.Steril. – 2019. – 13(1). – P.12-17. DOI: 10.22074/ijfs.2019.5503.
13. Крутова В.А., Коваленко Я.А. Современные представления о маточной форме бесплодия. // Электронный журнал. Современные проблемы науки и образования. – 2018. – №3. URL: http://www.science-education.ru/ru/article/view?id=27568 (дата обращения: 19.04.2020).
14. Steiner A.Z., Jukic A.M. Impact of female age and nulligravidity on fecundity in an older reproductive age cohort. // Fertil. Steril. – 2016. – 105(6). – P.1584-1588.e1. DOI: 10.1016/j.fertnstert.2016.02.028.
Об авторах
К. В. УрюпинаРоссия
Урюпина Кристина Владимировна, аспирант кафедры акушерства, гинекологии и перинатологии
Краснодар
И. И. Куценко
Россия
Куценко Ирина Игоревна, доктор медицинских наук, профессор, заведующий кафедрой акушерства, гинекологии и перинатологии
Краснодар
Е. И. Кравцова
Россия
Кравцова Елена Иосифовна, к.м.н., доцент кафедры акушерства, гинекологии и перинатологии
Краснодар
И. Н. Лукошкина
Россия
Лукошкина Ирина Николаевна, к.м.н., доцент кафедры акушерства, гинекологии и перинатологии
Краснодар
О. В. Томина
Россия
Томина Оксана Владимировна, к.м.н., доцент кафедры акушерства, гинекологии и перинатологии
Краснодар
Л. В. Каушанская
Россия
Каушанская Людмила Владимировна, д.м.н., профессор, руководитель симуляционного центра
Ростов-на-Дону
Рецензия
Для цитирования:
Урюпина К.В., Куценко И.И., Кравцова Е.И., Лукошкина И.Н., Томина О.В., Каушанская Л.В. Исследование структуры бесплодия и исходов программ ВРТ у пациенток позднего репродуктивного возраста. Медицинский вестник Юга России. 2022;13(2):59-71. https://doi.org/10.21886/2219-8075-2022-13-2-59-71
For citation:
Uryupina K.V., Kutsenko I.I., Kravtsovа E.I., Lukoshkina I.N., Tomina O.V., Kaushanskaya L.V. Investigation of the infertility structure and outcomes of ART programs in patients of late reproductive age. Medical Herald of the South of Russia. 2022;13(2):59-71. (In Russ.) https://doi.org/10.21886/2219-8075-2022-13-2-59-71







































