Перейти к:
Изменение показателей состава тела в зависимости от полиморфизма rs1801282 гена PPARG у пациентов с различными вариантами терапии ранних нарушений углеводного обмена
https://doi.org/10.21886/2219-8075-2021-12-4-27-33
Аннотация
Цель: изучить влияние полиморфизма rs1801282 гена PPARG на изменения показателей состава тела пациентов с ранними нарушениями углеводного обмена в группах пациентов с различными вариантами терапии.
Материалы и методы: в исследовании приняли участие 64 человека (8 мужчин и 56 женщин) с ранними нарушениями углеводного обмена. Всем пациентам в начале исследования были проведены генотипирование с определением полиморфизма rs1801282 гена PPARG и определение состава тела методом биоимпедансометрии. В дальнейшем пациенты были разделены на две группы в зависимости от варианта проводимой терапии. I группу составили пациенты, находящиеся на общепринятой при нарушениях углеводного обмена диетотерапии с исключением простых углеводов и ограничением сложных углеводов и жиров (40 человек, средний возраст — 45.2±15.4 лет). II группу составили пациенты, дополнительно к диетотерапии получающие монотерапию метформином (24 человека, средний возраст — 51.2±14.5 лет). Эффекты различных видов лечения на изменения состава тела пациентов оценивались через 3 месяца от начала лечения по результатам повторной биоимпедансометрии.
Результаты: носители мутантного аллеля G полиморфизма rs1801282 PPARG в группе метформина и диетотерапии показали значимое увеличение содержания активной клеточной массы (1.28±0.51% против 0.36±0.37%, p=0.021) по сравнению с гомозиготами СС при отсутствии различий в изменении массы тела в целом (p>0.05).
Выводы: наличие мутантного аллеля G rs1801282 гена PPARG способствует набору активной клеточной массы при добавлении метформина к диетотерапии у пациентов с ранними нарушениями углеводного обмена.
Для цитирования:
Валеева Ф.В., Медведева М.С., Хасанова К.Б., Турцева Т.С., Йылмаз Т.С. Изменение показателей состава тела в зависимости от полиморфизма rs1801282 гена PPARG у пациентов с различными вариантами терапии ранних нарушений углеводного обмена. Медицинский вестник Юга России. 2021;12(4):27-33. https://doi.org/10.21886/2219-8075-2021-12-4-27-33
For citation:
Valeeva F.V., Medvedeva M.S., Khasanova K.B., Turtseva T.S., Yilmaz T.S. Changes in body composition depending on the rs1801282 PPARG polymorphism in patients with different variants of treatment of early carbohydrate metabolism disorders. Medical Herald of the South of Russia. 2021;12(4):27-33. (In Russ.) https://doi.org/10.21886/2219-8075-2021-12-4-27-33
Введение
Одной из ведущих тенденций современной медицины является индивидуализация терапии различных патологий с учетом генетических характеристик пациента. Известно, что в зависимости от полиморфизма генов, отвечающих за обмен веществ, пациенты способны по-разному отвечать на проводимое лечение.
Терапия ранних нарушений углеводного обмена (НУО) с целью профилактики развития сахарного диабета 2 типа является одной из ключевых проблем эндокринологии. Ранее при выявлении данных нарушений проводилось исключительно обучение пациентов принципам сбалансированного питания без назначения сопутствующей медикаментозной терапии, однако в последние годы появляется всё больше рекомендаций ведущих эндокринологических сообществ в пользу назначения метформина [1][2]. Помимо сахароснижающего эффекта, метформин обладает способностью снижать массу тела преимущественно за счёт потери висцерального жира [3], однако ожидаемый эффект наблюдается лишь у части пациентов [4].
Пероксисомы — это внутриклеточные органеллы, играющие важную роль многих клеточных метаболических процессах, включая альфа- и бета-окисление жирных кислот, синтез плазмалогенов и обезвреживание в клетках печени глиоксилата, участвующего в конверсии жирных кислот в углеводы [5]. Ядерные рецепторы, активируемые пероксисомными пролифераторами (peroxisome proliferator-activated receptors, PPAR), являются важным регулятором процесса дифференцировки адипоцитов и модулятором внутриклеточных инсулин-зависимых сигнальных каскадов [6]. Одним из ключевых изотипов PPAR, участвующих в регуляции адипогенеза, является рецептор PPARγ, кодируемый геном PPARG [7].
PPARG располагается в 25-м локусе короткого плеча 3-й пары хромосом [8]. Активация рецептора PPARγ регулирует экспрессию генов, вовлечённых в транспорт глюкозы [9], а также запускает апоптоз в зрелых адипоцитах, в результате чего происходит стимуляция адипогенеза и образование юных адипоцитов, более чувствительных к действию инсулина [10]. Полиморфизм rs1801282 PPARG возникает при замещении пролина на аланин (C > G; Pro12Ala) в кодоне 12-го экзона B и является одним из наиболее изученных однонуклеотидных полиморфизмов данного гена. Известно, что наличие аллеля G ассоциировано со снижением активности PPARγ [11]. Аллель С полиморфизма rs1801282, напротив, ассоциирована с увеличением транскрипционной активности PPARγ [12].
Ген PPARG в соответствии со своей ролью в обмене липидов описывается как генетический маркер ожирения и различных заболеваний, связанных с ожирением [13], однако данные о влиянии мутации гена на развитие избыточной массы тела противоречивы. Так, аллель G полиморфизма Pro12Ala ассоциирована с ожирением в популяции Бразилии и Италии [14][15], однако в китайской популяции мутация опосредовала протективный эффект [16]. Таким образом, однонуклеотидный полиморфизм rs1801282 гена PPARG является потенциальным кандидатом, способным модулировать ответ пациентов на диетотерапию и фармакотерапию при ранних НУО со стороны показателей состава тела пациента.
Цель исследования — изучение влияния полиморфизма rs1801282 гена PPARG на показатели состава тела пациентов с ранними нарушениями углеводного обмена в группах с различными вариантами терапии.
Материалы и методы
В исследовании приняли участие 64 человека (8 мужчин и 56 женщин). Критерием включения в исследование было наличие ранних НУО, а именно нарушенной гликемии натощак (уровень гликемии в капиллярной крови натощак более 5.6, но менее 6.1 ммоль/л при уровне гликемии через 2 часа после стандартной углеводной нагрузки менее 7.8 ммоль/л), нарушения толерантности к глюкозе (уровень гликемии в капиллярной крови через 2 часа после стандартной углеводной нагрузки более 7.8 ммоль/л, но менее 11.1 ммоль/л) или впервые выявленного сахарного диабета 2 типа (уровень гликемии в капиллярной крови натощак более 6.1 ммоль/л и/или через 2 часа после стандартной углеводной нагрузки более 11.1 ммоль/л). Критериями исключения из исследования являлись возраст менее 18 лет, беременность, период лактации, сниженная функция почек (скорость клубочковой фильтрации (СКФ) <45 мл/мин/1.73м2), печени (повышение уровня печеночных ферментов, а именно аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ), более чем в три раза), наличие онкологических заболеваний в анамнезе, приём препаратов, оказывающих влияние на жировой и углеводный обмены.
В начале исследования всем пациентам было проведено генотипирование c определением полиморфизма rs1801282 гена PPARG методом полимеразной цепной реакции (ПЦР) в режиме реального времени при помощи роторного амплификатора Rotor Gene Q; субстратом для реакции служила ДНК, полученная из лимфоцитов цельной крови сорбентным методом («Ампли-Прайм ДНК-сорб-В», Москва). Также была произведена оценка состава тела методом биоимпедансометрии при помощи импедансного анализатора («Диамант-АИСТ», Санкт-Петербург). Далее пациенты путём рандомизации были разделены на две терапевтические группы. Первая группа находилась на общепринятой при нарушениях углеводного обмена диете с исключением простых и ограничением сложных углеводов и жиров. В данную группу вошли 40 человек (7 мужчин и 33 женщины, средний возраст — 45.2 ± 15.4 лет). Вторая группа в дополнение к диете получала терапию метформином, в данную группу вошли 24 человека (1 мужчина и 23 женщины, средний возраст — 51.2 ± 14.5 лет). Далее на протяжении трех месяцев раз в две недели проводился контроль пациентов путём проверки дневников питания, проведения промежуточных замеров. Через три месяца всем пациентам повторно была проведена биоимпедансометрия.
Статистическая обработка результатов была проведена при помощи среды R для статистической обработки данных. При анализе данных использовался метод ANCOVA с двумя независимыми категориальными переменными и их взаимодействием. Для оценки соответствия распределения частот генотипов изучаемой выборки закону Харди-Вайнберга применялся критерий χ2. Для описания количественных данных использовались среднее арифметическое значение (M) и стандартная ошибка среднего (SEM); для характеристики возраста изучаемых групп применялось стандартное отклонение (SD). Динамика изменения показателей биоимпедансометрии рассчитывалась в процентах от измерения в начальной точке.
Результаты
Исследование полиморфизма rs1801282 гена PPARG у пациентов выявило распределение частоты аллелей и генотипов изучаемого полиморфизма, соответствующее распределению Харди–Вайнберга (χ2 = 1.22; p >0.05). 67.6% пациентов являлись носителями аллеля С в гомозиготном варианте, 26.8% пациентов — гетерозиготами CG и 5.6% пациентов являлись носителями мутантного аллеля G в гомозиготном варианте; распространённость аллеля С в исследуемой выборке пациентов составила 81%, аллеля G — 19% (рис.1). Полученные данные соотносятся с базой данных проекта 1000 Genomes, согласно которой в европейской популяции распространенность аллеля С составляет 88%, аллеля G — 12%; на долю гомозигот CC приходится 76.9% популяции, CG — 22.1%, GG — 1%.
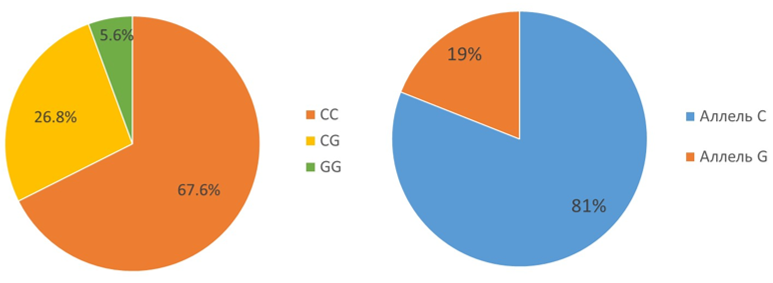
Рисунок 1. Распределение генотипов, частоты встречаемости аллелей rs1801282 PPARG в исследуемой выборке.
Figure 1. Frequency of occurrence of genotypes, alleles of rs1801282 PPARG in the study sample.
В результате статистической обработки полученных данных взаимосвязи полиморфизма изучаемого гена с изменениями массы тела, окружности талии и бёдер в исследуемых группах не наблюдалось (p >0.05). Также при анализе изменений показателей биоимпедансометрии не было выявлено взаимосвязи между полиморфизмом rs1801282 PPARG и динамикой жировой массы и общей воды в организме (p >0.05). Однако среди пациентов, получающих метформин на фоне диетотерапии, носители мутантного аллеля G характеризовались более выраженным набором активной клеточной массы (1.28 ± 0.51% против 0.36 ± 0.37%, p = 0.021; табл. 1, рис. 2). В группе диетотерапии аллель G не влиял на изменения активной клеточной массы среди пациентов (p >0.05; табл. 2).
Таблица / Table 1
Относительное содержание активной клеточной массы среди пациентов с НУО, принимавших метформин на фоне диетотерапии, в зависимости от полиморфизма rs1801282 PPARG
Changes in body cell mass among patients with early carbohydrate metabolism disorders taking metformin during diet therapy depending on the rs1801282 PPARG polymorphism
|
Генотип |
Активная клеточная масса, % |
||
|
в начале терапии |
через 3 месяца |
Δ |
|
|
CC |
42.28±0.72 (SD = 2.68) |
42.64±0.63 (SD = 2.35) |
0.36±0.37 (SD = 1.37) |
|
CG/GG |
40.74±1.38 (SD = 4.37) |
42.02±1.49 (SD = 4.73) |
1.28±0.51 (SD = 1.59) |
Таблица / Table 2
Относительное содержание активной клеточной массы среди пациентов с НУО, находившихся только на диетотерапии, в зависимости от полиморфизма rs1801282 PPARG
Changes in body cell mass among patients with early carbohydrate metabolism disorders who were only on diet therapy depending on the rs1801282 PPARG polymorphism
|
Генотип |
Активная клеточная масса, % |
||
|
в начале терапии |
через 3 месяца |
Δ |
|
|
CC |
42.64±0.58 (SD = 3.1) |
43.56±0.62 (SD = 3.36) |
0.92±0.27 (SD = 1.44) |
|
CG/GG |
43.14±1.19 (SD = 3.96) |
43.19±1.26 (SD = 4.18) |
0.05±0.48 (SD = 1.61) |
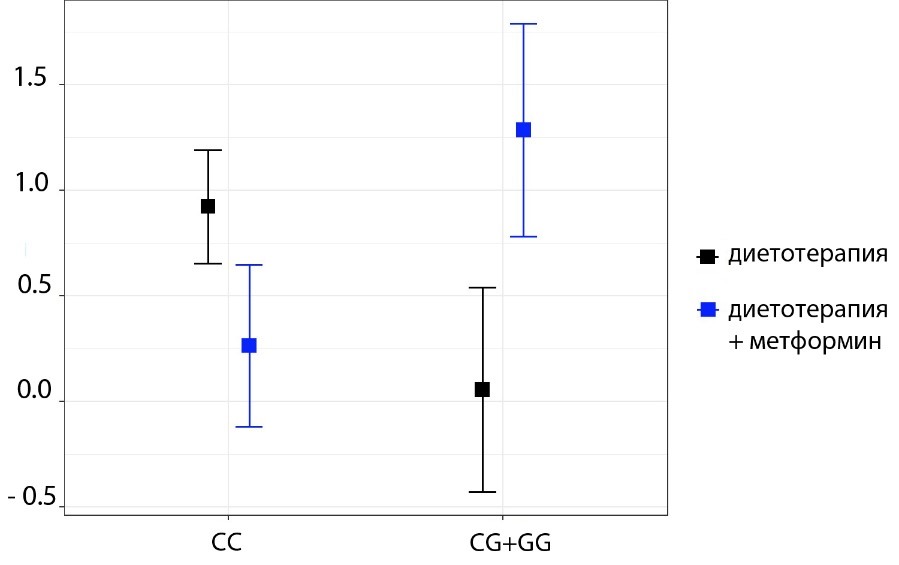
Рисунок 2. Динамика содержания активной клеточной массы (%) среди пациентов с ранними нарушениями углеводного обмена, получавших различные варианты терапии в зависимости от полиморфизма rs1801282 PPARG.
Figure 2. Dynamics of body cell mass (%) among patients with early carbohydrate metabolism disorders on various types of therapy depending on the rs1801282 PPARG polymorphism.
Обсуждение
Огромное значение определение полиморфизма PPARG приобрело в области генетики питания, при этом данные о влиянии мутантного аллеля G на исходы диетотерапии неоднозначны. По данным исследований, проведённых в бразильской и центральноевропейской популяциях, снижение жировой массы тела в ответ на общепринятую при избыточной массе тела диетотерапию, длящуюся на протяжении трёх месяцев, было более выражено у носителей аллеля G, чем у СС-гомозигот [17][18]. Противоположные результаты показало исследование Matsuo et al.: аллель G чаще встречалась среди пациентов, резистентных к диетотерапии [19]. Однако мы не обнаружили влияния мутантного аллеля G на изменения жирового компонента и массы тела в целом через 3 месяца от начала наблюдения за пациентами, находящимися исключительно на диетотерапии. Это, возможно, объясняется тем, что аллель G не оказывает влияния на краткосрочные результаты диетотерапии, но способствует изменению композиционного состава тела при более длительном применении диетотерапии.
Особое внимание ученых обращает на себя изучение эффекта диетотерапии в сочетании с сахароснижающими препаратами в зависимости от варианта rs1801282 PPARG. Несмотря на то, что в значительной части работ изучалась ассоциация данного полиморфизма с результатами терапии тиазолидиндионами [20], имеется ряд исследований, в которых изучалось влияние rs1801282 PPARG на эффективность лечения метформином. В исследовании DPP среди пациентов, получающих терапию метформином и соблюдающих общепринятую при избыточной массе тела диету, носители аллеля G имели более выраженное снижение массы тела, чем гомозиготы CC; также при наличии аллеля G отмечалось снижение количества жировой массы тела, у носителей СС данный эффект сочетанной терапии не проявлялся [21]. Данные, полученные при DPP, подтверждаются исследованием, ранее проведённым Masud S, Ye S., согласно которому среди людей, соблюдающих диету и получающих терапию метформином, снижение массы тела происходило более выражено у носителей G-аллеля [22]. Мы не обнаружили различий в изменении жировой массы и массы тела в целом между пациентами с различными вариантами rs1801282 PPARG при добавлении метформина к диетотерапии, однако нами было обнаружено влияние аллеля G на изменение количества активной клеточной массы при приеме метформина, что ранее не оценивалось при проведении иных исследований. Известно, что величина активной клеточной массы отражает количество метаболически активных тканей (клеток нервной системы, внутренних органов, мышечной ткани) и характеризует достаточность белкового компонента питания. Таким образом, увеличение содержания активной клеточной массы при добавлении метформина носителям мутантного аллеля G rs1801282 PPARG является признаком усиления анаболических процессов в организме, улучшения физической работоспособности пациентов уже на ранних сроках назначения препарата.
Данное исследование ограничено длительностью проведения и отражает краткосрочные изменения в составе тела пациентов при различных вариантах терапии. Дальнейшее наблюдение за пациентами и увеличение выборки поможет уточнить влияние мутантного аллеля G на изменения композиционного состава тела пациентов при различных вариантах терапии НУО на различных сроках терапии.
Выводы
- Изменение количества жировой ткани, а также общей воды в организме при приёме метформина на фоне диетотерапии через три месяца от начала лечения не связано с носительством аллеля G rs1801282 PPARG среди пациентов с ранними нарушениями углеводного обмена.
- Набор активной клеточной массы отмечается среди носителей аллеля G rs1801282 PPARG при добавлении метформина к общепринятой диете через три месяца от начала терапии ранних нарушений углеводного обмена.
Список литературы
1. Дедов И.И., Шестакова М.В., Майоров А.Ю., Викулова О.К., Галстян Г.Р., и др. «Алгоритмы специализированной медицинской помощи больным сахарным диабетом». Под редакцией И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова 9-й выпуск. Сахарный диабет. 2019; 22(1S1):1-144. DOI: 10.14341/DM221S1
2. Garber AJ, Handelsman Y, Grunberger G, Einhorn D, Abrahamson MJ, et al. Consensus statement by the American Association of Clinical Endocrinologists and American College of Endocrinology on the comprehensive type 2 diabetes management algorithm — 2020 executive summary. Endocr Pract. 2020; 26(1):107-139. DOI: 10.4158/CS-2019-0472.
3. Zhou J, Massey S, Story D, Li L. Metformin: An Old Drug with New Applications. Int J Mol Sci. 2018; 19(10):2863. DOI: 10.3390/ijms19102863.
4. Bankura B, Das M, Pattanayak A, Adhikary B, Bhattacharjee R, et al. Inter-patient Variability in Clinical Efficacy of Metformin in Type 2 Diabetes MellitusPatients in West Bengal, India. Journal of Metabolic Syndrome. 2016;(5):2. DOI: 10.4172/2167-0943.1000198.
5. Waterham HR, Ferdinandusse S, Wanders RJ. Human disorders of peroxisome metabolism and biogenesis. Biochim Biophys Acta. 2016; 1863(5):922-33. DOI: 10.1016/j.bbamcr.2015.11.015.
6. Christofides A, Konstantinidou E, Jani C, Boussiotis VA. The role of peroxisome proliferator-activated receptors (PPAR) in immune responses. Metabolism. 2021; 114:154338. DOI: 10.1016/j.metabol.2020.154338.
7. Grygiel-Górniak B. Peroxisome proliferator-activated receptors and their ligands: nutritional and clinical implications — a review. Nutr J. 2014; 13:17. DOI: 10.1186/1475-2891-13-17.
8. Yahaya TO, Salisu TF. A Review of Type 2 Diabetes Mellitus Predisposing Genes. Curr Diabetes Rev. 2019; 16(1):52-61. DOI: 10.2174/1573399815666181204145806.
9. Кононенко И.В., Майоров А.Ю., Кокшарова Е.О., Шестакова М.В. Фармакогенетика сахароснижающих препаратов. Сахарный диабет. 2015; 18(4):28-34. DOI: 10.14341/DM7681
10. Okuno A, Tamemoto H, Tobe K, Ueki K, Mori Y, et al. Troglitazone increases the number of small adipocytes without the change of white adipose tissue mass in obese Zucker rats. J Clin Invest. 1998; 101(6):1354-61. DOI: 10.1172/JCI1235.
11. Sarhangi N, Sharifi F, Hashemian L, Hassani Doabsari M, Heshmatzad K, et al. PPARG (Pro12Ala) genetic variant and risk of T2DM: a systematic review and meta-analysis. Sci Rep. 2020; 10(1):12764. DOI: 10.1038/s41598-020-69363-7.
12. Groop L, Pociot F. Genetics of diabetes — are we missing the genes or the disease? Mol Cell Endocrinol. 2014; 382(1):726- 739. DOI: 10.1016/j.mce.2013.04.002.
13. Leońska-Duniec A, Ahmetov II, Zmijewski P. Genetic variants influencing effectiveness of exercise training programmes in obesity — an overview of human studies. Biol Sport. 2016; 33(3):207-14. DOI: 10.5604/20831862.1201052.
14. Castro GV, Latorre AFS, Korndorfer FP, de Carlos Back LK, Lofgren SE. The Impact of Variants in Four Genes: MC4R, FTO, PPARG and PPARGC1A in Overweight and Obesity in a Large Sample of the Brazilian Population. Biochem Genet. 2021; 59(6):1666-1679. DOI: 10.1007/s10528-021-10079-2.
15. Bordoni L, Marchegiani F, Piangerelli M, Napolioni V, Gabbianelli R. Obesity-related genetic polymorphisms and adiposity indices in a young Italian population. IUBMB Life. 2017; 69(2):108-115. DOI: 10.1002/iub.1596.
16. Wang X, Liu J, Ouyang Y, Fang M, Gao H, Liu L. The association between the Pro12Ala variant in the PPARγ2 gene and type 2 diabetes mellitus and obesity in a Chinese population. PLoS One. 2013; 8(8):e71985. DOI: 10.1371/journal.pone.0071985.
17. Rodrigues APS, Rosa LPS, Silveira EA. PPARG2 Pro12Ala polymorphism influences body composition changes in severely obese patients consuming extra virgin olive oil: a randomized clinical trial. Nutr Metab (Lond). 2018; 15:52. DOI: 10.1186/s12986-018-0289-4.
18. Chmurzynska A, Muzsik A, Krzyżanowska-Jankowska P, Mądry E, Walkowiak J, Bajerska J. PPARG and FTO polymorphism can modulate the outcomes of a central European diet and a Mediterranean diet in centrally obese postmenopausal women. Nutr Res. 2019; 69:94-100. DOI: 10.1016/j.nutres.2019.08.005.
19. Matsuo T, Nakata Y, Katayama Y, Iemitsu M, Maeda S, et al. PPARG genotype accounts for part of individual variation in body weight reduction in response to calorie restriction. Obesity (Silver Spring). 2009; 17(10):1924-31. DOI: 10.1038/oby.2009.199.
20. Pearson ER. Diabetes: Is There a Future for Pharmacogenomics Guided Treatment? Clin Pharmacol Ther. 2019; 106(2):329-337. DOI: 10.1002/cpt.1484.
21. Franks PW, Jablonski KA, Delahanty L, Hanson RL, Kahn SE, et al. The Pro12Ala variant at the peroxisome proliferator-activated receptor gamma gene and change in obesity-related traits in the Diabetes Prevention Program. Diabetologia. 2007; 50(12):2451-60. DOI: 10.1007/s00125-007-0826-6.
22. Masud S, Ye S; SAS Group. Effect of the peroxisome proliferator activated receptor-gamma gene Pro12Ala variant on body mass index: a meta-analysis. J Med Genet. 2003; 40(10):773-80. DOI: 10.1136/jmg.40.10.773.
Об авторах
Ф. В. ВалееваРоссия
Валеева Фарида Вадутовна, доктор медицинских наук, профессор, заведующая кафедрой эндокринологии
Казань
М. С. Медведева
Россия
Медведева Мария Сергеевна, аспирант кафедры эндокринологии
Казань
К. Б. Хасанова
Россия
Хасанова Камиля Булатовна, аспирант кафедры эндокринологии
Казань
Т. С. Турцева
Россия
Турцева Татьяна Сергеевна, ординатор кафедры эндокринологии
Казань
Т. С. Йылмаз
Россия
Йылмаз Татьяна Сергеевна, кандидат медицинских наук, доцент кафедры эндокринологии
Казань
Рецензия
Для цитирования:
Валеева Ф.В., Медведева М.С., Хасанова К.Б., Турцева Т.С., Йылмаз Т.С. Изменение показателей состава тела в зависимости от полиморфизма rs1801282 гена PPARG у пациентов с различными вариантами терапии ранних нарушений углеводного обмена. Медицинский вестник Юга России. 2021;12(4):27-33. https://doi.org/10.21886/2219-8075-2021-12-4-27-33
For citation:
Valeeva F.V., Medvedeva M.S., Khasanova K.B., Turtseva T.S., Yilmaz T.S. Changes in body composition depending on the rs1801282 PPARG polymorphism in patients with different variants of treatment of early carbohydrate metabolism disorders. Medical Herald of the South of Russia. 2021;12(4):27-33. (In Russ.) https://doi.org/10.21886/2219-8075-2021-12-4-27-33







































