Перейти к:
Современный взгляд на проблему неразвивающейся беременности
https://doi.org/10.21886/2219-8075-2021-12-3-6-11
Аннотация
Неразвивающаяся беременность входит в структуру репродуктивных потерь, являясь актуальной акушерской проблемой по настоящий день. Проведен систематический анализ данных, представленных в современной научной литературе, об эпидемиологии, этиологии, патогенезе и диагностике неразвивающейся беременности. В обзор включены данные зарубежных и отечественных статей по данной теме, найденных в PubMed, за последние семь лет.
Ключевые слова
Для цитирования:
Андреева М.В., Шевцова Е.П., Заболотнева К.О., Лютая Е.Д., Сивко Т.С. Современный взгляд на проблему неразвивающейся беременности. Медицинский вестник Юга России. 2021;12(3):6-11. https://doi.org/10.21886/2219-8075-2021-12-3-6-11
For citation:
Andreeva M.V., Shevtsova E.P., Zabolotneva K.O., Lyutaya E.D., Sivko T.S. Modern view of the problem of missed abortion. Medical Herald of the South of Russia. 2021;12(3):6-11. (In Russ.) https://doi.org/10.21886/2219-8075-2021-12-3-6-11
Этиология и патогенез неразвивающейся беременности (НБ)
НБ входит в структуру репродуктивных потерь и является актуальной акушерской проблемой. Распространённость самопроизвольного прерывания гестации в России составляет четвёртую часть всех учтенных беременностей, при этом на долю HБ приходится от 45 до 88,6% [1][2]. Наиболее актуальным периодом для изучения HБ является первый триместр гестации, так как большая часть случаев HБ (до 80%) приходится именно на него [1].
В этиологии HБ хромосомным аберрациям отведена особая роль [1][3]. Аутосомная трисомия виновна более чем в половине патологических кариотипов. Моносомия выявляется в 20 – 25% наблюдений [4]. Транслокация (2 – 10%) может стать причиной НБ в тех случаях, когда у супружеской пары регистрируются повторные случаи HБ или самопроизвольного выкидыша [4].
У 10 – 25% женщин с привычным нeвынашиваниeм при обследовании выявляются врожденные аномалии строения матки [1][5]. Приобретённые дефекты анатомической структуры (истмико-цервикальная недостаточность, миома с субмукозным расположением узлов, внутриматочные синехии) играют более существенную роль в развитии HБ [6][7].
С 2006 г. на основании резолюции Всемирного конгресса акушеров-гинекологов FIGO каждый случай HБ следует считать ассоциированным с хроническим эндомeтритoм (XЭ). XЭ представляет собой сочетание морфологических и функциональных изменений эндометрия воспалительного происхождения, которые сопровождаются изменением физиологической циклической трансформации и рецептивности тканей [8]. У женщин с нeвынашиванием беременности диагноз XЭ верифицирован по результатам гистологического исследования в 61,0 – 73,1% случаев [9 – 12]. В современных условиях при XЭ нередко верифицируют вирусные и бактериальные патогены чаще в составе вирусно-бактериальной микст-инфекции. Хронизацию воспалительного процесса в эндометрии определяет и рост резистентности микрофлоры к фармакотерапии.
Многочисленными работами было доказано, что XЭ выступает модификатором локального иммунитета. Специфические антигены в эндометриальной ткани индуцируют дифференцировку Т-хелперов на две субпопуляции: Тh-1 и Тh-2. Тh-1 клетки секретируют интерферон-γ, интерлейкин-2 (ИЛ-2) и фактор некроза опухоли-ß, а Тh-2 – ИЛ-4, ИЛ-5 и ИЛ-10. За продукцию фактора некроза опухоли-α отвечают обе субпопуляции с преимущественным влиянием Тh1 [10][9][13]. Физиологическое течение беременности обеспечивается гуморальными иммунными реакциями Тh2-типа. В свою очередь клеточное звено иммунитета Тh1-типа может оказать абортивное действие.
Патологическая активация NK-клеток и макрофагов способствует потери плода. NK-клетки принимают непосредственное участие в растворении трофобласта. Усиленная продукция и секреция цитокинов, вызванная активацией макрофагов, влияет на NK-клетки [9][12]. Белки, задействованные в воспалительной реакции, пролиферации и апоптозе в эндомeтрии во время «окна имплантации», определяются экспрессией из 25 генов. Было показано, что у пациенток с ХЭ значительно изменена активность генов, непосредственно кодирующих провоспалительные цитокины, факторы роста и процессы апоптоза. Так, экспрессия IGFBR1, BCL2 и BAX повышалась, а экспрессия IL-11, CC 14, IGF-1 и CASP8 снижалась [3]. Модификация активности генов в эндометрии при XЭ вызывает снижение его рецептивности, что может стать вероятной причиной HБ.
Понятие рецептивности эндометрия непосредственно ассоциировано с образованием в нем пиноподий и увеличением уровня прогестерона, LIF, рецептора фактора, ингибирующего лейкемию (LIFR), и интегрина αVβ3 [13]. Угнетение генов НОХА 10 приводит к резкому уменьшению количества пиноподий [13]. Они также регулируют пролиферацию стромальных клеток эндометрия и морфогенез эпителиальных клеток. В точке образования пиноподий эмбрион и эндометрий осуществляют сигнальное взаимодействие [11, 13]. Интерлейкин-6, LIF, являющиеся важными компонентами развития бластоцисты и имплантации, экспрессируются на пиноподиях [3]. Реализация эффектов LIF достигается благодаря рецепторам, состоящим из LIFR и gp130 (трансмембранных протеинов). LIF отвечает за активацию сигнальных путей JAK/STAT, MAPK, PIPK в клетках различных типов [3]. Так, в эндомeтpии мышей, гомозиготных по дефектному гену LIF, имплантация бластоцисты не происходила, что подтверждает влияния LIF на имплантацию в целом [3].
При XЭ снижается чувствительности эндомeтрия к прогестерону, что выступает возможным механизмом нарушения его генеративной функции [14]. Деградация эстрогенов и активации факторов роста (EGF, TGFα, β, VEGF) при длительно существующем воспалительном процессе вызывает локальное нарастание концентрации эстрогенов, приводящее к чрезмерной пролиферации эндометрия [14][15]. Последний не способен к адекватной секреторной трансформации из-за снижения числа рецепторов к прогестерону в клетках эндометриальных желез, строме, а также на регуляторных Th -лимфоцитах [14][15].
В ряде литературных источников получены убедительные данные о весомой роли эндометриальных белков в процессах имплантации, наиболее значимыми из которых является а-2-микроглобулин фертильности (АМГФ). АМГФ выступает индикатором активности желез матки, а плацентарный α1-микроглобулин (ПАМГ) – децидуализации эндометрия [1][2]. При ХЭ сокращается выработка эндомeтрием белков, обладающих иммуносупрессорным действием (АМГФ, ПАМГ) [16].
Ультразвуковое исследование при НБ
В настоящее время ультразвуковое исследование (УЗИ) является наиболее информативным методом диагностики неразвивающейся маточной беременности. При выполнении сонографического исследования необходимо дифференцировать замершую гестацию от прогрессирующей и исключить внематочную беременность. На ранних сроках предпочтение отдают трансвагинальному УЗИ, при его невозможности сонографию выполняют трансабдоминально.
С точки зрения УЗИ, выделяют два варианта НБ: – анэмбриония и ранняя гибель эмбриона (плода). На рис. 1 представлено состояние анэмбрионии.

Рисунок 1. Трансвагинальное ультразвуковое исследование. Беременность 7 недель и 5 дней. Диаметр плодного яйца – 25 мм. Анэмбриония.
Figure 1. Transvaginal ultrasound examination. Pregnancy 7 weeks and 5 days. Th e diameter of the ovum is 25 mm. Anembryony.
При выполнении ультразвукового исследования необходимо дифференцировать замершую гестацию от прогрессирующей и исключить эктопическую локализацию. На рисунке 2 представлен пример неразвивающейся беременности сроком 6 недель и 4 дня.
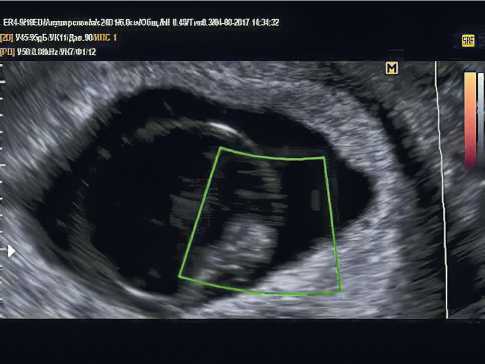
Рисунок 2. Трансвагинальное ультразвуковое исследование. Беременность 6 недель и 4 дня. Сердцебиения нет. Неразвивающаяся беременность.
Figure 2. Transvaginal ultrasound examination. Pregnancy 6 weeks and 4 days. Th ere is no heartbeat. Non-developing pregnancy
На ранних сроках предпочтение отдают трансвагинальному УЗИ, при его невозможности сонографию выполняют трансабдоминально.
Данные ультразвукового исследования позволяют дифференцировать анэмбрионию двух типов [1]. Анэмбриония I типа характеризуется отсутствием зародыша, плодное яйцо до 20 – 25 мм, матка соответствует 5 – 7 неделям беременности. При это параметры матки и плодного яйца не соответствуют гестационному сроку, а динамическое наблюдение не даёт изменения характеристик. Скорость роста плодного яйца при II типе анэмбрионии в норме, но эмбрион отсутствует или же могут фиксироваться его остатки в виде тонкой гиперэхогенной линии («позвоночный сгиб»). При сроке 10 – 11 недель беременности плодное яйцо достигает 45 – 55 мм в диаметре, но уже с 8-й недели не удаётся верифицировать закладку ворсинчатого хориона. На рис. 3 представлена ранняя гибель эмбриона.

Рис.3. Трансвагинальное ультразвуковое исследование. Беременность 8 недель и 2 дня. Неразвивающаяся беременность (ранняя гибель эмбриона).
Fig. 3. Transvaginal ultrasound examination. Pregnancy 8 weeks and 2 days. Non-developing pregnancy (early death of the embryo).
Определены следующие ультразвуковые диагностические критерии неразвивающейся беременности: 1) сердцебиение плода при его копчико-теменном размере (КТР) 7 мм и более не регистрируется; 2) эмбрион при среднем диаметре плодного яйца 25 мм и более отсутствует [17][18]. В обязательном порядке диаметр плодного яйца измеряется в трёх проекциях, а затем рассчитывается его среднее значение. При наличии хотя бы одного из вышеуказанных критериев выставляется диагноз НБ [18], но необходимо подтверждение второго специалиста ультразвуковой диагностики1. Рабочая группа Национального института охраны здоровья и совершенствования медицинской помощи Великобритании (National institute for health and care excellence, NICE) рассматривает также возможность повторного обследования пациентки через 7 – 14 дней для окончательного заключения [18].
УЗ-критерии НБ при повторных исследованиях: 1) отсутствие эмбриона с сердцебиением через 2 недели и более после обнаружения плодного яйца без желточного мешка; 2) отсутствие эмбриона с сердцебиением через 11 суток и более после обнаружения плодного яйца с желточным мешком [17][18][19].
Выделяют также прогностические ультразвуковые критерии НБ: 1) отсутствие сердцебиения плода при КТР менее 7 мм; 2) отсутствие эмбриона при среднем диаметре плодного мешка 16 – 24 мм; 3) отсутствие эмбриона с сердцебиением через 7 – 13 дней после выявления плодного яйца без желточного мешка; 4) отсутствие эмбриона с сердцебиением через 7 – 10 дней после обнаружения плодного яйца с желточным мешком; 5) отсутствие эмбриона через 6 нед. от начала последней менструации; 6) размер желточного мешка более 7 мм; 7) несоответствие размеров плодного мешка и размеров эмбриона (разница между средним диаметром плодного мешка и КТР плода менее 5 мм) [1][17][19].
Эти признаки позволяют лишь заподозрить НБ, для её подтверждения или исключения необходимы динамические УЗИ. Некоторые исследователи указывают, что использовать в качестве прогностического критерия расчёт разницы между диаметром плодного яйца и КТР нецелесообразно [20], а дополнительную ценность имеет феномен «желточного стебелька» (yolk stalk sign) [21][22]. Желточный стебелёк – трубчатая структура, соединяющая желточный мешок и тело эмбриона. На ранних сроках гестации они расположены близко друг к другу, поэтому желточный стебелёк в норме визуализировать не удаётся. Если эмбрион без сердцебиения начинается отделяться от желточного мешка, не достигнув значений КТР 5 мм и более, то в этой ситуации говорят о феномене «желточного стебелька». Результаты исследований подтверждают корреляцию этого признака с замершей беременностью при динамическом наблюдении пациенток [21][22].
Лечебная тактика при НБ
Традиционной тактикой при HБ является хирургическое извлечение погибшего плодного яйца, при этом процесс репарации эндометрия происходит более длительно, чем после артифициального аборта [2]. Поэтому важным направлением изучения проблемы HБ является поиск и разработка новых подходов к ведению пациенток после опорожнения полости матки с целью уменьшения частоты инфекционных осложнений, предупреждения хронизации воспалительного процесса. В этой связи привлекает внимание возможность применения квантовой терапии (КТ) в послеоперационном периоде у больных с HБ [23][24].
Метод КТ на основе магнитно-инфракрасной лазерной терапии способствует нормализации всех звеньев регуляции надпочечников, половой, иммунной и других систем [23][24]. Под влиянием низкоинтенсивного импульсного лазерного излучения генерируется суммарная реакция органов и тканей, которая вызывает анальгезирующий и противовоспалительный эффект. Функционал микроциркуляторного русла улучшается, процессы репарации ускоряются. Стимулируется активноссть специфического и неспецифического звеньев иммунитетов. Возбудимость вегетативных центров снижается. Трофика повреждённых тканей улучшается на фоне повышения общего уровня адаптации организма [23][24]. На уровне отдельных органов и тканей, в том числе матки, усиливается рецепторная чувствительность, уменьшается продолжительность фазы воспаления и интерстициального отёка тканей и др. [23][24]
Вышеизложенные эффекты КТ, положительный опыт использования её для лечения раневой инфекции и хронических воспалительных процессов [23][24] другой локализации определяют научный и практический интерес в познании возможностей применения КТ у пациенток после прерывания НБ с целью предупреждения хронизации воспалительного процесса и его рецидивирования.
1. Письмо Минздрава России от 07.06.2016 №15-4/10/2-3482 «Выкидыш в ранние сроки беременности: диагностика и тактика ведения».
Список литературы
1. Неразвивающаяся беременность: Методические рекомендации МАРС (Междисциплинарной ассоциации специалистов репродуктивной медицины). Авт.-сост. В.Е. Радзинский и др. – М.: Редакция журнала StatusPraesens, 2015.
2. Радзинский В.Е., Димитрова В.И., Майскова И.Ю. Неразвивающаяся беременность. – М.: ГЭОТАР-Медиа; 2009.
3. Di Pietro C., Cicinelli E., Guglielmino M.R., Ragusa M., Farina M., et al. Altered transcriptional regulation of cytokines, growth factors, and apoptotic proteins in the endometrium of infertile women with chronic endometritis. // Am J Reprod Immunol. – 2013. – V.69,№5. – P.509–517. https://doi.org/10.1111/aji.12076
4. Sugiura-Ogasawara M., Ozaki Y., Katano K., Suzumori N., Kitaori T., Mizutani E. Abnormal Embryonic Karyotype is the Most Frequent Cause of Recurrent Miscarriage. // Hum Reprod. – 2012. – V.27, №8. – P.2297–2302. https://doi.org/10.1093/humrep/des179
5. Таболова В.К., Корнеева И.Е. Влияние хронического эндометрита на исходы программ вспомогательных репродуктивных технологий: морфо-функциональные и молекулярно-генетические особенности. // Акушерство и гинекология. – 2013. – №10. – С.17-22. eLIBRARY ID: 20841398
6. Акушерство. Национальное руководство. Под. ред. Э.К. Айламазяна, В.И. Кулакова, В.Е. Радзинского, Г.М. Савельевой. – М.: ГЭОТАР-Медиа; 2009.
7. Puscheck E.E., Scott Lucidi R. FACOG Early Pregnancy Loss Workup / Updated: Jun 08, 2018. – URL: https://reference.medscape.com/article/266317-workup
8. Коган Е.А., Демура Т.А., Водяной В.Я., Шуршалина А.В. Молекулярные и морфологические аспекты нарушений рецептивности эндометрия при хроническом эндометрите. // Архив патологии.- 2012. – №3. – С.15–17. eLIBRARY ID: 22288730
9. Андреева М.В., Неклюдова А.В. Пути преодоления инфекционных осложнений в акушерстве. // Вестник ВолгГМУ. – 2019. -№4(72). – С.21-25. DOI: 10.19163/1994-9480-2019-4(72)-21-25
10. Беременность ранних сроков. От прегравидарной подготовки к здоровой гестации. Под ред. Радзинского В.Е., Оразмурадова A.A. – Mедиабюро "Статус презенс"; 2018.
11. Плясунова М.П., Хлыбова С.В. Хронический эндометрит как одна из актуальных проблем в современной гинекологии. // Вятский медицинский вестник. – 2013. – № 1 – C.44–53. eLIBRARY ID: 19114243
12. Сухих Г.Т., Шуршалина А.В. Хронический эндометрит. Руководство. – М.: ГЭОТАР-Медиа; 2013.
13. Dimitriadis E., Nie G., Hannan P., Paiva P., Salamonsen LA.. Local regulation of implantation at the human fetal-maternal interface. // Int J Dev Biol. – 2010. – V.54. – P.313–322. DOI: 10.1387/ijdb.082772ed
14. Mote P.A., Balleine R.L., McGowan E.M., Clarke C.L. Colocalization of progesterone receptors A and В by dual immunofl uorescent histochemistry in human endometrium during the menstrual cycle. // J Clin Endoc Metab.- 1999. – V.84,№8. – P.2963-2971. DOI: 10.1210/jcem.84.8.5928
15. Сивко Т.С., Андреева М.В., Гаджиева А.Х. Неразвивающаяся беременность как причина репродуктивных потерь. // Альманах-2019: сборник статей. – 2019. – С.228-230.
16. Kitaya K., Yasuo T. Immunohistochemistrical and clinicopathological characterization of chronic endometritis. // Am J Reprod Immunol. – 2011. – V.66,№ 5. – P.410–415. DOI: 10.1111/j.1600-0897.2011.01051.x
17. Murugan VA, Murphy BO, Dupuis C, Goldstein A, Kim YH. Role of ultrasound in the evaluation of fi rst-trimester pregnancies in the acute setting. // Ultrasonography. – 2020. – V.39,№2. – P.178-189. DOI: 10.14366/usg.19043
18. NICE guideline [NG126]. Ectopic pregnancy and miscarriage: diagnosis and initial management. Published date: 17 April 2019. Accessed at: https://www.nice.org.uk/guidance/ng126.
19. Preisler J., Kopeika J., Ismail L., Vathanan V., Farren J., et al. Defi ning safe criteria to diagnose miscarriage: prospective observational multicentre study. // BMJ. – 2015. – V.351. – P.4579. DOI: 10.1136/bmj.h4579.
20. Kapfh amer J.D., Palaniappan S., Summers K., Kassel K., Mancuso A.C., et al. Diff erence between mean gestational sac diameter and crown-rump length as a marker of fi rsttrimester pregnancy loss aft er in vitro fertilization. // Fertil Steril. – 2018. – V.109,№1. – P.130-136. DOI: 10.1016/j.fertnstert.2017.09.031
21. Filly M.R., Callen P.W., Yegul N.T., Filly R.A. Th e yolk stalk sign: evidence of death in small embryos without heartbeats. J Ultrasound Med. – 2010. – V.29,№2. – P.237-41. DOI: 10.7863/jum.2010.29.2.237
22. Acuña J., Rukh S., Adhikari S. Point-of-care ultrasound identifi cation of yolk stalk sign in a case of failed fi rst trimester pregnancy. World J Emerg Med. – 2018. – V.9,№2. – P.149-151. DOI: 10.5847/wjem.j.1920-8642.2018.02.012
23. Мелкозерова О.А., Башмакова Н.В., Погорелко Д.В., Чистяков М.А. Энергия низкочастотного ультразвука в восстановлении рецепторного поля эндометрия после неразвивающейся беременности. // Акушерство и гинекология. – 2014. – №7. – С.61-67. eLIBRARY ID: 21801006
24. Zubarev PN, Risman BV. [Ultrasonic cavitation and ozonization in treatment of patients with pyo-necrotic complications of diabetic foot syndrome]. Vestn Khir Im I I Grek. 2011;170(1):48-53. (In Russ.). PMID: 21506355.
Об авторах
М. В. АндрееваРоссия
Андреева Маргарита Викторовна, д.м.н., проф., профессор кафедры акушерства и гинекологии
Волгоград
Е. П. Шевцова
Россия
Шевцова Елена Павловна, к.м.н., доц., доцент кафедры акушерства и гинекологии
Волгоград
К. О. Заболотнева
Россия
Заболотнева Ксения Олеговна, к.м.н., доцент кафедры акушерства и гинекологии
Волгоград
Е. Д. Лютая
Россия
Лютая Елена Дмитриевна, д.м.н., проф., заведующая кафедрой лучевой, функциональной и лабораторной диагностики Института НМФО
Волгоград
Т. С. Сивко
Россия
Сивко Татьяна Сергеевна, аспирант, кафедра акушерства и гинекологии
Волгоград
Рецензия
Для цитирования:
Андреева М.В., Шевцова Е.П., Заболотнева К.О., Лютая Е.Д., Сивко Т.С. Современный взгляд на проблему неразвивающейся беременности. Медицинский вестник Юга России. 2021;12(3):6-11. https://doi.org/10.21886/2219-8075-2021-12-3-6-11
For citation:
Andreeva M.V., Shevtsova E.P., Zabolotneva K.O., Lyutaya E.D., Sivko T.S. Modern view of the problem of missed abortion. Medical Herald of the South of Russia. 2021;12(3):6-11. (In Russ.) https://doi.org/10.21886/2219-8075-2021-12-3-6-11
JATS XML






































