Перейти к:
Патоморфологические изменения в сосудах легких в разные сроки летальных исходов больных при COVID-19
https://doi.org/10.21886/2219-8075-2021-12-2-54-61
Аннотация
Цель: изучить патоморфологические изменения в сосудах легких в разные сроки летальных исходов больных при COVID-19. Материал и методы: проанализированы протоколы вскрытий 40 умерших при COVID-19 с гистологическим, гистохимическим исследованием, фоторегистрацией. Для определения степени поражений сосудов легких мы разработали и использовали шкалу полуколичественой оценки признака на основании подсчёта поражённых сосудов лёгких в 10 полях зрения, выраженное в процентах: отсутствие признака – (0%), слабый признак + (1 – 25%), умеренный признак ++ (26 – 50%), выраженный признак +++ (51 – 75%), резковыраженный признак ++++ (76 – 100%). Результаты: в течение первых 14 дней заболевания в сосудах микроциркуляторного русла отмечались стаз, набухание отдельных эндотелиоцитов. Через 15 – 21 дней развития COVID-19 в микрососудах отмечались признаки альтерации эндотелиоцитов, микротромбоз, а спустя 22 – 28 дней заболевания обнаруживались явления репарации и гиперплазии клеток эндотелия. В разные сроки развития заболевания в ткани легких отмечались явления острого респираторного дистресс-синдрома, интерстициальная пневмония, очаговый пневмофиброз. Выводы: при COVID-19 в лёгких имеет место прогрессирующая эндотелиопатия микрососудов, которая характеризуется набуханием, альтерацией, а в дальнейшем гиперплазией, регенерацией эндотелиоцитов в сочетании с микротромбозом. Деструктивные изменения стенок микрососудов лёгких носят поверхностный характер повреждения, без разрушения ретикулярного каркаса и базальных мембран. Эндотелиопатия, микротромбообразование микрососудов легких, интерстициальная пневмония создают порочный круг развития тяжелой дыхательной недостаточности, что необходимо учитывать в клинике для коррекции лечения больных COVID-19.
Для цитирования:
Тодоров С.С., Дерибас В.Ю., Казьмин А.С., Резникова Г.Л., Макаренко Ю.М., Полесовой Ф.В., Тодоров (мл) С.С. Патоморфологические изменения в сосудах легких в разные сроки летальных исходов больных при COVID-19. Медицинский вестник Юга России. 2021;12(2):54-61. https://doi.org/10.21886/2219-8075-2021-12-2-54-61
For citation:
Todorov S.S., Deribas V.Yu., Kazmin A.S., Reznikova G.L., Makarenko Yu.M., Polesovoy F.V., Todorov (jr) S.S. Pathomorphological changes in pulmonary vessels at different terms of lethal outcomes of patients with COVID-19. Medical Herald of the South of Russia. 2021;12(2):54-61. (In Russ.) https://doi.org/10.21886/2219-8075-2021-12-2-54-61
Введение
Несмотря на имеющиеся публикации, касающиеся изучения роли вируса SARS-CoV-2, вызывающего острый респираторный дистресс-синдром, развитие гемореологических расстройств в органах и тканях, а также динамика патоморфологических изменений в сосудах лёгких при COVID-19 остаются малоизученными. Представленные немногочисленные работы основаны, в основном, на анализе результатов отдельных аутопсий больных COVID-19 [1][2][3][4][5][6][7][8].
Альтерация сосудов легких — важное звено в патои танатогенезе умерших COVID-19. В этой связи патоморфологическая характеристика поражений сосудов различного калибра лёгких в различные сроки развития COVID-19 приобретает особое значение в связи с тромбообразованием, кровоизлияниями в лёгочную ткань, прогрессированием воспалительного процесса в легких. Несомненно, в развитии и прогрессировании дыхательной недостаточности, острого респираторного дистресссиндрома, пневмонии имеет значение повреждение аэрогематического барьера, представленного васкулярными и альвеолярными структурами. Развитие острого, а затем и хронического интерстициального воспаления в лёгких, сосудистые расстройства при COVID-19 могут служить основой прогрессирования заболевания с развитием тяжёлой дыхательной и тканевой гипоксии [9][10].
Таким образом, патоморфологические изменения в сосудах лёгких при COVID-19 представляют особый интерес в связи с возможностями своевременной и грамотной коррекции в динамике развития патологического процесса.
Цель исследования — изучить патоморфологические изменения в сосудах легких в разные сроки летальных исходов больных при COVID-19.
Материалы и методы
Материалом исследования послужили протоколы вскрытий 40 умерших пациентов, выполненных в двух патологоанатомических учреждениях: в Ростовском областном патологоанатомическом бюро (30 аутопсий), патологоанатомическом отделении ростовской клинической больницы ЮОМЦ ФМБА России (10 аутопсий). Во всех клинических случаях больные поступали в инфекционные ковидные моногоспитали с подтверждённым анализом ПЦР SARS-CoV-2.
В соответствии с Федеральным законом от 21.11.2011 №323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», п. 4, ст. 67 проведение патологоанатомических вскрытий и выполнение морфологических исследований являются неотъемлемой частью диагностического процесса для оценки основного заболевания, установлении причины смерти и других состояний. Волеизъявление умершего и его родственников для проведения таких исследований не требуется. Вскрытие проводилось в моргах, оборудованных для производства аутопсий умерших с инфекционными заболеваниями, использованием персоналом средств индивидуальной защиты в соответствии с российскими рекомендациями. Команда патологоанатомов с большим опытом работы с инфекционными заболеваниями принимала участие при вскрытии трупов в обеих больницах.
Вскрытие умерших проводилось методом неполной эвисцерации. Фрагменты органов и тканей вырезали и фиксировали в 10% забуференном растворе формалина в течение 48 – 72 часов для последующего рутинного гистологического исследования. Гистологический и гистохимический этапы исследования включали окрашивание микропрепаратов гематоксилином-эозином, пикрофуксином по Ван Гизону и метенамином серебра для оценки коллагеновых и аргирофильных волокон легочных сосудов, интерстициальной ткани. Фоторегистрация проводилась с использованием микроскопа Leica DM 1000 с камерой ICC50 E со встроенной платформой для визуализации (Германия).
Патологоанатомические диагнозы устанавливались по результатам аутопсий умерших больных с учётом клинической картины, лабораторных данных, результатов макроскопического и микроскопического исследований. Для определения степени поражений сосудов легких нами была разработана и использована шкала полуколичественой оценки признака, которая учитывала количество пораженных сосудов легких в 10 полях зрения, выраженное в процентах: отсутствие признака – (0%), слабый признак + (1 – 25%), умеренный признак ++ (26 – 50%), выраженный признак +++ (51 – 75%), резковыраженный признак ++++ (76 – 100%).
Результаты
Среди умерших с COVID-19 было 24 мужчин, 16 женщин, средний возраст больных составил 68 лет (диапазон — 53 – 86 лет). Согласно клиническим данным, хронологические сроки развития заболеваний были следующие: 3-7 дней (3 наблюдения, 7,5%), 8-14 дней (9 наблюдений, 22,5%), 15-21 дней (14 наблюдений, 35%), 22-28 дней (14 наблюдений, 35%).
Всем больным на этапе госпитализации выполнялась компьютерная томография лёгких, которая выявляла признаки интерстициальной вирусной пневмонии (симптомы «матового стекла»).
Во всех случаях в клиническом и патологоанатомическом диагнозах в качестве основного заболевания выступала новая коронавирусная инфекция (COVID-19). Среди сопутствующих заболеваний у больных отмечались прогрессирующий атеросклероз аорты, коронарных артерий сердца (50%), артериальная гипертензия (10%), сахарный диабет 2 типа (25%), ожирение 1 – 2 степени (15%).
Непосредственной причиной смерти были острый респираторный дистресс-синдром (45%), тромбоз ветвей легочной артерии (30%), полиорганная недостаточность (25%).
Полученные данные патоморфологических изменений в легких при COVID-19 оценивались с учётом сроков летальных исходов больных в ковидных госпиталях и поражений сосудов различного диаметра.
Среди патологических признаков поражений сосудов лёгких были стаз эритроцитов, альтерация эндотелиоцитов, тромбоз, нейтрофильная инфильтрация стенок сосудов, фибриноидные изменения, гиперплазия эндотелия, регенерация эндотелия.
У больных, умерших через 3 – 7 суток после манифестации заболевания, в лёгких были обнаружены признаки острого респираторного дистресс-синдрома с наличием гиалиновых мембран в стенках альвеол. Сосуды микроциркуляторного русла на всём протяжении были эктазированы, резко полнокровные, с признаками стаза, сладжа эритроцитов (55%, +++) (рис.1).
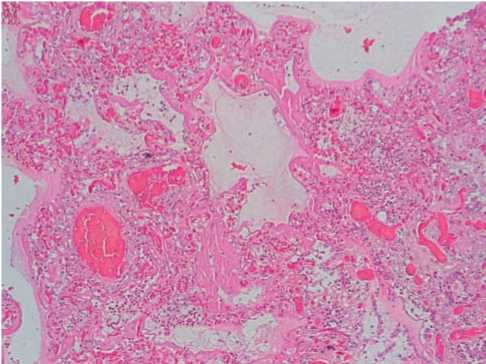
Рисунок 1. Изменения в легких при COVID-19: гиалиновые мембраны стенок альвеол, резкое полнокровие, стаз, сладж эритроцитов микрососудов. Гематоксилин-эозин, х100.
Figure 1. Changes in the lungs in COVID-19: hyaline membranes of the walls of the alveoli, sharp plethora, stasis, sludge of erythrocytes of microvessels. Hematoxylin-eosin, x100.
В капиллярах имелись мелкие скопления нейтрофилов, признаки альтерации единичных эндотелиоцитов (15%, +). Просветы отдельных мелких ветвей легочной артерии были обтурированы смешанными тромбами, состоящими из нитей фибрина, лизированных эритроцитов и немногочисленных нейтрофилов (30%, ++) (рис.2).
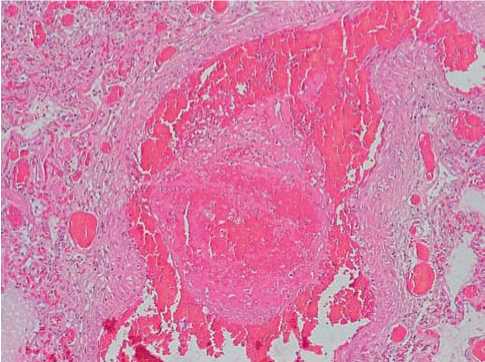
Рисунок 2. В просвете мелкой ветви легочной артерии при COVID-19 — обтурирующий смешанный тромб. Резкое полнокровие, стаз, периваскулярные кровоизлияния. Гематоксилин-эозин, х100.
Figure 2. In the lumen of a small branch of the pulmonary artery in COVID-19 — an obstructing mixed thrombus. Sharp plethora, stasis, perivascular hemorrhage. Hematoxylin-eosin, x100.
В просветах альвеол, вокруг капилляров и мелких артерий в интерстиции имелись свободно лежащие эритроциты, окружённые нежной сетью фибриновых нитей.
У больных, умерших через 8 – 14 суток от начала заболевания, в лёгких были обнаружены признаки острого респираторного дистресс-синдрома, характеризующегося плотными толстыми гиалиновыми мембранами в стенках альвеол с окружающей внутриальвеолярной инфильтрацией нейтрофилами с признаками лизиса клеток (рис. 3). В сосудах микроциркуляторного русла отмечался стаз крови, резкое полнокровие (60%, +++).
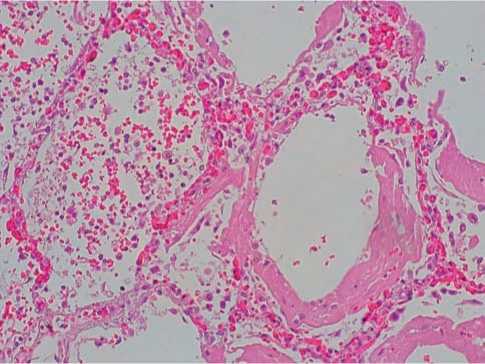
Рисунок 3. Гиалиновые мембраны стенок альвеол, нейтрофильная инфильтрация с лизисом клеток при COVID-19. Гематоксилин-эозин, х100.
Figure 3. Hyaline membranes of the alveolar walls, neutrophilic infiltration with cell lysis with COVID-19. Hematoxylin-eosin, х100.
В просветах немногочисленных мелких и средних ветвей легочной артерии имелись обтурирующие смешанные тромбы (40%, ++), представленные глыбками фибрина, окружённые лизированными эритроцитами. В стенках отдельных мелких ветвей легочной артерии имелись мелкие скопления нейтрофилов, альтерация отдельных групп эндотелиоцитов (35%, ++) (рис. 4).

Рисунок 4. Обтурирующие смешанные тромбы в просветах мелких ветвей легочной артерии, альтерация эндотелиоцитов при COVID-19. Гематоксилин-эозин, х100.
Figure 4. Obturating mixed blood thrombi in the lumen of small branches of the pulmonary artery, alteration of endothelial cells in COVID-19. Hematoxylin-eosin, x100.
У больных, умерших через 15 – 21 суток от начала заболевания в сосудах микроциркуляторного русла отмечался резковыраженный стаз крови (75%, +++), периваскулярные кровоизлияния. Мелкие ветви легочной артерии были резко эктазированы, содержали пристеночные смешанные тромбы в большинстве полей зрения (85%, ++++). В эндотелиоцитах данных сосудов на большем протяжении отмечались явления альтерации (80%, ++++), в стенках артерий отмечалась умеренно выраженная нейтрофильная инфильтрация (70%, +++), фибриноидные изменения (55%, +++) (рис. 5). Альвеолярные перегородки были разрушены, просветы альвеол заполнены большим количеством нейтрофилов (рис. 6). Аргирофильный каркас стенок мелких артерий был сохранен, хорошо выражен.
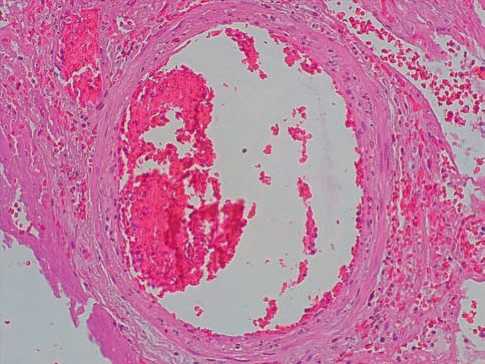
Рисунок 5. COVID-19: пристеночный смешанный тромб в просвете ветви легочной артерии. Альтерация эндотелиоцитов, нейтрофильная инфильтрация стенки артерии. Гематоксилин-эозин, х100.
Figure 5. COVID-19: mixed parietal thrombus in the lumen of a branch of the pulmonary artery. Alteration of endothelial cells, neutrophilic infiltration of the artery wall. Hematoxylin-eosin, x100.
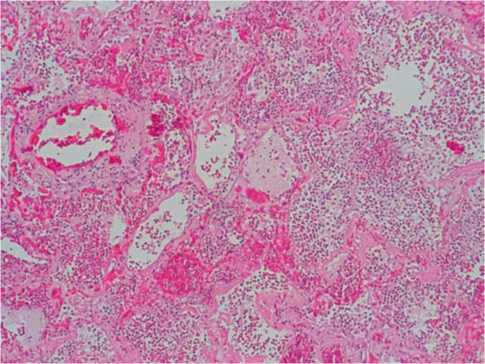
Рисунок 6. COVID-19: в просветах альвеол — выраженная нейтрофильная инфильтрация с деструкцией альвеол, кровоизлияниями. Гематоксилин-эозин, х100.
Figure 6. COVID-19: in the lumen of the alveoli — pronounced neutrophilic infiltration with destruction of the alveoli, hemorrhages. Hematoxylin-eosin, x100.
Указанные морфологические признаки свидетельствовали о преимущественном вовлечении в деструктивный процесс клеток эндотелия сосудов микроциркуляторного русла с сохранением структуры их базальных мембран и ретикулярных волокон.
У больных, умерших через 22 – 28 суток от начала заболевания, в большинстве мелких ветвей легочной артерии имелись обтурирующие смешанные тромбы (70%, +++), состоящие из глыбчатого фибрина и лизированных эритроцитов. В интиме сосудов отмечалась очаговая гиперплазия клеток эндотелия с формированием «подушкообразных» утолщений (30%, ++). Эндотелиоциты отдельных мелких артерий формировали структуры типа «частокола» (50%, ++). В отдельных мелких сосудах легких имелись фибриноидные изменения стенок с формированием обтурирующих смешанных тромбов (45%, ++) (рис. 7).

Рисунок 7. Очаговая гиперплазия клеток эндотелия мелкой ветви легочной артерии (стрелка), обтурирущий смешанный тромб. Гематоксилин-эозин, х100.
Figure 7. Focal hyperplasia of endothelial cells of the small branch of the pulmonary artery (arrow), obstructing mixed thrombus. Hematoxylin-eosin, x100.
В легочной ткани наряду с острыми воспалительными изменениями (гиалиновые мембраны, внутриальвеолярная нейтрофильная инфильтрация с лизисом клеток) наблюдались пролиферативные процессы (фиброзная трансформация с формированием фиброзных узелков ткани) (рис. 8).
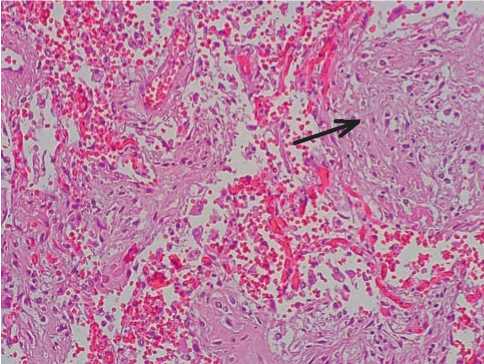
Рисунок 8. Формирование фиброзных «узелков» (стрелка) в ткани легкого при COVID-19. Гематоксилинэозин, х100.
Figure 8. Formation of fibrous nodules (arrow) in the lung tissue in COVID-19. Hematoxylin-eosin, x100.
Ретикулярный каркас стенок сосудов микроциркуляторного русла был сохранён, имелось увеличение аргирофильных волокон в межальвеолярных перегородках.
Полученные результаты патоморфологических изменений сосудов легких при COVID-19 отражены на рис. 9.
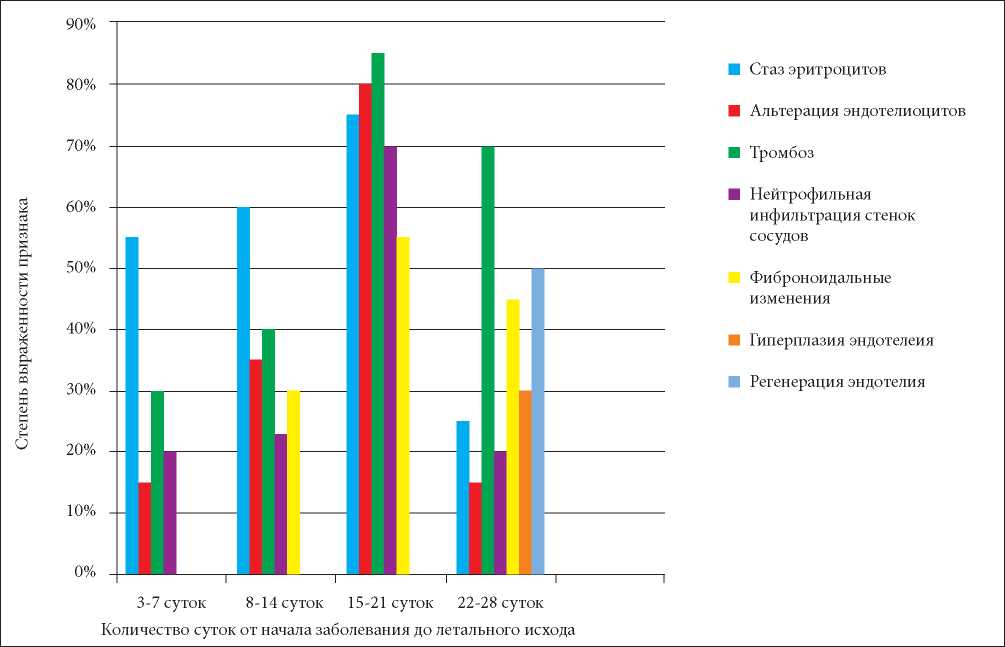
Рисунок 9. Патоморфологические изменения сосудов легких при COVID-19 в разные сроки развития заболевания (по оси абсцисс — количество суток от начала заболевания до летального исхода; по оси ординат — степень выраженности признака).
Figure 9. Pathomorphological changes in the pulmonary vessels in COVID-19 at di erent times of the development of the disease (on the abscissa — the number of days from the onset of the disease to death; on the ordinate — the severity of the sign).
Обсуждение
Научной платформой нашего исследования послужил аутопсийный материал 40 умерших с COVID-19, установленный прижизненно (ПЦР, компьютерная томография легких) и с помощью макро- и микроскопических признаков.
Особое внимание при патоморфологическом изучении легких при COVID-19 было обращено на особенности изменений кровеносных сосудов в разные сроки наступления летальных исходов (3 – 7, 8 – 14, 15 – 21, 22 – 28 дней от начала манифестации заболевания). Аналогичных научных работ в современной литературе нам не встретилось.
Нами было показано, что в течение 3 – 7 дней от начала заболевания COVID-19 в сосудах микроциркуляторного русла преобладали острые циркуляторные расстройства с развитием стаза эритроцитов, резкого полнокровия, которые были наиболее выражены к 15 – 21 суткам. В капиллярах, мелких артериях вначале появлялись признаки альтерации отдельных эндотелиоцитов (3 – 7 сутки) с развитием деструкции групп клеток на 15 – 21 сутки COVID-19, что сопровождалось тромбообразованием, фибриноидными изменениями с нейтрофильной инфильтрацией стенок сосудов. Ретикулярный и коллагеновый каркас стенок мелких артерий был сохранён, что указывало на поверхностный характер повреждения сосудов.
Через 15 – 21 дней развития COVID-19 отмечалась резковыраженная нейтрофильная инфильтрация альвеол с деструкцией альвеолярных перегородок, что, вероятно, было обусловлено альтерацией эндотелия сосудов с повышением сосудистой проницаемости и активацией нейтрофилов.
Через 22 – 28 дней развития COVID-19 в стенках сосудов легких наблюдались репаративные явления, такие как гиперплазия и регенерация эндотелиоцитов с формированием очаговых утолщений интимы с наличием обтурирующих фибриновых, смешанных тромбов. В лёгочной ткани наблюдались очаги интерстициального фиброза с формированием фиброзных узелков.
Заключение
Наше исследование согласуется с результатами других научных работ, посвящённых роли коагулопатии и тромбозу сосудов при COVID-19. Расстройства гемокоагуляции встречаются в зонах диффузного альвеолярного повреждения и сопровождаются развитием тяжелой гипоксемии [11][12][13][14][15].
Мы полагаем, что при COVID-19 в лёгких имеет место прогрессирующая эндотелиопатия микрососудов, которая характеризуется набуханием, альтерацией, а в дальнейшем гиперплазией, регенерацией эндотелиоцитов в сочетании с микротромбозом. Деструктивные изменения стенок микрососудов легких носят поверхностный характер повреждения, без разрушения ретикулярного каркаса и базальных мембран.
Нами впервые отмечено, что к 15 – 21 суткам развития COVID-19 в сосудах микроциркуляторного русла, мелких артериях легких выражены альтеративные изменения эндотелиоцитов, микротромбоз кровеносных сосудов, что в сочетании с нейтрофильной инфильтрацией стенок сосудов и лёгочной ткани способствует деструкции альвеолярных перегородок.
Мы полагаем, что указанные сроки развития (15 – 21 дней) COVID-19 являются критическими в формировании порочного круга развития патологических процессов в легких (микротромбообразования, пневмонии), что ведет к тяжёлой гипоксемии и острой дыхательной недостаточности.
Особый интерес представляют репаративные изменения клеток эндотелия микрососудов при COVID-19, что может иметь существенное значение в дальнейшем развитии стенозирующей микроангиопатии легких. Возможно, подобные «подушкообразные» утолщения интимы за счёт гиперплазии клеток эндотелия могут напоминать таковые при интимальной гиперплазии артерий, обусловленные другими патологическими процессами, описанными в литературе [16]. Данные структурные изменения интимы микрососудов легких при COVID-19 в отдалённом периоде могут служить основой развития гипертензии сосудов малого круга кровообращения и формирования легочного сердца с последующим развитием хронической правожелудочковой недостаточности. С этой целью в дальнейшем необходимо продолжить изучение иммуногистохимических, молекулярно-биологических особенностей поражения сосудов легких при COVID-19.
Таким образом, эндотелиопатия, микротромбообразование микрососудов лёгких, интерстициальная пневмония создают порочный круг развития тяжелой дыхательной недостаточности, что необходимо учитывать в клинике для коррекции лечения больных COVID-19.
Список литературы
1. Carsana L., Sonzogni A., Nasr A., Rossi R.S., Pellegrinelli A., et al. Pulmonary post-mortem findings in a series of COVID-19 cases from northern Italy: a two-centre descriptive study. // Lancet Infect Dis. – 2020. – V.20(10). – P. 1135-1140. DOI: 10.1016/S1473-3099(20)30434-5
2. Yao X.H., Li T.Y., He Z.C., Ping Y.F., Liu H.W., et al. [A pathological report of three COVID-19 cases by minimal invasive autopsies]. // Zhonghua Bing Li Xue Za Zhi. 2020. – V.49(5). – P. 411-417. (In Chinese). DOI: 10.3760/cma.j.cn112151-20200312-00193
3. Menter T, Haslbauer JD, Nienhold R, Savic S, Hopfer H, et al. Postmortem examination of COVID-19 patients reveals diffuse alveolar damage with severe capillary congestion and variegated findings in lungs and other organs suggesting vascular dysfunction. // Histopathology. – 2020. – V.77(2). – P. 198-209. DOI: 10.1111/his.14134
4. Goshua G., Pine A.B., Meizlish M.L., Chang C.H., Zhang H., et al. Endotheliopathy in COVID-19-associated coagulopathy: evidence from a single-centre, cross-sectional study. // Lancet Haematol. – 2020. – V.7(8). – P. e575-e582. DOI: 10.1016/S2352-3026(20)30216-7
5. Katneni UK, Alexaki A, Hunt RC, Schiller T, DiCuccio M, et al. Coagulopathy and Thrombosis as a Result of Severe COVID-19 Infection: A Microvascular Focus. // Thromb Haemost. – 2020. – V. 120(12). – P. 1668-1679. DOI: 10.1055/s-0040-1715841
6. Leppkes M., Knopf J., Naschberger E., Lindemann A., Singh J., et al. Vascular occlusion by neutrophil extracellular traps in COVID-19. // EBioMedicine. – 2020. – V.58. – P.102925. DOI: 10.1016/j.ebiom.2020.102925
7. do Espírito Santo D.A., Lemos A.C.B., Miranda C.H. In vivo demonstration of microvascular thrombosis in severe COVID-19. // J Thromb Thrombolysis. – 2020. – V. 50(4). – P. 790-794. DOI: 10.1007/s11239-020-02245-x
8. Iba T., Connors J.M., Levy J.H. The coagulopathy, endotheliopathy, and vasculitis of COVID-19. // Inflamm Res. – 2020. – V. 69(12). P.1181-1189. DOI: 10.1007/s00011-020-01401-6
9. Klok F.A., Kruip M.J.H.A., van der Meer N.J.M., Arbous M.S., Gommers D.A.M.P.J., et al. Incidence of thrombotic complications in critically ill ICU patients with COVID-19. // Thromb Res. – 2020. – V.191. – P.145-147. DOI: 10.1016/j.thromres.2020.04.013
10. Zhou F., Yu T., Du R., Fan G., Liu Y., et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. // Lancet. 2020. – V.395(10229). – P. 1054-1062. DOI: 10.1016/S0140-6736(20)30566-3
11. Kollias A., Kyriakoulis K.G., Dimakakos E., Poulakou G., Stergiou G.S., Syrigos K. Thromboembolic risk and anticoagulant therapy in COVID-19 patients: emerging evidence and call for action. // Br J Haematol. – 2020. V.189(5). – P.846-847. DOI: 10.1111/bjh.16727
12. Bray M.A., Sartain S.E., Gollamudi J., Rumbaut R.E. Microvascular thrombosis: experimental and clinical implications. // Transl Res. – 2020. – V. 225. – P. 105-130. DOI: 10.1016/j.trsl.2020.05.006
13. Рыбакова М.Г., Карев В.Е., Кузнецова И.А. Патологическая анатомия новой коронавирусной инфекци COVID-19. Первые впечатления. // Архив патологии. – 2020. – т.82. - №5. - С.5-15. DOI: 10.17116/patol2020820515
14. Одилов А.А., Цимбалист Н.С., Волков А.В., Бабиченко И.И. Изменения органов, выявленные при посмертном исследовании пациентов с COVID-19. // Архив патологии. - 2020.- т.82. - №6. - С.63-69. DOI: 10.17116/patol20208206163
15. Самсонова М.В., Михалева Л.М., Зайратьянц О.В., Варясин В.В. Быканова А.В. и др. Патология легких при COVID-19 в Москве // Архив патологии. - 2020. - т.82. - №4. - С.32-40. DOI: 10.17116/patol20208204132
16. Тодоров С.С., Сидоров Р.В., Талалаев Е.П., Шлык И.Ф. Роль гликозаминогликанов в развитии интимальной гиперплазии при шунтировании коронарных артерий. // Медицинский вестник Юга России. - 2018. - 9(3). - С.94-98. DOI: 10.21886/2219-8075-2018-9-3-94-98
Об авторах
С. С. ТодоровРоссия
Тодоров Сергей Сергеевич, д.м.н., доцент кафедры оперативной хирургии, клинической анатомии и патологической анатомии, руководитель морфологического отдела клиники, врач-патологоанатом высшей категории
Ростов-на-Дону
В. Ю. Дерибас
Россия
Дерибас Виктория Юрьевна, заведующий отделением, врач-патологоанатом высшей категории, ассистент кафедры патологической анатомии
Ростов-на-Дону
А. С. Казьмин
Россия
Казьмин Андрей Сергеевич, ассистент кафедры патологической анатомии, врач-патологоанатом высшей категории
Ростов-на-Дону
Г. Л. Резникова
Россия
Резникова Галина Леонидовна, кандидат медицинских наук, главный врач, врач-патологоанатом высшей категории
Ростов-на-Дону
Ю. М. Макаренко
Россия
Макаренко Юрий Маркович, кандидат медицинских наук, заведующий отделом организационно-методической работы
Ростов-на-Дону
Ф. В. Полесовой
Россия
Полесовой Филипп Валерьевич, заведующий патологоанатомическим отделением, врач-патологоанатом
Ростов-на-Дону
С. С. Тодоров (мл)
Россия
Тодоров Сергей Сергеевич (мл.), студент лечебно-профилактического факультета
Ростов-на-Дону
Рецензия
Для цитирования:
Тодоров С.С., Дерибас В.Ю., Казьмин А.С., Резникова Г.Л., Макаренко Ю.М., Полесовой Ф.В., Тодоров (мл) С.С. Патоморфологические изменения в сосудах легких в разные сроки летальных исходов больных при COVID-19. Медицинский вестник Юга России. 2021;12(2):54-61. https://doi.org/10.21886/2219-8075-2021-12-2-54-61
For citation:
Todorov S.S., Deribas V.Yu., Kazmin A.S., Reznikova G.L., Makarenko Yu.M., Polesovoy F.V., Todorov (jr) S.S. Pathomorphological changes in pulmonary vessels at different terms of lethal outcomes of patients with COVID-19. Medical Herald of the South of Russia. 2021;12(2):54-61. (In Russ.) https://doi.org/10.21886/2219-8075-2021-12-2-54-61
JATS XML







































