Перейти к:
Морфологическая верификация причин первой неразвивающейся беременности
https://doi.org/10.21886/2219-8075-2021-12-1-62-67
Аннотация
Цель: сопоставить анамнестические данные о перенесенных воспалительных заболеваниях генитального тракта с результатами расширенного морфологического исследования вакуум-аспиратов полости матки при первой неразвивающейся беременности.
Материалы и методы: I группа — 15 пациенток с первой неразвивающейся беременностью в сроках на 6–8-ой неделях гестации. У всех женщин отмечены эпизоды персистирующей вирусной инфекци: периодические герпетические высыпания на губах или половых органах, определение методом ПЦР в крови вируса простого герпеса (HSV), вируса папилломы человека (HPV) и цитомегаловируса (CMV). Исключены пациентки с привычным невынашиванием, анэмбрионией (по данным УЗИ), эндокринопатии, а также мужской фактор и другие причины ранней потери беременности. II группа — 20 здоровых женщин сопоставимого возраста, решившие прервать нежеланную беременность. Уровень иммуноэкспресии интерферона альфа-2 (IFN альфа 2) исследовали в клетках вакуум-аспиратов (синцитиотрофобласте ворсин и его депортантах, в децидуальных клетках париетального эндометрия и маточноплацентарной области) по 3-хбалльной шкале. Расчет статистических данных выполняли на персональном компьютере с использованием программы «Microsoft excel 2011 для Mac» и статистической программы «Statistica».
Результаты: в группе здоровых женщин основными продуцентами IFN альфа 2 стали синцитиотрофобласт ворсин и его депортанты, а также материнские децидуальные клетки в составе париетального эндометрия и маточно-плацентарной области. В основной группе диагностировано выраженное гематогенное инфицирование (микроабсцессы, васкулиты, лимфомакрофагальная инфильтрация) с дистрофией и некрозом децидуальных материнских клеток и вторичной патологией ворсин плацент, что привело к достоверному снижению иммуноэкспрессии IFN альфа 2 во всех изученных клетках.
Выводы: отсутствие анамнестических данных о перенесённых урогенитальных инфекциях не исключает этиологическую роль воспалительного компонента в генезе неразвивающейся беременности. Первая репродуктивная потеря требует адекватной интерферонотерапии после операции и тщательного обследования семейной пары для уточнения доказательных причин первой репродуктивной потери.
Ключевые слова
Для цитирования:
Лебеденко Е.Ю., Милованов А.П., Саблина Н.В., Фокина Т.В., Гайда О.В. Морфологическая верификация причин первой неразвивающейся беременности. Медицинский вестник Юга России. 2021;12(1):62-67. https://doi.org/10.21886/2219-8075-2021-12-1-62-67
For citation:
Lebedenko E.Y., Milovanov A.P., Sablina N.V., Fokina T.V., Gaida O.V. Morphological verification of the first missed abortion. Medical Herald of the South of Russia. 2021;12(1):62-67. https://doi.org/10.21886/2219-8075-2021-12-1-62-67
Введение
Неразвивающаяся беременность (НБ) — осложнение, связанное с гибелью эмбриона, плода в полости матки. Термин «неразвивающаяся беременность», используемый в Российской практике, в англоязычных странах заменен на определение «несостоявшийся выкидыш» (missed abortion), что более точно отображает суть данной патологии — отсутствие прогрессирования беременности при задержке эмбриона (плода) в полости матки.
В современных акушерстве и гинекологии общепринятыми причинами репродуктивных потерь со стороны матери являются структурные аномалии матки, антифосфолипидный синдром, гормональные и метаболические нарушения. Генетические нарушения провоцируют 50–60% репродуктивных потерь на ранних сроках [1]. Роль соматических заболеваний матери как причин прерывания беременностей преимущественно возрастает во втором и третьем триместрах беременности. В 26–40% случаев причины несостоявшегося выкидыша считаются неизвестными.
Следует отметить, что сложившаяся концепция значимой роли хромосомных аномалий как главной причины гестационных потерь I триместра беременности сформировала у клиницистов пассивную позицию, которая даже при отсутствии в эмбриональных клетках хромосомных нарушений не побуждает клинициста к верификации других причин репродуктивной неудачи. В результате стремление семейной пары в ближайшие сроки после первой потери беременности раннего срока реализовать свою репродуктивную функцию на фоне отсутствия у акушеров-гинекологов настороженного отношения к первой репродуктивной неудаче переводит акушерскую ситуацию в привычное невынашивание.
Удельный вес НБ в структуре репродуктивных потерь варьируется, но остаётся на довольно высоком уровне — 10–20%. По данным А.П. Милованова и О.Ф. Серовой (2011), среди потерь I триместра НБ составила 4–10% всех подтвержденных беременностей [2]. При этом из 180 обследованных женщин с НБ у 108 (60%) выявлены воспалительные (чаще всего — вирусные) причины при наличии субхронических форм или вирусоносительства. В абортном материале фиксировано сочетание париетального и базального децидуита, васкулитов, микроабсцессов и других признаков вирусного поражения клеток.
Таким, образом, при подтверждении факта НБ наиболее информативными способами выяснения её причин является подробное уточнение анамнестических данных и развернутое морфологическое исследование эвакуированного содержимого полости матки [3][4].
Цель исследования — сопоставить анамнестические данные о перенесенных воспалительных заболеваниях генитального тракта с результатами расширенного морфологического исследования вакуум-аспиратов полости матки при первой неразвивающейся беременности.
Материалы и методы
I группу составили 15 нерожавших женщин (средний возраст — 29,4±2,3 года) с первой НБ в сроках 6–8 недель, диагностированной методом прогрессивной оценки динамики уровня β-ХГЧ крови, а также методом ультразвукового исследования. Группу сравнения (II) составили 20 здоровых женщин сопоставимого возраста (27,1± 3,1 года), пожелавшие прервать непланируемую беременность путем артифициального аборта на том же сроке.
Критериями исключения служили роды в анамнезе, привычное невынашивание, неразвивающаяся беременность по типу анэмбрионии, а также связанная с эндокринопатиями и нарушениями гемостаза, хирургическими вмешательствами на матке, шейке матки.
В обеих группах пациенток опорожнение полости матки осуществляли в гинекологическом отделении ГБУЗ ГКБ им. С.П. Боткина (Москва) вакуум-аспирацией (методом, регламентированным Приказом № 572н, а также руководством ACOG (2015) [5]), аппаратом Eschmann VP 35 (Великобритания) при отрицательном давлении 80 kPa или пластиковым аспиратором объемом 60 мл с использованием одноразовых пластиковых канюль без предварительного расширения шейки матки с внутривенным обезболиванием.
Сбор инфекционного анамнеза, а также результатов предыдущих клинико-лабораторных исследований проводился по специально разработанной анкете.
В НИИ морфологии человека (г. Москва) из вакуумаспиратов готовили гистологические срезы и окрашивали их гематоксилином и эозином. После просмотра в микроскопе «Leica 2500» (Германия) отбирали блоки с ворсинами плаценты, париетальным эндометрием, а также маточно-плацентарной области, то есть места соединения ворсин со стенкой матки. Из этих блоков делали дополнительные срезы и после их депарафинизации помещали на предметные стекла с полилизиновым покрытием. Демаскировку антигенов проводили в СВ печи в течение 20 минут в цитратном буфере (рH 6,0). C помощью иммунопероксидазной технологии использовали следующие антитела: 1) поликлональное антитело против IFNa2 с оценкой степени иммуноэкспрессии: 1 балл — светлокоричневое окрашивание цитоплазмы клеток, 2 балла — коричневое, 3 балла — т`мно-коричневое; 2) моноклональное кроличье антитело против виментина (Vimentin EP21) для определения децидуадьных стромальных клеток; 3) моноклональное кроличье антитело против гранзима Б (Granzyme B) — маркер маточных натуральных киллеров. Для визуализации результатов иммурореакции использована система детекции. Проводили отрицательные реакции на используемые реагенты.
Статистическую обработку балльной оценки иммуноэкспрессии IFNa2 осуществляли с использованием критерия сравнения Манна-Уитни.
Результаты
При подробном исследовании инфекционного анамнеза пациенток I группы установлено, что четыре пациентки (26,7%) перенесли острые воспалительные заболевания бактериальной этиологии только во время данной беременности, диагностированной как неразвивающаяся. У остальных (73,3%) анамнестические данные свидетельствовали о перенесенных острых вирусных заболеваниях во время беременности: острая герпесвирусная и острая респираторная вирусная инфекция (ОРВИ). Также у данных пациенток до наступления беременности методом ПЦР однократно выявляли в крови HSV-2 — 40,0%, CML — 26,6%, вирус краснухи — 26,6% и бактериальные агенты — 26,6%. 7 пациенток (46,7%) перенесли острые воспалительные заболевания вирусной и бактериальной этиологии.
Результаты гистологического исследования вакуумаспиратов полости матки пациенток 1 группы показали, что у всех пациенток обнаружены выраженные признаки гематогенного инфицирования, в частности микроабсцессы, васкулиты, лимфомакрофагальная инфильтрация в париетальном эндометрии и маточно-плацентарной области, демонстрирующие картину острого или хронического эндометрита. При этом маркеры вирусного поражения эндометрия диагностированы у каждой второй пациентки (50%). В 7 случаях (46,7%) в эндометрии визуализировались признаки базального децидуита с микроабсцессами. Нарушения локального гемостаза в виде микротромбозов артерий выявлены в 11 случаях (73,3%). При этом ни у одной пациентки, вошедшей в исследование, нарушений свертывающей системы крови ранее диагностировано не было. В 12 из 15 случаев (80%) выявлены реологические нарушения по типу развития ретрохориальной гематомы различных сроков давности.
Сопоставление анамнестических данных о перенесённых инфекционно-воспалительных заболеваниях с результатами цитоморфологического исследования показало следующее. У 11 (73,3%) пациенток причиной НБ являлось локальное воспаление, возникшее путем восходящего или гематогенного инфицирования, которое при погружении бластоцисты в эндометрий и формировании хориального мешка повредило эпителиоциты желез, децидуальные клетки и инвазирующий цитотрофобласт.
У четырёх женщин (26,7%), не имевших инфекционного анамнеза, морфологические признаки воспаления на фоне пролиферации эпителия с клеточной инфильтрацией стромы интерпретированы как следствие воспалительной реакции, возникшей в результате задержки погибшего плодного яйца в полости матки и отторжения ворсин хориона. У данных пациенток были выявлены неинфекционные факторы, обусловившие раннюю потерю плода, имеющие алло / аутоиммунную природу (аномальная активность естественных киллеров (NK-клеток), наличие аллоиммунных антител, HLA-несовместимость партнёров, тромбофилические состояния).
При гистологическом исследовании 20 вакуум-аспиратов пациенток II группы отсутствовали признаки воспалительной реакции (децидуальная ткань, ворсины хориона, прогрессирующая маточная беременность), что соответствовало отсутствию анамнестических данных о перенесенных бактериальных и вирусных инфекционных заболеваниях до и в течение беременности.
Если принимать во внимание данные некоторых авторов о роли инфекционных агентов как пускового механизма в последующей индукции аутоиммунных реакций эндометрия [6], развития вторичных иммунодефицитных и иммуносупрессивных состояний, представляло определенный интерес сопоставление уровней иммуноэкспресии интерферона альфа-2 (IFNa2) в клетках вакуум-аспиратов после первой НБ в сроках 6–8 недель с такими же во II группе (медицинских абортов) .
Основным объектом иммуногистохимического исследования стали клетки, продуцирующие IFN a2. При балльной оценке достоверно более низкой была иммуноактивность всех клеток, продуцентов IFNa2 в группе пациенток с НБ (I группа) (табл. 1).
Таблица / Table 1
Балльная оценка иммуноэкспрессии IFNα2 в клетках вакуум-аспиратов медицинских абортов (МА) и неразвивающейся беременности (НБ)
Scoring of IFNα2 immunoexpression in medical abortion (MA) and first occurred missed abortion caused by inflammation (NB) cells
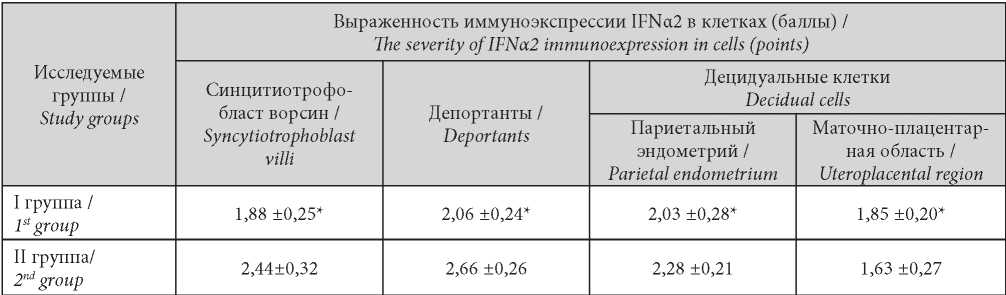
Примечание: * — p <0,001 (критерий сравнения Манна-Уитни).
Иммуногистохимически воспалительная инфильтрация характеризовалась микроабсцессами в маточно-плацентарной области с сохранением IFNa2 продуцирующих клеток только в зоне пограничного слоя фибриноида (слева) и гибелью децидуальных клеток в зоне воспаления (рис. 1). Выявляли сближение ворсин возле стенки хориального мешка, уменьшение числа депортантов, в межворсинчатом пространстве определялся истонченный синцитиотрофобласт при сниженной иммуноэкспресии IFNa2, в строме — васкулогенез отсутствовал (рис. 2 и рис. 3).
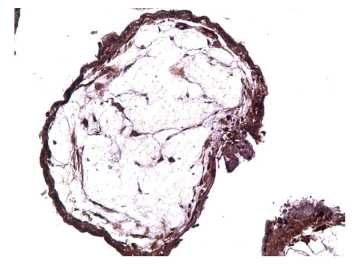
Рисунок 1. НБ (7 нед п.о.): микроабсцесс в маточноплацентарной области, сохранение IFNa2- продуцирующих клеток только в зоне пограничного слоя фибриноида (слева) и гибель децидуальных клеток в зоне воспаления, иммуногистохимия, х100.
Figure 1. Occurred missed abortion (7 weeks bp): microabscess in the uteroplacental region, retention of IFNa2- producing cells only in the zone of the fibrinoid boundary layer (left) and death of decidual cells in the inflammation zone, immunohistochemistry, x100.
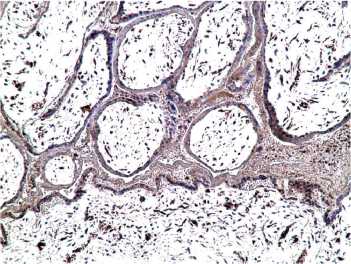
Рисунок 2. НБ (6 нед): ворсина плаценты с истонченным синцитиотрофобластом при сниженной иммуноэкспресии IFNa2, в строме — отсутствие васкулогенеза, х200.
Figure 2. Occurred missed abortion (6 weeks): placental villi with thinned syncytiotrophoblast with reduced immunoexpression of IFN-2, in the stroma absence of vasculogenesis, x200.
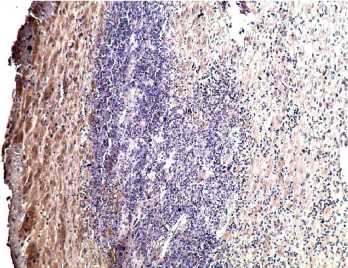
Рисунок 3. НБ (8 нед): сближенные ворсины возле хориального мешка (внизу), отсутствие имууноэкспресии IFNa2, в строме — отдельные плацентарные макрофаги, х200.
Figure 3. Occurred missed abortion (8 weeks): contiguous villi near the chorionic sac (bottom), lack of immunoexpression of IFN-2, in the stroma individual placental macrophages, x200.
При иммуногистохимическом исследовании клеток пациенток II группы максимальная экспрессия IFNa2 обнаружена в покровном эпителии ворсин плаценты-синцитиотрофобласте, а также в его производных частях — депортантах (рис. 4).
Выраженная иммунореакция (3 балла) была видна в цитоплазме и поверхностной щеточной кайме синцитиотрофобласта. Кроме того, характерными стали боковые выпячивания эпителия с множеством ядер в общей цитоплазме. Связи депортантов с синцитиотрофобластом постепенно истончались, и они оказывались в межворсинчатом пространстве, в венозных коллекторах.
Визуализированные ворсины плаценты отличались толстым синцитиотрофобластом и выраженной экспрессией IFNa2, в строме обнаруживали интенсивный васкулогенез (рис. 5).
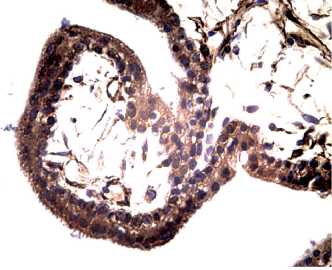
Рисунок 4. Артифициальный аборт — вакуумаспирация (6 нед): ворсины плаценты с толстым синцитиотрофобластом и выраженной экспрессией IFNa2, в строме — интенсивный васкулогенез, иммуногистохимия, х 200.
Figure 4. Artificial abortion — vacuum aspiration (6 weeks): placental villi with thick syncytiotrophoblast and pronounced expression of IFN-2, in the stroma intense vasculogenesis, immunohistochemistry, x 200.
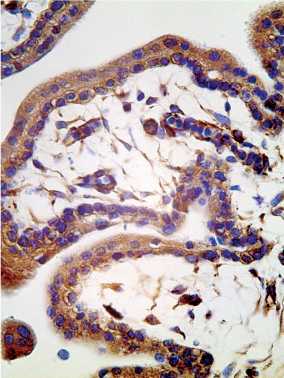
Рисунок 5. Артифициальный аборт — вакууумаспирация (7 нед): полноценные ворсины возле хориального мешка, иммуноэкспрессия IFNa2 в синцитиотрофобласте и стромальных сосудах (ангиогенез), иммуногистохимия, х 200.
Figure 5. Artificial abortion — vacuum aspiration (7 weeks): full-fledged villi near the chorionic sac, immunoexpression of IFNa2 in syncytiotrophoblast and stromal vessels (angiogenesis), immunohistochemistry, x 200.
Обсуждение
Проведённое сравнение иммуноэкспрессии IFNa2 между пациентками после первой НБ (I группа) и здоровыми женщинами с медицинскими абортами (II группа) подтвердило достоверный дефицит интерфероногенеза в материнских децидуальных клетках и плацентарных структурах — синцитиотрофобласте и его депортантах. При физиологическом развитии беременности в I триместре у пациенток II группы зарегистрирована существенная продукция IFNa2 синцитиотрофобластом ворсин и его депортантами с доставкой в материнский организм, а также материнскими децидуальными клетками в составе париетального эндометрия и маточно-плацентарной области.
Нет сомнений в том, что этот феномен причинно связан с массивным воспалительным процессом в париетальном эндометрии и маточно-плацентарной области, а также с дистанционным эффектом местных факторов воспаления матери на ворсины плаценты, в том числе цитотоксическое действие маточных клеток-киллеров.
Заключение
Полученные данные коррелируют с общепринятой на международном конгрессе FIGO 2006 г. ассоциацией неразвивающейся беременности и хронического эндометрита [10]. Однако рутинное назначение антибиотиков каждой пациентке с НБ без доказанного причинно-значимого инфекта необходимо признать нерациональным, поскольку применение химиопрепаратов при асептическом воспалении может усилить иммунодепрессию и усугубить структурно-функциональные нарушения эндометрия.
Полученные результаты убеждают в необходимости пересмотра сформировавшегося среди акушеров-гинекологов стереотипа рассматривать первую НБ как спорадический элемент естественного отбора. Целесообразным подходом к профилактике последующего привычного невынашивания беременности среди пациенток, имеющих первую НБ в анамнезе, следует считать формирование группы высокого риска повторных репродуктивных неудач. При подтверждении вирус-ассоциированной воспалительной причины первой НБ необходимо проводить адекватную интерферонотерапию в послеоперационном периоде и аналогичную прегравидарную подготовку к следующей беременности.
Активное выявление анамнестических данных о персистирующей вирусной инфекции позволяет верифицировать её этиологическую роль в генезе НБ, заключающуюся в развитии морфофункциональных изменений эндометрия, сопровождающихся нарушением нормальной циклической трансформации и рецептивности ткани, нарушением имплантации, трофики и ранней потере эмбриона. Необоснованное проведение антибиотикотерапии препаратами широкого спектра действия в рамках реабилитации после НБ оставляет в «тени» истинные этиологические факторы и механизмы остановки развития беременности. Сопоставление данных инфекционного анамнеза с развернутым морфологическим исследованием уточняет цели последующей прегравидарной подготовки при планировании беременности, обосновывает целесообразность и спектр дополнительных диагностических мер для профилактики повторных ранних репродуктивных потерь.
Список литературы
1. Адамян Л.В., Серов В.Н. Выкидыш в ранние сроки беременности: диагностика и тактика ведения. Клинические рекомендации (протокол лечения). – 2016.
2. Милованов А.П. Серова О.Ф. Причины и дифференцированное лечение раннего невынашивания беременности. - М. Студия МДВ; 2011.
3. Ранние сроки беременности. Под ред. В.Е. Радзинского, А.А. Оразмурадова. – М.; 2005.
4. Милованов А.П. Патология системы мать-плацентаплод.- М.: Медицина; 1999.
5. Акушерство. Национальное руководство. Под ред. Э. К. Айламазяна, В. И. Кулакова, В. Е. Радзинского, Г. М. Савельевой. - 2014.
6. Радзинский В.Е., Запертова Е.Ю., Мисник В.В. Генетические и иммунологические аспекты привычного невынашивания беременности. // Акуш. и гин. - 2005. - №6. – С.24-29. eLIBRARY ID: 9141156
7. Милованов А.П., Волощук И.Н. Депортированный синцитиотрофобласт и плацентарные микрочастицы в организме матери при нормальной беременности и преэклампсии (28 лет спустя). // Архив патологии. – 2017. - №79(1). - С: 61–7. DOI: 10.17116/patol201779161-67
8. Papadopoulos N, Simopoulos C, Karamanidis D, Kotini A, Tamiolakis D. Large granular lymphocytes activity in women with spontaneous abortions during the 1st trimester of gestation. .. Panminerva Med. - 2002. – V. 44(4). – P. 343-347.
9. Lambropoulou M. Tamiolokis N. Venizelos J., Liberis V., Galazios G., et al. Imbalance of mononuclear cell infiltrates in the placental tissue from after spontaneous abortion versus therapeutic termination from 8th to 12th weeks of gestational age. // Clin. Exp. Med. - 2006. – V. 6(4). – P.171- 176. DOI: 10.1007/s10238-006-0111-x.
10. ACOG’s Guide to Managing Miscarriage: Follow Patient Preference. Updated clinical management of early pregnancy loss focuses on patient choice. Gupta S. Ed. - Medpageto- day, 04.22.2015.
Об авторах
Е. Ю. ЛебеденкоРоссия
Лебеденко Елизавета Юрьевна, д.м.н, доц., профессор кафедры акушерства и гинекологии №3
Ростов-на-Дону
А. П. Милованов
Россия
Милованов Андрей Петрович, д.м.н., проф., главный научный сотрудник лаборатории патологии репродукции
Москва
Н. В. Саблина
Россия
Саблина Наталья Валерьевна, врач акушер-гинеколог гинекологического отделения
Москва
Т. В. Фокина
Россия
Фокина Татьяна Васильевна, к.м.н., старший научный сотрудник лаборатории патологии репродукции
Москва
О. В. Гайда
Россия
Гайда Оксана Владимировна, доцент кафедры акушерства и гинекологии № 3
Ростов-на-Дону
Рецензия
Для цитирования:
Лебеденко Е.Ю., Милованов А.П., Саблина Н.В., Фокина Т.В., Гайда О.В. Морфологическая верификация причин первой неразвивающейся беременности. Медицинский вестник Юга России. 2021;12(1):62-67. https://doi.org/10.21886/2219-8075-2021-12-1-62-67
For citation:
Lebedenko E.Y., Milovanov A.P., Sablina N.V., Fokina T.V., Gaida O.V. Morphological verification of the first missed abortion. Medical Herald of the South of Russia. 2021;12(1):62-67. https://doi.org/10.21886/2219-8075-2021-12-1-62-67







































