Перейти к:
Изучение биопленок штаммов V. cholerae на поверхностях биотических и абиотических субстратов с помощью MALDI-ToF масс-спектрометрии
https://doi.org/10.21886/2219-8075-2020-11-2-94-101
Аннотация
Цель: идентификация и сравнительное изучение белковых спектров биопленок холерных вибрионов методом MALDI-ToF масс-спектрометрии.
Материалы и методы: исследованы штаммы V. cholerae О1, выделенные из разных источников. Методы: бактериологический, масс-спектрометрический.
Результаты: масс-спектрометрический анализ показал невозможность идентификации штаммов из планктонных проб и из биопленок на хитине и пластике. После культивирования штаммов биопленки и планктона все они были отнесены к виду V. cholerae c показателями Score выше 2,300. Сравнительный анализ MALDI-ToF масс-спектров различных вариантов культур V. cholerae выявил различия, в то же время сохранялись общие пики, отличающиеся по интенсивности.
Выводы: все пробы культур холерных вибрионов, взятые в анализ после культивирования на питательной среде, были достоверно идентифицированы с высоким показателем Score. В результате сравнительного анализа белковых масс-спектров по величине масса/заряд и относительной интенсивности пиков не выявлено белков, характерных только для планктонных культур или биопленок холерных вибрионов. Показана стабильность фенотипических свойств холерного вибриона независимо от формы его существования и высокая достоверность метода MALDI-ToF масс-спектрометрии для идентификации как планктонных, так и биопленочных форм V. сholeraе при сохранении протокола исследования и бактериологическом высеве.
Ключевые слова
Для цитирования:
Полеева М.В., Чемисова О.С., Меньшикова Е.А., Сагакянц М.М., Курбатова Е.М. Изучение биопленок штаммов V. cholerae на поверхностях биотических и абиотических субстратов с помощью MALDI-ToF масс-спектрометрии. Медицинский вестник Юга России. 2020;11(2):94-101. https://doi.org/10.21886/2219-8075-2020-11-2-94-101
For citation:
Poleeva M.V., Chemisova O.S., Menshikova E.A., Sagakyants M.M., Kurbatova E.M. Study of biofilms by V. cholerae strains on the surfaces of biotic and abiotic substrates using mass spectrometry. Medical Herald of the South of Russia. 2020;11(2):94-101. (In Russ.) https://doi.org/10.21886/2219-8075-2020-11-2-94-101
Введение
Холерные вибрионы способны образовывать биопленки как на биотических, так и на абиотических поверхностях. Формирование биопленки можно рассматривать как один из факторов персистенции этих микроорганизмов, так как биопленочные штаммы демонстрируют множественную лекарственную устойчивость [1], устойчивость к дезинфектантам [2], что представляет собой потенциальную угрозу для здоровья человека. Формируя биопленки, микроорганизмы могут быть в 1000 раз более устойчивыми к стрессу, чем планктонные формы [3,4], сохраняя при этом способность к заражению. Биопленки являются защитным механизмом, позволяющим холерным вибрионам выживать на поверхностях гидробионтов, в то время как их планктонные варианты погибают [5,6]. Также рядом авторов была выдвинута гипотеза о том, что штаммы V. cholerae, ассоциированные с хитином, лучше защищены во время транзита через кислотный барьер желудка, что позволяет большему количеству бактерий достичь места колонизации тонкой кишки [7,8].
В последнее время в связи с увеличением использования пластика в промышленности и быту происходит загрязнение вод Мирового океана полиэтиленом и пластиковым мусором [9], на котором часто встречаются колонии бактерий, относящиеся к роду вибрионов, в том числе и патогенные для человека. Высказывается предположение, что они способствуют распространению морем инфекционных заболеваний [10], в том числе и холеры.
Особую роль в сохранении холерного вибриона в водных экосистемах играют хитиновые покрытия членистоногих, некоторых диатомовых водорослей и грибов, на поверхности которых вибрион способен существовать в виде биопленки. Хитин является вторым по распространенности полисахаридом на Земле [11]. Эволюционно он служит для вибрионов основным питательным субстратом, а сформированные на его поверхности биопленки местом обитания и убежищем от неблагоприятных факторов окружающей среды. В результате многочисленных исследований установлено, что вибрионы обладают сложным хитинолитическим комплексом, обуславливающим утилизацию хитина в качестве источника энергии, углерода и азота. Известно, что для человека биопленки могут являться средством инфицирования при употреблении загрязненной планктоном воды или необработанных морепродуктов [12].
В настоящее время метод MALDI-ToF масс-спектрометрии активно используется в практике микробиологических лабораторий для видовой идентификации культур микроорганизмов [13-16]. При проведении анализа масс-спектров бактериальных штаммов возможно выявление пиков, характерных не только для вида, но и для определенных штаммов, что позволяет использовать метод масс-спектрометрического анализа для внутривидового типирования [16]. Использование кластерного анализа позволяет разделять штаммы на группы, а композитный индекс корреляции (СС1) — количественно определять степень родства тех или иных штаммов.
Присутствие в масс-спектрах определенных пиков может коррелировать с наличием у микроорганизмов факторов патогенности (адгезинов, токсинов, гемолизинов), быстрое определение наличия которых необходимо для выбора правильной тактики лечения. Разными авторами были получены данные, свидетельствующие о достоверных различиях белкового состава биопленочных и небиопленочных форм микроорганизмов родов Candida, Acinetobacter, Pseudomonas aeruginosa, Staphylococcus pneumoniae, V. parahaemolyticus и других [17-21].
Цель исследования — использование метода MALDI- ToF масс-спектрометрии для идентификации и сравнительного изучения белковых спектров биопленок холерных вибрионов, сформированных на биотических и абиотических субстратах.
Материалы и методы
Штаммы. В работе были исследованы штаммы V. cholerae О1, характеристика которых приведена в табл. 1. Все штаммы были получены из коллекции Музея живых культур с Центром патогенных для человека вибрионов ФКУЗ Ростовский-на-Дону противочумный институт Роспотребнадзора.
Питательные среды. Для культивирования штаммов использовали 1% пептонную воду (рН 7,8); 2% агар Мартена (рН 7,7); 0,3% агар Мартена (рН 7,7).
Субстраты. В качестве биотического субстрата использовали хитиновый экзоскелет речного рака Astacus astacus, в качестве абиотического — пластик. Субстраты нарезали пластинами 5х5 мм, помещали во флаконы с речной водой и автоклавировали при 130°С, 1,5 атм в течение 60 минут.
Культивирование биопленки. Из суточной агаровой культуры штаммов V. cholerae готовили взвесь 109 (микробных клеток/мл) мк.кл./мл. Во флаконы с 50 мл речной воды и субстратами добавляли взвесь вибрионов до конечной концентрации во флаконе 104 мк.кл./мл. Параллельно проводили высев на твердую питательную среду для определения КОЕ/мл. В качестве контроля все исследуемые штаммы засевали во флаконы с 50 мл речной воды без субстратов. Флаконы инкубировали при комнатной температуре (t = 25 - 27°С).
На 7-е сутки культивирования биотические субстраты высевали методом «отпечатков» [22], высев планктонных образцов всех штаммов проводили по 0,1 мл на твердую питательную среду. Посевы инкубировали в течение 24-х часов при 37°С и использовали для проведения масс-спектрометрического анализа. В качестве контроля использовали испытуемые штаммы, хранящиеся на пробирках с 0,3 % агаром Мартена. Для проведения масс- спектрометрии готовили взвесь 109 мк.кл./мл выросших штаммов биопленки и планктона. После этого проводили экстракцию этанолом/муравьиной кислотой. В качестве матрицы использовали а-циано-гидроксикоричную кислоту.
На 14-е сутки культивирования для определения возможности проведения идентификации с помощью масс-спектрометрического анализа без предварительного культивирования отбирали по 0,3 мл из контрольных проб. Из опытных флаконов стерильно отбирали фрагменты хитина и пластика, трижды отмывали физиологическим раствором (рН 7,2) от несвязавшихся клеток, избавлялись от излишков влаги с помощью фильтровальной бумаги и помещали в 0,3 мл дистиллированной воды. Также отбирали по 0,3 мл проб планктонных микроорганизмов. После чего проводили экстракцию этанолом/ муравьиной кислотой. В качестве матрицы использовали а-циано-гидроксикоричную кислоту.
Таблица / Table 1
Характеристика штаммов V. cholerae О1, использованных в работе
Characteristics of strains used in this study
№ | № штамма в коллекции Strain ID (Collection of Research Institute for Plaque Control, Rostov-on-Don, Russia) | Биовар/серовар Biotype / Serotype | Генетическая характеристика Genetic characteristic | Объект, место и год выделения Source and year of isolation |
1 | 17917 | classical Ogawa | ctxА+tcpА+ | р. Дон, г. Ростов-на-Дону, 1999 г. water, riv. Don, Rostov-on-Don, Russia, 1999 |
2 | 18336 | El Tor Ogawa | ctxА+tcpА+ | человек, г. Казань, 2001 г. clinical, Kazan, Russia, 2001 |
3 | Р-19613 | El Tor Inaba | ctxА+tcpА+ | р. Темерник, г. Ростов-на-Дону, 2014 г. water, riv. Temernik, Rostov-on-Don, Russia, 2014 |
4 | Р-20000 | El Tor Ogawa | ctxА-tcpА- | р. Темерник, г. Ростов-на-Дону, 2016 г. water, riv. Temernik, Rostov-on-Don, Russia, 2016 |
MALDI-ToF-масс-спектрометрия. MALDI-ToF масс- спектрометрию проводили с использованием масс- спектрометра «Autoflex speed III Bruker Daltonics» (Германия) с программным обеспечением: FlexControl — программа для управления времяпролетными масс- спектрометрами серии flex компании Bruker; Flex Analysis 3.3 — программа для ручного анализа полученных масс- спектров (визуальное сопоставление, оценка качества масс-спектров, калибровка); Biotyper 3.1 — программа для обработки и анализа масс-спектров, полученных на масс-спектрометрах фирмы Bruker для анализа общего индекса корреляции спектров, кластерного анализа спектров.
Видовую идентификацию проводили с использованием базы белковых спектров компании Bruker. Вероятность соответствия исследуемого спектра к известному таксону определяется показателем Score: высокая достоверность видовой идентификации характеризуется Score > 2,300; высокая достоверность родовой идентификации - Score от 2,299 до 2,0001.
Результаты
В протоколе, рекомендуемом Bruker Daltonics, и МР 4.2.0089-14 по использованию метода MALDI-ToF масс- спектрометрии для индикации и идентификации биологических агентов I - II групп патогенности необходимо предварительное выделение чистой культуры микроорганизмов, что требует дополнительных затрат времени. В связи с чем на первом этапе работы была оценена возможность идентификации штаммов холерных вибрионов путем проведения масс-спектрометрического анализа непосредственно биопленки, сформированной на биотическом и абиотическом субстратах, а также планктонных форм без предварительного посева на питательные среды. В работу были взяты по четыре разных варианта каждого штамма вибрионов — биопленка, сформированная на хитине, биопленка на пластике, планктон из флакона с хитином и планктон из флакона с пластиком. Каждое исследование проводили в пяти повторностях. MALDI-ToF масс-спектрометрический анализ этих образцов показал невозможность идентификации штаммов из планктонных проб и с пластинок хитина и пластика. Показатели Score составили менее 2,000.
Для оценки степени изменений, возникающих у холерных вибрионов при формировании биопленок, провели высев из планктонных культур, взятых в работу штаммов V. cholerae и биопленок, сформированных на 7-е сутки культивирования. В результате идентификации культур после первого пассажа из исследуемых проб в автоматическом режиме все они были отнесены к виду V. cholerae c показателями Score выше 2,300.
Был проведен сравнительный анализ масс-спектров различных вариантов культур V. cholerae, полученных в результате высева планктона и биопленок (рис. 1). Все штаммы холерных вибрионов независимо от субстратов, на которых сформировалась биопленка, имели общие пики, отличающиеся по интенсивности.
Из опытных образцов штаммов наибольшим сходством с контрольным (рис. 1Е) обладал масс-спектр штамма биопленки вибрионов на пластинках хитина (рис. 1А). Оба образца имели пики наибольшей интенсивности со значениями m/z 4750 ± 3, 9492 ± 4.
Сходство между масс-спектрами штаммов V. cholerae после посева образцов было изучено путем построения корреляционной матрицы в программе Biotyper 3.1 (Bruker Daltonics) (рис. 2) на основе композитного индекса корреляции (СО). Значения CCI, близкие к 1, свидетельствуют о высокой степени сходства спектров, значения, близкие к 0 — о четких различиях. В матрице цвет ячеек соответствует значению СО (1,0 — коричневый, далее по мере уменьшения оранжевый, желтый, зеленый, синий).
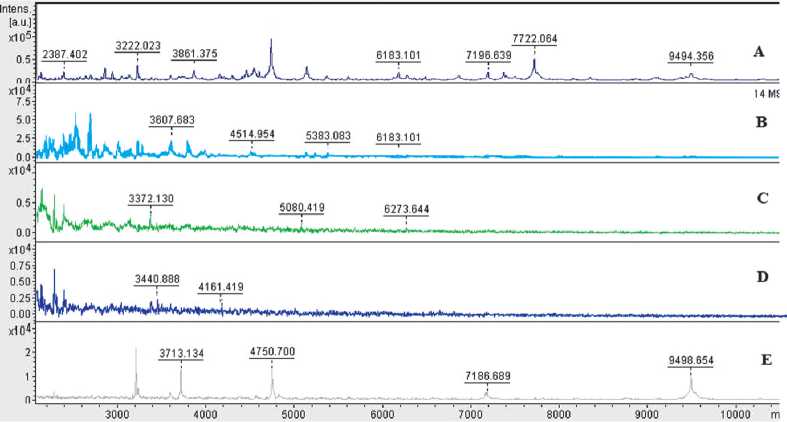
Рисунок 1. Масс-спектры биопленки и планктона штамма V. cholerae Р-19613: А — масс-спектр биопленки на хитине; B — масс-спектр супернатанта; C — масс-спектр биопленки на пластике; D — масс-спектр супернатанта; Е — масс-спектр контрольного штамма.
Figure 1. Mass spectra of “biofi lm” and “plankton” forms of Vibrio cholerae: A — mass spectrum of the “biofi lm” form of the strain on hitin; B — mass spectrum of the “plankton” form; C — mass spectrum of the “biofi lm” form of the strain on plastic; D — mass spectrum of the “plankton” form; E — mass spectrum of the control strain.
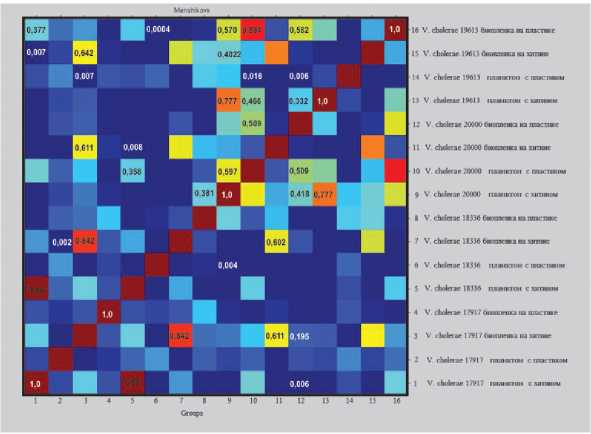
Рисунок 2. Корреляционная матрица биопленочных и планктонных форм штаммов холерных вибрионов.
Figure 2. Composite correlation index matrix of “biofi lm” and “plankton” forms of strains V. cholerae.
Как видно в корреляционной матрице, наибольшим сходством обладают варианты биопленки на хитине (цвет ячеек матрицы красный). Индекс корреляции для этих образцов составил от 0,990 до 0,894. Часть штаммов характеризовалась CCI от 0,776 до 0,402 (цвет ячеек в матрице от оранжевого до светло-зеленого). Большая часть матрицы окрашена в голубой и синий цвета, что свидетельствует о низком индексе корреляции и незначительном сходстве.
С помощью программы Biotyper 3.1 на основе масс- спектрометрических профилей штаммов построена MSP-дендрограмма (рис. 3). При анализе дендрограммы отмечено, что штаммы холерных вибрионов разделились на три кластера. Культуры V. cholerae, сформировавшие биопленку на хитине, относились к одному кластеру. Среди остальных образцов какой-либо закономерности в распределении штаммов по кластерам не отмечено.
Проведенный MALDI-ToF масс-спектрометрический анализ непосредственно субстратов, а также супернатантов без предварительного посева на питательные среды показал невозможность идентификации штаммов V. cholerae из планктонных проб и с пластинок хитина и пластика. Показатели Score составили менее 2,000, что говорит лишь о возможной родовой идентификации. Таким образом, несмотря на имеющиеся в литературе данные о возможности использования метода MALDI-ToF масс-спектрометрии для проведения экспресс-идентификации микроорганизмов в биологических жидкостях (кровь, моча) без предварительного выделения культуры [23,24], использование данного метода для идентификации биопленок V. cholerae не является достоверным и требует высева на питательные среды. В результате идентификации культур холерных вибрионов, полученных через 24 часа после высева биопленок и планктона, все исследуемые пробы были отнесены к виду V. cholerae c показателями Score выше 2,300, что свидетельствует о высокой достоверности определения вида.
Проведенный сравнительный анализ белковых масс- спектров штаммов V. cholerae после посева из различных образцов показал, что все штаммы независимо от субстратов имели общие пики, отличающиеся по интенсивности (рис. 1). Это можно объяснить тем, что метод масс-спектрометрии позволяет проводить анализ преимущественно консервативных рибосомальных белков, специфичных для микроорганизмов, состав которых не зависит от условий существования.
Вместе с тем, культуры V. cholerae, выращенные на разных субстратах, имели различия в источнике питания. Так вибрионы утилизируют хитин, используя его в качестве источника углерода и азота, в результате чего индуцируются хитинолитические ферменты (что несвойственно при культивировании на питательных средах) и это в свою очередь приводит к изменениям метаболизма, синтезу ферментов и выявлению дополнительных белковых пиков (рис. 1А). Об этом же свидетельствует анализ MSP-дендрограммы (рис. 3), согласно которой, штаммы, выращенные на хитине, объединились в один кластер и высокие значения индекса корреляции (CCI) для масс- спектров этих штаммов (рис. 2). Композитный индекс корреляции для составил от 0,99 до 0,894, что свидетельствуют о высокой степени сходства спектров.
Штаммы холерных вибрионов, которые сформировали биопленку на пластике, а также планктонная форма с пластиком, имели недостаток питательных веществ, что также приводило к изменениям белкового состава за счет процесса автолиза клеток. Эти штаммы характеризовались низким индексом корреляции и в MSP- дендрограмме (рис. 3) были распределены по разным кластерам.
Заключение
Изменения масс-спектров штаммов V. cholerae в процессе перехода в биопленочную форму влияют на достоверность идентификации холерных вибрионов методом MALDI-ToF масс-спектрометрического анализа. Также необходимо учитывать тот факт, что при внесении спектров в базы данных используются суточные культуры, выращенные на питательных средах, и более длительное культивирование в составе биопленок может приводить к изменениям белкового спектра. Для проведения масс- спектрометрического анализа с целью идентификации культур вибрионов, находящихся в составе биопленок, необходим предварительный бактериологический высев исследуемого материала на стандартизованные питательные среды. В результате сравнительного анализа белковых масс-спектров по величине масса / заряд и относительной интенсивности пиков не было выявлено белков, характерных только для планктонных культур или биопленок холерных вибрионов. Таким образом, показана стабильность фенотипических свойств холерного вибриона независимо от формы его существования и высокая достоверность масс-спектрометрии для идентификации V. cholerae при соблюдении протокола исследований (высеве на питательные среды), независимо от формы существования в объектах окружающей среды.
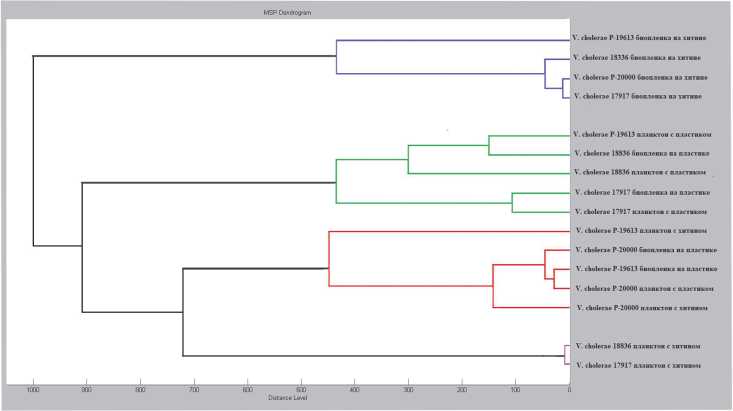
Рисунок 3. MSP дендрограмма биопленочных и планктонных форм штаммов V. Cholerae.
Figure 3. MSP dendrogram of “biofi lm” and “plankton” strains of V. cholerae.
Финансирование. Исследование не имело спонсорской поддержки.
Finansing. The study did not have sponsorship.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interest. Authors declares no conflict of interest.
1. МР 4.2.0089-14 Использование метода времяпролетной масс-спектрометрии с матрично-активированной лазерной десорбцией/ионизацией (MALDI-ToF MS) для индикации и идентификации возбудителей I-II групп патогенности: Методические рекомендации. – М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2015. – 19 с.
Список литературы
1. Ahmed A.H., El Bayomi R.M., Hussein M.A., Khedr M.H.E., Remela A.E.M., El-Ashram A.M.M. Molecular characterization, antibiotic resistance pattern and biofi lm formation of Vibrio parahaemolyticus and V. cholerae isolated from crustaceans and humans // International Journal of Food Microbiology. – 2018. – V.274. – P.31-37. https://doi.org/10.1016/j.ijfoodmicro.2018.03.013
2. Song X., Ma Y., Fu J., Zhao A., Guo Z., et al. Effect of temperature on pathogenic and non-pathogenic Vibrio parahaemolyticus biofilmformation // Food Control. – 2017. – V.7. P.485-491. https://doi.org/10.1016/j.foodcont.2016.08.041
3. Brooun A., Liu S., Lewis K. A dose-response study of antibiotic resistance in Pseudomonas aeruginosa biofilms // Antimicrobial Agents and Chemotherapy. – 2000. – V. 44(3). – P. 640-646. https://doi.org/10.1128/aac.44.3.640-646.2000
4. Ashrafudoulla M., Furkanur M., Mizan R., Park H., Byun K.-H., et al. Genetic Relationship, Virulence Factors, Drug Resistance Profi le and Biofi lm Formation Ability of Vibrio parahaemolyticus Isolated From Mussel // Front Microbiol. – 2019. – V. 10. https://doi.org/10.3389/fmicb.2019.00513
5. Matz C., McDougald D., Moreno A.M., Yung P.Y., Yildiz F.H., Kjelleberg S. Biofi lm formation and phenotypic variation enhance predation-driven persistence of Vibrio choleraе // Proc Natl Acad Sci USA. – 2005. – V.102(46). – P.16819-16824. https://doi.org/10.1073/pnas.0505350102
6. Tamayo R., Patimall Bh., Camilli A. Growth in a Biofi lm Induces a Hyperinfectious Phenotype in Vibrio cholerae // Infect Immun. – 2010. – V.78(8). – P.3560-3569. https://doi.org/10.1128/iai.00048-10
7. Nalin D.R., Daya V., Reid A., Levine M.M., Cisneros L. Adsorption and growth of on chitin. // Infect Immun. – 1979. – V.25. – P.768-770. https://doi.org/10.1128/iai.25.2.768-770.1979
8. Zhu J., Mekalanos J.J. Quorum sensing-dependent biofilms enhance colonization in Vibrio cholerae // Dev Cell. – 2003. – V.5. – P.647-656. https://doi.org/10.1016/s1534-5807(03)00295-8
9. Нirai H., Takada H., Ogata Y., Yamashita R., Mizukawa K., etal. Organic micropollutants in marine plastics debris from the open ocean and remote and urban beaches // Mar Pollut Bull. – 2011. – V.62(8). – P.1683-1692. https://doi.org/10.1016/j.marpolbul.2011.06.004
10. Zettler E.R., Mincer T.J., Amaral-Zettler L.A. Life in the «Plastisphere»: Microbial Communities on Plastic Marine Debris // Environ Sci Technol. – 2013. V.47(13). – P.7137-7146. https://doi.org/10.1021/es401288x
11. Осовская И.И., Будилина Д.Л., Тарабукина Е.Б., Нудьга Л.А. Хитин-глюкановые комплексы. Физико-химические свойства и молекулярные характеристики. Под. ред. Полторацкого Г.М. – СПб.: ГОУВПО СПбГТУРП; 2010.
12. Куликалова Е.С., Урбанович Л.Я., Саппо С.Г., Миронова Л.В., Марков Е.Ю. и др. Биопленка холерного вибриона: получение, характеристика и роль в резервации возбудителя в водной окружающей среде // Журн. микробиол. – 2015, №1. – С.3-11. eLIBRARY ID: 25592654.
13. Kull S., Pauly D., Stormann B., Kirchner S., Stommler M., etmunoaffi nity Enrichment and Matrix-Assisted Laser Desorption/ Ionization Mass Spectrometry // Anal Chem. – 2010. – V.82(7). – P.2910-2924. https://doi.org/10.1021/ac902909r
14. Gagnaire J., Dauwalder O., Boisset S., Khau D., Freydière A.- M., et al. Detection of Delta-Toxin Production by Whole-Cell MALDI-TOF Mass Spectrometry // PLoS One. – 2012. 7(7). https://doi.org/10.1371/journal.pone.0040660
15. Fagerquist K.C., Zaragozа J.W., Bacteriophage cell lysis of Shiga toxin-producing Escherichia coli for top-down proteomic identifi cation of Shiga toxins 1 & 2 using matrix-assisted laser desorption/ionization tandem time-of-fl ight mass spectrometry // Rapid Commun Mass Spectrom. – 2016. – V.30(6). – P.671-680. https://doi.org/10.1002/rcm.7507
16. Бочарова Ю.А., Чеботарь И.В., Маянский Н.А. Возможности, проблемы и перспективы масс-спектрометрических технологий в медицинской микробиологии (обзор литературы)// Клин лаб диагностика. – 2016. – Т. 61, №4. – С.249-256. https://doi10.18821/0869-2084-2016-61-4-249-256
17. Kuhns M., Zautner A.E., Rabsch W., Zimmermann O., Weig M., Bader O, Groß U. Rapid discrimination of Salmonella enterica serovar Typhi from other serovars by MALDI-TOF mass spectrometry // PLoS One. – 2012. – V.7(6). https://doi.org/10.1371/journal.pone.0040004
18. Allegrucci M., Hu F.Z., Shen K., Hayes J., Ehrlich G.D., Post J.C., Sauer K. Phenotypic characterization of Streptococcus pneumoniae biofi lm development // J Bacteriol. – 2006. – V.188(7). – P.2325-2335. https://doi.org/10.1128/jb.188.7.2325-2335.2006
19. Shin J.H., Lee H.W., Kim S.M., Kim J. Proteomic analysis of Acinetobacter baumannii in biofi lm and planktonic growth mode // J Microbiol. – 2010. – V.47(6). – P.728-735. http://doi.org/10.1007/s12275-009-0158-y
20. Park A.J., Murphy K., Krieger J.R., Brewer D., Taylor P., Habash M., Khursigara C.M. A temporal examination of the planktonic and biofi lm proteome of whole cell Pseudomonas aeruginosa PA O1 using quantitative mass spectrometry // Mol Cell Proteomics. – 2014. – V.13(4). – P.1095-105. https://doi.org/10.1074/mcp.m113.033985
21. Thomas D.P., Bachmann S.P., Lopez-Ribot J.L. Proteomics for the analysis of the Candida albicans biofi lm lifestyle // Proteomics. 2006. Vol. 6(21). PP. 5795-5804. https://doi.org/10.1002/pmic.200600332
22. Титова С.В., Веркина Л.М. Моделирование биопленок холерного вибриона на твердых поверхностях (стекло и пластик) и визуализация их в световом и люминисцентном микроскопах // Клиническая и лабораторная диагностика. – 2016. – Т.61,№4. – C.238-241. https://doi.org/10.18821/0869-2084-2016-61-2-238-241
23. Попов Д.А., Овсеенко С.Т., Вострикова Т.Ю. Экспрессидентификация положительных гемокультур с помощью метода прямой MALDI-TOF-масс-спектрометрии // Анестезиология и реаниматология. – 2015. – Т.60,№5. – С.71- 75. eLIBRARY ID: 24379920
24. Ferreira L., Sanchez-Juanes F., Gonzalez-Avila M., Cembrero-Fucinos D., et al. Direct identifi cation of urinary tract pathogens from urine samples by matrix-assisted laser desorption ionization-time of flight mass spectrometry // J Clin Microbiol. – 2010. – V.48(6). – P.2110-2115. https://doi.org/10.1128/jcm.02215-09
Об авторах
М. В. ПолееваРоссия
Полеева Марина Владимировна, научный сотрудник
Ростов-на-Дону
О. С. Чемисова
Россия
Чемисова Ольга Сергеевна, к.б.н., врио зав. лабораторией
Ростов-на-Дону
Е. А. Меньшикова
Россия
Меньшикова Елена Аркадьевна, к.б.н., старший научный сотрудник
Ростов-на-Дону
М. М. Сагакянц
Россия
Сагакянц Маргарита Мардиросовна, научный сотрудник
Ростов-на-Дону
Е. М. Курбатова
Россия
Курбатова Екатерина Михайловна, научный сотрудник
Ростов-на-Дону
Рецензия
Для цитирования:
Полеева М.В., Чемисова О.С., Меньшикова Е.А., Сагакянц М.М., Курбатова Е.М. Изучение биопленок штаммов V. cholerae на поверхностях биотических и абиотических субстратов с помощью MALDI-ToF масс-спектрометрии. Медицинский вестник Юга России. 2020;11(2):94-101. https://doi.org/10.21886/2219-8075-2020-11-2-94-101
For citation:
Poleeva M.V., Chemisova O.S., Menshikova E.A., Sagakyants M.M., Kurbatova E.M. Study of biofilms by V. cholerae strains on the surfaces of biotic and abiotic substrates using mass spectrometry. Medical Herald of the South of Russia. 2020;11(2):94-101. (In Russ.) https://doi.org/10.21886/2219-8075-2020-11-2-94-101







































