Перейти к:
Паранеопластические нейромышечные синдромы на амбулаторно-поликлиническом уровне.
https://doi.org/10.21886/2219-8075-2019-10-3-72-82
Аннотация
Цель исследования: разработать тактику дифференциальной диагностики паранеопластических нейромышечных синдромов у пациентов на амбулаторно-поликлиническом уровне.
Материалы и методы: выборочным методом в исследование включены 25 пациентов с классическими нейромышечными паранеопластическими синдромами (опытная группа) и 25 пациентов с нейромышечными синдромами непаранеопластической природы (контрольная группа). Всем пациентам проведено комплексное лабораторно-инструментальное обследование в государственном автономном учреждении Ростовской области «Областной консультативно-диагностический центр» Минздрава Ростовской области с 2014 по 2018 гг.
Результаты: Выполнена оценка клинических различий у пациентов опытной и контрольной групп. При сравнении лабораторных показателей выявлено, что уровни РФМК, D-димер, CRP-2 значимо повышаются у пациентов с паранеопластическими поражениями (p<0,05). В опытной группе отмечено значимое увеличение амплитуды М-ответа от сенсорных нервов (>5,25 мВ). На основании анализа полученных данных разработаны алгоритмы дифференциальной диагностики для пациентов с изучаемыми нейромышечными поражениями на амбулаторно-поликлиническом уровне.
Выводы: проведенное исследование позволяет внедрить алгоритмы несерологической диагностики классических нейромышечных паранеопластических синдромов в амбулаторной практике.
Ключевые слова
Для цитирования:
Чертоусова А.Е., Черникова И.В. Паранеопластические нейромышечные синдромы на амбулаторно-поликлиническом уровне. Медицинский вестник Юга России. 2019;10(3):72-82. https://doi.org/10.21886/2219-8075-2019-10-3-72-82
For citation:
Chertousova A.E., Chernikova I.V. Paraneoplastic neuromuscular syndromes at the outpatient level. Medical Herald of the South of Russia. 2019;10(3):72-82. (In Russ.) https://doi.org/10.21886/2219-8075-2019-10-3-72-82
Введение
При развитии онкологического процесса в организме пациента происходит ряд структурных и биохимических изменений, называемых обобщенным термином «паранеопластический синдром». Паранеопластические синдромы являются системными проявлениями злокачественных новообразований, не связанными с прямым действием опухоли или ее метастазов, инфекцией, коагулопатией, а также побочными эффектами лекарственной терапии [1][2]. Наряду с опухолевым процессом паранеопластические поражения значительно ухудшают клинический статус больных, а значимость их изучения значительно возросла с момента открытия иммунологических механизмов как основной причины их формирования (F.Graus et al., 1997).
Паранеопластические неврологическе синдромы (ПНС) характеризуются большой вариабельностью и идентичностью некоторых из них с самостоятельными неврологическими нарушениями. Дебют ПНС в 80 % случаев предшествует развитию опухолей, а оценка подобных изменений в динамике может свидетельствовать о естественном течении и рецидиве онкологического процесса [3].
С другой стороны, при развитии ПНС необходимо проведение специфического лечения, так как контроль опухолевого заболевания не гарантирует обратного развития изменений в нервной системе. При этом неврологическая симптоматика может быть доминирующей в клиническом статусе больного [4].
Все эти факторы и обусловили актуальность изучения паранеопластических неврологических синдромов как самостоятельной клининической проблемы, представляющей интерес не только для неврологов, участвующих в первичной диагностике данной категории пациентов, но и для других клиницистов, осуществляющих комплексное лечение онкологических больных.
Несмотря на опубликованные работы по данной проблеме, исследований, касающихся дифференциальной диагностики пациентов с паранеопластическими неврологическими синдромами на амбулаторно-поликлиническом уровне, практически нет, что делает актуальным изучение этого вопроса с определением клинико-диагностических алгоритмов и их этапности.
Целью исследования — разработка тактики дифференциальной диагностики паранеопластических нейро- мышечных синдромов у пациентов на амбулаторно-поликлиническом уровне.
Материалы и методы
В исследование выборочным методом включены 100 пациентов с нейромышечными синдромами, разделенные на опытную (n = 50) и контрольную (n = 50) группы. Всем больным проводилось комплексное обследование в Государственном автономном учреждении Ростовской области «Областной консультативно-диагностический центр» Минздрава Ростовской области с 2014 по 2018 гг.
Клинический диагноз нейромышечного поражения устанавливался по клинико-анамнестическим данным при первичном осмотре неврологом. Затем пациентам проводилось лабораторно-инструментальное исследование, включающее общий анализ крови, общий анализ мочи, биохимический анализ крови, коагулограмма, иммунограмма, электрофорез белков сыворотки крови, определение онкомаркеров в сыворотке крови, электронейромиография, ультразвуковые исследования, мангитно-резонансная томография, спиральная компьютерная томография.
Опытную группу составили 24 мужчины и 26 женщин с нейромышечными поражениями паранеопластической природы в возрасте от 48 до 75 лет (средний возраст — 63,8 лет). Нейромышечные синдромы выявлены на основании клинико-анамнестических данных, дополненных электронейромиографией (ЭНМГ). Опухоли диагностированы посредством инструментальных методов исследования и верифицированы методом предоперационной биопсии или гистологического (иммуногистохимического) исследования операционного материла в условиях лаборатории патоморфологии ГАУ РО ОКДЦ или специализированных онкологических учреждений.
По гистологической структуре опухоли распределились следующим образом: карциномы кишечника — 20 случаев, карциномы почек — 6 наблюдений, карциномы легких — 4 пациента, карциномы простаты — 4 случая, карциномы яичников, молочной железы, желудка, кожи и холангиокарцинома — по два случая, четверо пациентов с хроническим лимфолейкозом и два — с POEMS.
Учитывая низкую доступность проведения анализа на онконевральные антитела, при установлении диагноза паранеопластического нейромышечного поражения мы пользовались одним из абсолютных диагностических критериев, включающем наличие классического паранеопластического неврологического синдрома и выявленной злокачественной опухоли в течение 5 лет до или после развития неврологической симптоматики.
Распределение по типу паранеопластического синдрома: 28 пациентов с хронической сенсорной полинейропатией, 12 пациентов с синдромом Ламберта-Итона и 10 — с дерматомиозитом (рис. 1).
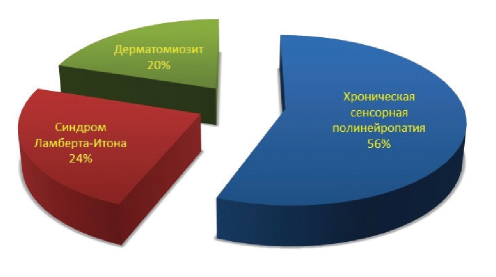
Рисунок 1. Распределение пациентов по типам паранеопластических нейромышечных синдромов (опытная группа).
Figure 1. The distribution of patients according to the types of paraneoplastic neuromuscular syndromes (experimental group).
Для сравнения с опытной группой выборочным методом сформирована когорта пациентов с аналогичной структурой нейромышечных синдромов, возникших на фоне неонкологической патологии, выявленной согласно соответствующим диагностическим критериям. Контрольная группа состоит из 18 мужчин и 32 женщин с нейромышечными синдромами непаранеопластической природы в возрасте от 35 до 82 лет (средний возраст — 56,3 лет).
Распределение пациентов по непаранеопластическими нейромышечными синдромам в контрольной группе (n = 50): 28 пациентов с хронической сенсорной полинейропатией диабетического или дисметаболического генеза, 12 пациентов с различными формами миастении гравис и 10 пациентов с идиопатическим дерматомиозитом (рис. 2).

Рисунок 2. Распределение пациентов по типам непаранеопластических нейромышечных синдромов (контрольная группа).
Figure 2. The distribution of patients according to the types of paraneoplastic neuromuscular syndromes (control group).
Статистическая обработка данных производилась методами описательной статистики и корреляционного анализа с использованием программного пакета STATISTICA 8. Оценка нормальности распределения производилась с использованием критерия Колмогорова-Смирнова, корреляция оценивалась посредством коэффициента линейной корреляции Пирсона, а достоверность различий — с помощью t-критерия Стьюдента с учетом количества наблюдений и параметрического характера данных.
Результаты
В группе в пациентов с паранеопластическими полинейропатиями первыми дебютировали грубые расстройства поверхностной и глубокой чувствительности, выраженные нейропатические боли (более 70 % пациентов) и нарушения равновесия. В группе с диабетическими полинейропатиями также доминировали нарушения чувствительности, тогда как нейропатические боли, превышавшие 6 баллов по ВАШ, отмечались лишь в 4 случаях (табл. 1).
Таблица / Table 1
Клиническая характеристика пациентов с полинейропатией
Clinical characteristics of patients with polyneuropathy
Симптом / Symptom | Опытная группа / Experimental group n=28 | Контрольная группа / Control group n=28 |
|---|---|---|
Нарушение поверхностной чувствительности / Surface sensitivity disorders | 28 | 24 |
Нарушение глубокой чувствительности / Deep sensitivity disorders | 16 | 20 |
Нарушение равновесия / Imbalance | 18 | 2 |
Гипорефлексия / Hyporeflexia | 14 | 12 |
Атрофии мышц / Muscle atrophy | 10 | 2 |
Нейропатическая боль (>6 баллов по ВАШ) / Neuropathic pain (> 6 scores by VAS) | 20 | 4 |
В группах пациентов с паранеопластическим миастеническим синдромом и миастенией гравис в равной степени отмечались выраженные окулобульбарные нарушения и проксимальная мышечная слабость. У пациентов с миастеническим синдромом нарушений дыхания не отмечено, тогда как в группе сравнения выявлена высокая встречаемость дыхательных расстройств. Вегетативные нарушения возникали исключительно у пациентов опытной группы (таблица 2).
Таблица / Table 2
Клиническая характеристика пациентов с миастеническим синдромом
Clinical characteristics of patients with myasthenic syndrome
Симптом / Symptom | Опытная группа / Experimental group n=12 | Контрольная группа / Control group n=12 |
|---|---|---|
Птоз / Ptosis | 12 | 8 |
Диплопия / Diplopia | 8 | 8 |
Бульбарный синдром / Bulbar syndrome | 8 | 12 |
Гипорефлексия / Hyporeflexia | 6 | 2 |
Слабость проксимальных мышц / Proximal muscle weakness | 6 | 8 |
Вегетативные проявления / Vegetative manifestations | 8 | 0 |
Дыхательные нарушения / Respiratory disorders | 0 | 8 |
В группах пациентов с дерматомиозитами паране- опластической и непаранеопластической природы не было значимых различий по интенсивности болевого синдрома, слабости проксимальных мышц и гипорефлексии. Однако у пациентов с паранеопластическим поражением превалировали бульбарные нарушения (6 из 10), среди больных с идиопатическими дерматомиозитами зафиксировано только два подобных случая. В группе сравнения в 4 случаях из 10 отмечен субфебрилитет и нарушения чувствительности (таб. 3).
Таблица / Table 3
Клиническая характеристика пациентов с дерматомиозитом
Clinical characteristics of patients with dermatomyositis
Симптом/ Symptom | Опытная группа / Experimental group n=10 | Контрольная группа / Control group n=10 |
|---|---|---|
Боли в мышцах > 6 баллов по ВАШ / Muscle pain (> 6 scores by VAS) | 6 | 6 |
Слабость проксимальных мышц / Proximal muscle weakness | 10 | 10 |
Гипорефлексия / Hyporeflexia | 4 | 4 |
Нарушение поверхностной чувствительности / Surface sensitivity disorders | 0 | 4 |
Бульбарные расстройства / Bulbar syndrome | 6 | 2 |
Субфебрилитет / Subfebrile condition | 0 | 4 |
Кожная сыпь / Skin rash | 6 | 8 |
Дыхательные нарушения / Respiratory disorders | 4 | 6 |
По итогам обследования пациентов опытной группы выявлен ряд показателей, превышающих референсные значения в абсолютном большинстве случаев: СОЭ, уровень высокочувствительного белка острой фазы CRP-2, РФМК и D-димера в сыворотке крови. При этом ни у кого из больных не выявлено тромбозов, признаков синдрома диссеминированного внутрисосудистого свертывания и септического воспалительного процесса.
Основываясь на полученных данных, выполнен статистический анализ соответствующих показателей в опытной и контрольной группах, в ходе которого проведена оценка «нормальности» распределения всех исследуемых параметров. Для этого использован критерий Колмогорова-Смирнова, значение которого во всех случай составило менее 0,895 (табл. 4).
Таблица / Table 4
Оценка «нормальности» распределения параметров в опытной и контрольной группах (p< 0,05)
Evaluation of the “normality” of the distribution of parameters in the experimental and control groups (p <0.05)
Статистические значения / Statistical values | Опытная группа / Experimental group | Контрольная группа / Control group | ||||||
|---|---|---|---|---|---|---|---|---|
D-димер, нг/мл D-dimer, ng/ ml | РФМК, мг/100 мл SFMC, mg/100 ml | CRP-2, мг/л CRP-2, mg/ | СОЭ, мм/час ESR, mm/h | D-димер, нг/мл D-dimer, ng/ml | РФМК, мг/100 мл SFMC, mg/100 ml | CRP-2, мг/л CRP-2, mg/l | СОЭ, мм/ час ESR, mm/h | |
K-S критерий / K-S criterion | 0,28 | 0,20 | 0,24 | 0,14 | 0,18 | 0,29 | 0,28 | 0,12 |
Средние значения | 1406,32+ | 6,93+ | 7,08+ | 25,24+ | 493,52+ | 4,77+ | 3,84+ | 18,88+ |
(со стандартным отклонением)/ Mean values (with standard deviation) | 1517,24 | 3,70 | 6,78 | 12,70 | 299,23 | 3,82 | 4,29 | 8,44 |
Средние значения | 1406,32+ | 6,93+ | 7,08+ | 25,24+ | 493,52+ | 4,77+ | 3,84+ | 18,88+ |
(со стандартной ошибкой средней) / Mean values (with standard error of mean) | 303,45 | 0,74 | 1,36 | 2,54 | 59,85 | 0,76 | 0,86 | 1,69 |
Результат обработки данных дал основание для гипотезы об однородности выборок, несмотря на синдромологические различия составляющего их материала (сенсорная полинейропатия, дерматомиозит и миастенический синдром).
Во всех случаях в опытной группе опухоли выявлены после развития неврологической симптоматики, при этом длительность временного промежутка составила от 1 до 60 месяцев, в среднем —13,35 месяцев. Среднее время между изменениями в лабораторных тестах и выявлением опухоли составило 35,5 месяцев.
В опытной группе выполнена оценка корреляции между распределением лабораторных данных, для чего был использован коэффициент линейной корреляции Пирсона. Выявлена лишь слабая прямая корреляция между уровнем CRP-2 и СОЭ с коэффициентом r = 0,22 (рис. 3).
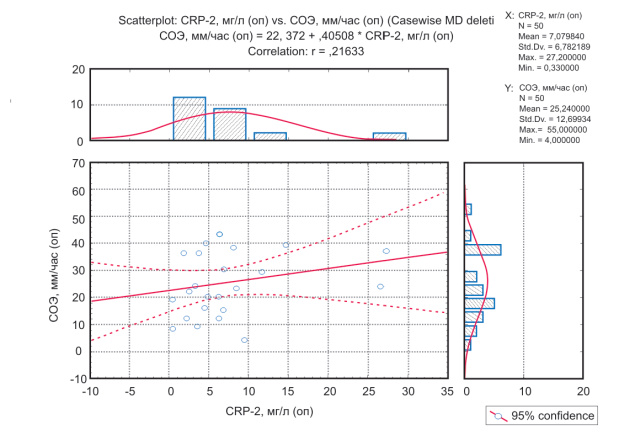
Рисунок 3. График оценки корреляции между значениями CRP-2 и СОЭ в опытной группе.
Figure 3. Graph of the estimate of the correlation between CRP-2 and ESR values (experimental group).
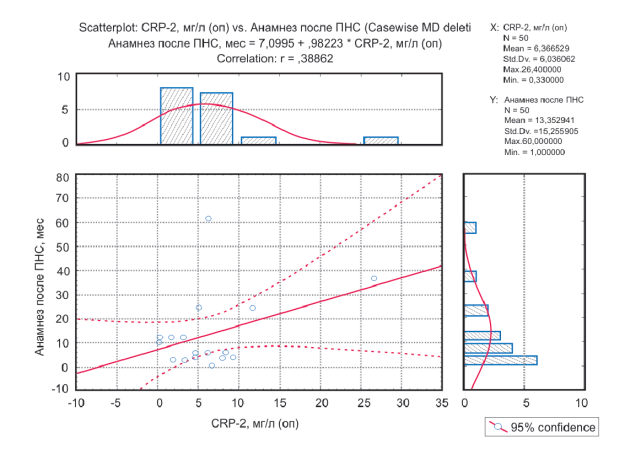
Рисунок 4. График оценки корреляции между значениями CRP-2 и временным промежутком между развитием паранеопластического синдрома и выявлением опухоли.
Figure 4. Graph of the assessment of the correlation between the values of CRP-2 and the time interval between the paraneoplastic syndrome development and the detection of a tumor.
Выявлена слабая отрицательная связь между уровнем D-димера и длительностью временного промежутка между появлением неврологической симптоматики и выявлением опухоли. Иными словами, чем длительнее анамнез, тем ниже уровень D-димера в сыворотке крови (рис. 5).
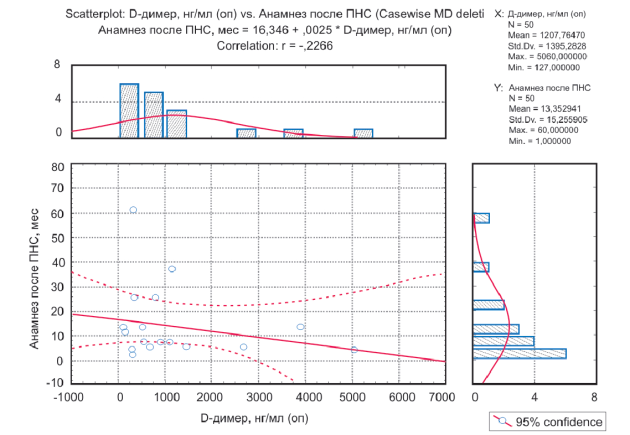
Рисунок 5. График оценки корреляции между значениями D-димера и временным промежутком между развитием паранеопластического синдрома и выявлением опухоли.
Figure 5. Graph of the assessment of the correlation between the values of D-dimer and the time interval between the paraneoplastic syndrome development and the detection of a tumor.
Аналогическая оценка корреляции между распределением параметров выполнена в группе пациентов с непаранеопластическими нейромышечными поражениями. Подобно опытной группе, выявлена слабая прямая корреляция между уровнем CRP-2 и СОЭ с коэффициентом r = 0,30 (рис. 6).
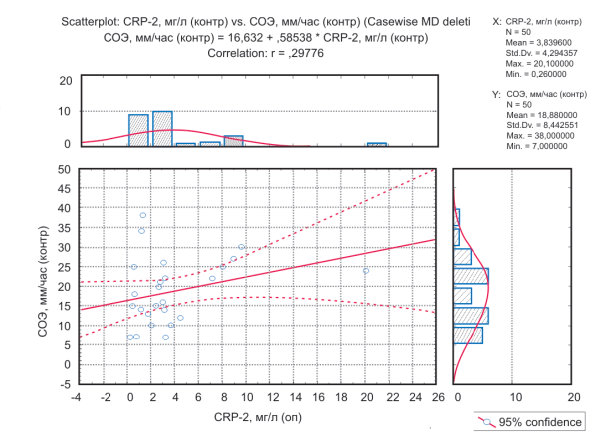
Рисунок 6. График оценки корреляции между значениями CRP-2 и СОЭ в контрольной группе.
Figure 6. Graph of the estimate of the correlation between CRP-2 and ESR values (contral group).
Проведен сравнительный анализ параметров, полученных в двух исследуемых группах, с последующей оценкой статистически значимых различий. Учитывая параметрический характер данных и относительно небольшое количество наблюдений оценка различий выполнялась с использованием t-критерия Стьюдента при уровне достоверности p < 0,05. При этом выявлены значимые различия распределения всех рассматриваемых показателей (табл. 5).
Таблица / Table 5
Уровень достоверности различий параметров в опытной и контрольной группах с использованием t-критерия
ne level of reliability of differences in parameters in the experimental and control groups using t-test
Опытная группа / Experimental group Контрольная группа / Control group | D-димер/ D-dimer | РФМК / SFMC | CRP-2 / CRP-2 | СОЭ / ESR |
|---|---|---|---|---|
D-димер / D-dimer | P=0,005 | - | - | - |
РФМК / SFMC | - | P=0,047 | - | - |
CRP-2 / CRP-2 | - | - | P=0,049 | - |
СОЭ / ESR | - | - | - | P=0,043 |
Для оценки инструментальных данных проведен статистический анализ параметров стимуляционной электронейромиографии у пациентов с сенсорной полинейропатией. В исследуемые показатели включены: время латентности (мс), амплитуда сигнала (мВ), скорость распространения возбуждения (м/с), полученные при стимуляции сенсорных порций срединного и икроножного нервов с двух сторон, а также величина F-ответа (%), полученная от срединных нервов с двух сторон.
При сравнении распределения времени латентности (мс), амплитуды М-ответа (мВ), скорость распространения возбуждения (м/с) и величины F-ответа (%), полученных от правых и левых срединных и икроножных нервов, различий не выявлено как в опытной, так и в контрольной группах. Таким образом, удалось объединить электрофизиологические характеристики от нервов обеих сторон и проводить оценку различий между общими выборками. В результате анализа получены статистически значимые различия только при сравнении распределения амплитуды М-ответа от икроножных нервов (р=0,00047), а также значительное отличие значений средних (табл. 6).
Таблица / Table 6
Сравнение электрофизиологических данных в опытной и контрольной группах с использованием t-критерия
Comparison of electrophysiological data in the experimental and control groups using t-test
Значения / Values Параметры / Parameters | Средние значения в опытной группе/ Average values in the experimental group | Средние значения в контрольной группе/ Average values in the control group | Достоверность различия, / Credibility of differences P | Оценка различий / Evaluation of differences |
|---|---|---|---|---|
Терминальная латентность от срединного нерва, мс / Terminal latency from the median nerve, ms | 2,89 | 2,84 | 0,80 | нет |
Амплитуда М-ответа от срединного нерва, мВ / Amplitude of M-response from the median nerve, mV | 4,41 | 5,23 | 0,48 | нет |
Скорость проведения от срединного нерва, м/с / Rate of excitation along the median nerve, m/s | 45,75 | 47,51 | 0,46 | нет |
F-ответ от срединного нерва, % / F-response from the median nerve, % | 76,68 | 80,39 | 0,44 | нет |
Терминальная латентность от икроножного нерва, мс / Terminal latency from the calf nerve, ms | 2,67 | 2,44 | 0,06 | нет |
Амплитуда М-ответа от икроножного нерва, мВ / Amplitude of M-responsefrom the calf nerve, mV | 3,00 | 7,49 | 0,00047 | есть |
Скорость проведения от икроножного нерва, м/с / Rate of excitation along the calf nerve, m/s | 47,38 | 48,21 | 0,65 | нет |
Какой-либо корреляции между значениями амплитуды М-ответа и длительностью анамнеза полинейропатии перед выявлением онкологического заболевания не выявлено (r = 0,078).
Становится очевидным, что значимой диагностической ролью обладают повышение уровней D-димера, РФМК, белка CRP-2, СОЭ и показатели амплитуды М-ответа сенсорных нервов.
На основании полученных данных мы сформировали алгоритм диагностики пациентов с нейромышечными неврологическими расстройствами на амбулаторно-поликлиническом уровне. Всем пациентам с миастеническим синдромом, дерматомиозитом, а также сенсорной полинейропатией предлагаем определять уровень D-димера, РФМК, CRP-2, СОЭ, а пациентам с сенсорной полинейропатией — также выполнять оценку амплитуды М-ответа чувствительных нервов, по данным электронейромиографии, Значимый уровень для D-димера составляет 1406,32+303,45 нг/мл, для РФМК — 6,93+0,74 мг/100 мл, для CRP-2 — 7,08+1,36 мг/л, для СОЭ — 25,24+2,54 мм/ час, а для амплитуды М-ответа (при сенсорных полинейропатиях) — 5,25+2,54 мВ. При превышении указанных значений неврологическую симптоматику рекомендовано расценивать как паранеопластическую и проводить соматический скрининг. Если опухоль не выявлена, то необходимо повторять онкопоиск через интервалы от 3 до 6 мес. в течение 5 лет. При отсутствии значимого изменения рассматриваемых лабораторных и инструментальных показателей целесообразно расценивать нейромышечный синдром как непаранеопластический и следовать соответствующему диагностическому алгоритму (рис. 7).

Рисунок 7. Алгоритм дифференциальной диагностики паранеопластических и непаранеопластических нейромышечных синдромов.
Figure 7. Algorithm for the differential diagnosis of paraneoplastic and non-paraneoplastic neuromuscular syndromes.
Обсуждение
Выполнена комплексная оценка лабораторно-инструментальных показателей, полученных от пациентов с нейромышечными поражениями паранеопластической и непаранеопластической природы. Включение в исследование пациентов с классическими ПНС позволило избежать дорогостоящих серологических тестов и сформировать диагностические алгоритмы, основанные на рутинных и общедоступных исследованиях.
По данным литературы сенсорная паранеопластическая полинейропатия характеризуется мультифокальными асимметричными поражениями, проявляется псевдоатетозом, постуральной неустойчивостью и арефлексией [5]. Диабетическая нейропатия характеризуется болью, парестезиями и потерей чувствительности. Механизмы, участвующие в развитии болевых ощущений до сих пор плохо изучены, но есть достаточно доказательств того, что причиной являются аномальные разряды в соматосенсорных волокнах [6][7]. Спонтанная активность в периферической ноцицепторной системе может также вызывать изменения в центральной нервной системе, обусловливающую гипералгезию и аллодинию [8][9].
При миастеническом синдроме пациенты обычно отмечают прогрессирующую слабость и утомляемость мышц проксимальных отделов конечностей [10][11]. В дополнение можно отметить, что при паранеопластическом миастеническом синдроме симптомы развиваются значительно быстрее, чем при миастении гравис. Мышечная слабость может нарастать постепенно по мере физической нагрузки. Дисфункция двигательной части краниальных нервов менее характерна для паранеопластического нейромышечного синдрома, чем для миастении гравис. Наиболее частыми симптомами со стороны краниальных нервов являются птоз и диплопия, однако могут встречаться дизартрия и дисфагия [12]. Когда окулобульбарные симптомы выражены, необходимо задуматься о миастении гравис [13].
Медианой интервала между появлением признаков синдрома Ламберта-Итона и выявлением опухоли является 6 месяцев, хотя известны случаи, когда данный период составил 36 лет [10]. С возможностью современной рентгенологической техники мелкоклеточный рак легкого удается выявить в течение года после появления
миастенического синдрома в 96 % случаев [14]. Для паранеопластического миастенического синдрома респираторные нарушения менее характерны, чем для миастении гравис, однако встречаются в 16 % случаев, причем в 6 % наблюдений возникает необходимость проведения аппаратной поддержки, а в 6 % — необходимость пролонгированной вентиляции легких после хирургической операции [10][15][16].
При полимиозите и дерматомиозите мышечная слабость развивается в течение нескольких недель или месяцев, а иногда и быстрее. Поражаются обычно проксимальные группы мышц конечностей, чаще - симметрично.
Cредний временной промежуток между изменениями в лабораторных тестах и выявлением опухоли в нашем исследовании составил 35,5 месяцев, а между дебютом неврологического синдрома и выявлением опухоли — 13,35 месяцев.
Согласно анализу клинических данных, для полинейропатии паранеопластического генеза характерными явились расстройства равновесия и высокая интенсивность нейропатической боли по ВАШ (> 6 баллов). При миастеническом синдроме в большинстве случаев отмечались сопутствующие вегетативные нарушения, тогда как нарушения дыхания, в отличие от пациентов с непаранеопластическими синдромами, не отмечены. У пациентов с паранеопластическим дерматомиозитом превалировали бульбарные нарушения, а в группе больных с идиопатическими дерматомиозитами в 4 случаях из 10 отмечен субфебрилитет и нарушения чувствительности.
Главным лабораторным паттерном явилось достоверно более значимое увеличение показателей D-димера, РФМК, CRP-2 и СОЭ при паранеопластических процессах. По данным стимуляционной ЭНМГ при паранеопластической полинейропатии отмечено значимое повышение амплитуды М-ответа от сенсорных нервов (>5,25 мВ). Преимуществом предлагаемых тестов является их доступность на амбулаторно-поликлиническом уровне, однако исключить онкологический процесс при отсутствии изменений изучаемых показателей не представляется возможным.
Разработаны оптимальные диагностические алгоритмы для пациентов с нейромышечными синдромами в зависимости от исходных клинических и анамнестических данных. Всем пациентам с сенсорной полинейропатией, миастеническим синдромом и дерматомиозитом рекомендовано определение РФМК, D-димера и высокочувствительного белка острой фазы CRP-2. При значимом повышении этих показателей (6,93+0,74 мг/100 мл для РФМК, 1406,32+303,45 нг/мл для D-димера, 7,08+1,36 мг/л для CRP-2), а также при превышении значений амлитуды М-ответа от сенсорных нервов при полинейропатиях (>5,25 мВ) необходимо проведение инструментального онкологического скрининга для выявления опухоли, а при отрицательном результате данных тестов - повторить исследования через 3—6 месяцев.
В литературе опубликован ряд статей о значимом повышении уровня D-димера у пациентов с раком легких, простаты, молочной железы и колоректальным раком [17][18][19][20][21][22][23]. Однако прогностическая ценность уровня данного маркера остается спорной. Некоторые авторы сообщают, что повышение уровня D-димера до лечения онкологической патологии свидетельствует о поздней стадии прогрессии опухоли и ассоциируется с плохим прогнозом. Это особенно актуально для опухолей женской репродуктивной системы [24].
Растворимые фибрин-мономерные комплексы, определяемые в сыворотке крови, представляют собой мономеры фибрина, фибриногена, а также их производные, образующиеся в ранней фазе коагуляции [25][26]. Определение уровня РФМК имеет важное диагностическое значение при синдроме диссеминированного внутрисосудистого свертывания, когда фаза гиперкоагуляции сменяется быстрым фибринолизом [27]. В отличие от D-димера, образующегося при вторичном фибринолизе, РФМК образуются в фазе гиперкоагуляции. Иными словами, РФКМ являются претромботическим маркером [28]. Данных о прогностической значимости уровня РФМК, а также CRP- 2, у пациентов со злокачественными опухолями в литературе мы не встретили.
Выводы
Проведенное исследование позволяет внедрить алгоритмы несерологической диагностики классических нейромышечных паранеопластических синдромов в амбулаторной практике.
Список литературы
1. Darnell R.B., Posner J.B. eds. Paraneoplastic syndromes. New York: Oxford University Press, 2011; 7–17.
2. Yu H, Fu R, Wang H, Liu H & Shao Z Paraneoplastic Evans syndrome in a patient with adenocarcinoma of the lung: A case report. Thoracic cancer. 2017; 8: 57-60. doi: 10.1111/1759-7714.12398
3. Pelosof L.C., Gerber D.E. Paraneoplastic syndromes: an approach to diagnosis and treatment. Mayo Clin Proc. 2010; 85(9): 838-854.
4. doi: 10.4065/mcp.2010.0099.
5. Vedeler CA et al. Management of paraneoplastic neurological syndromes: report of an EFNS Task Force. Eur J Neurol. 2006 Jul;13(7):682-90. doi: 10.1111/j.1468-1331.2006.01266.x
6. Kuntzer T., Antoine J.C., A. Steck J. Clinical features and pathophysiological basis of sensory neuronopathies (ganglionopathies). Muscle Nerve. 2004 Sep; 30(3): 255–268.
7. doi: 10.1002/mus.20100
8. Edwards JL, Vincent AM, Cheng HT, Feldman EL. Diabetic neuropathy: mechanisms to management. Pharmacol Ther 2008; 120: 1– 34. doi: 10.1016/j.pharmthera.2008.05.005
9. Boulton AJ, Vinik AI, Arezzo JC et al. American Diabetes Association Diabetic neuropathies: a statement by the American Diabetes Association. Diabetes Care 2005; 28: 956–962.
10. Yasuda H, Terada M, Maeda K et al. Diabetic neuropathy and nerve regeneration. Prog Neurobiol 2003; 69: 229–285.
11. Duby JJ, Campbell RK, Setter SM, White JR, Rasmussen KA: Diabetic neuropathy: an intensive review. Am J Health Syst Pharm 2004; 61: 160–173. doi: 10.1093/ajhp/61.2.160
12. Wirtz PW, Smallegange TM, Wintzen AR, Verschuuren JJ. Differences in clinical features between the Lambert-Eaton myasthenic syndrome with and without cancer: an analysis of 227 published cases. Clin Neurol Neurosurg. 2002 Sep;104(4):359-63
13. Sanders DB. Lambert-eaton myasthenic syndrome: diagnosis and treatment. Ann N Y Acad Sci. 2003 Sep;998:500-8.
14. Burns TM, Russell JA, LaChance DH, Jones HR. Oculobulbar involvement is typical with Lambert-Eaton myasthenic syndrome.Ann Neurol. 2003 Feb;53(2):270-3. doi: 10.1002/ana.10477
15. Toyka KV, Schneider-Gold C. Oculomotor signs in Lambert-Eaton myasthenic syndrome-coincidence with myasthenia gravis. Ann Neurol. 2003 Jul;54(1):135-6; author reply 136-7. doi: 10.1002/ana.10640
16. Titulaer MJ, Wirtz PW, Willems LN, van Kralingen KW, Smitt PA, Verschuuren JJ. Screening for small-cell lung cancer: a follow-up study of patients with Lambert-Eaton myasthenic syndrome. J Clin Oncol. 2008 Sep 10;26(26):4276-81. doi: 10.1200/JCO.2008.17.5133.
17. Smith AG, Wald J. Acute ventilatory failure in Lambert-Eaton myasthenic syndrome and its response to 3,4-diaminopyridine. Neurology. 1996 Apr;46(4):1143-5.
18. Tseng A, Claussen GC, Oh SJ. Respiratory failure in lambert-eaton myasthenic syndrome precipitated by calcium-channel blockers: report of a case and literature review. J Clin Neuromuscul Dis. 2002 Dec;4(2):60-3.
19. Komurcuoglu B, Ulusoy S, Gayaf M, Guler A, Ozden E. Prognostic value of plasma D-dimer levels in lung carcinoma. Tumori 2011;97:743-748. doi: 10.1700/1018.11091.
20. Wang Y, Wang Z. Predictive value of plasma D-dimer levels in patients with advanced non-small-cell lung cancer. Onco Targets Ther 2015;8:805-808. doi: 10.2147/OTT.S78154
21. Fukumoto K, Taniguchi T, Usami N et al. Preoperative plasma D-dimer level is an independent prognostic factor in patients with completely resected non-small cell lung cancer. Surg Today 2015;45:63-67. doi: 10.1007/s00595-014-0894-4
22. Nakashima J, Tachibana M, Ueno M, Baba S, Tazaki H: Tumor necrosis factor and coagulopathy in patients with prostate cancer. Cancer Res 1995;55:4881-4885.
23. Okajima K, Kohno I, Tsuruta J, Okabe H, Takatsuki K, Binder BR. Direct evidence for systemic fibrinogenolysis in a patient with metastatic prostatic cancer. Thromb Res 1992;66:717-727.
24. Ferroni P, Roselli M, Portarena I et al. Plasma plasminogen activator inhibitor-1 (PAI-1) levels in breast cancer - relationship with clinical outcome. Anticancer Res 2014;34:1153-1161.
25. Stender MT, Larsen TB, Sorensen HT, Thorlacius-Ussing O. Preoperative plasma D-dimer predicts 1-year survival in colorectal cancer patients with absence of venous thromboembolism (VTE): a prospective clinical cohort study. J Thromb Haemost 2012;10:2027-2031. doi: 10.1111/j.1538-7836.2012.04887.x.
26. W. Li, Y. Tang, Y. Song et al. Prognostic Role of Pretreatment Plasma D-Dimer in Patients with Solid Tumors: a Systematic Review and Meta-Analysis. Cell Physiol Biochem 2018;45:1663-1676 doi: 10.1159/000487734.
27. Dempfle CE. The use of soluble fibrin in evaluating the acute and chronic hypercoagulable state. Thromb Haemost. 1999 Aug;82(2):673-83.
28. Koga S. A novel molecular marker for thrombus formation and life prognosis--clinical usefulness of measurement of soluble fibrin monomer-fibrinogen complex (SF). Rinsho Byori. 2004 Apr; 52(4):355-61.
29. Leko M. Soluble fibrin monomer degradation products as a potential useful marker for hypercoagulable states with accelerated fibrinolysis. Clinica Chimica Acta 2007;386:38
30. doi: 10.1016/j.cca.2007.07.023
31. K-J Park, E-H Kwon, H-J Kim, and S-H Kim. Evaluation of the Diagnostic Performance of Fibrin Monomer in Disseminated Intravascular Coagulation. Korean J Lab Med 2011;31:143-147
32. doi: 10.3343/kjlm.2011.31.3.143
Об авторах
А. Е. ЧертоусоваРоссия
Чертоусова Анастасия Евгеньевна - врач-невролог.
Ростов-на-Дону
И. В. Черникова
Россия
Черникова Ирина Владимировна - к.м.н., доцент, заведующая кафедрой неврологии и нейрохирургии с курсами мануальной терапии и рефлексотерапии ФПК и ППС.
Ростов-на-ДонуРецензия
Для цитирования:
Чертоусова А.Е., Черникова И.В. Паранеопластические нейромышечные синдромы на амбулаторно-поликлиническом уровне. Медицинский вестник Юга России. 2019;10(3):72-82. https://doi.org/10.21886/2219-8075-2019-10-3-72-82
For citation:
Chertousova A.E., Chernikova I.V. Paraneoplastic neuromuscular syndromes at the outpatient level. Medical Herald of the South of Russia. 2019;10(3):72-82. (In Russ.) https://doi.org/10.21886/2219-8075-2019-10-3-72-82







































