Перейти к:
Протективная роль рекомбинантного IL-2 в комплексной терапии эндометриоидных кист яичников у пациенток позднего репродуктивного возраста
https://doi.org/10.21886/2219-8075-2019-10-2-29-34
Аннотация
Цель: оценить возможности протективного влияния рекомбинантного IL-2 на овариальный резерв пациенток в позднем репродуктивном возрасте после энуклеации эндометриоидной кисты яичника (ЭКЯ).
Материалы и методы: Исходно и в течении года после лапароскопической цистэктомии ЭКЯ с применением гемостатического материала на основе оксидируемой целлюлозы обследованы 63 пациентки в возрасте 36-45 лет с односторонней ЭКЯ (4-7 см). В перитонеальной жидкости и периферической крови определены уровни цитокинов (IL-6, IL-2, IL-10, TNF), содержание диеновых конъюгатов ненасыщенных жирных кислот, малонового диальдегида, супероксиддисмутазы и уровень молекул средней массы. Сравнительный анализ овариального резерва (число антральных фолликулов (ЧАФ) и уровень ан-тимюллерова гормона (АМГ)) проводился между 32 пациентками, получающими адьювантную терапию диеногестом (6 месяцев) с дополнительным введением рекомбинантного IL-2 и 31 пациенткой, получающими только диеногест.
Результаты: При использовании в раннем послеоперационном периоде рекомбинантного IL-2 статистически достоверно увеличиваются ЧАФ как в интактном, так и в оперированном яичнике и уровень АМГ, который восстанавливается до результатов исходных параметров.
Выводы: Рекомбинантный IL-2 восполняет исходный дефицит регуляторного цитокина, уменьшает проапоптическое влияние на ткань яичников и активирует антиоксидантные системы. При применении в послеоперационном периоде комплексной терапии (IL-2 и диеногест) практически на исходном уровне сохраняется овариальный резерв, что благоприятствует реализации репродуктивных планов и уменьшает вероятность раннего наступления менопаузы.
Для цитирования:
Соколова Е.И., Куценко И.И., Кравцова Е.И., Батмен С.К. Протективная роль рекомбинантного IL-2 в комплексной терапии эндометриоидных кист яичников у пациенток позднего репродуктивного возраста. Медицинский вестник Юга России. 2019;10(2):29-34. https://doi.org/10.21886/2219-8075-2019-10-2-29-34
For citation:
Sokolova E.I., Kutsenko I.I., Kravtsova E.I., Batmen S.K. The protective role of the recombinant IL-2 in complex therapy of cystic ovarian endometriosis in patients of advanced reproductive age. Medical Herald of the South of Russia. 2019;10(2):29-34. (In Russ.) https://doi.org/10.21886/2219-8075-2019-10-2-29-34
Введение
Эндометриоидные кисты (ЭЯК) выявляют у 10-14 % женщин [1], оперированных по поводу объемных образований органов малого таза как в активном, так и позднем репродуктивном возрасте. У возрастного контингента, помимо естественного обеднения овариального запаса, наблюдается дополнительное, связанное с наличием ЭКЯ, прогрессивное уменьшение параметров овариального резерва вплоть до инфертильности. По данным литературы последних лет, у пациенток с ЭКЯ выявлены сопряжение снижения параметров овариального резерва с активацией провоспалительного звена цитокинового каскада на местном и системном уровнях, дефицитарностью регуляторных механизмов, определяемых уровнем IL2 и интенсификацией процессов перекисного окисления в перитонеальной жидкости с развитием явлений окислительного стресса [2][3][4]. Рост эндометриоидной кисты яичника, болевой синдром и бесплодие часто вынуждают прибегнуть к хирургическому удалению ЭКЯ с возникновением неизбежной операционной травмы, которая усугубляет вышеуказанные дисфункции и прогрессивно ухудшает параметры овариального резерва, особенно у пациенток позднего репродуктивного возраста [3][4].
Вышесказанное обусловливает поиск методов хирургического воздействия, уменьшающих операционную травму и препаратов для послеоперационной адьювант- ной терапии, направленной на сохранение овариального резерва у пациенток с ЭКЯ. Учитывая доминирующую роль иммунологических нарушений на системном и местном уровнях с нарушением механизмов регуляции опосредованных IL2, применение данного препарата может обеспечить изменение в цитокиновом балансе и позитивно отразится на состоянии овариального резерва у пациенток позднего репродуктивного возраста с ЭКЯ.
Цель исследования — оценить возможности протективного влияния рекомбинантного IL-2 на овариальный резерв пациенток в позднем репродуктивном возрасте после энуклеации эндометриоидной кисты яичника.
Материалы и методы
Проведено обследование 63 пациенток позднего репродуктивного возраста с односторонними эндометриоидными кистами яичника (ЭКЯ), прооперированных в ГБУЗ «НИИ ККБ№1 им. С.В.Очаповского» и Клинике ФГБОУ ВО КубГМУ.
В группу исследования были включены пациентки в возрасте 36-45лет, с наличием впервые выявленной односторонней эндометриоидной кистой яичника размером 4-7 см, не имеющих других доброкачественных или подозрения на злокачественную опухоль яичника, другой гинекологической и тяжелой эктрагенитальной патологии, подписавшие информированное добровольное согласие на медицинское вмешательство и проводимое исследование. Всем пациенткам проведена лапароскопическая энуклеация ЭКЯ с применением с целью гемостаза материала на основе оксидируемой целлюлозы. Послеоперационный период у всех исследуемых велся стандартно, согласно протоколу: профилактическая антибактериальная терапия (цефазолин 2,0 в/в однократно), обезболивание — нестероидные противовоспалительные препараты (кетонал), ранняя активизация. Приём диеногеста в качестве адъювантной терапии начинали с 5-х суток послеоперационного периода 2 мг ежедневно длительностью 6 месяцев. На основании предыдущих исследований, с целью коррекции иммунологических дисфункций 32 пациенткам (I группа) дополнительно назначено внутривенное капельное введение рекомбинантного IL2 (Ронколейкин) дозе 0,5 мг в 400 мл инъекционного изотонического раствора хлорида натрия интраоперационно и далее двукратно на 3-и и 5-е сутки послеоперационного периода. Пациентки II группы (n=31) велись согласно обычному протоколу. Группу контроля составили 35 условно здоровых женщин, поступивших на хирургическую стерилизацию.
Оценивалось клиническое течение послеоперационного периода. Всем пациенткам в динамике до операции и на протяжении 12 месяцев после с целью оценки течения овариального резерва проводили трансвагинальное ультразвуковое исследование (ТВУЗИ) органов малого таза. С помощью соответствующих тест-систем определяли уровень антимюллерова гормона (АМГ) как биохимического параметра фолликулярного резерва. В перитонеальной жидкости (ПЖ) и периферической крови (ПК) определяли уровни содержания цитокинов (IL6, IL 2, IL10, TNF-α) с использованием панели моноклональных антител (ВЕКТОР-БЕСТ), рассчитывался провоспалительный индекс (ПВИ) периферической крови и перитонеальной жидкости как отношение IL6/IL10. Изучалось содержание диеновых конъюгатов (ДК) ненасыщенных жирных кислот, малонового диальдегида (МДА), супе- роксиддисмутазы (СОД), уровня молекул средней массы (МСМ, Е280,у.е ОП) по соответствующим методикам, с расчетом интегрального показателя окислительной активности соответствующей среды (МДА/СОД, у.е).
Статистическую обработку полученных результатов проводили с использованием компьютерной программы Excel и Statistica 6,0. Достоверность различий параметрических данных оценивали по критерию Стьюдента. Различия между группами считались достоверными при р<0,05.
Результаты
Послеоперационный период у всех обследуемых протекал гладко, выписаны домой на амбулаторное лечение под наблюдение врача женской консультации на 5-6-е сутки, что соответствовало среднему количеству койко- дней у пациенток данного профиля.
Анализ уровней продуктов ПОЛ и АОС ПЖ показал, что при применении рекомбинантного IL2 в первые сутки послеоперационного периода наблюдается статистически значимое (р<0,05), по сравнению с исходными данными, увеличение уровня ДК (5,9±1,1 Ед/мл против 4,1±0,4 Ед/мл в контроле), уровня МДА (8,6±0,5 мкмоль/л против 7,9±1,0 мкмоль/л в контроле), при этом статистически значимого отличия от результатов второй группы выявлено не было. Уровень МСМ, Е280 у.е ОП в статистически значимо не отличался, в сравнении с исходными данными и результатами пациенток второй группы, и составил 0,4±0,2 у.е., р>0,01. При этом отмечена статистически значимая разница в увеличении уровня СОД относительно пациенток второй группы (первая группа — 7,2±0,5 ед/мг; вторая группа — 4,4±0,6 ед/мл, р<0,05), и, как следствие, уменьшение (МДА/СОД, у.е) (1,1±0,5 у.е.) ПЖ в послеоперационном периоде, отразившее менее выраженный окислительный потенциал перитонеальной жидкости, по сравнению с результатами полученными у пациенток второй группы — 1,9±0,2 у.е. против р<0,05. При сравнительном анализе изменений в функционировании системы ПОЛ/АОС ПК статистически значимой разницы не было выявлено. Уровень ДК прогрессивно нарастал в первые сутки послеоперационного периода до 11,3±3,2 мкмоль/л во II группе и до 10,9±3,9 мкмоль/л в I группе, к 5-м суткам снижался до исходных значений 8,9±1,9 мкмоль/л в первой группе и до 9,3±2,5 мкмоль/л во второй, и к концу первого месяца послеоперационного периода у всех пациенток снижался до уровня значений контрольной группы (4,2±0,6 мкмоль/л) и находился в этих пределах уровня группы контроля в течении всего периода наблюдения. Динамика соотношения между МДА/СОД также статистически значимо не отличалась, нарастая к первым суткам послеоперационного периода до 2,3±1,2 у.е. в первой группе и до 2,6±1,2 у.е во второй группе. К 5-м суткам соотношение МДА/СОД статистически значимо более активно снижалось в I группе до 0,6±0,3 у.е (0,9±0,3 у.е — II группа, р<0,05), что практически соответствовало результатам группы контроля (0,4±0,2 у.е) и в дальнейшем сохранялось на этом уровне. Во II группе соотношение между МДА/СОД приблизилось к результатам группы контроля только к 12 месяцу наблюдения (0,5±0,4 у.е.). Динамика МСМ, Е280, у.е. ОП ПК по группам статистически значимо не различалась (р>0,05), прирост наблюдался только в первые сутки послеоперационного периода до 0,33±0,02 в I группе и до 0,32±0,01 во II группе, р>0,05. Далее уровень МСМ снижался до результатов контрольной группы у всех пациенток и оставался таковым до конца периода наблюдения.
Анализ динамики цитокинового баланса показал, что на фоне интраоперационного внутривенного введения рекомбинантного IL-2 в ПЖ отмечалось статистически высоко значимое увеличение уровня этого цитокина, обладающего регуляторной функцией (14,8±2,1 пкг/мл (I группа) против 6,7±1,2 пкг/мл (II группа)), р<0,01. У пациенток I группы отмечалось более выраженное, по сравнению со II группой, значимое увеличение уровня провоспалительного IL6 (56,2±7,4 пкг/мл против 45,7±4,9 пкг/мл), а также двукратное увеличение противовоспалительного IL10 (25,3±3,2 пкг/мл против 12,3±2,1 пкг/ мл), приведшее к снижению ПВИ ПЖ пациенток первой группы до 2,2±0,5 у.е. относительно исходных параметров (2,9±0,8 у.е), что значимо отличалось от показателей II группы (3,8±1,2 у.е), р<0,01. Также у пациенток I группы не было выявлено значимого нарастания уровня TNF-α, который составил 7,5±1,7 пкг/мл, против 7,3±1,5 пкг/мл исходно, что было достоверно ниже, по сравнению с показателем, полученным у пациенток II группы (9,1 ±0,7 пкг/мл), р<0,01.
В периферической крови в первые сутки послеоперационного периода у пациенток I группы наблюдался значимый прирост уровня IL2, связанный с внутривенным ведением препарата (12,1±4,4 пкг/мл против 4,6±1,4 пкг/ мл исходно). При этом отмечена высокозначимая разница с аналогичными показателями у пациенток второй группы (6,9±2,1 пкг/мл), р<0,01. К 5-м суткам послеоперационного периода уровень IL2 несколько снижался, приближаясь к результатам контрольной группы через 1 месяц (3,4±0,8 пкг/мл против 2,8±0,2 пкг/мл). При дальнейшем обследовании уровень IL2 не изменялся, сохраняясь на прежнем уровне до конца периода наблюдения. На фоне повышения уровня регуляторного IL2 отмечено статистически высоко значимое повышение IL6 (112,5±6,9 пкг/мл против 78,5±7,2 пкг/мл исходно), и IL10 (15,3±3,7 пкг/мл против 9,5±2,1 пкг/мл исходно (р<0,01). Эти параметры существенно отличались от аналогичных показателей полученных у пациенток второй группы (IL6 — 99,5±5,9 пкг/мл и IL10 — 10,5±1,3 пкг/мл), р<0,05, и отражались на ПВИ ПК, который у пациенток первой группы достоверно снижался, по сравнению с исходным показателем до 7,4±1,0 у.е., в отличие от достоверно нарастающего ПВИ у пациенток второй группы ( 9,5±1,2 у.е.) (р<0,05).
К 5-м суткам послеоперационного периода отмечено нарастание уровня IL10 до 17,4±3,2 пкг/мл при некотором снижении IL6 до 96,4±6,3 пкг/мл, что сопровождалось дальнейшим снижением ПВИ. По данным исследования, ПВИ у пациенток первой группы приблизился к показателям контроля к 1-му месяцу п/о периода (3,2±1,4 у.е. против 2,9±0,9 у.е. в третьей группе (контроль)) и сохранялся таковым до конца периода наблюдения, в отличии от ПВИ ПК у пациенток во второй группе, который статистически значимо повышался к концу периода наблюдения (6,1±2,1 у.е.), р<0,01.
Отмечено, что уровень TNF-α, у пациенток первой группы в первые сутки статистически значимо снижался в 1-ые сутки послеоперационного периода (3,6±0,9 пкг/ мл против 4,3±0,6 пкг/мл исходно, р<0,05) существенно отличаясь от результатов пациенток второй группы на тот же момент обследования (6,2±1,5 пкг/мл), р<0,05. Такая же тенденция сохранялась на 5-е сутки послеоперационного периода, и концу месячного интервала в первой группе уровень TNF-α, снижаясь, достиг результатов третьей группы (контроль) (1,4±0,6 пкг/мл против 1,1±1,1 пкг/мл в контроле, р>0,05).
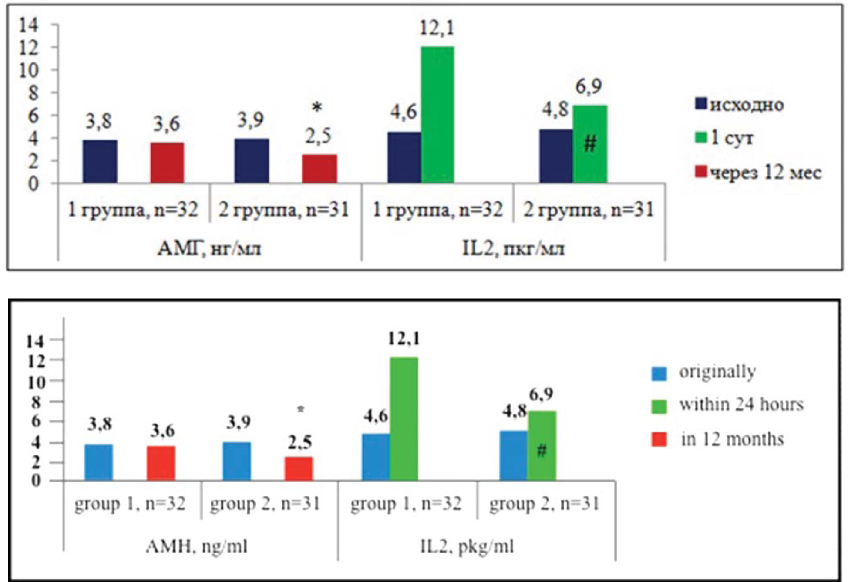
Рисунок 1. Динамика уровня антимюллерова гормона в течение года наблюдения при использовании в послеоперационном периоде рекомбинантного IL2.
Примечание: * — р<0,05 относительно исходных данных, # — р<0,001 относительно аналогичных показателей в первой группе.
Figure 1. The changes in antimullarian hormone level during 1 year follow-up after surgery with the use of recombinant IL.
Note: * — p<0,05, regarding on baseline data, # — p<0,001, regarding on equivalent indicators in 1st group.
В течение 12 месяцев наблюдения после проведения операции с применением гемостатического материала суммарный объем яичниковой ткани несколько уменьшился достоверно, не отличаясь по группам, однако при подсчете антральных фолликулов в оперированном яичнике выявлено пятикратное увеличение их количества в первой группе (3,3±0,9), статистически значимо отличающееся от их количества во 2 группе (1,5±0,4), р<0,05. В интактном яичнике у пациенток первой группы также выявлено достоверно значимое увеличение числа антральных фолликулов, как по сравнению с исходными данными, так и сравнительно с данными, полученными во второй группе (6,5±1,2 против 5,1±1,8 в 1 группе и 3,3±1,2 исходно, р<0,05). Уровень АМГ, у пациенток 1 группы к финалу наблюдения статистически значимо не отличался от исходных параметров (3,6±1,8 нг/мл против 3,8±0,9 нг/мл исходно) (р>0,01) и был статистически значимо выше, чем во второй группе (2,5±0,7 нг/мл), р<0,05.
Обсуждение
Полученные результаты свидетельствуют о протективной роли рекомбинантного IL2 в отношении сохранения овариального резерва у пациенток позднего репродуктивного возраста после удаления ЭКЯ (энуклеация эндометриоидной кисты с применением гемостатического материала). На фоне применения данного препарата отмечены позитивные изменения цитокиновового баланса периферической крови и перитонеальной жидкости, что благоприятно влияло на течение процессов репарации. Вероятно, использование рекомбинантного IL-2 восполняет исходный дефицит регуляторного цитокина и модулирует утраченную физиологическую реакцию организма пациенток с ЭКЯ в позднем репродуктивном возрасте, в том числе и на операционную травму, в виде одномоментного увеличения содержания цитокинов провоспалительного и противовоспалительного каскада (IL-6 и IL-10). Так как избыток IL-6 ингибирует продукцию TNFa, который обладает проапоптическим влиянием на местном и системном уровне, а активация противовоспалительного звена ингибирует цитотоксическую активность макрофагов, итогом этого взаимного влияния является уменьшение токсического и проапоптического влияния на здоровую ткань как оперированного, так и интактного яичника [5][6][7][8].
Рекомбинантный IL-2, усиливает генерацию основных форм кислорода, и его перекисей [9], что проявляется в быстром снижении окислительного потенциала и активации антиоксидантных систем перитонеальной жидкости и периферической крови.
Выводы
В результате вышеуказанных воздействий (уменьшение интраоперационной травмы путем применения гемостатического материала и коррекции исходной иммунологической компрометированности) у пациенток с ЭКЯ в позднем репродуктивном периоде при применении в раннем послеоперационном периоде практически на исходном уровне сохраняется овариальный резерв, что благоприятствует возможности реализации ими репродуктивных планов и уменьшает вероятность раннего наступления менопаузального периода.
Список литературы
1. Качалина Т.С., Зиновьев А.Н., Богатова М.Е. Комплексная оценка факторов риска развития рецидива эндометриоидных кист яичников // Медицинский альманах. -2017. - Т.46 - №1 - С. 107-110.
2. Соколова Е.И., Куценко И.И., Кравцова Е.И., Томина О.В. Влияние различных методов эндохирургического гемостаза на овариальный резерв при энуклеации эндометриоидных кист у пациенток позднего репродуктивного возраста.//Современные проблемы науки и образования. -2018.- №5 - С.1-6. DOI: 10.17513/spno.28182
3. Goodman L.R., Goldberg J.M., Flyckt R.L., Gupta M., Harwalker J., Falcone T. Effect of surgery on ovarian reserve in women with endometriomas, endometriosis and controls. // Am J Obstet Gynecol. - 2016. - V.215(5). - P.589 e1-589.e6. doi: 10.1016/j.ajog.2016.05.029.
4. Бахтияров К.Р., Семерюк Т.А., Чурганова А.А., Сохранение овариального резерва у больных с эндометриозом // Здоровье и образование в XXI веке. - 2018. - №5. - С. 9-14. doi: 10.26787/nydha-2226-7425-2018-20-5-9-14
5. Uncu G., Kasapoglu I., Ozerkan K., Seyhan A., Oral Yilmaztepe A., Ata B. Prospective assessment of the impact of endometriomas and their removal on ovarian reserve and determinants of the rate of decline in ovarian reserve. // Hum Reprod. - 2013. - V.28. - P.2140-2145
6. Chen Y., Pei H., Chang Y., Chen M., Wang H., at al. The impact of endometrioma and laparoscopic cystectomy on ovarian reserve and the exploration of related factors assessed by serum anti-Mullerian hormone: a prospective cohort study. // J Ovarian Res. - 2014. - V.7. - P.108. doi: 10.1186/s13048-014-0108-0
7. Sanchez A.M., Vigano P., Somigliana E., Panina-Bordignon P., Vercellini P., Candiani M. The distinguishing cellular and molecular features of the endometriotic ovarian cyst: from pathophysiology to the potential endometrioma-mediated damage to the ovary. // Hum Reprod Update. - 2014. - V.20. -P.217-230
8. Ding Y., Yuan Y., Ding J., Chen Y., Zhang X., Hua K. Comprehensive assessment of the impact of laparoscopic ovarian cystectomy on ovarian reserve. // J Minim Invasive Gynecol. - 2015. - V.22. - P.1252-1259
9. Егорова В.Н., Бабаченко И.В., Дегтярева М.В., Попович А.М. Интерлейкин-2: опыт клинического применения в педиатрической практике. - СПб.:Издательство «Новая альтернативная полиграфия», 2008.
Об авторах
Е. И. СоколоваРоссия
Екатерина Игоревна Соколова - врач акушер-гинеколог, Клиника, аспирант кафедры Акушерства, гинекологии и перинатологии.
КраснодарКонфликт интересов: Нет конфликта интересов
И. И. Куценко
Россия
Ирина Игоревна Куценко - доктор медицинских наук, профессор, заведующая кафедрой Акушерства, гинекологии и перинатологии.
КраснодарКонфликт интересов: Нет конфликта интересов.
Е. И. Кравцова
Россия
Елена Иосифовна Кравцова - кандидат медицинских наук, доцент кафедры Акушерства, гинекологии и перинатологии.
Краснодар
Конфликт интересов: Нет конфликта интересов
С. К. Батмен
Россия
Саида Казбековна Батмен - кандидат медицинских наук, доцент кафедры Акушерства, гинекологии и перинатологии.
КраснодарКонфликт интересов: Нет конфликта интересов.
Рецензия
Для цитирования:
Соколова Е.И., Куценко И.И., Кравцова Е.И., Батмен С.К. Протективная роль рекомбинантного IL-2 в комплексной терапии эндометриоидных кист яичников у пациенток позднего репродуктивного возраста. Медицинский вестник Юга России. 2019;10(2):29-34. https://doi.org/10.21886/2219-8075-2019-10-2-29-34
For citation:
Sokolova E.I., Kutsenko I.I., Kravtsova E.I., Batmen S.K. The protective role of the recombinant IL-2 in complex therapy of cystic ovarian endometriosis in patients of advanced reproductive age. Medical Herald of the South of Russia. 2019;10(2):29-34. (In Russ.) https://doi.org/10.21886/2219-8075-2019-10-2-29-34







































