Перейти к:
Системный амилоидоз с преимущественным поражением сердца, ассоциированный с множественной миеломой
https://doi.org/10.21886/2219-8075-2025-16-3-75-82
Аннотация
Представлен клинический случай амилоидной кардиомиопатии, ассоциированной с множественной миеломой, с развитием хронической сердечной недостаточности с сохранной фракцией выброса, рефрактерной к терапии. Исследуется роль клинических признаков, в особенности «красных флагов» амилоидоза, а также необходимость повышения осведомленности врачей о симптомах и признаках амилоидной кардиомиопатии, и раннего выявления, и лечения патологии. Обсуждаются актуальные методы диагностики, включая гистологическое исследование и иммунофенотипирование, что позволяет улучшить прогноз пациента.
Для цитирования:
Ахвердиева М.К., Гарина И.А., Живага В.В., Литвинова М.С., Хаишева Л.А. Системный амилоидоз с преимущественным поражением сердца, ассоциированный с множественной миеломой. Медицинский вестник Юга России. 2025;16(3):75-82. https://doi.org/10.21886/2219-8075-2025-16-3-75-82
For citation:
Akhverdieva M.K., Garina I.A., Zhivaga V.V., Litvinova M.S., Khaisheva L.A. Systemic amyloidosis with predominant cardiac involvement associated with multiple myeloma. Medical Herald of the South of Russia. 2025;16(3):75-82. (In Russ.) https://doi.org/10.21886/2219-8075-2025-16-3-75-82
Введение
Амилоидная кардиомиопатия включает гетерогенную группу заболеваний, характеризующихся структурно-функциональными изменениями сердца, которые развиваются вследствие отложения во внеклеточном матриксе миокарда аномального фибриллярного белка амилоида [1][2][3]. Ранее патология считалась редкой, но на данный момент ежегодно регистрируется около двух тысяч новых случаев. Чаще амилоидная кардиомиопатия встречается у лиц старческого возраста. Так, среди пациентов старше 97 лет распространённость амилоидоза достигает 37%, а у 20–25% людей старше 80 лет является находкой при патологоанатомическом исследовании [3][4][5].
Выделяют более 30 видов белков-предшественников амилоида, которые синтезируются при различных патологических состояниях и могут поражать различные органы и системы, такие как почки, надпочечники, желудочно-кишечный тракт, сердце, кожа, опорно-двигательная и нервная система [5]. Считается, что примерно в 5% случаев амилоидоз протекает в виде изолированного поражения сердца [4].
Согласно консенсусу европейского общества кардиологов, 95% амилоидных кардиомиопатий связано всего с двумя типами амилоида: белком, образованным из лёгких цепей иммуноглобулинов (AL-амилоидоз), и белком-транстиретином (ATTR-амилоидоз) [6]. Выделяют две основные формы ATTR-амилоидоза: наследственный системный амилоидоз и старческий. В первом случае наблюдается аутосомно-доминантный тип наследования, заболевание чаще протекает в виде тяжёлой полинейропатии, вегетативной дисфункции и поражения сердца [7][8]. При старческом ATTR-амилоидозе выявляются отложения белка транстиретина дикого типа, локализующиеся преимущественно в сердце. Данный вариант чаще развивается у лиц старше 60 лет [7][9][10]. В 2017 г. зарегистрирован пока единственный в мире препарат для патогенетического лечения транстиретинового амилоидоза — тафамидис, при применении которого общая смертность больных амилоидозом снижается на 30%, а риск госпитализаций по поводу сердечно-сосудистых заболеваний — на 32% [4].
На долю AL-амилоидоза приходится около 68% всех случаев амилоидных кардиомиопатий [3][6]. Как правило, основным клиническим синдромом является прогрессирующая сердечная недостаточность (ХСН), резистентная к стандартной многокомпонентной терапии [11][12]. Считается, что среди пациентов, госпитализированных по причине декомпенсации ХСН с сохранной фракцией выброса левого желудочка, у 13% диагностируется амилоидная кардиомиопатия. AL-амилоидоз подразделяется на первичный (идиопатический) и амилоидоз, ассоциированный с миеломной болезнью, встречающийся у 7–10% больных с множественной миеломой. Прогрессирование заболевания связано с развитием плазмоклеточной или лимфоплазмоцитарной опухоли, продуцирующей моноклональные свободные лёгкие цепи иммуноглобулинов, откладывающиеся в составе амилоида в различных органах, вызывая их дисфункцию. При первичном AL-амилоидозе плазмоклеточная дискразия более доброкачественная, в то время как при множественной миеломе, она обладает признаками злокачественной опухоли, что приводит к генерализации процесса с мультисистемным поражением, включая сердце, почки, желудочно-кишечный тракт, нервную систему и кожу. Полиорганная дисфункция приводит к отсутствию специфической картины заболевания и расширению круга диагностического поиска [13]. При своевременной диагностике и назначении специфической терапии значительно улучшается прогноз пациентов: снижение уровня смертности за первые 2,5 года лечения достигает не менее 13%. В случае отсутствия болезнь-модифицирующего лечения медиана выживаемости пациентов с AL-амилоидозом составляет менее 1 года. [14].
Несмотря на многоликость клинического течения, заподозрить амилоидную кардиомиопатию позволяют так называемые «красные флаги амилоидоза» — совокупность симптомов и признаков, отражающих накопление патологических белков в миокарде. Однако низкая осведомленность врачей об этом тяжёлом заболевании по-прежнему обусловливает позднюю диагностику на трудно курабельных стадиях заболевания [5].
Описание клинического случая
Пациентка К. (69 лет) обратилась на приём с жалобами на одышку в покое и при незначительной повседневной нагрузке, ортопноэ, отёки ног, резкую общую слабость, снижение массы тела, эпизоды синкопе. Вышеописанные симптомы больная стала отмечать около двух лет назад с прогрессирующим увеличением их выраженности. Кроме того, женщина с 55 лет регулярно принимала антигипертензивную терапию, при этом около года из-за развития гипотонии полностью отменила лечение. На момент обращения регулярно принимала торасемид в дозе 10–20 мг/сут., бисопролол в дозе 1,25 мг/сут и апиксабан в дозе 5 мг 2 раза в сутки.
Согласно представленным документам, ранее на электрокардиограмме (ЭКГ) выявлены комплексы типа QS в отведениях II, III, aVF, V1–V3. Однократно зафиксирован пароксизм фибрилляции предсердий. При выполнении эхокардиографии (ЭХОКГ) была обнаружена массивная концентрическая гипертрофия левого желудочка с утолщением межжелудочковой перегородки (МЖП) и задней стенки левого желудочка (ЗСЛЖ) до 16 мм, признаки гипокинеза передней стенки при сохраненной фракции выброса — 62%. Данные изменения расценены как постинфарктный кардиосклероз. В связи с этим пациентке выполнена селективная коронароангиография, по результатам которой гемодинамически значимого поражения коронарных артерий не выявлено.
Также, согласно ретроспективным данным, в течение 1,5 лет выявлялась анемия лёгкой степени со снижением гемоглобина до 100 г/л, в связи с чем выполнен онкопоиск, в результате которого данных об онкопатологии внутренних органов не выявлено. По поводу сохраняющейся анемии больная обследована гематологом. Был обнаружен М-градиент, проведено иммунотипирование белков с панелью антисывороток, идентифицирована тяжёлая цепь IgG и лёгкая цепь лямбда, в связи с этим пациентке выполнены рентгенография костей черепа и стернальная пункция, данных о миеломной болезни не получено. Пациентке был поставлен диагноз «Моноклональная гаммапатия неясного генеза», рекомендовано динамическое наблюдение и приём препаратов железа внутрь. Кроме этого, в биохимическом анализе отмечались двукратное увеличение уровня щелочной фосфатазы, выраженная протеинурия. Остальные показатели, в том числе тиреоидный статус, не выходили за пределы референсных значений.
В связи с сохраняющейся одышкой пациентке была выполнена компьютерная томография органов грудной клетки с признаками гидроторакса, гидроперикарда, косвенные признаки лёгочной гипертензии, в связи с чем больная вновь направлена на консультацию к кардиологу.
Объективно при осмотре пациентка нормостенического телосложения, рост — 167 см, вес — 78 кг, ИМТ — 28 кг/м². Кожные покровы и видимые слизистые бледные. Периферические лимфатические узлы не увеличены. Определялось набухание яремных вен. Отёки ног симметричные, плотные до колен. Частота дыхания — 20 в минуту. Сатурация (SpO2) — 96%. Аускультативно в лёгких дыхание жёсткое, ослаблено ниже угла лопатки с обеих сторон. Тоны сердца глухие, ритмичные, акцент II тона над лёгочной артерией. Частота сердечных сокращений — 70 уд./мин. Артериальное давление — 110/70 мм рт. ст. на обеих руках. Живот при пальпации мягкий, безболезненный, край печени выступал из-под рёберной дуги (+2 см), безболезненный. Перитонеальные и пузырные симптомы — отрицательны.
Далее выполнена ЭКГ в 12 отведениях: на фоне синусового ритма отмечается очагово-рубцовый паттерн - комплексы типа QS в отведениях II, III, aVF, V1-V3 (рис. 1).
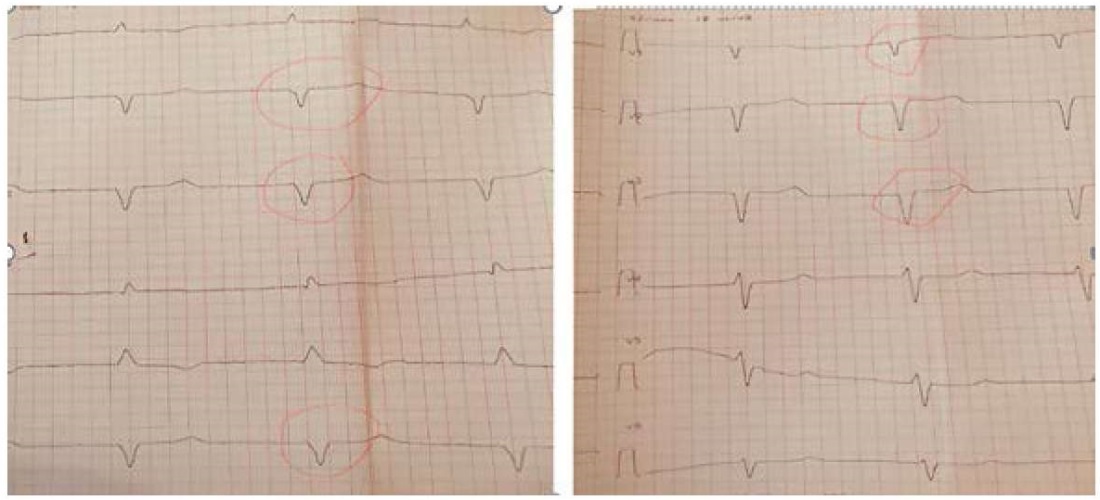
Рисунок 1. Электрокардиограмма
Figure 1. Electrocardiogram
Повторно проведена ЭХО-КГ (аппарат Toshiba Aplio 500) (рис. 2). В сравнении c исследованием, выполненным за 6 месяцев до настоящего, наблюдалось увеличение выраженности гипертрофии ЛЖ, значительный рост показателей толщины МЖП и ЗСЛЖ, увеличение индекса массы миокарда ЛЖ, превышавшего двукратно нормативные показатели. При этом фракция выброса сохранена, зоны нарушения локальной сократимости достоверно не определялись (табл. 1).
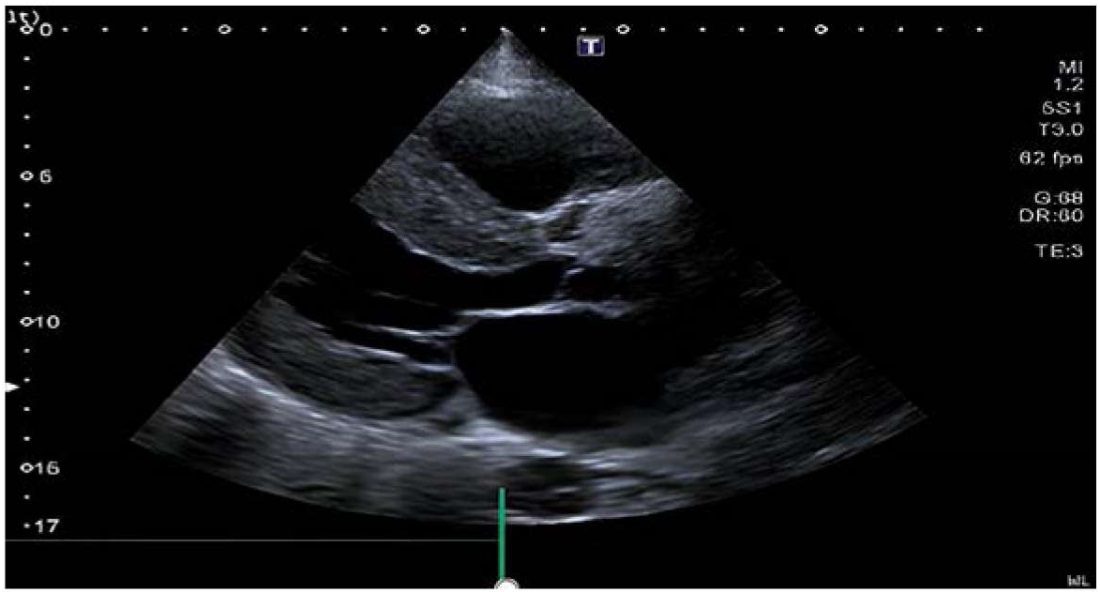
Рисунок 2. Эхокардиография (апикальное четырёхкамерное сечение)
Figure 2. Echocardiography (apical four-chamber section)
Таблица / Table 1
Результаты эхокардиографического исследования в динамике
Results of echocardiographic examination in dynamics
Параметры / Parameters | I | II |
ПЖ, мм RV, mm | 28 | 29 |
Толщина стенки ПЖ, мм RVWT, mm | 5 | 5 |
VperТК, м/c TRV, m/ s | до 2,6 | до 2,6 |
ДвЛА, мм рт ст PAP, mmHg | до 41 | до 42 |
МЖПд, мм IVSd, mm | 18,3 | 24,5 |
ЗСЛЖд, мм PWTd, mm | 17,3 | 22,8 |
КДР, мм EDD, mm | 46 | 43 |
КДО, мл EDV, ml | 102 | 81 |
КСР, мм ESD, mm | 31 | 25 |
КСО, мл ESV, ml | 38 | 23 |
УО, мл SV, ml | 63 | 58 |
МОК, л/мин CO, l/min | 3,8 | 4,1 |
ФВ по Teichgolz, % EF, % | 62 | 71 |
ФУ, % FS, % | 33 | 40 |
ИММЛЖ, г/м² LVMI, g/m² | 197 | 283 |
Примечание: ПЖ — правый желудочек, VperТК — скорость трикуспидальной регургитации, ДвЛА — давление в лёгочной артерии, МЖПд — межжелудочковая перегородка в диастолу, ЗСЛЖд — задняя стенка левого желудочка в диастолу, КДР — конечно-диастолический размер, КДО — конечно-диастолический объём, КСР — конечный систолический размер; КСО — конечно-систолический объём; УО — ударный объём; МОК — минутный объём крови; ФВ — фракция выброса; ФУ — фракция укорочения; ИММЛЖ — индекс массы миокарда левого желудочка.
Note: RV — right ventricle, RVWT — right ventricular wall thickness, TRV — tricuspid regurgitation velocity, PAP — pulmonary artery pressure, IVSd — interventricular septum in diastole, PWTd — posterior wall of the left ventricle in diastole, EDD — end-diastolic dimension, EDV — end-diastolic volume, ESD — end-systolic dimension; ESV — end-systolic volume; SV — stroke volume; CO — cardiac output; EF — ejection fraction; FS —fraction shortening; LVMI — left ventricular myocardial mass index.
При выполнении холтеровского мониторирования ЭКГ регистрировался синусовый ритм с минимальной частотой 41 удар в минуту, максимальной частотой 77 в минуту, средняя частота сердечных сокращений составила 53 удара в минуту. В течение суток отмечались редкая полиморфная желудочковая экстрасистолия и постоянная атриовентрикулярная блокада 1 степени с удлинением РQ до 280 мсек. Других преходящих нарушений ритма и проводимости не выявлено. В течение всей записи регистрировались постоянные нарушения реполяризации по 1-му и 3-му мониторному отведениям с периодическим углублением депрессии сегмента ST в ночные часы до 1 мм.
По результатам ультразвукового исследования органов брюшной полости определялись признаки гепато- и спленомегалии, признаки асцита.
Лабораторно выявлено повышение уровня NT-proBNP до 9626 пг/мл, умеренное повышение уровня щелочной фосфатазы — до 177 Ед/л, мочевой кислоты — до 480 мкмоль/л, гамма-глутамилтранспептидазы — до 76 ЕД/л и протеинурия 3,5 г/сутки. Уровень высокочувствительного сердечного тропонина не превышал референсных значений.
В связи с ретроспективными данными и вновь выявленными изменениями была заподозрена амилоидная кардиомиопатия, больная была направлена на дообследование к гематологу. Ей проведена трепанобиопсия подвздошной кости, по результатам которой среди клеточных элементов миелоидной ткани обнаружены интерстициальные диффузные скопления, разрушение костных балок и высокая клеточность костного мозга (рис. 3).
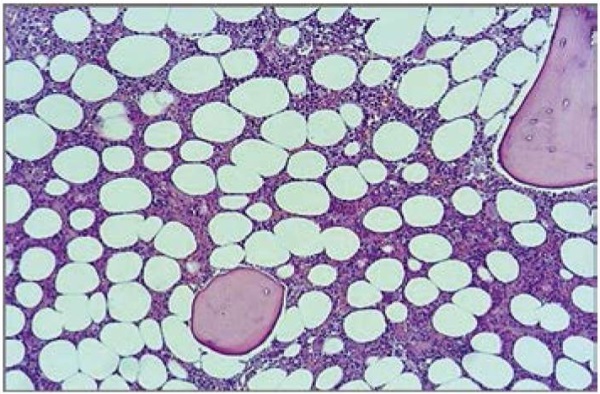
Рисунок 3. Гистологическое исследование трепанобиоптата гребня подвздошной кости
Figure 3. Histological examination of a trephine biopsy of the iliac crest
Кроме того, выполнено иммуногистохимическое исследование, определена экспрессия CD138-маркера плазматических клеток, подтвердившая диагноз «Плазмоклеточная миелома» (рис. 4).
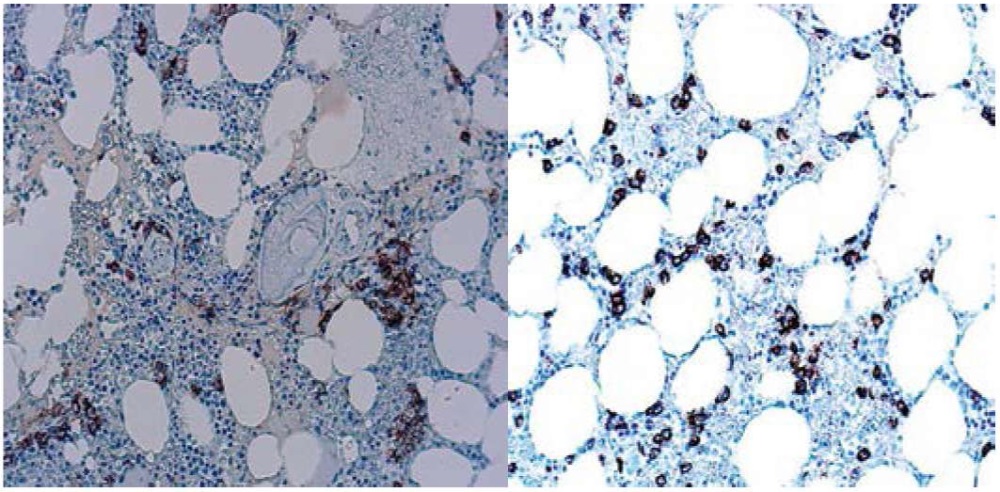
Рисунок 4. Иммуногистохимическое исследование трепанобиоптата гребня подвздошной кости
Figure 4. Immunohistochemical study of iliac crest trephine biopsy
Таким образом, пациентке был поставлен клинический диагноз «Системный амилоидоз с преимущественным поражением сердца, ассоциированный с множественной миеломой, ХСН с сохраненной фракцией выброса, 2 стадия, III функциональный класс». Проведена коррекция терапии сердечной недостаточности: увеличена доза торасемида до 40 мг/сутки, добавлен эплеренон в дозе 100 мг/сутки и дапаглифлазин 10 мг/сутки. В условиях гематологического стационара больная начала химиотерапевтическое лечение, однако спустя 7 месяцев с начала специфической терапии констатирована смерть пациентки. Аутопсия не выполнена по настоянию родственников.
Обсуждение
Понятие «красные флаги» амилоидоза введено в 2021 г. в новом консенсусном документе Европейского общества кардиологов (ЕОК) [15] и включают совокупность клинических, инструментальных и лабораторных признаков, которые позволяют врачу заподозрить амилоидоз сердца.
Выделяют кардиальные и некардиальные проявления амилоидоза. К первым прежде всего относят симптомы хронической сердечной недостаточности, такие как слабость, одышка, выраженные отёки вплоть до развития анасарки, при этом выявляется сохранённая систолическая функция левого желудочка. Данное обстоятельство обусловлено развитием рестриктивной кардиомиопатии, развивающейся вследствие отложения амилоида между кардиомиоцитами, снижением эластичности и растяжимости стенок сердца и резким снижением ударного объёма [15][16]. Важно отметить, что при AL-амилоидозе течение сердечной недостаточности более тяжёлое, чем при ATTR, что, по мнению ряда авторов, связано с большей выраженностью окислительного стресса, прямым повреждением кардиомиоцитов [17][18] и позволяет предположить тип амилоида на основании выраженности клинической симптоматики. В настоящем наблюдении у больной отмечались тяжёлые проявления право- и левожелудочковой недостаточности, отсутствие эффекта в ответ на стандартную терапию ХСН, что согласуется с литературными данными.
Помимо диастолической дисфункции, отложение амилоида в проводящей системе сердца может проявляться различными нарушениями проводимости и ритма, в том числе фибрилляцией предсердий (ФП) [15]. Однако в большинстве случаев у пациентов длительно сохраняется синусовый ритм, а присоединение ФП обусловлено прогрессированием заболевания, вовлечением миокарда предсердий, а также их объёмной перегрузкой [19]. Зафиксированные в анамнезе у нашей пациентки пароксизмы фибрилляции предсердий свидетельствуют о далеко зашедших патофизиологических изменениях в сердце.
Признаками амилоидной кардиомиопатии на ЭКГ считается низкая амплитуда комплекса QRS в стандартных отведениях и/или псевдорубцовый паттерн в правых грудных отведениях [17]. Согласно публикациям учёных из клиники Майо, несмотря на более сильную инфильтрацию сердца амилоидом при ATTR форме, обнаружение низкого вольтажа ЭКГ гораздо более распространено при AL-амилоидозе, тогда как для первого характерными считаются рубцовые изменения [20]. Зубцы P чаще имеют нормальный вольтаж, но расширены и могут иметь различные морфологические аномалии, указывающими на замедление внутрипредсердной проводимости [17]. В описываемом нами клиническом случае псевдоинфарктный паттерн обнаружен по нижней и передней стенкам миокарда ЛЖ, а также замедление АВ-проводимости, что свидетельствует о невысокой специфичности ЭКГ-признаков.
При ультразвуковом исследовании сердца первым настораживающим признаком в отношении амилоидоза является концентрическое утолщение стенки ЛЖ, которое нередко превышает 15 мм, при этом толщина стенки более 18 мм встречается гораздо чаще при ATTR-форме, чем при AL-амилоидозе [17]. Важно отметить, что в отличие от истинной гипертрофии желудочков эхогенность миокарда при амилоидозе выше, его текстура имеет типичный «зернистый, сверкающий» вид [17][21]. Также может обнаруживаться двустороннее увеличение предсердий и утолщение межпредсердной перегородки [22]. Предсердия могут стать местом образования тромбов даже при отсутствии аритмии вследствие низкого ударного объёма и неровной поверхности эндокарда предсердий из-за инфильтрации амилоидом [17][22]. Иногда наблюдаются плевральный или перикардиальный выпоты [22], что и было обнаружено нами у больной, причём особенно привлекала внимание скорость прогрессии утолщения миокарда ЛЖ: за 6 месяцев толщина МЖП увеличилась на 6,2 мм, а ЗСЛЖ — на 5,5 мм. Но наиболее специфичным инструментальным признаком амилоидной кардиомиопатии считается нарушение продольной деформации базальных и средних сегментов ЛЖ с сохранением в апикальных сегментах, получивший название «вишенка на торте» (или «бычий глаз»), редко выявляющееся при других кардиомиопатиях [15][17]. К сожалению, технические возможности не позволили оценить данный признак у нашей пациентки.
Как известно, концентрация натрийуретического пептида B-типа (BNP) и N-концевого фрагмента NT-proBNP увеличивается при различных формах сердечной недостаточности, но в случае амилоидной кардиомиопатии независимо от типа патогенного белка их уровень непропорционально высок из-за прямого сжатия кардиомиоцитов и стресса, вызванного повышенным давлением наполнения [17], что было обнаружено нами у больной. Также надежным индикатором гибели кардиомиоцитов как при AL-, так и при ATTR-амилоидозе считается сердечный тропонин [20][21]. У нашей пациентки он не превышал нормативных значений, несмотря на тяжесть клинической симптоматики, что, возможно, требовало серийного изучения, не выполненного в настоящем наблюдении.
Некардиальные симптомы весьма разнообразны. Инфильтрация мягких тканей и мелких сосудов может проявляться макроглоссией, периорбитальной пурпурой, дистрофией ногтей. Довольно часто в патологический процесс вовлекается периферическая нервная система с формированием сенсомоторной нейропатии по типу «перчатки и чулки». Поражение нервных окончаний автономной нервной системы приводит к ортостатической гипотонии, прогрессирующему снижению артериального давления [17], на что пожаловалась пациентка при первичном осмотре. Часто при системном процессе выявляется нефротический синдром, иногда гепатомегалия или спленомегалия [21][22], что также было обнаружено нами.
Несмотря на выраженность клинической симптоматики и лабораторно-инструментальных признаков, ранее окончательный диагноз «Сердечный амилоидоз» можно было установить только после обнаружения амилоида и определения его типа. Золотым стандартом диагностики считались эндомиокардиальная биопсия и гистологический анализ [10], однако данная процедура инвазивная, что требует существенного навыка от врача и представляет определённый риск осложнений. Более доступна биопсия подкожно-жировой клетчатки передней брюшной стенки, обладающая достаточно высокой чувствительностью для AL-амилоидоза (до 84%), тогда как для идентификации ATTR формы чувствительность метода не превышает 45% [23], так что отрицательный результат биопсии непоражённого органа не исключает диагноз «Амилоидоз». На сегодняшний день обязательным методом диагностики AL-амилоидоза со специфичностью 99% признано обнаружение моноклонального белка в сыворотке крови и/или моче методом иммунофиксации [15]. При выявлении ATTR-амилоидоза аналогичной специфичностью обладает сцинтиграфия миокарда с остеотропными радиофармпрепаратами [5]. В описываемом клиническом наблюдении сцитиграфия не выполнялась по техническим причинам, однако идентифиция тяжёлой цепи IgG и лёгкой цепи лямбда с последующей трепанобиопсией подвздошной кости, подтвердившие диагноз «Миеломная болезнь», позволили завершить диагностический поиск.
Заключение
Амилоидоз — мультисистемное, многоликое и далеко не очевидное заболевание, выявляемость которого прогрессивно увеличивается в последние годы. Определяющую роль в прогнозе играет время от начала появления клинической симптоматики до постановки диагноза. Определение белка-предшественника является краеугольным камнем в тактике ведения пациента с амилоидной кардиомиопатией. Своевременно возникшее подозрение и грамотная дифференциальная диагностика решающим образом влияют на развитие тяжёлой сердечной недостаточности и продолжительность жизни пациента.
Список литературы
1. Загребнева А.И., Потешкина Н.Г., Кузнеченко Д.И., Бабак В.В. Системный амилоидоз, ассоциированный с множественной миеломой: клиническое наблюдение. РМЖ. 2018;12(II):107-109. eLIBRARY ID: 36578898 EDN: VOIHOV
2. Орлов Ф.И., Аншелес А.А., Насонова С.Н., Саидова М.А., Жиров И.В., и др. Трудности дифференциальной диагностики AL- и ATTR-амилоидоза сердца. Терапевтический архив. 2023;95(9):789-795. https://doi.org/10.26442/00403660.2023.09.202376
3. Гудкова А.Я., Лапекин С.В., Бежанишвили Т.Г., Трукшина М.А., Давыдова В.Г., и др. AL-амилоидоз с преимущественным поражением сердца. Алгоритм неинвазивной диагностики амилоидной кардиомиопатии. Терапевтический архив. 2021;93(4):487-496. https://doi.org/10.26442/00403660.2021.04.200689
4. Моисеев С.В., Рамеев В.В. Тафамидис в лечении транстиретинового амилоидоза сердца. Клиническая фармакология и терапия. 2021;30(2):44-50. https://doi.org/10.32756/0869-5490-2021-2-44-50
5. Терещенко С.Н., Насонова С.Н., Жиров И.В., Саидова М.А., Аншелес А.А., и др. Амилоидоз сердца. Москва: ФГБУ «НМИЦ кардиологии» Минздрава России; 2021. eLIBRARY ID: 46699146 EDN: DMWKPZ
6. Garcia-Pavia P, Bengel F, Brito D, Damy T, Duca F, et al. Expert consensus on the monitoring of transthyretin amyloid cardiomyopathy. Eur J Heart Fail. 2021;23(6):895-905. https://doi.org/10.1002/ejhf.2198
7. Аниконова Л.И., Воробьева О.А., Бакулина Н.В. ATTR-амилоидоз - системное заболевание с вовлечением почек. Нефрология и диализ. 2022;24(3):441-456. https://doi.org/10.28996/2618-9801-2022-3-441-456
8. Резник Е.В., Нгуен Т.Л., Борисовская С.В., Брылев Л.В., Желнин А.В., Сексяев Н.Е. Клинический случай наследственного транстиретинового амилоидоза. Архивъ внутренней медицины. 2021;11(3):229-240. https://doi.org/10.20514/2226-6704-2021-11-3-229-240
9. Адян Т.А., Поляков А.В. Наследственный транстиретиновый амилоидоз. Нервно-мышечные болезни. 2019; 9(4):12-25. https://doi.org/10.17650/2222-8721-2019-9-4-12-25
10. Резник Е.В., Нгуен Т.Л., Степанова Е.А., Устюжанин Д.В., Никитин И.Г. Амилоидоз сердца: взгляд терапевта и кардиолога. Архивъ внутренней медицины. 2020;10(6):430-457. https://doi.org/10.20514/2226-6704-2020-10-6-430-457
11. Rowczenio D, Quarta CC, Fontana M, Whelan CJ, Martinez-Naharro A, et al. Analysis of the TTR gene in the investigation of amyloidosis: A 25-year single UK center experience. Hum Mutat. 2019;40(1):90-96. https://doi.org/10.1002/humu.23669
12. Yilmaz A, Bauersachs J, Bengel F, Büchel R, Kindermann I, et al. Diagnosis and treatment of cardiac amyloidosis: position statement of the German Cardiac Society (DGK). Clin Res Cardiol. 2021;110(4):479-506. https://doi.org/10.1007/s00392-020-01799-3
13. Лысенко (Козловская) Л.В., Рамеев В.В., Моисеев С.В., Благова О.В., Богданов Э.И. и др. Клинические рекомендации по диагностике и лечению системного амилоидоза. Клиническая фармакология и терапия. 2020;29(1):13-24. https://doi.org/10.32756/0869-5490-2020-1-13-24
14. Maurer MS, Schwartz JH, Gundapaneni B, Elliott PM, Merlini G, et al. Tafamidis Treatment for Patients with Transthyretin Amyloid Cardiomyopathy. N Engl J Med. 2018;379(11):1007-1016. https://doi.org/10.1056/NEJMoa1805689
15. Pankuweit S, Dörr R. Erratum zu: Diagnose und Behandlung der kardialen Amyloidose : Positionspapier der ESC Working Group on Myocardial and Pericardial Diseases 2021 [Erratum to: Diagnosis and treatment of cardiac amyloidosis : A position statement of the ESC Working Group on Myocardial and Pericardial Diseases 2021]. Herz. 2022;47(2):176. (In German). Erratum for: Herz. 2022;47(1):41-47. https://doi.org/10.1007/s00059-022-05100-2
16. Ishaq S, Lin F, Martins J, Huggett R. Unexpected manifestation of cardiac amyloidosis. BMJ Case Rep. 2018;2018:bcr2017222852. https://doi.org/10.1136/bcr-2017-222852
17. Ash S, Shorer E, Ramgobin D, Vo M, Gibbons J, et al. Cardiac amyloidosis-A review of current literature for the practicing physician. Clin Cardiol. 2021;44(3):322-331. https://doi.org/10.1002/clc.23572
18. Lu Y, Jiang Y, Prokaeva T, Connors LH, Costello CE. Oxidative Post-Translational Modifications of an Amyloidogenic Immunoglobulin Light Chain Protein. Int J Mass Spectrom. 2017;416:71-79. https://doi.org/10.1016/j.ijms.2016.11.006
19. Kocher F, Kaser A, Escher F, Doerler J, Zaruba MM, et al. Heart failure from ATTRwt amyloid cardiomyopathy is associated with poor prognosis. ESC Heart Fail. 2020;7(6):3919-3928. https://doi.org/10.1002/ehf2.12986
20. Muchtar E, Gertz MA, Kumar SK, Lacy MQ, Dingli D, et al. Improved outcomes for newly diagnosed AL amyloidosis between 2000 and 2014: cracking the glass ceiling of early death. Blood. 2017;129(15):2111-2119. https://doi.org/10.1182/blood-2016-11-751628
21. Fradley MG, Thakuria JV, Collins AB, Moore SA, Stone JR. Direct tissue evaluation via immunofluorescence: in the diagnosis of hereditary transthyretin cardiac amyloidosis. Tex Heart Inst J. 2012;39(1):71-75. PMID: 22412233; PMCID: PMC3298917.
22. Kristen AV. Amyloid cardiomyopathy. Herz. 2020;45(3): 267-271. https://doi.org/10.1007/s00059-020-04904-4
23. Quarta CC, Gonzalez-Lopez E, Gilbertson JA, Botcher N, Rowczenio D, et al. Diagnostic sensitivity of abdominal fat aspiration in cardiac amyloidosis. Eur Heart J. 2017;38(24):1905-1908. https://doi.org/10.1093/eurheartj/ehx047.
Об авторах
М. К. АхвердиеваРоссия
Ахвердиева Милана Камиловна, к.м.н., доцент кафедры терапии
Ростов-на-Дону
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
И. А. Гарина
Россия
Гарина Ирина Андреевна, к.м.н., ассистент кафедры терапии
Ростов-на-Дону
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
В. В. Живага
Россия
Живага Валерия Владимировна, клинический ординатор кафедры терапии
Ростов-на-Дону
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
М. С. Литвинова
Россия
Литвинова Марина Сергеевна, к.м.н., ассистент кафедры терапии
Ростов-на-Дону
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Л. А. Хаишева
Россия
Хаишева Лариса Анатольевна, д.м.н., профессор кафедры терапии
Ростов-на-Дону
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Рецензия
Для цитирования:
Ахвердиева М.К., Гарина И.А., Живага В.В., Литвинова М.С., Хаишева Л.А. Системный амилоидоз с преимущественным поражением сердца, ассоциированный с множественной миеломой. Медицинский вестник Юга России. 2025;16(3):75-82. https://doi.org/10.21886/2219-8075-2025-16-3-75-82
For citation:
Akhverdieva M.K., Garina I.A., Zhivaga V.V., Litvinova M.S., Khaisheva L.A. Systemic amyloidosis with predominant cardiac involvement associated with multiple myeloma. Medical Herald of the South of Russia. 2025;16(3):75-82. (In Russ.) https://doi.org/10.21886/2219-8075-2025-16-3-75-82







































