Перейти к:
Особенности структурно-функционального ремоделирования сердца у пациентов с хронической сердечной недостаточностью и синдромом старческой астении
https://doi.org/10.21886/2219-8075-2025-16-2-83-91
Аннотация
Цель: оценить особенности структурно-функциональных параметров сердца у пациентов с хронической сердечной недостаточностью (ХСН) и синдромом старческой астении (ССА). Материалы и методы: в исследовании принял участие 161 респондент с ХСН на фоне артериальной гипертензии (АГ) (82 женщины и 79 мужчин) в возрасте от 80 лет до 91 года. С учётом наличия ССА пациенты распределены в 2 группы: I группа — пациенты с ХСН и ССА (n = 84), II группа — пациенты с ХСН без ССА (n = 77). Скрининг и диагностику ССА выполняли с помощью опросника «Возраст не помеха» и комплексной гериатрической оценки. Для определения структурно-функциональных показателей сердца выполняли трансторакальное эхокардиографическое (ЭхоКГ) и допплер -ЭхоКГ исследование. Результаты: у пациентов с АГ и ХСН при развитии ССА в сравнении с больными АГ и ХСН без ССА наблюдались статистически значимо более высокие значения индексированных показателей передне-заднего размера ЛП (ИЛП), объёма ЛП (ИОЛП), массы миокарда левого желудочка (ИММЛЖ) (р <0,05), а также больший процент развития концентрического ремоделирования ЛЖ (КРЛЖ) и меньший — концентрической гипертрофии ЛЖ (КГЛЖ), что ассоциируется с увеличением риска развития неблагоприятных сердечно-сосудистых событий. Анализ систолической функции ЛЖ выявил у «хрупких» пациентов с АГ и ХСН значимо более высокие показатели индекса конечного систолического размера (ИКСР) ЛЖ, конечного диастолического размера (ИКДР) ЛЖ, конечного диастолического объёма (ИКДО) ЛЖ, конечного систолического объёма (ИКСО) ЛЖ, более низкий показатель минутного объёма (МО), что отражает снижение сократительной способности миокарда ЛЖ. Кроме того, у пациентов с ССА определяется более низкий процент показателя фракции выброса (ФВ) ЛЖ: 44% против 59,2% (р=0,002). Соответственно, среди пациентов с ССА выявлялся меньший процент сердечной недостаточностью с сохранённой фракцией выброса (СНсФВ) ЛЖ (p = 0,028). Зарегистрированное статистически значимое снижение показателей DT, IVRT и e', а также увеличение соотношения Е/e', что свидетельствует о более выраженном прогрессировании диастолической дисфункции ЛЖ у «хрупких» пациентов с АГ и ХСН. Заключение: при наличии ССА у пациентов с АГ и ХСН в возрасте 80 лет и старше определялись более значимые изменения структурно-функциональных параметров сердца, свидетельствующие о более выраженном нарушении систолической и диастолической функции.
Ключевые слова
Для цитирования:
Сафроненко В.А., Чесникова А.И., Сафроненко А.В. Особенности структурно-функционального ремоделирования сердца у пациентов с хронической сердечной недостаточностью и синдромом старческой астении. Медицинский вестник Юга России. 2025;16(2):83-91. https://doi.org/10.21886/2219-8075-2025-16-2-83-91
For citation:
Safronenko V.A., Chesnikova A.I., Safronenko A.V. Features of structural and functional remodeling of the heart in patients with chronic heart failure and senile asthenia syndrome. Medical Herald of the South of Russia. 2025;16(2):83-91. (In Russ.) https://doi.org/10.21886/2219-8075-2025-16-2-83-91
Введение
Как известно, в последнее время демографическая ситуация как во всем мире, так и в Российской Федерации характеризуется увеличением продолжительности жизни населения. Однако рост процента пациентов пожилого и старческого возраста, как правило, сопровождается увеличением коморбидной патологии [1]. Так, 65% пациентов в возрасте от 65 до 84 лет имеет сочетанную патологию, а у больных старше 84 лет её вероятность увеличивается до 82%. Следует отметить, что артериальная гипертензия (АГ) в 66% случаев является составляющей коморбидности у пожилых пациентов [2]. Согласно национальным рекомендациям по диагностике и лечению ХСН (2024), в 88% случаев АГ является причиной развития ХСН [3][4]. В свою очередь, по данным исследования ЭПОХА-ХСН, распространённость ХСН в стране за последние двадцать лет увеличилась с 6,1 до 8,2% [5]. Кроме того, по мнению ряда авторов, с возрастом повышается и частота развития синдрома старческой астении, который сопровождается снижением физиологических резервов и приводит к прогрессированию уже имеющихся заболеваний [6][7]. Наличие ССА повышает риск госпитализаций в 1,2–1,8 раза и смерти — в 1,8–2,3 раза, являясь прогностически неблагоприятным фактором [8]. В связи с этим, по мнению экспертов Российской ассоциации геронтологов и гериатров, наличие ССА у пожилых пациентов с ССЗ требует более тщательной оценки результатов лабораторных и инструментальных методов обследования с целью определения стратегии и тактики ведения данной категории пациентов, а также профилактики развития сердечно-сосудистых осложнений [8].
В настоящее время особое внимание уделяется работам, посвященным изучению структурно-функциональных параметров сердца у пациентов с АГ и ХСН в пожилом возрасте, особенно в зависимости от наличия ССА.
Цель исследования — оценить особенности структурно-функциональных параметров сердца у пациентов с ХСН в зависимости от наличия ССА.
Материал и методы
В исследование типа «случай-контроль» был включён 161 респондент с ХСН на фоне АГ (IIA–IIБ стадии и II–IV функционального класса (ФК)) в возрасте от 80 до 91 года — 82 женщины и 79 мужчин. Все участники в зависимости от наличия ССА были распределены в две группы: I группа — пациенты с ХСН и ССА (n = 84), II группа — больные с ХСН без ССА (n = 77).
Наличие острого нарушения мозгового кровообращения или транзиторной ишемической атаки в течение последних 6 месяцев, ишемической болезни сердца в анамнезе, гемодинамически значимых пороков сердца, имплантированного электрокардиостимулятора, тяжелой патологии печени (повышение уровня трансаминаз в 5 раз и более нормы) или почек (скорость клубочковой фильтрации ≤ 30 мл/мин.), злокачественных новообразований рассматривали как критерий исключения из исследования.
В исследование включались пациенты с ранее диагностированной АГ и ХСН.
Скрининг ССА (или синдром хрупкости, frailty) проводили с помощью опросника «Возраст не помеха», краткой батареи тестов физического функционирования, динамометрии и теста Мини-Ког. Если пациент набирал ≥ 5 баллов по опроснику «Возраст не помеха» или ≤ 7 баллов по краткой батарее тестов физического функционирования и/или < 3 баллов по Мини-Ког, то с высокой долей вероятности судили о наличии ССА. Для подтверждения диагноза гериатр выполнял комплексную гериатрическую оценку [9].
Всем пациентам проводили трансторакальную ЭхоКГ и допплер-ЭхоКГ на аппарате MyLab70 («Esaote», Италия). Протокол исследования включал оценку линейных и объёмных показателей ЛЖ: передне-задний размер левого предсердия (ЛП, мм), индекс передне-заднего размера ЛП (ИЛП, мм/м2), объём ЛП (ОЛП, мл), индекс объёма ЛП (ИОЛП, мл/м2), толщина межжелудочковой перегородки ЛЖ (МЖП, мм), толщина задней стенки ЛЖ (ЗСЛЖ, мм), индекс относительной толщины стенок ЛЖ (ИОТ), масса миокарда ЛЖ (ММЛЖ), индекс массы миокарда ЛЖ (ИММЛЖ, г/м2), конечный диастолический размер (КДР, мм) ЛЖ, индекс КДР ЛЖ (ИКДР ЛЖ, мм/м2), конечный диастолический объём (КДО, мл) ЛЖ, индекс КДО ЛЖ (ИКДО ЛЖ, мл/м2), конечный систолический размер (КСР, мм) ЛЖ, индекс КСР ЛЖ (ИКСР ЛЖ, мм/м2), конечный систолический объём (КСО, мл) ЛЖ, индекс КСО ЛЖ (ИКСО ЛЖ, мл/м2); определение фракции выброса левого желудочка (ФВ ЛЖ, %) по методу Sуmpson, ударного объема (УО, мл), ударного индекса (УИ, мл/м2), минутного объёма (МО, мл/мин), сердечного индекса (СИ, л/мин/м2), фракции укорочения (ФУ, %) и миокардиального стресса (МС, г/см2 ). Диастолическую функцию оценивали по соотношению максимальной скорости потока через митральный клапан в фазу ранней диастолы ЛЖ (Е, м/с) к максимальной скорости потока через митральный клапан в фазу поздней диастолы ЛЖ (А, м/с), по соотношению Е (м/с) к раннему диастолическому удлинению ЛЖ (e′), а также фазе изоволюмического расслабления (IVRT, мс) и времени замедления скорости потока быстрого наполнения ЛЖ (DT, мс).
Статистический анализ полученных данных осуществлялся в программе STATISTICA 12.0 (StatSoft Inc., США), SPSS 21.0, MedCalc (версия 9.3.5.0). Для оценки нормальности распределения использовались критерии Колмогорова-Смирнова и Шапиро-Уилка. Количественные показатели при нормальном распределении определялись посредством критерия Стьюдента. При распределении, отличном от нормального, для качественных признаков применялся критерий χ2 с поправкой Йетса, для количественных — критерий Манна-Уитни. Сравнение трёх и более групп пациентов выполнялось с помощью критериев ANOVA и Краскела-Уоллиса. Результаты считались достоверными при р < 0,05.
Результаты
Частота встречаемости факторов риска и сопутствующей патологии у участников исследования представлена на рисунке 1, из которого следует, что у пациентов с АГ и ХСН, имеющих ССА, по сравнению с больными без ССА статистически значимо чаще наблюдались хроническая болезнь почек (ХБП) (на 26,4%, р < 0,001) и фибрилляция предсердий (ФП) (на 25,3%, р < 0,001). В то же время в I группе значимо реже встречалось ожирение (на 13,5%, р = 0,032).
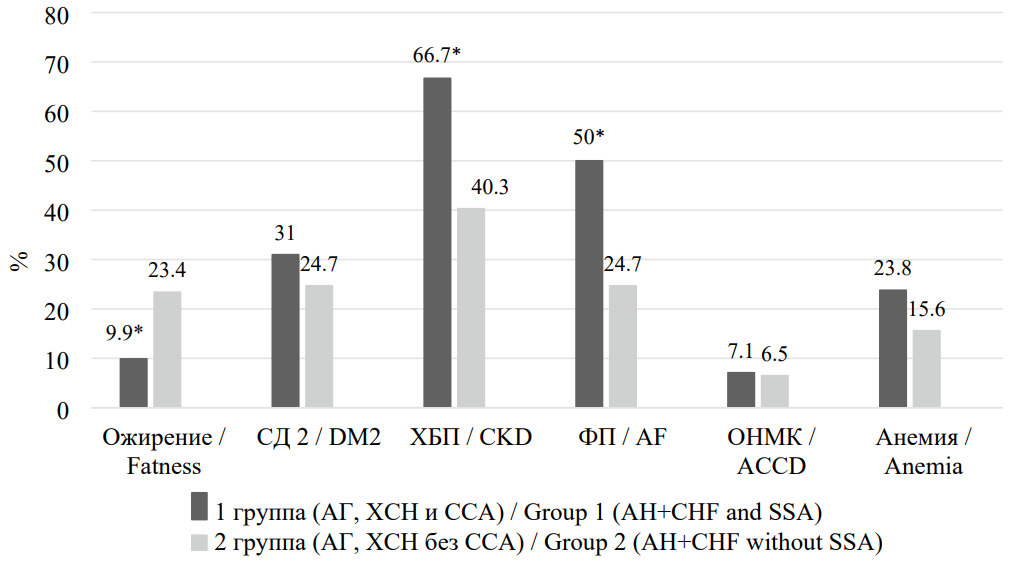
Рисунок 1. Распространённость факторов риска и сопутствующей патологии у пациентов, включенных в исследование
Figure 1. Prevalence of risk factors and concomitant pathology in patients included in the study
Примечание: * — р < 0,05 при сравнении со II группой. СД 2 — сахарный диабет 2-го типа; ХБП — хроническая болезнь почек; ФП — фибрилляция предсердий; ОНМК — острое нарушение мозгового кровообращения.
Note: * — p < 0.05 when compared with group II.DM2 — type 2 diabetes mellitus; CKD — chronic kidney disease; AF — atrial fibrillation; ACCD — acute cerebrovascular accident.
Длительность анамнеза АГ в изучаемых группах составила 22,0 ± 1,7 года, при этом значимых межгрупповых различий по данному параметру обнаружено не было (р > 0,05). Все пациенты в обеих группах имели III стадию гипертонической болезни и очень высокий кардиоваскулярный риск.
Не было выявлено статистически значимых различий (р > 0,05) между группами и по продолжительности течения ХСН, которая составила 8,4±3,6 годам, а также по стадиям заболевания. Вместе с тем у больных с АГ, ХСН и ССА значимо чаще отмечалась ХСН III ФК (61,9 против 45,5%, р = 0,041), в то время как у пациентов без ССА значимо чаще регистрировалась ХСН II ФК (41,6 против 28,6%, р = 0,041). Отметим, что «хрупкие» больные с АГ и ХСН в отличие от «крепких» пациентов имели статистически значимо более высокий (на 28,6%, р < 0,001) балл по ШОКС и более низкий бал по результатам ТШХ (238,5 м [ 181,3–310,8] против 365,0 м [ 261,5–405,5], p <0,001).
Участники исследования получали лечение по поводу АГ и ХСН в соответствии с действующими рекомендациями и значимо не различались в плане медикаментозной терапии (р > 0,05) (рис. 2) [10][11].
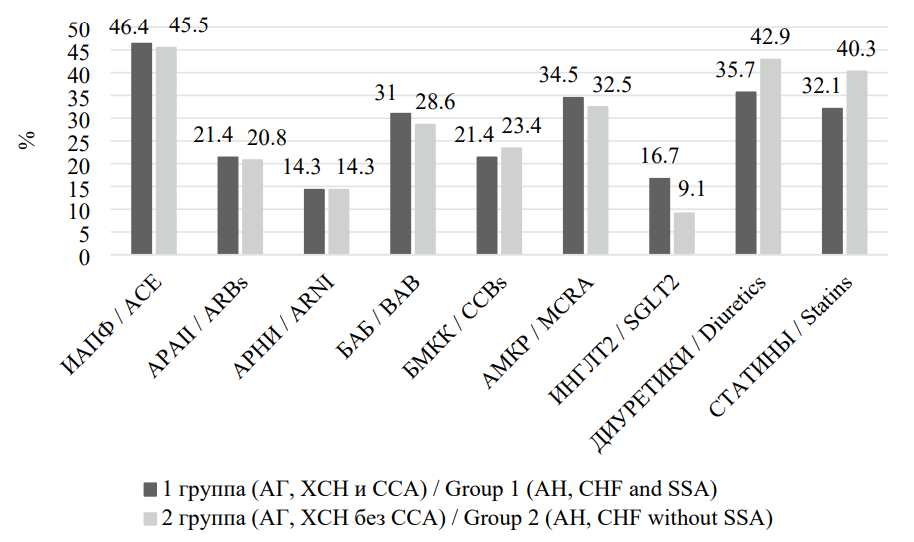
Рисунок 2. Частота назначения различных классов препаратов у пациентов, включенных в исследование
Figure 2. The frequency of prescribing different classes of drugs in patients included in the study
Примечание: ИАПФ — ингибиторы ангиотензинпревращающего фермента; АРАII — антагонисты рецепторов ангиотензина II типа; АРНИ — ангиотензиновых рецепторов и неприлизина ингибитор; ББ — бета-блокаторы; БМКК — блокаторы медленных кальциевых каналов; АМКР — антагонисты минералокортикоидных рецепторов; ИНГЛТ-2 — ингибиторы натрий-глюкозного котранспортера 2-го типа.
Note: ACE — Аngiotensin Converting Enzyme inhibitors; ARBs — Angiotensin II Receptor Blockers; ARNI — Angiotensin receptor-neprilysin inhibitor; BAB — beta blockers; CCBs — slow calcium channel blockers; MCRA — mineralocorticoid receptor antagonists; SGLT2 - Sodium glucose cotransporter-2 inhibitors.
По результатам опросника Мориски – Грина (8-item Morisky Medication Adherence Scale (MMAS-8), пациенты исследуемых групп имели среднюю приверженность к лечению (I группа — 6,4 ± 1,1,2 балла, II — 6,4 ± 1,1 балла), которая при межгрупповом сравнении не имела статистически значимых различий (р > 0,05).
Сравнительный анализ результатов ЭхоКГ исследования показал, что «хрупкие» пациенты с АГ и ХСН в отличии от «крепких» пациентов с АГ и ХСН имели статистически значимо более высокие значения как линейных (на 12,3%, р=0,018), так и объёмных (на 16,6%, р=0,018) показателей ЛП, а также их индексированных показателей (на 30%, р=0,007 и 28,4%, р=0,006, соответственно), что ассоциируется с увеличением риска развития неблагоприятных сердечно-сосудистых событий (табл. 1).
Таблица / Table 1
Линейные и объемные показатели левых отделов сердца у пациентов, включенных в исследование
Linear and volumetric parameters of the left heart in patients included in the study
|
Показатель / Index |
I группа АГ+ХСН+ССА (n=84) / Group 1 AH+ CHF + SSA (n=84) |
II группа АГ+ХСН без ССА (n=77) / Group 2 AH+ CHF without SSA (n=77) |
р |
|
ИЛП, мм/м2 / LAI mm/m2 |
30,3 [ 26,85;32,28] |
23,3 [ 22,2;24,45] |
0,007
|
|
ИОЛП, мл/м2 / LAVI ml/m2 |
47,0 [ 45,38;50,53] |
36,6 [ 34,7;37,95] |
0,006
|
|
ИКДР, мм/м2 / LVDDI mm/m2 |
29,3 [ 27,3;30,98] |
24,9 [ 23,9;25,7] |
0,047
|
|
ИКСР, мм/м2 / LVSDI mm/m2 |
20,1 [ 19,2;21,4] |
16,3 [ 15,7;17,1] |
0,041
|
|
ИКДО, мл/м2 / LV EDVI ml/m2 |
95,7 [ 86,85;100,63] |
68,9 [ 65,3;72,7] |
<0,001
|
|
ИКСО, мл/м2 / LV ESVI ml/m2 |
47,6 [ 42,3;50,48] |
28,1 [ 27;28,95] |
<0,001
|
|
МЖП, мм / IVSd mm |
12,9 [ 12,7;13,1] |
12,4 [ 11,9;12,7] |
0,728
|
|
ЗСЛЖ, мм / PWLVd mm |
12,9 [ 12,5;13,3] |
12,1 [ 11,9;12,5] |
0,758
|
|
ИОТ / RWTI |
0,57 [ 0,50;0,61] |
0,52 [ 0,50;0,58] |
0,452
|
|
ИММЛЖ, г/м2 / LVMI g/m2 |
212,0 [ 184,63;223,48] |
164,9 [ 158,2;173,3] |
0,001 |
Примечание: ИЛП — индекс передне-заднего размера левого предсердия, ИОЛП — индекс объёма левого предсердия, ИКДР ЛЖ — индекс конечного диастолического размера левого желудочка, ИКДО ЛЖ — индекс конечного диастолического объёма левого желудочка, ИКСР ЛЖ — индекс конечного систолического размера левого желудочка, ИКСО ЛЖ — индекс конечного систолического объёма левого желудочка; МЖП — толщина межжелудочковой перегородки левого желудочка, ЗСЛЖ — толщина задней стенки левого желудочка, ИОТ — индекс относительной толщины стенок левого желудочка, ИММЛЖ — индекс массы миокарда ЛЖ.
Note: LAI — index of antero-posterior size of the left atrium, LAVI — left atrium volume indexed, LVDDI — left ventricular diastolic dimension index, LVSdI — left ventricular sistolic dimension index, LV EDVI — indexed left ventricular-end-diastolic volume, LV ESVI — left ventricular-end-systolic volume; IVSd — interventricular septal thickness, PWLVd — thickness of the posterior wall of the left ventricle, RWTI — index of relative wall thickness of the left ventricle, LVMI — left ventricular mass index.
Кроме того, линейные, объёмные показатели ЛЖ и их индексированные значения у пациентов, включённых в исследование, также имели значимые различия. Так, установлено, что у больных I группы анализируемые показатели были статистически значимо выше по сравнению с таковыми у больных II группы: ИКДР — на 17,7% (р=0,047), ИКСР — на 23,3% (р=0,041), КДО — на 19,2% (р <0,01), ИКДО — на 28% (р <0,01), КСО — на 31,7% (р <0,01) и ИКСО — на 41% (р <0,01), что, по-видимому, обусловлено гемодинамической нагрузкой с последующим ремоделированием сердца у пациентов не только на фоне АГ и ХСН, но и при развитии ССА.
Анализ морфометрических показателей ЛЖ выявил наличие гипертрофии ЛЖ у всех пациентов, включённых в исследование. Несмотря на отсутствие значимых различий при сравнении толщины стенок ЛЖ (МЖП и ЗСЛЖ) (р>0,05), была продемонстрирована статистически значимо более выраженная ГЛЖ у пациентов с АГ и ХСН на фоне ССА, о чём свидетельствует более высокий показатель ИММЛЖ (на 22,2%, р=0,001).
С учётом значений ИОТ и ИММЛЖ были определены типы ремоделирования ЛЖ у пациентов, включённых в исследование. Как представлено на рисунке 3, пациенты с АГ, ХСН и ССА имели статистически значимо чаще концентрическое ремоделирование ЛЖ (КРЛЖ) и реже концентрическую гипертрофию ЛЖ (КГЛЖ) в сравнении с больными АГ и ХСН без ССА (р <0,05). Частота встречаемости ремоделирования ЛЖ по типу эксцентрической гипертрофии (ЭГЛЖ) в сравниваемых группах значимо не отличалась (р >0,05).
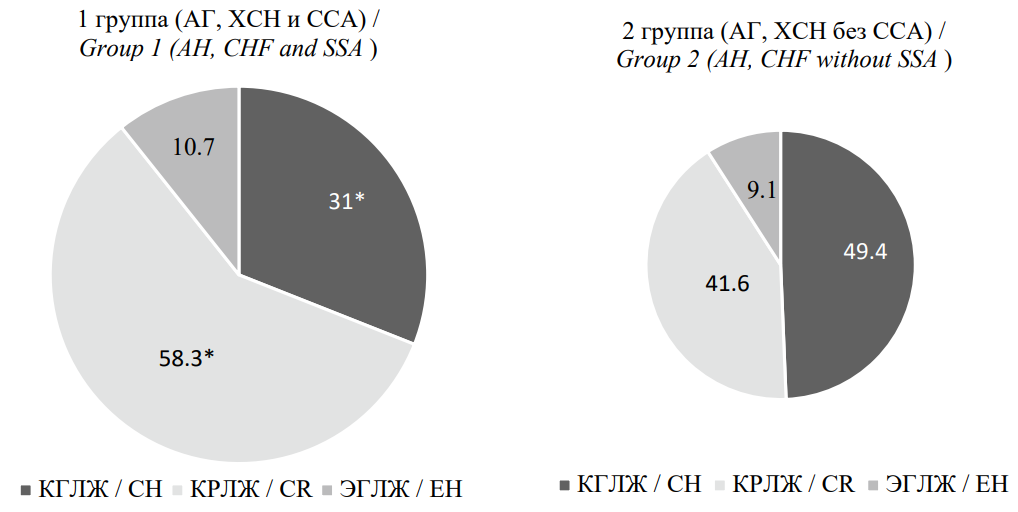
Рисунок 3. Типы ремоделирования левого желудочка у пациентов, включённых в исследование
Figure 3. Types of left ventricular remodeling in patients included in the study
Примечание: * — р < 0,05 при сравнении со II группой. КГЛЖ — концентрическая гипертрофия левого желудочка; КРЛЖ — концентрическое ремоделирование левого желудочка; ЭГЛЖ — эксцентрическая гипертрофия левого желудочка.
Note: * — p <0.05 when compared with group 2. CH — concentric hypertrophy left ventricular; CR — concentric remodeling left ventricular; EH — eccentric hypertrophy left ventricular.
Особое внимание было уделено систолической функции ЛЖ. Так, значимо меньший показатель ФВ ЛЖ отмечали у пациентов I группы (44,0% [ 42,4;47,32]), свидетельствующий о наличии систолической дисфункции ЛЖ, который отличался от аналогичного показателя у пациентов II группы (59,2% [ 57,79;60,54]) (р=0,002), соответствующий сердечной недостаточности с сохраненной фракцией выброса (СНсФВ) ЛЖ. При анализе фенотипов ХСН в зависимости от ФВ ЛЖ выявлены значимые отличия между группами. Так, СНсФВ ЛЖ в I и II группах исследования была верифицирована у 38,1% и 76,6% (p = 0,028) пациентов, СН с умеренно сниженной фракцией выброса (СНунФВ) ЛЖ — у 45,2% и 14,3% (p = 0,003) больных, а СН со сниженной ФВ (СНнФВ) — у 16,7% и 9,1% пациентов соответственно (р = 0,031). Следует отметить, что отличий в функциональной активности ЛЖ по показателям УО, УИ, СИ, ФУ и МС в исследуемых группах установлено не было (р >0,05). Однако у пациентов I группы регистрировали значимо меньшую величину МО (5,4 мл/мин [ 4,8;5,8]) в сравнении с больными II группы (6,6 мл/мин [ 5,9;7,3]) (р=0,008).
Особого внимания заслуживает оценка диастолической функции ЛЖ у пациентов, включённых в исследование. Как известно, при наличии постоянной формы ФП оценка диастолической функции ЛЖ не представляется возможным [12]. В связи с этим для оценки трансмитрального потока (Е/А) из исследования были исключены пациенты с постоянной формой ФП. Анализ полученных результатов выявил наличие у пациентов I и II групп диастолической дисфункции ЛЖ (ДДЛЖ) II типа (псевдонормальный тип наполнения ЛЖ, 0,8<Е/А<2) и сопоставимость данных по скорости раннего наполнения ЛЖ в диастолу (пик Е) и скорости позднего наполнения в момент систолы ЛП (пик А), а также отношение пиковых скоростей (Е/А) между сравниваемыми группами (р>0,05).
В свою очередь при оценке показателей DT и IVRT у пациентов с АГ, ХСН и ССА в сравнении с больными АГ, ХСН без ССА регистрировали значимое уменьшение времени замедления скорости потока быстрого наполнения ЛЖ (<150 мс) (на 24%, р=0,002) и изоволюмического расслабления ЛЖ (<80 мс) (на 35%, р=0,020), что говорит об увеличении давлении наполнения ЛЖ и более выраженной диастолической дисфункции на фоне ССА (табл. 2).
Таблица / Table 2
Показатели количественной оценки диастолической функции ЛЖ у пациентов, включённых в исследование
Indicators of quantitative assessment of LV diastolic function in patients included in the study
|
Показатель / Index |
I группа АГ+ХСН+ССА (n=84) / Group 1 AH+ CHF + SSA (n=84) |
II группа АГ+ХСН без ССА (n=77) / Group 2 AH+ CHF without SSA (n=77) |
р |
|
DT, мс / DT, ms |
146,5 [ 143,63;150,86] |
192,7 [ 186,79;199,37] |
0,002
|
|
IVRT, мс / IVRT, ms |
68,8 [ 67,36;70,05] |
105,7 [ 100,57;109,9] |
0,020
|
|
Е/А / Е/А |
1,42 [ 1,38;1,47] (n=42) |
1,43 [ 1,38;1,45] (n=58) |
0,847
|
|
Е/е' / Е/е' |
13,9 [ 10,5;14,2] |
10,4 [ 9,64;11,3] |
0,018
|
Примечание: DT — время замедления скорости потока быстрого наполнения ЛЖ, IVRT — фаза изоволюмического расслабления, Е/А — отношение скоростей раннего и позднего диастолического наполнения ЛЖ через митральный клапан, Е/e′ — отношение максимальных скоростей раннего наполнения трансмитрального кровотока и движения фиброзного кольца митрального клапана.
Note: DT — the time of deceleration of the flow rate of rapid filling of the left ventricle, IVRT — isovolumic relaxation time, Е/А — the ratio of the maximum flow rate in the phase of early LV diastole to the maximum flow rate in the phase of late LV diastole through the mitral valve, Е/e′ — the ratio of the maximum flow velocity through the mitral valve in the phase of early LV diastole to early LV diastolic elongation.
Кроме того, при оценке фазовой скорости движения митрального кольца, которая, как известно, является индикатором диастолического расслабления и растяжимости ЛЖ и выражается в раннем диастолическом удлинении ЛЖ (e′), были также выявлены значимые отличия. Так, у «хрупких» пациентов с АГ и ХСН в сравнении с «крепкими» пациентами с АГ и ХСН регистрировали статистически значимо более низкую скорость движения латерального края кольца митрального клапана (e′) (на 26,1%, р=0,026), а также увеличение соотношения Е/e′ (на 33,7%, р=0,018).
Обсуждение
Как известно, при ХСН миокард претерпевает ряд патогенетических изменений, характеризующихся структурно-функциональным ремоделированием. Компенсаторная активация симпато-адреналовой и ренин-ангиотензин-альдостероновой систем приводит к усилению синтеза коллагена и развитию фиброза, что в дальнейшем сопровождается увеличением жёсткости и уменьшению эластичности миокарда. При прогрессировании процесса стенки миокарда истончаются, полость ЛЖ увеличивается в объёме с последующим изменением его геометрии с эллиптической формы на сферическую, что в итоге приводит к развитию систолической и диастолической дисфункции ЛЖ [13].
Следует учитывать, что у пожилых людей без сердечно-сосудистых заболеваний наблюдаются структурно-функциональные изменения миокарда, которые развиваются в старческом возрасте [14].
В последнее время отмечается рост распространённости ССА среди пациентов с ХСН пожилого и старческого возраста, что приводит к более тяжёлому течению заболевания, усугубляя прогноз [15], что нашло подтверждение и в нашей работе.
Так, «хрупкие» пациенты с ХСН имели статистически значимо более высокий показатель ИОЛП и ИММЛЖ, что привело к формированию в большем проценте случаев КРЛЖ, которое характеризуется высоким периферическим сосудистым сопротивлением и повышенной жёсткостью артерий, что было также выявлено у данной категории пациентов и представлено в ранее опубликованных нами работах [16]. Важно подчеркнуть, что подобные структурные изменения приводят к повышению риска развития неблагоприятных сердечно-сосудистых исходов у пациентов старческого возраста с АГ, ХСН и ССА.
Следует отметить, что, по данным ряда исследований, с одной стороны, ММЛЖ у пожилых людей с возрастом несколько снижается [17][18]. С другой стороны, по мере увеличения сосудистой ригидности увеличивается постнагрузка на миокард с формированием ГЛЖ и, следовательно, увеличением ММЛЖ [19]. Кроме того, с возрастом наблюдается увеличение толщины стенок ЛЖ, с преобладающим развитием концентрического ремоделирования ЛЖ [19]. Сдвиг аорты вправо, а также физиологическое уменьшение длины ЛЖ приводят к изменению его геометрии от эллиптической до сферической формы [20]. Претерпевает возрастные изменения и ЛП с развитием дилатации полости и гипертрофии стенок [21].
Как правило, глобальная систолическая функция миокарда ЛЖ у здоровых людей с возрастом не меняется [22], однако есть данные о нарушениях биомеханики сокращения – изменения «скручивания-раскручивания» [23].
В работе Xi L (2023) продемонстрировано влияние ССА на структуру и функцию миокарда ЛЖ у пациентов с СНсФВ ЛЖ. Так, «хрупкие» пациенты имели повышенный ИММЛЖ, увеличение ОЛП и кондуита ЛП [24]. Результаты нашего исследование также показали, что наличие ССА у пациентов с ХСН приводит к более значимому увеличению показателей ИКСР ЛЖ, ИКДР ЛЖ, ИКДО ЛЖ, ИКСО ЛЖ, а также более низким показателям МО, что отражает увеличение гемодинамической нагрузки, развитие ремоделирования и снижение сократительной способности миокарда ЛЖ. Статистически значимо меньший показатель МО, рассчитанный как произведение УО и ЧСС, у «хрупких» пациентов, по-видимому, может быть объяснён значимо меньшим уровнем ЧСС среди пациентов с АГ, ХСН и ССА в сравнении с таковым показателем у пациентов с АГ и ХСН без ССА. Кроме того, нарушение систолической функции ЛЖ у пациентов с ССА сопровождалось более низким значением показателя ФВ ЛЖ, а также большим процентом пациентов с СНунФВ ЛЖ.
Известно, что на фоне прогрессирования фиброзообразования повышается жёсткость миокарда и снижается его эластичность, что приводит к развитию диастолической дисфункции ЛЖ с возрастом [25]. Установленные различия в оценке показателей диастолической функции ЛЖ в нашей работе: значимое снижение показателей DT, IVRT и e′, а также увеличение соотношения Е/e′ свидетельствуют о более выраженном прогрессировании диастолической дисфункции ЛЖ у «хрупких» пациентов с АГ и ХСН. Подобные результаты были показаны и в работах других исследователей. Так, Kusunose K (2018) и Xi L (2023) продемонстрировали, что у «хрупких» пациентов с СНсФВ ЛЖ развивалась диастолическая дисфункция ЛЖ, которая была значимо связана с увеличением риска развития сердечно-сосудистых катастроф [24][26].
Заключение
Таким образом, в исследовании было показано, что ССА у пациентов с АГ и ХСН в возрасте 80 лет и старше оказывает дополнительное влияние на структурно-функциональные параметры сердца, что характеризуется более выраженными нарушениями систолической и диастолической функций ЛЖ, способствующими прогрессированию ХСН.
Список литературы
1. Драпкина О.М., Концевая А.В., Калинина А.М., Авдеев С.Н., Агальцов М.В., и др. Коморбидность пациентов с хроническими неинфекционными заболеваниями в практике врача-терапевта. Евразийское руководство. Кардиоваскулярная терапия и профилактика. 2024;23(3):3996. https://doi.org/10.15829/1728-8800-2024-3996. EDN: AVZLPJ
2. Barnett K, Mercer SW, Norbury M, Watt G, Wyke S, Guthrie B. Epidemiology of multimorbidity and implications for health care, research, and medical education: a cross-sectional study. Lancet. 2012;380(9836):37-43. https://doi.org/10.1016/S0140-6736(12)60240-2
3. Фомин И.В. Артериальная гипертония в Российской Федерации — последние 10 лет. Что дальше? Сердце. 2007;6(3):1-6.
4. Ситникова М.Ю., Юрченко А.В., Лясникова Е.А., Трукшина М.А., Либис Р.А., и др. Результаты Российского госпитального регистра хронической сердечной недостаточности в 3 субъектах Российской Федерации. Кардиология. 2015;55(10):5-13. eLIBRARY ID: 24872760 EDN: UYHOGD
5. Поляков Д.С., Фомин И.В., Беленков Ю.Н., Мареев В.Ю., Агеев Ф.Т., и др. Хроническая сердечная недостаточность в Российской Федерации: что изменилось за 20 лет наблюдения? Результаты исследования ЭПОХА-ХСН. Кардиология. 2021;61(4):4-14. https://doi.org/10.18087/cardio.2021.4.n1628
6. Давыдов Е.Л., Тихонова Н.В., Глушанко В.С., Шульмин А.В., Захарова А.С. Синдром старческой астении: особенности диагностики, лечения и реабилитации. Сибирское медицинское обозрение. 2020;5:40-48. https://doi.org/10.20333/2500136-2020-5-40-48
7. Хазова E.В., Сметанина Е.Д., Малкова М.И. Синдром старческой астении у пациентов с сердечно-сосудистыми заболеваниями: вопросы эпидемиологии, диагностики, прогноза. Медицинский альманах. 2023;3(76):98-106. eLIBRARY ID: 54678736 EDN: YELHVQ
8. Ткачева О.Н., Котовская Ю.В., Рунихина Н.К., Фролова Е.В., Мильто А.С., и др. Комплексная гериатрическая оценка у пациентов пожилого и старческого возраста с сердечно-сосудистыми заболеваниями. Экспертное мнение Российской Ассоциации Геронтологов и Гериатров. Кардиология. 2021;61(5):71-78. https://doi.org/10.18087/cardio.2021.5.n1349
9. Ткачева О.Н., Котовская Ю.В., Рунихина Н.К., Фролова Е.В., Наумов А.В., и др. Клинические рекомендации «Старческая астения». Российский журнал гериатрической медицины. 2025;1(21):6-48. https://doi.org/10.37586/2686-8636-1-2025-6-48
10. Кобалава Ж.Д., Конради А.О., Недогода С.В., Шляхто Е.В., Арутюнов Г.П., и др. Артериальная гипертензия у взрослых. Клинические рекомендации 2024. Российский кардиологический журнал. 2024;29(9):6117 https://doi.org/10.15829/1560-4071-2024-6117 . EDN GUEWLU
11. Галявич А.С., Терещенко С.Н., Ускач Т.М., Агеев Ф.Т., Аронов Д.М., и др. Хроническая сердечная недостаточность. Клинические рекомендации 2024. Российский кардиологический журнал. 2024;29(11):6162. https://doi.org/10.15829/1560-4071-2024-6162. EDN: WKIDLJ
12. Маслова А.П., Либис Р.А. Диастолическая дисфункция левого желудочка при сочетании ХСН и постоянной формы фибрилляции предсердий. Журнал Сердечная Недостаточность. 2012;13(4):205-208. eLIBRARY ID: 18379397 EDN: PMFCOV
13. Pfeffer JM, Pfeffer MA, Braunwald E. Influence of chronic captopril therapy on the infarcted left ventricle of the rat. Circ Res. 1985;57(1):84-95. https://doi.org/10.1161/01.res.57.1.84
14. Lakatta EG, Levy D. Arterial and cardiac aging: major shareholders in cardiovascular disease enterprises: Part I: aging arteries: a "set up" for vascular disease. Circulation. 2003;107(1):139-146. https://doi.org/10.1161/01.cir.0000048892.83521.58
15. Подобед И.В., Прощаев К.И., Ахмедов Т.А., Рукавишников А.С., Коваленко О.Ю. Гериатричекие аспекты течения хронической сердечной недостаточности. Современные проблемы здравоохранения и медицинской статистики. 2021;(1):303-325. eLIBRARY ID: 46327505 EDN: FQAAHB
16. Сафроненко В.А., Чесникова А.И. Особенности центрального аортального давления у пациентов с артериальной гипертензией в возрасте 80 лет и старше с учётом наличия хронической сердечной недостаточности и синдрома старческой астении. Медицинский вестник Юга России. 2025;16(1):28-38. https://doi.org/10.21886/2219-8075-2025-16-1-28-38
17. Khouri MG, Maurer MS, El-Khoury Rumbarger L. Assessment of age-related changes in left ventricular structure and function by freehand three-dimensional echocardiography. Am J Geriatr Cardiol. 2005;14(3):118-125. https://doi.org/10.1111/j.1076-7460.2005.03845.x
18. Nikitin NP, Loh PH, de Silva R, Witte KK, Lukaschuk EI, et al. Left ventricular morphology, global and longitudinal function in normal older individuals: a cardiac magnetic resonance study. Int J Cardiol. 2006;108(1):76-83. https://doi.org/10.1016/j.ijcard.2005.04.009
19. Ganau A, Saba PS, Roman MJ, de Simone G, Realdi G, Devereux RB. Ageing induces left ventricular concentric remodelling in normotensive subjects. J Hypertens. 1995;13(12 Pt 2):1818-1822. PMID: 8903659.
20. Hees PS, Fleg JL, Lakatta EG, Shapiro EP. Left ventricular remodeling with age in normal men versus women: novel insights using three-dimensional magnetic resonance imaging. Am J Cardiol. 2002;90(11):1231-1236. https://doi.org/10.1016/s0002-9149(02)02840-0
21. Lakatta EG. Arterial and cardiac aging: major shareholders in cardiovascular disease enterprises: Part III: cellular and molecular clues to heart and arterial aging. Circulation. 2003;107(3):490-497. https://doi.org/10.1161/01.cir.0000048894.99865.02
22. Younis LT, Melin JA, Robert AR, Detry JM. Influence of age and sex on left ventricular volumes and ejection fraction during upright exercise in normal subjects. Eur Heart J. 1990;11(10):916-924. https://doi.org/10.1093/oxfordjournals.eurheartj.a059613
23. Takeuchi M, Nakai H, Kokumai M, Nishikage T, Otani S, Lang RM. Age-related changes in left ventricular twist assessed by two-dimensional speckle-tracking imaging. J Am Soc Echocardiogr. 2006;19(9):1077-1084. https://doi.org/10.1016/j.echo.2006.04.011
24. Xi L, Xuemei Z, Ling Y, Changchun C, Zhuo H, et al. Correlation between frailty and cardiac structure and function in echocardiography in elderly patients with normal ejection fraction. Aging Clin Exp Res. 2023;35(4):775-784. https://doi.org/10.1007/s40520-023-02363-5
25. Burlew BS. Diastolic dysfunction in the elderly--the interstitial issue. Am J Geriatr Cardiol. 2004;13(1):29-38. https://doi.org/10.1111/j.1076-7460.2004.00059.x
26. Kusunose K, Okushi Y, Yamada H, Nishio S, Torii Y, et al. Prognostic Value of Frailty and Diastolic Dysfunction in Elderly Patients. Circ J. 2018;82(8):2103-2110. https://doi.org/10.1253/circj.CJ-18-0017
Об авторах
В. А. СафроненкоРоссия
Виктория Александровна Сафроненко, к.м.н., доцент кафедры внутренних болезней № 1
Ростов-на-Дону
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
А. И. Чесникова
Россия
Анна Ивановна Чесникова, д.м.н., профессор, заведующая кафедрой внутренних болезней № 1
Ростов-на-Дону
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
А. В. Сафроненко
Россия
Андрей Владимирович Сафроненко, д.м.н., профессор, заведующий кафедрой фармакологии и клинической фармакологии
Ростов-на-Дону
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Рецензия
Для цитирования:
Сафроненко В.А., Чесникова А.И., Сафроненко А.В. Особенности структурно-функционального ремоделирования сердца у пациентов с хронической сердечной недостаточностью и синдромом старческой астении. Медицинский вестник Юга России. 2025;16(2):83-91. https://doi.org/10.21886/2219-8075-2025-16-2-83-91
For citation:
Safronenko V.A., Chesnikova A.I., Safronenko A.V. Features of structural and functional remodeling of the heart in patients with chronic heart failure and senile asthenia syndrome. Medical Herald of the South of Russia. 2025;16(2):83-91. (In Russ.) https://doi.org/10.21886/2219-8075-2025-16-2-83-91






































