Перейти к:
Рецидив первичного склерозирующего холангита в трансплантате
https://doi.org/10.21886/2219-8075-2024-15-3-97-105
Аннотация
Первичный склерозирующий холангит (ПСХ) — заболевание, характеризующиеся воспалением, фиброзом и облитерацией как внутри-, так и внепечёночных желчевыводящих протоков, сопровождающееся холестазом, с дальнейшим исходом в билиарный цирроз печени, холангиокарциному. Патогенез заболевания плохо изучен, но, по данным различных источников, в нем участвуют генетические факторы, механизмы врождённого и адаптивного иммунитета, токсическое воздействие гидрофобных желчных кислот и, возможно, дисбиоз кишечника. Тесная связь с воспалительными заболеваниями кишечника связана со значительно повышенным риском развития колоректального рака, который наряду с холангиокарциномой представляет собой наиболее серьёзную диагностическую проблему при долгосрочном лечении ПСХ. Диагноз «ПСХ» устанавливают на основании выявления типичных холангиографических поражений желчных протоков и исключения вторичных причин склерозирующего холангита. Сложная патофизиология, гетерогенность клинических особенностей и редкая природа заболевания обусловили отсутствие эффективной терапии на сегодняшний день, алгоритмы лечения отсутствуют, но может быть назначен курс урсодезоксихолевой кислоты в дозах 17–23 мг/кг/день на срок до года с целью наблюдения за динамикой снижения уровня щелочной фосфатазы в сыворотке. Ряд препаратов находится на стадии исследования, в том числе агонисты FXR (фарнезоидных Х-рецепторов) с желчегонными и противомикробными свойствами. Клинически значимые стенозы можно успешно лечить с помощью интервенционной эндоскопии, но трансплантация печени (ТП) в настоящее время является единственным радикальным методом лечения, имея высокий показатель выживаемости. У 20–25% пациентов, по разным литературным данным, развивается рецидив заболевания в трансплантате. Наш клинический случай возврата ПСХ у пациента через 5 лет после ортотопической ТП даёт обзор варианта ведения больного с практической, ориентированной на пациента точки зрения.
Ключевые слова
Для цитирования:
Пак Е.С., Петрова Т.М., Коробка Р.В., Ушаков А.А., Кучеренко О.Б., Коцияев В.Ю., Бухтин О.В. Рецидив первичного склерозирующего холангита в трансплантате. Медицинский вестник Юга России. 2024;15(3):97-105. https://doi.org/10.21886/2219-8075-2024-15-3-97-105
For citation:
Pak E.S., Petrova T.M., Korobka R.V., Ushakov A.A., Kucherenko O.B., Katsiyaev V.Yu., Bukhtin O.V. Recurrence of primary sclerosing cholangitis in the graft. Medical Herald of the South of Russia. 2024;15(3):97-105. (In Russ.) https://doi.org/10.21886/2219-8075-2024-15-3-97-105
Введение
Заболеваемость первичным склерозирующим холангитом (ПСХ) составляет от 16 на 100 000 человек, соотношение мужчин и женщин — 2:1, средний возраст больных — 25–40 лет [1–3]. В патогенезе ПСХ участвуют генетические факторы (выявлено 9 локусов, связанных с развитием ПСХ), активированные лимфоциты при воспалительных заболевания кишечника (ВЗК), повышенная проницаемость слизистой кишечника, снижение образования вторичных желчных кислот, нарушения микробиома кишечника [3]. Наиболее частые симптомы — кожный зуд, повышение температуры тела, пожелтение кожных покровов, снижение массы тела. Лабораторно при ПСХ наблюдается повышение уровня щелочной фосфатазы (ЩФ), гамма-глютамилтранспептидазы (ГГТП), гипербилирубинемия и умеренное повышение аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ) [1]. Специфичных для ПСХ антител нет. [4]. При диагностике ПСХ необходимо исключить причины, которые могут приводить к вторичному склерозированию желчных протоков (ЖП) (последствия хирургических вмешательств, токсические, инфекционные и другие факторы).
Методы диагностики ПСХ:
1) Экспертное чрескожное ультразвуковое исследование (УЗИ) позволяет установить локализацию блока ЖП, что определяет выбор дальнейших методов обследования больных для установления причины механической желтухи. УЗИ является доступным, безопасным и высокоинформативным методом оценки уровня билиарного блока. К его недостаткам относится субъективность результатов, которые зависят от опыта оператора, класса аппаратуры и подготовки больного. [5].
2) Магнитно-резонансная холангиография (МР ХГ) является основным методом диагностики ПСХ, имеет диагностическую ценность, сопоставимую с ретроградной холангиопанкреатографией (ЭРХПГ), при этом является более безопасным методом диагностики ПСХ. При МР ХГ визуализируются стриктуры желчевыводящих путей, чередующиеся с нормальными или расширенными протоками («бусы») [1][6][7]. В мировых рекомендациях предпочтение отдается результатам МР ХГ [5].
3) ЭРХПГ применяется при невозможности проведения МР ХГ из-за противопоказаний, для уточнения диагноза при сомнительных результатах МР-ХГ или в лечебных целях, для расширения суженных ЖП и постановки стентов. [1][7].
4) Спиральная компьютерная томография брюшной полости с контрастированием не является основным методом диагностики ПСХ, но используется для дифференциальной диагностики с опухолевым поражением ЖП. [1]
5) Гистологическое исследование применяется при подозрении на ПСХ с поражением мелких внутрипечёночных желчевыводящих протоков, а также для выявления аутоиммунного гепатита (overlap-синдром). Для ПСХ характерны перидуктальный фиброз («луковичная шелуха»), облитерация ЖП. [1].
Возможные осложнения ПСХ — образование желчных камней в желчевыводящих протоках, бактериальный холангит, абсцесс печени, билиарный цирроз печени, холангиокарцинома, стриктуры ЖП.
В 60–80% случаев ПСХ сочетается с воспалительными заболеваниями кишечника (ВЗК): 80% — с неспецифическим язвенным колитом (ЯК), 10% — с болезнью Крона, 10% — с недифференцированным колитом [2][8]. Дебют ПСХ происходит в среднем через 10 лет после дебюта ВЗК. [3] При ВЗК, протекающих на фоне ПСХ, наиболее характерно тотальное поражение толстой кишки со слабо выраженной клиникой [2][3]. Необходим регулярный контроль биохимических показателей у больных с ВЗК, при повышении уровня ЩФ и ГГТП нужно провести дообследование для подтверждения или исключения ПСХ. У пациентов с ПСХ возможно бессимптомное или малосимптомное течение ВЗК, поэтому таким больным следует выполнять фиброколоноскопию (ФКС) с полифокальной биопсией. У пациентов с ПСХ и ВЗК повышен риск развития злокачественных новообразований толстой кишки и холангиокарциномы [7][9].
В терапии ПСХ применяются препараты урсодезоксихолевой кислоты (УДХК) с целью нормализации биохимических показателей крови [7], но УДХК не влияет на течение самого заболевания [1][10][11]. Азатиоприн и глюкокортикостероиды также не оказывают влияния на течение ПСХ, но могут применяться при сочетании ПСХ с аутоиммунным гепатитом. [12]. Потенциальной эффективностью при лечении ПСХ обладает обетихолевая кислота, однако на данный момент она не зарегистрирована в Российской Федерации. [12][13] Также при лечении ПСХ могут использоваться холестирамин (препарат 1 очереди), рифампицин (2 очереди), налтрексон (3 очереди), сертралин (4 очереди) для купирования кожного зуда [12][13], антибактериальная терапия — при развитии бактериального холангита [12], заместительная ферментная терапия (ЗФТ) — при дефиците жирорастворимых витаминов. Эффективность ЗФТ оценивается по нормализации витаминного статуса, прибавлению массы тела, улучшению клинических показателей [14].
Единственным методом радикального лечения ПСХ является трансплантация печени (ТП), [1][4][16], причём ТП обеспечивает высокую курабельность необратимых заболеваний печени (в том числе ПСХ). [16] Выживаемость через 1 год после ТП — 90%, через 5 лет — 70%. [1][4][12], что сопоставимо с общими показателями выживаемости после ТП (80–90%). [17]
В 20–25% случаев через 5–10 лет происходит рецидив ПСХ в трансплантате, который необходимо дифференцировать с ишемической холангиопатией, рубцовыми стриктурами анастомоза и хроническим отторжением трансплантата [2][4][19][20].
Существуют критерии Мейо, по которым можно диагностировать рецидив ПСХ: подтверждённый диагноз ПСХ до трансплантации печени; стриктуры внутри- и внепечёночных желчных протоков на холангиограммах, возникшие позднее, чем 90 дней после трансплантации; фиброзный холангит, облитерирующее поражение протоков с дуктопенией или без неё, цирроз по результатам гистологического исследования биоптата трансплантата; отсутствие тромбоза или стеноза печёночной артерии, дуктопенического отторжения, стриктур анастомоза желчевыводящих путей или стриктур, возникших менее чем через 90 дней после ТП, несовместимости донора и реципиента. [18–21]
Также стоит отметить, что риск рецидива ПСХ выше при возникновении ВЗК de novo, развитии острого клеточного отторжения в анамнезе, а также при наличии у донора аллели HLA-DRB1*07. [20]. Также стоит отметить, что ЦМВ-инфекция и использование антилимфоцитарных антител для лечения отторжения трансплантата повышают риск возврата ПСХ.
Рецидив ПСХ повышает риски потери трансплантата и уменьшает выживаемость пациентов. [21] Эффективной профилактики рецидива ПСХ не существует. Есть источники, в которых предлагается выполнение колэктомии у пациентов с ПСХ и ВЗК перед проведением ТП для снижения рисков рецидива ПСХ [3][10][18].
Клинический случай
Пациент Г. в апреле 2006 г. впервые отметил жалобы на боли в животе, тошноту, ознобы, жидкий стул в течение 2 недель, по поводу которых обратился в хирургическое отделение по месту жительства, где был поставлен предварительный диагноз — «Острый панкреатит, острая кишечная инфекция». Проведённая терапия не дала значимого положительного эффекта, в связи с чем пациент был переведён в инфекционное отделение ЦГБ им. Семашко, г. Ростов-на-Дону. Бактериологическое исследование кала на кишечную группу отрицательно. Серологическое исследование крови на йерсиниоз – реакция отрицательная. ОАК: Hb — 122 г/л, эритроциты — 4,4*10^12, лейкоциты — 9,9*10^9, СОЭ — 8 мм/ч. Диастаза в моче — 64 ед. Проведённое лечение: ферментные препараты, УДХК. Поставлен диагноз «Синдром раздражённого кишечника», рекомендовано проведение фиброколоноскопии, по результатам которой верифицирован ЯК, тотальное поражение толстой кишки. Назначена следующая терапия: преднизолон, 5-аминосалициловая кислота (сульфасалазин), омепразол, фосфолипиды, пробиотики, метронидазол, дротаверин, с положительной динамикой.
В октябре 2006 г. пациент обратился на консультацию к гастроэнтерологу ГАУ РО ОКДЦ с жалобами на периодические боли в правом подреберье, вздутие живота, урчание, метеоризм, кровь в стуле не отмечал. Назначено дообследование для исключения ПСХ, по результатам дообследования диагноз не подтверждён. В дальнейшем в течение 9 лет отмечал ремиссию.
В октябре 2015 г. пациент обратился в ГАУ РО ОКДЦ с жалобами на учащённый стул до 9 р/день без примесей, болезненные позывы к дефекации, кожный зуд. БАК от 15.10.15: общий билирубин — 53,6 мкмоль/л, прямой билирубин — 43,2 мкмоль/л, АСТ — 203 ЕД/л, АЛТ — 309 ЕД/л, ЩФ — 1290 ЕД/л, ГГТ — 639 ЕД/л. ФКС: язвенный колит умеренной степени активности, долихосигма. МР ХГ: Левый печёночный проток с неравномерным диаметром, локально расширен до 7,2 мм. Правый — 3,7 мм. Средняя треть холедоха неравномерно сужена за счёт множественных кольцевидных стриктур диаметром до 2,5 мм, с неравномерным супра- и постстенотическим расширением до 7,5 мм. Отмечается также неравномерность просвета общего печёночного протока с небольшими стенотическими сужениями, чередующимися с участками нормального протока. Заключение: изменения внепечёночных и левого печёночного протоков могут соответствовать холангиту. Заключительный диагноз: язвенный колит, рецидивирующее течение, тотальное поражение. ПСХ. Проводимое лечение: 5-аминосалициловая кислота (сульфасалазин) — 3 г в сутки, азатиоприн — 100 мг, преднизолон — 30 мг, УДХК — 1000 мг в сутки. БАК от 24.10.15: общий билирубин — 20,2 мкмоль/л, прямой билирубин — 8,9 мкмоль/л, АСТ — 51 ЕД/л, АЛТ — 150 ЕД/л, ЩФ — 683 ЕД/л, ГГТ — 276 ЕД/л. Выписан с положительной динамикой под наблюдение врача по м/ж.
В октябре 2017 г. при проведении непрямой эластометрии печени выявлены признаки фиброза F4 по шкале Metavir.
В феврале 2018 г. обратился к гастроэнтерологу ГБУ РО РОКБ с жалобами на кожный зуд, потемнение кожных покровов. На момент осмотра получал сульфасалазин — 2 г/сутки, азатиоприн — 150 мг, преднизолон — 30 мг в сутки, урсосан — 1500 мг в сутки. Назначено дообследование для определения показаний к ТП. СКТ ОБП: признаки склерозирующего холангита, гепатомегалии (179 мм) (рис.1). СА-19.9: 184 Ед/мл. В феврале 2018 г. внесён в лист ожидания ТП.
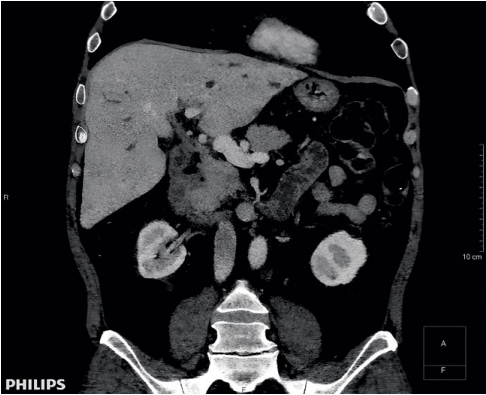
Рисунок 1. Компьютерная томограмма органов брюшной полости (февраль 2018г.)
Figure 1. Computed tomography of abdominal organs (February 2018)
В апреле 2018 г. в связи с ухудшением состояния госпитализирован в ГАУ РО ОКДЦ, отмечалось периодическое повышение температуры до фебрильных цифр. По результатам посевов крови на стерильность выявлен рост S. pneumoniae, назначено лечение: цефтриаксон 2,0 + 0,9% р-р NaCl 100,0 в/в капельно 2 р./день, метронидазол 5 мг/мл 100,0 в/в капельно 2 р./день, ципрофлоксацин 2 мг/мл 100,0 в/в капельно 2 р./день, сульфасалазин 500 мг внутрь 3 р./сутки, флуконазол 50 мг 1 таб. внутрь 1 р./день, адеметионин 1200 мг + 0,9% р-р NaCl 200,0 в/в капельно 1 р./день, меглюмина натрия сукцинат 400,0 в/в капельно 1 р./день.
В июне 2018 г. произведена ортотопическая трансплантация трупной печени по поводу цирроза печени в исходе ПСХ. Гистологическое исследование печени: склерозирующий холангит в стадии обострения, холангиолит, хронический холестатический гепатит с исходом в мелкоузловой цирроз, гнойный перихолецистит, хронический холецистит (рис.2, 3).
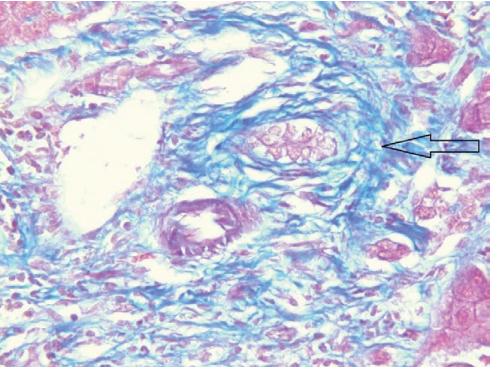
Рисунок 2. Удалённая печень, окраска по Массону, мелкий желчный проток с перидуктальным фиброзом (увеличение ×400)
Figure 2. Removed liver, Masson staining, small bile duct with periductal fibrosis (×400 magnification)
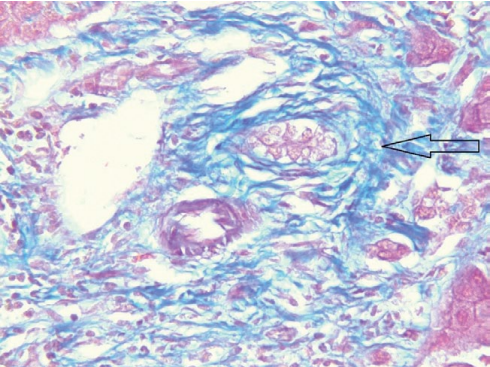
Рисунок 3. Удалённая печень, окраска гематоксилин и эозин, мелкий желчный проток (увеличение ×400)
Figure 3. Removed liver, hematoxylin and eosin staining, small bile duct (×400 magnification)
После трансплантации назначены следующие препараты: такролимус — 9 мг/сутки, метилпреднизолон — 16 мг/сутки, нистатин — 1 табл. 4 р./день, сульфаметоксазол + триметоприм — 120 мг*4 р./сутки, валганцикловир — 900 мг/сутки, 5-аминосалициловая кислота (сульфасалазин) — 3 г/сутки, ацетилсалициловая кислота — 100 мг. Через 2 месяца после ТП — ЦМФ-инфекция, получен ответ на фоне приёма валганцикловира. Концентрация такролимуса — 6,7 нг/мл.
В декабре 2018 г. был госпитализирован в гастроэнтерологическое отделение (ГЭО) ГБУ РО РОКБ с жалобами на кашицеобразный стул, дискомфорт в левом подреберье, субфебрилитет, появление кольцевидной эритемы. ОАК: Hb — 114 г/л, эритроцциты — 3,64*10^12, лейкоциты — 6,1*10^9, тромбоциты — 254*10^9. БАК: общий билирубин — 12,3 мкмоль/л, прямой билирубин — 2,5 мкмоль/л, АЛТ — 45 ед./л, АСТ — 17 ед./л, ЩФ — 73 ед./л, ГГТ — 124 ед./л, общий белок — 64 г/л, мочевина — 8,5 ммоль/л, креатинин — 114,2 мкмоль/л. Коагулограмма: АЧТВ — 32,1 сек., МНО — 1,0, ПТИ — 102,8%. Концентрация такролимуса — 6,1 нг/мл, контрольный анализ через 7 дней — 9,6 нг/мг. IgM к капсидному антигену вируса Эпштейн-Барр (ВЭБ) выявлены. МРТ ОБП с болюсным усилением: Состояние после ТП. Трансплантат печени расположен обычно, контуры чёткие, ровные, размеры: краниокаудальный 177 мм. Структура паренхимы печени однородная. Воротная вена до анастомоза диаметром 16 мм, на уровне анастомоза — 14 мм и после анастомоза — 16 мм. Селезёночная артерия диаметром 10 мм, верхнебрыжеечная вена 13 мм. Печёночная артерия средним диаметром 6 мм на всём протяжении. Внтурипечёночные желчные протоки и холедох не расширены. К воротам печени подведена двенадцатиперстная кишка, в области холедоходуоденоанастомоза без видимых патологических изменений. Поставлен следующий диагноз «Дисфункция трансплантата печени». Состояние после ортотопической ТП от трупного донора по поводу цирроза печени в исходе ПСХ высокой степени активности, стероидозависимого, F4 по шкале Metavir, MELD 19. Осложнения: хроническая инфекция ВЭБ, реактивация. Синдром холестаза высокой степени активности, рецидивирующий холангит. Проведённое лечение: такролимус 9 мг внутрь, метилпреднизолон 4 мг внутрь, валганцикловир 900 мг внутрь, УДХК 250 мг по 2 капсулы внутрь 3 р./день, микросферированные ферменты 25000 ЕД внутрь 3 р./день, ацетилсалициловая кислота 100 мг внутрь, 5-аминосалициловая кислота (сульфасалазин) 500 мг внутрь 3 р/день, метронидазол 100,0 в/в капельно, ципрофлоксацин 100,0 в/в капельно. Выписан с улучшением, даны рекомендации.
В феврале 2020 г. повторно госпитализирован в ГЭО ГБУ РО РОКБ с жалобами на кашицеобразный стул, дискомфорт в правом и левом подреберье, подъём температуры до субфебрильных цифр. ОАК: Hb — 128 г/л, эритроциты — 4,05*10^12, лейкоциты — 10,5*10^9, тромбоциты — 235*10^9. БАК: общий билирубин — 18,5 мкмоль/л, прямой билирубин — 3,9 мкмоль/л, АЛТ — 95 ед./л, АСТ — 42 ед./л, общий белок — 64 г/л, мочевина — 10,7 ммоль/л, креатинин — 131,5 мкмоль/л, ГГТ — 421 ед./л, ЩФ — 73 ед./л. Коагулограмма: АЧТВ — 27,8 сек., МНО — 0,9, ПТИ — 114%. Концетрация такролимуса — 6,6 ед./мл. МРТ ОБП: расширение внутрипечёночных ЖП, в месте анастомоза холедох неравномерно сужен до 2 мм. В ходе лечения произошло уменьшение симптоматики, снижение уровней печёночных ферментов (АЛТ 23 ед/л, АСТ 16 ед/л, ГГТ 146 ед/л, ЩФ 33 ед/л). Поставлен диагноз: стриктура терминального отдела холедоха, рецидивирующий холангит. Пациент переведён в хирургическое отделение, где выполнено ЭРХПГ: внутрипечёночные протоки до 7 мм, гомогенны. Холедох 8–9 мм, извит, на границе средней и дистальной трети конически сужен до 1,5 мм на протяжении 5 мм; на границе общего печёночного протока и средней трети конически сужен до 1,5 мм на протяжении 5 мм. Произведена эндоскопическая ретроградная папиллосфинктеротомия, баллонная дилатация холедоха. На контрольном МРТ ОБП от 11.06.2020 г.: расширение внутрипечёночных желчных протоков до 4–5 мм, в просвете общего печёночного протока дефекты наполнения (воздух?), холедох диаметром до 8 мм, в месте анастомоза холедох неравномерно сужен до 2 мм.
В марте 2021 г. госпитализирован в отделение эндовидеохирургии РОКБ в связи ухудшением состояния после перенесённой коронавирусной инфекции. Биохимический анализ крови: общий билирубин — 106,7 мкмоль/л, прямой билирубин — 60,8 мкмоль/л, АЛТ — 137 ед./л, АСТ — 187 ед./л, ГГТ — 256 ед./л, ЩФ — 170 ед./л. ЭРХПГ: на границе средней и верхней трети холедоха определяется непротяжённое сужение до 2 мм, выполнено балонное бужирование стеноза, на контрольной холангиограмме сужения нет. Контрольный биохимический анализ крови: общий билирубин — 13,9 мкмоль/л, прямой билирубин — 3,9 мкмоль/л, АЛТ — 23 ед./л, АСТ — 12 ед./л, ГГТ — 87 ед./л, ЩФ — 72 ед./л.
МРТ ОБП от 11.10.2021 г.: признаки желчной гипертензии, блок на уровне ворот печени и нижней трети холедоха, признаки кисты правой доли трансплантата. МР ХГ от 12.09.2022 г.: неравномерное расширение внутрипечёночных ЖП, больше в левой доле (до 6,8 мм), долевые протоки диаметром 3 мм, общий печёночный проток диаметром до 4 мм, холедох диаметром до 5,3 мм, в нижней трети холедох неравномерно сужен до 2 мм, МР-сигналы от просвета неравномерные. Стенки общего печёночного протока и холедоха утолщены, внутренний контур неравномерный. Антитела к печени от 21.10.2022 г.: ANA, AMA 2, АТ к gp 210, sp 100, SLA/LP, LKM-1, LC-1 не обнаружены.
04.05.2023 г. выполнена биопсия печени, получено заключение: в доставленных трепан-биоптатах печени отмечаются 8 портальных трактов, 3 из них с фиброзом F1 и лимфоцитарной инфильтрацией с формированием крупных скоплений, плазматические клетки и сегментоядерные лейкоциты отсутствуют, желчных протоков в триадах по 3–5, мелкие, часть с облитерированным просветом, остальные 5 портальных трактов относительно сохранны, с умеренным отёком и очаговой лимфоцитарной инфильтрацией. Гепатоциты с выраженной зернистой дистрофией, а также внутриклеточным холестазом, центральные вены с отёком стенки, в окружающей паренхиме некробиотические изменения гепатоцитов зоны 3, синусоиды отёчны с редкими лимфоидными элементами и эритроцитами. Заключение: признаков клеточного и гуморального отторжения не выявлено 0R, AMR0. Морфологическая картина более характерна для рецидива склерозирующего холангита в трансплантате, также выявлены признаки умеренной ишемии трансплантата. (рис. 4, 5).
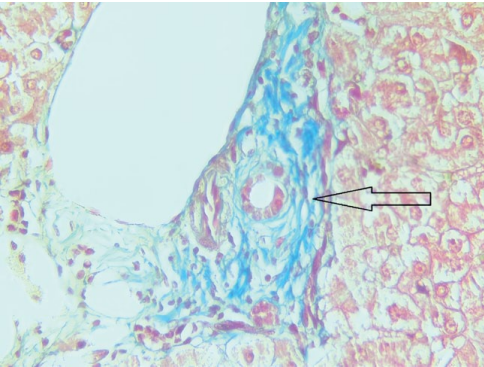
Рисунок 4. Биоптат трансплантата печени, окраска по Массону, мелкий желчный проток с перидуктальным фиброзом (увеличение ×400)
Figure 4. Liver transplant biopsy, Masson staining, small bile duct with periductal fibrosis (×400 magnification)
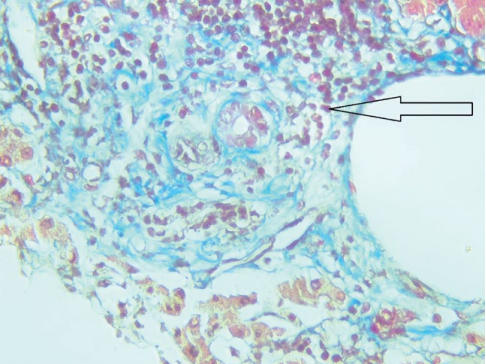
Рисунок 5. Биоптат трансплантата печени, окраска по Массону, портальный тракт с лимфоидной инфильтрацией и перидуктальным фиброзом (увеличение ×400)
Figure 5. Liver transplant biopsy, Masson staining, portal tract with lymphoid infiltration and periductal fibrosis (×400 magnification)
СКТ ОБП с в/в контрастированием от 03.08.2023 г.: внутрипечёночные желчные протоки справа не расширены (до 2 мм), левой доли долевой и сегментарные протоки диаметром до 3–4 мм, общий печёночный проток диаметром до 4 мм, холедох диаметром до 7 мм. На уровне большого дуоденального сосочка дивертикул размерами 8,5*12,5*18 мм, в просвете жидкое содержимое и воздух с горизонтальным уровнем.
МР ХГ от 11.09.2023 г.: расширение внутрипечёночных ЖП до 6 мм, правый долевой проток — 4,4 мм, левый долевой проток — 3,8 мм, общий печёночный проток диаметром до 6 мм, холедох определяется на всём протяжении неравномерным диаметром до 3–5 мм, внутренний контур неравномерный в области анастомоза (рис.6).
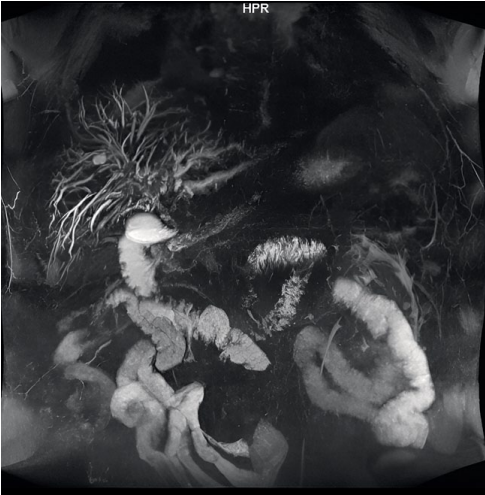
Рисунок 6. Магниторезонансная холангиография от 11.09.2023 г.
Figure 6. Magnetic resonance cholangiography from 09/11/2023
ФКС от 30.11.2023г.: баугиниева заслонка губовидной формы, смыкается плотно. Просвет кишки обычной формы. Стенки кишки эластичные. Тонус сегментарно снижен. Перистальтика вялая. Складки выражены соответственно отделам кишки. Слизистая очагово гиперемирована, чистая, сосудистый рисунок обычный. Язв, новообразований не выявлено. Заключение: хронический катаральный колит.
Выявлены антитела к HLA: А*11,25,26,43,66; В*15, DQA1*01; DQB1*05,06.
Иммуноглобулины: иммуноглобулин G — 21,3 г/л, иммуноглобулин M — 2,4 г/л, иммуноглобулин A — 1,1 г/л.
По результатам дообследования поставлен диагноз «Рецидив первичного склерозирующего холангита в трансплантате (de novo)», пациент внесён в лист ожидания ретрансплантации печени. В настоящее время пациент принимает следующую терапию: такролимус — 2,5 мг в сутки, метилпреднизолон — 8 мг в сутки, УДХК — 500 мг 3 р/день, ацетилсалициловая кислота — 100 мг в сутки, 5-аминосалициловая кислота (сульфасалазин) — 500 мг 2 р./день, рабепразол — 20 мг, микросферированные ферменты — 25000 ЕД 3 р./сутки.
Заключение
Рецидив ПСХ в трансплантате (de novo) остаётся актуальной проблемой трансплантологии и зачастую приводит к потере трансплантированного органа. Отсутствие доказанных способов профилактики данного состояния требует постоянного лабораторного и инструментального мониторинга пациентов с ПСХ после выполнения ОТП. При выявлении данного вида поражения трансплантата усугубляет ситуацию прогрессивное течение заболевание, зачастую неэффективность проводимой консервативной терапии, необходимость хирургического вмешательства у пациентов, находящихся на иммуносупрессивной терапии. Между тем частота ассоциации ПСХ с ВЗК, в частности с ЯК, заставляет проявлять бдительность врачей, наблюдающих за пациентами для возможной профилактики хирургических осложнений, характерных для данной группы заболеваний. ЦМВ инфекция — ещё один фактор риска развития рецидива ПСХ в трансплантате печени, которой обязательно своевременно выявлять и профилактировать. В предоставленном клиническом случае у пациента Г. можно отметить факторы, предрасполагающие к развитию рецидива ПСХ в трансплантате печени: мужской пол и средний возраст, сочетанное течение ПСХ с язвенным колитом, ЦМВ инфекция в раннем послеоперационном периоде. Несмотря на все возможные попытки предотвратить развитие данного состояния (иммуносупрессивную терапию, постоянный приём препаратов УДХК, контроль течения язвенного колита, лечение ЦМВ в короткие сроки) и постоянное диспансерное наблюдение произошел возврат ПСХ, отмечается прогрессирование заболевания, требующее ретрансплантацию печени, в связи с чем пациент поставлен в ЛО ТП.
Список литературы
1. Винницкая Е.В., Абдулхаков С.Р., Абдурахманов Д.Т., Алиханов Р.Б., Бакулин И.Г., и др. Актуальные вопросы диагностики и лечения первичного склерозирующего холангита (по материалам Российского Консенсуса по диагностике и лечению первичного склерозирующего холангита. Москва, 2018 г.). Терапевтический архив. 2019;91(2):9-15. https://doi.org/10.26442/00403660.2019.02.000075
2. Байкова О.А., Николаева Н.Н., Грищенко Е.Г., Николаева Л.В., Саламатова М.М., Макаркин А.А. Клинический случай сочетанного течения первичного склерозирующего холангита и болезни Крона. Медикофармацевтический журнал «Пульс». 2020;22(4):13-21. https://doi.org/10.26787/nydha-2686-6838-2020-22-4-13-21
3. Никитин А.А., Волынец Г.В. Склерозирующий холангит и воспалительные заболевания кишечника: что первично? Российский вестник перинатологии и педиатрии. 2021;66(1):39-46. https://doi.org/10.21508/1027-4065-2021-66-1-39-46
4. Сюткин В.Е., Салиенко А.А., Олисов О.Д., Новрузбеков М.С. Возврат аутоиммунных болезней после трансплантации печени. Трансплантология. 2022;14(4):421-431. https://doi.org/10.23873/2074-0506-2022-14-4-421-431
5. Хатьков И.Е., Аванесян Р.Г., Ахаладзе Г.Г., Бебурешвили А.Г., Буланов А.Ю., и др. Диагностические и терапевтические аспекты лечения больных с синдромом механической желтухи: по следам Российского консенсуса. Терапевтический архив. 2021;93(2):138-144. https://doi.org/10.26442/00403660.2021.02.200619
6. Khoshpouri P, Habibabadi RR, Hazhirkarzar B, Ameli S, Ghadimi M, et al. Imaging Features of Primary Sclerosing Cholangitis: From Diagnosis to Liver Transplant Follow-up. Radiographics. 2019;39(7):1938-1964. https://doi.org/10.1148/rg.2019180213
7. Подставкина И.С., Мордасова В.И., Коротких Н.Н., Трунова П.А., Тимченко И.В. и др. Влияние трансплантации печени на течение язвенного колита у пациентов с первичным склерозирующим холангитом - язвенным колитом на клинических примерах. Фармакология & Фармакотерапия. 2023;(2):26-36. https://doi.org/10.46393/27132129_2023_2_26
8. Никитин А.В., Хавкин А.И., Скворцова Т.А., Волынец Г.В., Атамеева А.О. Сочетание язвенного колита с циррозом печени в исходе первичного склерозирующего холангита. Экспериментальная и клиническая гастроэнтерология. 2020;174(5):104-107. https://doi.org/10.31146/1682-8658-ecg-177-5-104-107
9. Цыркунов В.М., Прокопчик Н.И., Андреев В.П. Аутоиммунные холестатические поражения желчных протоков. Гепатология и гастроэнтерология. 2021;5(2):99-100. https://doi.org/10.25298/2616-5546-2021-5-2-99-100
10. Chen C, Ke R, Yang F, Cai Q, Liu J, et al. Risk factors for recurrent autoimmune liver diseases after liver transplantation: A meta-analysis. Medicine (Baltimore). 2020;99(20):e20205. https://doi.org/10.1097/MD.0000000000020205
11. Gumm A, Perez-Atayde A, Wehrman A. Posttransplant considerations in autoimmune liver disease: Recurrence of disease and de novo. Clin Liver Dis (Hoboken). 2022;20(4):130-135. https://doi.org/10.1002/cld.1239
12. Райхельсон К.Л., Пазенко Е.В., Марченко Н.В. Первичный склерозирующий холангит: обзор рекомендаций по диагностике и лечению заболевания. Consilium Medicum. 2017;19(8):121–130. https://doi.org/10.26442/2075-1753_19.8.121-130
13. Полунина Т.Е. Холестаз: алгоритмы диагностики и лечения. Академия медицины и спорта. 2021;2(4):28-36. https://doi.org/10.15829/2712-7567-2021-43
14. Хатьков И.Е., Маев И.В., Бордин Д.С., Кучерявый Ю.А., Абдулхаков С.Р., и др. Российский консенсус по диагностике и лечению хронического панкреатита: заместительная ферментная терапия. Терапевтический архив. 2017;89(8):80-87. https://doi.org/10.17116/terarkh201789880-87
15. Восканян С.Э., Сюткин В.Е., Сушков А.И., Восканян Ю.В., Веселкова А.Ю. Патология трансплантата печени в отдаленном посттрансплантационном периоде. Трансплантология. 2023;15(3):359-375. https://doi.org/10.23873/2074-0506-2023-15-3-359-375
16. Коробка В.Л., Пасечников В.Д., Коробка Р.В., Пак Е.С., Шаповалов А.М. Использование эндоскопического лигирования варикозных узлов в комбинации с неселективными β-блокаторами, или самостоятельно, в профилактике кровотечений у больных с асцитом, включенных в лист ожидания трансплантации печени. Вестник трансплантологии и искусственных органов. 2022;24(3):42-50. https://doi.org/10.15825/1995-1191-2022-3-42-50
17. Коробка В.Л., Пак Е.С., Шаповалов А.М., Кострыкин М.Ю., Ткачев А.В. Оценка четырехлетнего ведения листа ожидания трансплантации печени Ростовской области: перспективы снижения смертности в листе. Медицинский вестник Юга России. 2019;10(3):32-39. https://doi.org/10.21886/2219-8075-2019-10-3-32-39
18. Visseren T, Erler N.S., Heimbach J.K., Eaton J.E., Selzner N, et al. Inflammatory conditions play a role in recurrence of PSC after liver transplantation: An international multicentre study. JHEP Rep. 2022;4(12):100599. https://doi.org/10.1016/j.jhepr.2022.100599
19. Steenstraten IC, Sebib Korkmaz K, Trivedi PJ, Inderson A, van Hoek B, et al. Systematic review with meta-analysis: risk factors for recurrent primary sclerosing cholangitis after liver transplantation. Aliment Pharmacol Ther. 2019;49(6):636-643. https://doi.org/10.1111/apt.15148
20. Bajer L, Slavcev A, Macinga P, Sticova E, Brezina J, et al. Risk of recurrence of primary sclerosing cholangitis after liver transplantation is associated with de novo inflammatory bowel disease. World J Gastroenterol. 2018;24(43):4939-4949. https://doi.org/10.3748/wjg.v24.i43.4939
21. Visseren T, Erler NS, Polak WG, Adam R, Karam V, et al. Recurrence of primary sclerosing cholangitis after liver transplantation – analysing the European Liver Transplant Registry and beyond. Transpl Int. 2021;34(8):1455-1467. https://doi.org/10.1111/tri.13925
Об авторах
Е. С. ПакРоссия
Пак Екатерина Сергеевна, к.м.н., ассистент кафедры реконструктивной, сердечно-сосудистой, торакальной, челюстно-лицевой хирургии и трансплантологии;
заведующая гастроэнтерологическим отделением Центра хирургии и координации донорства (областного)
Ростов-на-Дону
Т. М. Петрова
Россия
Петрова Татьяна Максимовна, врач-гастроэнтеролог гастроэнтерологического отделения Центра хирургии и координации донорства (областного)
Ростов-на-Дону
Р. В. Коробка
Россия
Коробка Роман Вячеславович, к.м.н., доцент кафедры реконструктивной, сердечно-сосудистой, торакальной, челюстно-лицевой хирургии и трансплантологии;
директор Центра хирургии и координации донорства (областного)
Ростов-на-Дону
А. А. Ушаков
Ушаков Артём Андреевич, врач-гастроэнтеролог гастроэнтерологического отделения Центра хирургии и координации донорства (областного)
Ростов-на-Дону
О. Б. Кучеренко
Россия
Кучеренко Ольга Борисовна, ассистент кафедры лучевой диагностики;
заведующая рентгенодиагностическим отделением
Ростов-на-Дону
В. Ю. Коцияев
Россия
Кацияев Владимир Юрьевич, врач-патологоанатом, заведующий лабораторией иммуногистохимии
Ростов-на-Дону
О. В. Бухтин
Россия
Бухтин Олег Владимирович, ординатор кафедры внутренних болезней №1
Ростов-на-Дону
Рецензия
Для цитирования:
Пак Е.С., Петрова Т.М., Коробка Р.В., Ушаков А.А., Кучеренко О.Б., Коцияев В.Ю., Бухтин О.В. Рецидив первичного склерозирующего холангита в трансплантате. Медицинский вестник Юга России. 2024;15(3):97-105. https://doi.org/10.21886/2219-8075-2024-15-3-97-105
For citation:
Pak E.S., Petrova T.M., Korobka R.V., Ushakov A.A., Kucherenko O.B., Katsiyaev V.Yu., Bukhtin O.V. Recurrence of primary sclerosing cholangitis in the graft. Medical Herald of the South of Russia. 2024;15(3):97-105. (In Russ.) https://doi.org/10.21886/2219-8075-2024-15-3-97-105







































