Перейти к:
Гиперкальциемия при тяжёлом повреждении почек, дифференциальный диагноз
https://doi.org/10.21886/2219-8075-2024-15-4-21-30
Аннотация
Гиперкальциемия — метаболическое состояние, характеризующееся повышением общей концентрации кальция в сыворотке крови, как правило, выше 2,6–2,65 ммоль/л. Распространённость гиперкальциемии в популяции, по данным пилотных скрининговых исследований, составляет около 1–3%, чаще всего гиперкальциемия является паратиреоид-зависимой. В большинстве случаев гиперкальциемия остается бессимптомной, а клинические проявления появляются лишь при повышении уровня общего кальция до 3,0–3,5 ммоль/л. Обнаружение у пациента гиперкальциемии позволяет врачу в первую очередь заподозрить патологию околощитовидных желез (первичный гиперпаратиреоз или злокачественные новообразования), когда под влиянием метастазов солидных опухолей происходит разрушение костной ткани. Представлен клинический случай выявления гиперкальциемии у пациентки в сочетании с тяжёлым почечным повреждением, артериальной гипертензией и многочисленными кистовидными просветлениями на рентгенограммах левого плечевого сустава. Определение концентрации интактного паратиреоидного гормона в пределах референсных значений позволило отвергнуть гиперпаратиреоз и провести расширенный дифференциальнодиагностический поиск. В результате нефробиопсии установлен диагноз «Множественная миелома, миеломная нефропатия». Именно обнаружение гиперкальциемии, нехарактерной для терминальной стадии хронической болезни почек, и поиск её причины позволили в короткие сроки верифицировать диагноз множественной миеломы.
Для цитирования:
Гафурова Н.А., Горбатова Е.В., Стрелкова А.В., Постоева А.В. Гиперкальциемия при тяжёлом повреждении почек, дифференциальный диагноз. Медицинский вестник Юга России. 2024;15(4):21-30. https://doi.org/10.21886/2219-8075-2024-15-4-21-30
For citation:
Gafurova N.A., Gorbatova E.V., Strelkova A.V., Postoeva A.V. Hypercalciemia in severe kidney failure, differential diagnosis. Medical Herald of the South of Russia. 2024;15(4):21-30. (In Russ.) https://doi.org/10.21886/2219-8075-2024-15-4-21-30
Введение
Оценка состояния фосфорно-кальциевого обмена — важная составляющая обследования пациента с клинически значимой патологией почек. Развитие почечной недостаточности вносит изменения в жёсткую систему регуляции поддержания нормокальциемии, нарушая равновесие между поступлением кальция в организм (~1000 мг) и выделением его желудочно-кишечным трактом (~900 мг) и почками (~100 мг) (риc. 1) [1].
Так при хронической болезни почек (ХБП) уменьшение массы функционирующих нефронов сопровождается снижением гидроксилирования в митохондриях клеток проксимальных канальцев почек 25-гидроксихолекальциферола в активную форму витамина D (1,25-дигидроксихолекальциферол) — кальцитриол. Это ограничивает всасывание кальция в кишечнике (в норме — ~350 мг/сут., рис. 1) и формирует адаптационные механизмы устранения гипокальциемии за счёт вторичного гиперпаратиреоза с сохранением обратной связи между уровнями кальция и паратиреоидного гормона (ПТГ) [2]. Развиваются системные нарушения минерально-костного обмена, обусловленные дефицитом витамина D, нарушением экскреции фосфатов, вторичным увеличением уровня ПТГ и гиперплазией клеток околощитовидных желез; развитием кальциноза сосудов и мягких тканей в результате отложения в них фосфата кальция; нарушением обновления и минерализации костной ткани с превалированием резорбции [2].
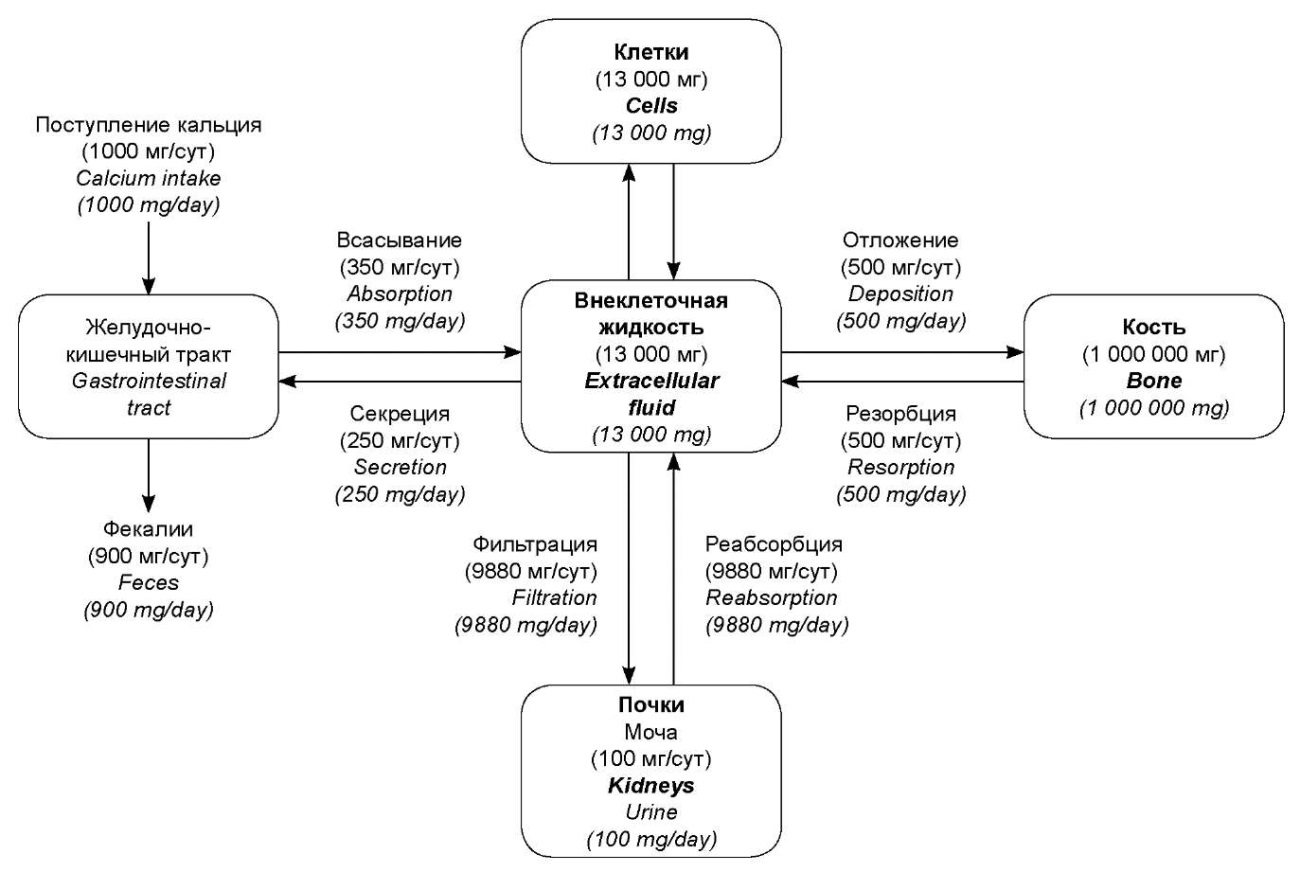
Рисунок 1. Распределение кальция между различными тканями и органами у человека, получающего 1000 мг кальция ежедневно (адаптировано из учебника «Медицинская физиология по Гайтону и Холлу». Пер. с англ.; Под ред. В.И. Кобрина, М.М. Галагудзы, А.Е. Умрюхина. 2-е изд., испр. и доп.)
Figure 1. Calcium distribution between different tissues and organs in a person who receives 1000 mg of calcium daily (adapted from the Guyton and Hall Textbook of Medical Physiology (13th ed.))
Гиперкальциемия при ХБП развивается на стадии третичного гиперпаратиреоза (автономии паращитовидной железы/желез) или имеет иную этиологию и механизмы развития, как правило, ухудшая течение ХБП. К примеру, может являться следствием иммобилизации (в первые дни/недели), тиреотоксикоза, передозировки витамина Д, приёма тиазидоподобных диуретиков, паранеопластического процесса, первичного гиперпаратиреоза и др. (табл. 1) [3].
Таблица / Table 1
Заболевания, ассоциированные с гиперкальциемией
Diseases associated with hypercalcemia
|
Повышенная резорбция костной ткани / Increased bone resorption |
|
|
Паратиреоид-зависимая гиперкальциемия / Parathyroid hormone mediated hypercalcemia |
Спорадический первичный гиперпаратиреоз / Sporadic primary hyperparathyroidism |
|
Семейный / наследственный первичный гиперпаратиреоз / Familial / inherited primary hyperparathyroidism a) Множественные эндокринные неоплазии / Multiple endocrine neoplasia b) Семейный изолированный гиперпаратиреоз / Familial isolated hyperparathyroidism c) Синдром гиперпаратиреоза с опухолью челюсти / Hyperparathyroidism jaw-tumor syndrome d) Семейная гипокальциурическая гиперкальциемия (варианты CASR, GNA11, AP2S1 и так далее) / Familial hypocalciuric hypercalcemia (CASR, GNA11, AP2S1 variants, etc) e) Тяжёлый неонатальный первичный гиперпаратиреоз (вариант CASR) / Neonatal severe hyperparathyroidism (CASR variant) |
|
|
Рак паращитовидной железы / Parathyroid cancer |
|
|
Третичный гиперпаратиреоз / Tertiary hyperparathyroidism |
|
|
Вызванный лекарственными препаратами — литий / Drugs-induced — lithium |
|
|
Злокачественные новообразования, приводящие к эктопической выработке ПТГ (редко) / Malignancy ectopic parathyroid hormone production (rare) |
|
|
Паратиреоид-независимая гиперкальциемия / Non-parathyroid hormone mediated hypercalcemia |
Злокачественные новообразования (паранеопластическая гиперкальциемия) / Malignant neoplasms (paraneoplastic hypercalcemia) a) Гуморальная гиперкальциемия злокачественных опухолей (секреция паратиреоидного гормон-родственного белка) / Humoral hypercalcemia of malignancy (parathyroid hormone–related protein) b) Остеолитические метастазы или миелома / Osteolytic metastases or myeloma |
|
Иммобилизация / Immobilization |
|
|
Гипервитаминоз витамина А / Hypervitaminosis of vitamin A |
|
|
Гипертиреоз / Hyperthyroidism |
|
|
Приём лекарственных препаратов — терипаратид, абалопаратид, рикошетный остеолиз после отмены деносумаба / Drugs-induced –teriparatide, abaloparatide, rebound after denosumab discontinuation |
|
|
Метафизарная хондродисплазия, тип Янсена (вариант активации PTH1R) / Jansen-type metaphyseal chondrodysplasia (activating PTH1R variant) |
|
|
Гуморальная гиперкальциемия доброкачественного характера (секреция паратиреоидподобного белка доброкачественной тканью) / Humoral hypercalcemia of benignancy (parathyroid hormone-related protein secretion by benign tissue) |
|
|
Повышенное всасывание в желудочно-кишечном тракте / Increased gastrointestinal absorption |
|
|
Опосредованное витамином D / Vitamin D mediated |
Гипервитаминоз витамина D / Hypervitaminosis of vitamin D |
|
Опосредованный 1,25(OH)2D3 / 1,25-dihydroxyvitamin D mediated a) Гематологические злокачественные новообразования (повышение активности 1α-гидроксилазы) / Hematologic malignancies (increased 1α-hydroxylase activity) b) Гранулематозные болезни / Granulomatous disorders - Инфекционные — туберкулёз, болезнь кошачьих царапин, гистоплазмоз, криптококкоз, кандидоз, проказа, пневмоцистоз и т.д. / Infectious — tuberculosis, cat-scratch disease, histoplasmosis, cryptococcosis, candidiasis, leprosy, pneumocystosis, etc - Воспалительные — саркоидоз, гранулематозВегенера, болезнь Крона, синдром Блау, гистиоцитоз из клеток Лангерганса и т. д. / Inflammatory—sarcoid, Wegener granulomatosis,Crohn disease, Blau syndrome, Langerhans cell histiocytosis, etc |
|
|
Инородное тело — силикоз, тальк, лечение палочки Кальметта-Герена, бериллиоз, парафиновое масло / Foreign body — silicosis, talc, bacille Calmette-Guérin therapy, berylliosis, paraffin oil |
|
|
Другие причины / Other causes a) подкожный адипонекроз новорождённых / subcutaneous fat necrosis of the newborn b) липоидная пневмония / lipoid pneumonia |
|
|
Не связанное с витамином D / Non–vitamin D mediated |
Лактазная недостаточность / Lactase deficiency |
|
Сахарозо-изомальтазная недостаточность / Sucrase-isomaltase deficiency |
|
|
Влияние на почечный клиренс/реабсорбцию кальция / Effect on renal clearance/reabsorption of calcium |
|
|
Приём тиазидов / Drugs-induced – thiazides |
|
|
Молочно-щелочной синдром (поступление избыточного количества карбоната кальция) / Milk-alkali syndrome (concomitant with excess calcium carbonate ingestion) |
|
|
Острая почечная недостаточность / Acute kidney failure |
|
|
Синдром Барттера (в первую очередь гипокалиемия) / Bartter syndrome (especially hypokalemia) |
|
|
Надпочечниковая недостаточность / Adrenal insufficiency |
|
|
Другой или неясный механизм / Other or unclear mechanism |
|
|
Снижение депонирования кальция в скелете / Reduced deposition of skeletal calcium |
Адинамическая костная болезнь / Adynamic bone disease |
|
Гипофосфатазия / Hypophosphatasia |
|
|
Перераспределение / Redistribution |
Рабдомиолиз / Rhabdomyolysis |
|
Другие заболевания и состояния / Other diseases and conditions |
Акромегалия / Acromegaly |
|
Феохромоцитома / Pheochromocytoma |
|
|
Кетогенная диета / Ketogenic diet |
|
|
Почечный канальцевый ацидоз / Kidney tubular acidosis |
|
|
COVID-19 / COVID-19 |
|
|
Синдром Вильямса (генетический дефект синтеза эластина) / Williams syndrome (genetic defect of elastin synthesis) |
|
|
Лекарственные препараты / Drugs |
Теофиллин / Theophylline |
|
Фоскарнет / Foscarnet, |
|
|
Омепразол / Omeprazole |
|
|
Ингибиторы ароматазы / Aromatase inhibitors |
|
|
Ингибиторы натрий-глюкозного ко-транспортера 2-го типа / Sodium-glucose cotransporter 2 protein inhibitors |
|
|
Ингибиторы иммунных контрольных точек / Immune checkpoint inhibitors |
|
|
Гранулы сульфата кальция / Calcium-sulfate beads |
|
Острое почечное повреждение (ОПП), напротив, может первично сопровождаться гиперкальциемией, сопряжённой с относительным снижением почечного клиренса кальция.
Регуляция выделения кальция почками зависит от потребностей организма, но модифицировать почечные потери макроэлемента сложно. В норме лишь 60% кальция плазмы, не связанного с белками и фосфатами, проходит через почечный фильтр, но это довольно много — ~10 граммов кальция (9980 мг/сут.). Из этого количества 99% реабсорбируется: 65% — в проксимальных канальцах, ПТГ-независимо; 25–30% — в петле Генле, 4–9% — в дистальных канальцах и собирательных трубочках. Лишь 1% (или 100 мг/сут.) составляют потери с мочой, что в 9 раз меньше, чем через желудочно-кишечный тракт. К факторам, снижающим выделение кальция, относят высокий уровень ПТГ, гиповолемию, гипотонию, гиперфосфатемию, метаболический алкалоз, прие` витамина D3. Повышают выделение кальция низкий уровень ПТГ, большой объём внеклеточной жидкости, артериальная гипертензия (АГ), гипофосфатемия и метаболический ацидоз. Как правило, наличие/отсутствие гиперкальциемии при ОПП обусловлено этиологией ОПП.
Целью публикации является представление случая обнаружения гиперкальциемии у пациентки, обследованной в связи с тяжёлым поражением почек, манифестировавшим спустя ~8 недель после перенесённой коронавирусной инфекции, и последующего диагностического поиска её причины.
Клиническое наблюдение
Пациентка Т., 64 года, была доставлена родственником в приёмный покой городской клинической больницы с жалобами на слабость, снижение диуреза в течение 2 дней, отёчность правой голени, боль в правой малоберцовой и большеберцовой костях. С диагнозом «Тромбоз суральных вен правой голени» была госпитализирована в хирургическое отделение для наблюдения и дообследования.
Из анамнеза: ухудшение состояния отмечала в течение месяца общую слабость, одышку, отсутствие аппетита, снижение диуреза, повышение артериального давления (АД) до 220 мм рт. ст. Пациентка связывала данные симптомы с астенией после перенесённой инфекции SARS-CoV-2. За медицинской помощью не обращалась даже после падения, в результате которого считала, что сломала руку и была вынуждена фиксировать конечность косынкой. Два дня назад отметила увеличение отёка правой голени и общей пастозности; резко сократилось количество мочи, усилился болевой синдром в правой ноге. Сын женщины привез её в приёмный покой.
Пациентка Т. — неработающий пенсионер, группы инвалидности нет, проживала в сельской местности. С 23-летнего возраста отмечала повышение АД до высоких цифр; бессистемно принимала иАПФ и дигидроперидиновые антагонисты кальция. В анамнезе 2 беременности, 2 родов, менопауза с 50 лет, однако в 57 в связи с симптомной миомой была выполнена экстирпация. Тогда же, 7 лет назад, установлен диагноз «СД 2 типа», была назначена терапия метформином в дозе 2000 мг в сутки. За 2 месяца до госпитализации пациентка перенесла инфекцию SARS-CoV-2 без госпитализации; получала противовирусные и жаропонижающие препараты. Субъективно пациентка считала, что перенесла коронавирусную инфекцию легко.
В хирургическом отделении состояние пациентки было расценено как состояние средней степени тяжести. Сознание ясное, в личности, времени и пространстве ориентирована. Беспокоила слабость, аппетит снижен, отмечала тошноту, рвоты не было. Кожный покров чистый, сухой. Температура — 36,6°С. Дыхание везикулярное, хрипы не выслушивались, частота дыхания — 20 в минуту (SpO2 — 95%). АД — 250/110–160/70 мм.рт. ст, ЧСС — 57–70 в минуту. Тоны сердца ритмичны, приглушены, шумы не выслушивались, акцент — 2 тона на аорте. Живот при пальпации мягкий, безболезненный. Нижние конечности обычного цвета, тёплые на ощупь, отмечался умеренный отёк правой голени (+1 см), пальпация умеренно болезненная, чувствительность сохранена. Пульс на магистральных артериях нижних конечностей определялась на всех уровнях. Движения в голеностопном и коленном суставах в полном объёме. Левая верхняя конечность «висящая», фиксирована косынкой. Рука теплая, розовая. Рост — 156 см, вес — 100 кг. ИМТ — 41,09 кг/м². Диурез — 400 мл.
В результате обследования вероятность наличия тромбоза глубоких вен нижних конечностей по клиническим признакам была определена как низкая.
При лабораторном обследовании были выявлены критическая гиперазотемия (мочевина — 44,4 ммоль/л, креатинин — 919 мкмоль/л) и метаболический (лактат-) ацидоз (pH — 7,21, BE — 13,8 ммоль/л, лактат — 10,7 ммоль/л), калий — 5,23 ммоль/л, натрий — 135 ммоль/л (динамика показателей азотемии и кислотно-щелочного равновесия в период госпитализации представлена в таблице 2). В общем анализе мочи незначительная протеинурия: относительная плотность мочи — 1,009, цвет мочи соломенный, моча прозрачная, pH — 5,00, белок — 0,5 г/л, глюкоза не обнаружена, лейкоциты не обнаружены, эритроциты — 0,3 мг/л.
Таблица / Table 2
Динамика показателей азотемии и кислотно-щелочного равновесия в период госпитализации
Dynamics of indices of azotemia and acid-base balance during hospitalization
|
1-е сутки First 24 hours |
2–4-е сутки Second to fourth day |
5–14-е сутки (отделение нефрологии) 5–14 days (nephrology department) |
15–28-е сутки (отделение нефрологии и выписка) 15–28 days (nephrology department and discharge from the hospital) |
|
|
Креатинин, мкмоль/л Сreatinine, μmol/L |
981 |
951 |
565 |
599 |
|
Мочевина, ммоль/л Urea, μmol/L |
47,2 |
45,5 |
29,7 |
10,9 |
|
pH |
7,25 |
7,26 |
7,33 |
7,37 |
|
Бикарбонат актуальный, ммоль/л сНСО, μmol/L |
12,5 |
15,3 |
23,3 |
22,9 |
|
Стандартный избыток оснований, BE, ммоль/л Base excess, BE, μmol/L |
-15,9 |
-11,5 |
-0,9 |
-1,1 |
|
Лактат, ммоль/л Lactate, μmol/L |
10,7 |
2,4 |
1,4 |
1,2 |
|
Калий, ммоль/л Potassium, μmol/L |
5,3 |
5,0 |
5,0 |
4,6 |
|
Натрий, ммоль/л Sodium, μmol/L |
135 |
138 |
135 |
134 |
|
Глюкоза, ммоль/л Glucose, μmol/L |
5,2 |
6,3 |
5,5 |
6,9 |
Было проведено УЗИ почек. Правая почка: положение обычное, контур неровный, нечёткий, размеры — 12,3×6,2 см, толщина паренхимы — 1,2 см, структура паренхимы уплотнена, пирамидки выражены, полостная система расширена за счёт чашек до 0,8 см, лоханки — 2,2×2,0 см. Левая почка: положение обычное, контур неровный, нечёткий, размеры — 12,4×6,5 см, толщина паренхимы — 1,7 см, структура паренхимы уплотнена, пирамидки выражены, полостная система расширена за счёт чашек — до 0,9 см, лоханки — 2,3×2,0 см, мочевой пузырь пустой. Отмечено некоторое расширение чашечно-лоханочной системы и после осмотра урологом, с учётом противопоказаний (гиперазотемия) для внутривенной урографии была выполнена спиральная компьютерная томография (СКТ) почек, исключившая обструктивную нефропатию как причину тяжёлого поражения почек.
В связи с выраженной гиперазотемией, лактатацидозом (табл. 2) и неконтролируемой АГ пациентка была переведена в отделение реанимации, где были начаты сеансы гемодиализа. Через сутки на фоне лечения нормализовался уровень лактата и стабилизировались гемодинамические показатели. Диурез редуцирован.
На 5-е сутки пациентка была переведена в отделение нефрологии с диагнозом «Нефропатия неуточнённая. Тяжелое ОПП на фоне ХБП».
Дальнейшие диагностические мероприятия были направлены на уточнение этиологии тяжёлого почечного повреждения. Пациентка отрицала приём холекальциферола, однако сообщала об эпизодическом приеме препаратов НПВС по поводу болевого синдрома и регулярном — метформина, — что, безусловно, могло послужить причиной острого почечного повреждения (ОПП) и лактатацидоза, но «идеальный» уровень гликированного гемоглобина (5,3%) на монотерапии бигуанидами отрицал возможность развития диабетической нефропатии. Не было также признаков «вторично-сморщенной почки» на фоне длительной неконтролируемой АГ.
Данные лабораторного и инструментального обследования в отделении нефрологии
В общем анализе крови лейкоциты — 9,28*10⁹/л (N 3,9–9,0×10¹²/л), эритроциты — 3,17×10¹²/л (N 3,6–5,0*10¹²/л), гемоглобин — 77 г/л (N 120–140 г/л), СОЭ — 28 мм/час, остальные показатели были в пределах референсных значений.
В общем анализе мочи при суточном диурезе не более 200 мл белок — 1,0 г/л (N до 0,033г/л), эритроциты — 0,30 мг/л (N менее 0,2 мг/л), остальные показатели так же в пределах референсных значений.
В биохимическом исследовании крови отмечалось снижение уровня мочевины и креатинина (табл.2).
Сохранялся чуть сниженный уровень натрия (133,2 ммоль/л, N 136–146 ммоль/л), нормокалиемия — 4,63 ммоль/л (N 3,4–4,5 ммоль/л), показатели мочевой кислоты — 267,57 мкмоль/л (N 140–310 мкмоль/л), щелочной фосфатазы — 55 Ед/л (N 35–104 Ед/л). Трансаминаза в норме: АЛТ — 14 Ед/л (N 5–30 Ед/л), АСТ — 25 Ед/л (N 5–31 Ед/л). Снижен уровень общего белка (58,4 г/л, N 60–83г/л) при сохранном уровне альбумина 41,1 г/л (N 32–52 г/л). Высокие показатели ферритина (372,7 нг/мл. N 10–120 нг/мл) на фоне анемии и дефицита железа (7,9 мкмоль/л). СРБ — 7,0 мг/л. СКФ по CKD-EPI — 6,32 мл/мин./1,73м².
Профиль липидов свидетельствовал о дислипидемии, ассоциированной с метаболическим синдромом: холестерин — 5,78 ммоль/л (N до 5,2 ммоль/л), триглицериды — 2,71 ммоль/л (N до 1,71 ммоль/л), холестерин липопротеидов высокой плотности — 1,47 ммоль/л (N 1,2–1,55 ммоль/л), холестерин липопротеидов низкой плотности — 3,41 ммоль/л (N до 2,59 ммоль/л).
Выявлена гиперкальциемия (2,95 ммоль/л, N 2,02–2,6 ммоль/л), уровень фосфора на верхней границе нормы (1,41 ммоль/л, N 0,81–1,45 ммоль/л). Кальций, скорректированный по альбумину, — 2,93 ммоль/л. Пациентке было выполнено определение интактного ПТГ (32,21 пг/мл, N 15–65 пг/мл), он был в норме, что исключило наличие классического вторичного гиперпаратиреоза при ХБП в сочетании с иной причиной гиперкальциемии, как и любого другого гиперпаратиреоза.
Однако заключение рентгенолога по снимкам левого плечевого сустава свидетельствовало об изменениях структуры костей, сходных с почечной остеодистрофией: были выявлены признаки снижения плотности костной ткани за счёт остеопороза, многочисленные кистовидные просветления левой плечевой кости, деформация верхней 1/3 диафиза плечевой кости (консолидированный перелом?); аналогичные изменения левой лопатки, ключицы, ребер на видимом протяжении; достоверных свежих костно-травматических изменений не обнаружено; соотношение в суставе допустимое (рис. 2).
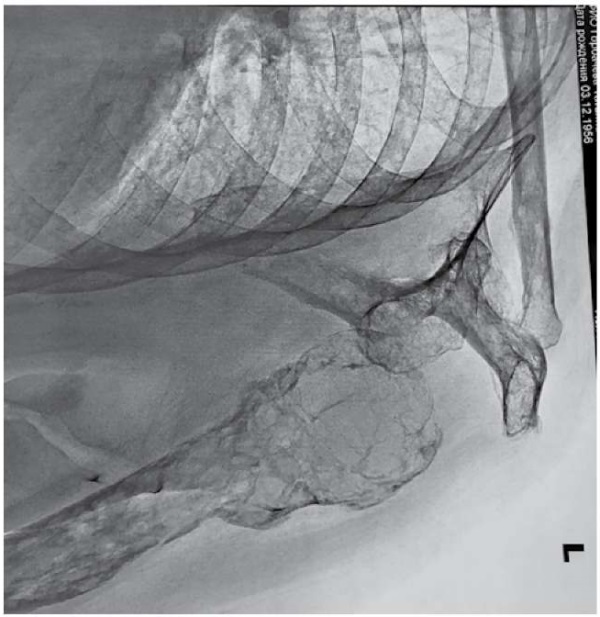
Рисунок 2. Рентгенография левого плечевого сустава
Figure 2. Radiography of the left shoulder joint
Почечная остеодистрофия — это нарушение костной морфологии у пациентов с ХБП, являющееся одной из характеристик скелетного компонента системных нарушений минеральных и костных нарушений [4]. Наличие фиброзного остеита в сочетании с гиперкальциемией предполагает почечную остеодистрофию с высоким костным метаболизмом на фоне гиперпаратиреоза, чего не оказалось у этой пациентки.
При СКТ брюшной полости также были выявлены признаки остеопороза поясничного отдела позвоночника и нижних грудных позвонков. При СКТ органов малого таза обнаружены признаки остеопороза в костях таза.
На основании данных обследования был установлен предварительный диагноз «Нефропатия неуточнённая. Тяжёлое острое почечное повреждение. Заместительная почечная терапия. Паратиреоид-независимая гиперкальциемия. Анемия средней (общий гемоглобин — 77,00 г/л) степени тяжести. Осложнённый тотальный остеопороз. Артериальная гипертензия 3 степени».
Таким образом, нормальный уровень ПТГ исключил гиперпаратиреоз как причину патологии костной ткани и переключил дальнейший диагностический поиск на уточнение генеза гиперкальциемии, в первую очередь паранеопастического, конкурирующего по частоте встречаемости с первичным гиперпаратиреозом 0,86–1% [5].
Наиболее распространённые виды опухолей и соответствующий им патогенетические механизмы, вызывающий гиперкальциемию, представлены в таблице 3 [6]. У пациентки описанные выше изменения структуры костей позволили в первую очередь заподозрить остеолитические метастазы.
Таблица / Table 3
Наиболее распространённые виды опухолей и соответствующий им патогенетический механизм, приводящий к развитию гиперкальциемии
The most common types of tumors and their corresponding pathogenetic mechanism leading to the development of hypercalcaemia
|
Злокачественная гуморальная гиперкальциемия (секреция паратгормонподобного белка) / Humoral hypercalcemia of malignancy (parathyroid hormone–related protein) |
Бронхиальный карциноид / Bronchial carcinoid |
|
Почечно-клеточный рак / Renal cell carcinoma |
|
|
Опухоли мочеполовой системы / Tumors of the urogenital system |
|
|
Карциномы яичников / Ovarian carcinomas |
|
|
Неходжкинские лимфомы / Non-Hodgkin's lymphomas |
|
|
Карциномы молочных желез / Mammary gland carcinomas |
|
|
Сквамозно-клеточная карцинома / Squamous cell carcinoma |
|
|
Хронический миелоидный лейкоз / Chronic myeloid leukemia |
|
|
Остеолитические метастазы / Osteolytic metastasis |
Карциномы молочных желез / Mammary gland carcinomas |
|
Множественная миелома / Multiple myeloma |
|
|
Лейкемия / Leukemia |
|
|
Лимфомы / Lymphomas |
|
|
Эктопическая секреция кальцитриола / Ectopic secretion of calcitriol |
Неходжкинские лимфомы / Non-Hodgkin's lymphomas |
|
Эктопическая секреция паратиреоидного гормона / Ectopic secretion of parathyroid hormone |
Карцинома яичников / Ovarian carcinomas |
|
Рак бронхов / Bronchial cancer |
|
|
Нейроэндокринные опухоли / Neuroendocrine tumors |
|
|
Карциномы щитовидной железы / Thyroid carcinomas |
|
|
Рак поджелудочной железы / Pancreatic cancer |
В рамках исключения миеломы выполнено определение белковых фракции крови методом электрофореза: общий белок — 58,4 г/л, альбумины — 58,2% (N 55,80–66,10 %), a1-глобулины — 6,4% (N 2,90–4,90%), a2-глобулины — 12,1% (N 7,10–11,80%), b1-глобулины — 6,1% (N4,70–7,20%), b2-глобулины — 3,8% (N3,20–6,50%), g1-глобулины — 13,4% (N11,10–18,80%); выявлен легкий сдвиг в сторону a1- и a2-глобулинов; при последующем иммунотипировании обнаружены свободные каппа лёгкие цепи иммуноглобулина.
Свободные лёгкие цепи (СЛЦ) ассоциированы с множественной миеломой (ММ), так как продуцируются при всех типах ММ, их концентрация в сыворотке крови не зависит от сохранности почечной функции и напрямую отражает их секрецию плазматическими клетками, а так же СЛЦ могут быть использованы с прогностическими целями [7]. Обнаружение СЛЦ позволило аккумулировать имеющиеся данные по паратиреоид-независимой гиперкальциемии, анемии, множественном поражении костей, почечной недостаточности и заподозрить III стадию множественной миеломы (по B. Durie, S. Salmon), несмотря на отсутствие белка Бенс-Джонса в моче, сохранный уровень альбумина и низкий уровень общего белка в сыворотке крови пациентки1.
Множественная миелома — В-клеточная злокачественная опухоль, морфологическим субстратом которой являются плазматические клетки, продуцирующие моноклональный иммуноглобулин1. В 2021 г. заболеваемость множественной миеломой в России, по данным А.Д. Каприна, В.В. и соавт., составила 1,47 на 100 тысяч населения. Среди всех злокачественных опухолей заболеваемость ММ составляет приблизительно 1%, а среди всех опухолей кроветворной и лимфоидной тканей до 10–13 %2. Преимущественно заболевают пациенты старшей возрастной группы, среди групп населения моложе 40 лет распространённость множественной миеломы не превышает 2%, а средний возраст вновь заболевших — примерно 70 лет [8].
Миеломный остеолиз может затронуть любую кость, но чаще поражаются те, в которых содержание кортикального вещества больше, чем губчатого. В основе остеолитической деструкции при ММ лежит секреция миеломными клетками остеокластактивирующих факторов и подавление пролиферации клеток остеобластического ряда, что приводит к разрушению костной матрицы без последующего ее замещения. В результате миеломный остеолиз на рентгенограмме выглядит как «зона совершенно пустого участка», что указывает на отсутствие минерализации костного дефекта [9].
Течение миеломной болезни может соответствовать тлеющей (асимптоматической) или симптоматической форме. Критериям асимптоматической миеломной болезни пациентка не удовлетворяла в связи с наличием органных повреждений — признаков поражения костей. Для подтверждения симптоматической множественной миеломы, помимо присутствовавших у пациентки симптомов, таких как гиперкальциемии, нарушения функции почек и остеолитических очагов, необходимо присутствие в костном мозге ≥10 % клональных плазматических клеток или подтвержденное биопсией наличие моноклональных плазматических клеток в костных или экстрамедуллярных очагах1.
В связи с нахождением пациентки в отделении нефрологии и невозможностью выполнить стернальную пункцию в условиях отделения на 14-е сутки госпитализации была выполнена нефробиопсия левой почки.
Заключение, полученное в результате нефробиопсии — «Сочетанная моноклональная парапротеинемическая нефропатия: 1. BJCN/Κ: Диффузная тяжёлая моноклональная цилиндровая нефропатия BenceJones’ (Kappa) с резко выраженным тубуло-интерстициальным воспалением и тотальным острым канальцевым некрозом. 2. LHCDD/IgGk: Диффузное отложение моноклональных лёгкой (Kappa) и тяжёлой (Gamma) цепей во всех базальных мембранах ткани почки (ГБМ, ТБМ, БМГК); полный гломерулосклероз (9%); умеренный тубуло-интерстициальный фиброз (30%); артериоло-артериосклероз крайней степени тяжести с резким сужением просветов сосудов.
С учётом клинической картины результаты лабораторных и инструментальных исследований был установлен следующий диагноз:
Основной — «Моноклональная гаммапатия ренального значения (множественная миелома)».
Осложнение основного: Миеломная нефропатия (сочетанная моноклональная парапротеинемическая нефропатия BJCN/k: Диффузная тяжёлая моноклональная цилиндровая нефропатия Вепсе Jones' (Карра) с резко выраженным тубуло-интерстициальным воспалением и тотальным острым канальцевым некрозом. LHCDD/lgGk: Диффузное отложение моноклональных лёгкой (Карра) и тяжёлой (Gamma) цепей во всех базальных мембранах ткани почки (ГБМ, ТБМ, БМГК); полный гломерулосклероз (9%); умеренный тубулоинтерстициальный фиброз (30%); артериоло-артериосклероз крайней степени тяжести с резким сужением просветов сосудов. Острое почечное повреждение ренального генеза С3, олигоурическая форма с исходом в хроническую болезнь почек С5 Д. Анемия средней (Hb 77 г/л) степени тяжести сочетанного генеза. Гипопротеинемия. Костно-минеральные нарушения. Вторичный тотальный остеопороз. Консолидированный перелом верхней трети диафиза левой плечевой кости.
Таким образом, метаболический ацидоз, низкий уровень ПТГ и неконтролируемая АГ были отчасти механизмами адаптации к тяжёлой остеолитической гиперкальциемии, они, на сколько это возможно, повышали выделение кальция до тотальной инвазии клубочков моноклональными плазматическими клетками и некроза канальцев почек.
В ходе лечения пациентка была гемодинамически стабильна, не лихорадила, сохранялась стойкая анурия, сеансы гемодиализа переносила удовлетворительно. Для дальнейшего лечения была переведена в профильное гематологическое отделение. В отделении гематологии назначена программа иммунохимиотерапии, включающая циклофосфамид, бортезомиб и дексаметазон. Патогенетическое лечение, в частности бортезомибом, не только оказывает выраженное воздействие на опухолевые клетки, но и снижает дифференцировку и функциональную активность остеокластов, снижая таким образом резорбцию костной ткани [10]. Первый курс по программе перенесла удовлетворительно. В дальнейшем для контроля гиперкальциемии и костной резорбции с учётом сниженной функции почек, возможна терапия деносумабом3.
Заключение
Гиперкальциемия является относительно редкой и чаще всего лабораторной находкой, ассоциирующейся в первую очередь с первичным гиперпаратиреозом.
Однако нельзя упускать из виду и остальные связанные с гиперкальциемией заболевания. В случае с множественной миеломой её диагностика длительное время может быть затруднена, а врачи чаще сталкиваются с уже осложнённым течением данного заболевания. Это связано с тем, что в практической деятельности клинические проявления множественной миеломы крайне разнообразны, неспецифичны и отдалены от начала заболевания. В то же время определение ПТГ у пациентов с гиперкальциемией и ХБП позволяет сузить дифференциальный поиск, ускоряя путь к диагнозу и необходимому лечению.
1. Ассоциация онкологов России, Национальное гематологическое общество, Российское профессиональное общество онкогематологов. Клинические рекомендации Множественная миелома. 2020
2. Каприн А.Д., Старинский В.В., Шахзадова А.О. Злокачественные новообразования в России в 2021 году (заболеваемость и смертность). Москва: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2022.
3. Российская ассоциация эндокринологов, Ассоциация эндокринных хирургов. Клинические рекомендации Первичный гиперпаратиреоз. 2020
Список литературы
1. Hall jE. Guyton and Hall Textbook of Medical Physiology. 13th ed. 2015.
2. Мокрышева Н.Г., Маганева И.С. Минерально-костные нарушения у пациентов с хронической болезнью почек и сахарным диабетом: реальные возможности кардио- и нефропротекции. Медицинский Совет. 2018;(4):60-65. https://doi.org/10.21518/2079-701x-2018-4-60-65
3. Walker MD, Shane E. Hypercalcemia: A Review. JAMA. 2022;328(16):1624-1636. https://doi.org/10.1001/jama.2022.18331
4. Редакционная с. Практические рекомендации KDIGO по диагностике, профилактике и лечению минеральных и костных нарушений при хронической болезни почек (ХБП–МКН). Нефрология. 2011;15(1):87-95. https://doi.org/10.24884/1561-6274-2011-15-1-87-95
5. Мокрышева Н.Г., Ковалева Е.В., Еремкина А.К. Регистры заболеваний околощитовидных желез в Российской Федерации. Проблемы Эндокринологии. 2021;67(4):4-7. https://doi.org/10.14341/probl12803
6. Suttmann Y, Fischereder M. Hyperkalzämie: Häufig steckt eine Tumorerkrankung dahinter : Onkologische Zufallsbefunde [Hypercalcemia]. MMW Fortschr Med. 2020;162(7):35-38. (In German). https://doi.org/10.1007/s15006-020-0388-9
7. Скворцова Н.В., Ковынев И.Б., Хальзов К.В., Поспелова Т.И. Значение исследования сывороточных свободных легких цепей иммуноглобулинов для прогнозирования исхода у пациентов с впервые диагностированной множественной миеломой в условиях реальной клинической практики. Онкогематология. 2020;15(3):38-50. https://doi.org/10.17650/1818-8346-2020-15-3-38-50
8. Яриков А.В., Бояршинов А.А., Лобанов И.А., Дубских А.О., Перльмуттер О.А., Фраерман А.П., Соснин А.Г., Кузнецов С.Ф., Кабардаев Р.М. Множественная миелома: эпидемиология, этиология, диагностика и современные аспекты хирургического лечения. Поволжский онкологический вестник 2021;12(2):53-64. eLIBRARY ID: 47289133 EDN: ZwjOMq
9. Гельцер Б.И., жилкова Н.Н., Ануфриева Н.Д., Кочеткова Е.А. Поражение костей при множественной миеломе. Тихоокеанский медицинский журнал. 2011;(3):11-16. eLIBRARY ID: 22661267 EDN: TBxHVx
10. Смирнов А.В., Добронравов В.А., Храброва М.С., Афанасьев Б.В. Поражение почек при моноклональной гаммапатии: мультидисциплинарный подход в онкогематологии и нефрологии. Онкогематология. 2020;15(2):49-60. https://doi.org/10.17650/1818-8346-2020-15-2-49-60
Об авторах
Н. А. ГафуроваРоссия
Наталья Александровна Гафурова, ассистент кафедры госпитальной терапии и эндокринологии
Архангельск
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Е. В. Горбатова
Россия
Екатерина Викторовна Горбатова, к.м.н., доцент кафедры факультетской терапии
Архангельск
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
А. В. Стрелкова
Россия
Александра Витальевна Стрелкова, к.м.н., доцент кафедры госпитальной терапии и эндокринологии, Северный государственный медицинский университет; Федеральный исследовательский центр комплексного изучения Арктики им. ак. Н.П. Лавёрова Уральского отделения Российской академии наук
Архангельск
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
А. В. Постоева
Россия
Анна Викторовна Постоева, к.м.н., доцент кафедры госпитальной терапии и эндокринологии
Архангельск
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Рецензия
Для цитирования:
Гафурова Н.А., Горбатова Е.В., Стрелкова А.В., Постоева А.В. Гиперкальциемия при тяжёлом повреждении почек, дифференциальный диагноз. Медицинский вестник Юга России. 2024;15(4):21-30. https://doi.org/10.21886/2219-8075-2024-15-4-21-30
For citation:
Gafurova N.A., Gorbatova E.V., Strelkova A.V., Postoeva A.V. Hypercalciemia in severe kidney failure, differential diagnosis. Medical Herald of the South of Russia. 2024;15(4):21-30. (In Russ.) https://doi.org/10.21886/2219-8075-2024-15-4-21-30







































