Перейти к:
Иммуномодулирующая терапия у пациенток с привычной неэффективной имплантацией
https://doi.org/10.21886/2219-8075-2024-15-4-79-89
Аннотация
Цель: оценка влияния персонифицированной иммунотерапии на частоту наступления и вынашивания беременности у женщин с привычной неэффективной имплантацией.
Материалы и методы: клиническая иммунограмма до и после курсов персонифицированной иммуномодулирующей терапии у 65 женщин с привычной неэффективной имплантацией в анамнезе на этапе подготовки к лечению по программе ВРТ (24 криопротокола в естественном цикле, 41 криопротокол с заместительной гормональной терапией без блокады гипофиза): CD3+, CD3+CD4+, CD3+CD8+, CD3+CD20+, CD16+ в прямой реакции поверхностной иммунофлюоресценции с помощью моноклональных антител; концентрация сывороточных иммуноглобулинов (Ig) классов G, A, M методом ИФА; общие циркулирующие иммунные комплексы (ЦИК); НСТ-тест; фагоцитарная активность нейтрофилов.
Результаты: иммунный статус 100% пациенток с вторичным бесплодием и 36,4% женщин с первичным бесплодием характеризуется вторичным Т-иммунодефицитом и значительной активацией как В-лимфоцитов, так и клеточных факторов неспецифической защиты организма — периферических NK-клеток (CD16+) и нейтрофилов. Повторные курсы персонифицированной иммуномодулирующей терапии у женщин с привычной неэффективной имплантацией в анамнезе привели к нормализации измененных показателей иммунитета и показали свою эффективность у 67,7% пациенток, родивших живых детей.
Заключение: одной из ведущих причин привычной неэффективной имплантации при наличии эуплоидных эмбрионов хорошего качества является общий и местный (эндометриальный) иммунологический дисбаланс. Персонифицированный подход к выбору иммуномодулирующих препаратов для каждой пациентки оптимизирует частоту имплантации, наступления и исход беременности.
Ключевые слова
Для цитирования:
Трунова О.А., Гюльмамедова И.Д., Майлян Э.А. Иммуномодулирующая терапия у пациенток с привычной неэффективной имплантацией. Медицинский вестник Юга России. 2024;15(4):79-89. https://doi.org/10.21886/2219-8075-2024-15-4-79-89
For citation:
Trunova O.A., Gulmamedova I.D., Maylyan E.A. Immunotherapy in patients with recurrent implantation failure. Medical Herald of the South of Russia. 2024;15(4):79-89. (In Russ.) https://doi.org/10.21886/2219-8075-2024-15-4-79-89
Введение
Основной лимитирующий фактор эффективности вспомогательных репродуктивных технологий (ВРТ) возникает на этапе имплантации, так как 70% перенесённых эмбрионов не имплантируется [1].
Термин «привычная неэффективная имплантация» (ПНИ) необходим для того, чтобы выявить женщин с аномально низкой вероятностью наступления беременности на один эмбрион, предоставить прогностические данные и провести лечебные мероприятия для оптимизации имплантации при последующих переносах.
В настоящее время существует неоднородность критериев ПНИ. По данным международного опроса, 735 врачей [2], 84% клиницистов определили ПНИ на основании количества перенесённых эмбрионов, при этом самая большая группа (45%) определила ПНИ как неудачный перенос трёх свежих или замороженных эмбрионов. Интересно, что такие факторы, как расположение клиники (европейская или неевропейская), вид собственности (частная или государственная), коррелировали с используемым определением.
Консорциум преимплантационной генетической диагностики Европейского общества репродукции человека и эмбриологии определил привычную неэффективную имплантацию (ПНИ) как 3 и более неудачных переноса эмбрионов высокого качества или неудачный перенос ≥10 эмбрионов при множественных переносах [3]. Американское общество репродуктивной медицины не опубликовало критериев ПНИ. Проблема с определением ПНИ заключается в том, что существует множество факторов, влияющих на успех имплантации: возраст ооцитов и матки, длительность периода бесплодия, генетический статус эмбрионов (метод диагностики), системные заболевания, образ жизни (ожирение или курение), структурные аномалии матки, хронический эндометрит, наличие эндометриоза.
Роль иммунологических факторов в ПНИ — предмет многочисленных дискуссий. Ранняя репродуктивная недостаточность является наиболее частым осложнением беременности, при этом только одна треть зачатий достигает живорождения [4].
Рецидивирующая репродуктивная недостаточность связана с экспансией циркулирующих NK-клеток, ключевых клеток для материнской толерантности, децидуального ангиогенеза и роста эмбриона [5]. NK-клетки в матке (мNK) являются наиболее распространёнными лимфоцитами, обнаруженными в децидуальной оболочке во время имплантации и в первом триместре беременности. Они важны для раннего развития плаценты, особенно инвазии трофобласта и трансформации спиральных артерий. Однако неадекватная функция мNK связана с репродуктивной недостаточностью, такой как привычный выкидыш (ПВ) и ПНИ. Значительное повышение уровня мNK в эндометрии женщин с ПВ и ПНИ может указывать на лежащее в основе нарушение иммунной среды, достигающее кульминации в имплантации и/или недостаточности плацентации [6].
Существует обширная и постоянно развивающаяся литература по балансу Th-1/Th-2 во время беременности. Хотя определенная локальная провоспалительная среда необходима для имплантации эмбриона и ангиогенеза [7], считается, что доминирование провоспалительных цитокинов Th-1 неблагоприятно для наступления и течения беременности, а противовоспалительные цитокины Th-2 регулируют и улучшают ответ Th- 1 [8]. Показано, что у пациенток с ПНИ наблюдалось нарушение баланса про- и противовоспалительных цитокинов в периферической крови: повышение уровня провоспалительных цитокинов IFN-γ, IL-1β и IL-6; снижение уровня противовоспалительного цитокина TGF-β1 и повышенное соотношение провоспалительных/противовоспалительных цитокинов [9].
В течение последних 20 лет для лечения невынашивания беременности активно использовались различные способы иммунотерапии [10] (гранулоцитарный колониестимулирующий фактор [11], ингибиторы ФНО-альфа, ингибитор лейкемии [12][13], глюкокортикоиды [14], интралипид [15][16][17][18], иммуноглобулины [19], иммуноцитотерапия [20][21][22][23][24][25]).
Рандомизированным контролируемым клиническим испытаниям в этой области не достает персонифицированного подхода.
Цель исследования — оценка влияния персонифицированной иммунотерапии на частоту наступления и вынашивания беременности у женщин с привычной неэффективной имплантацией.
Материалы и методы
На этапе подготовки к лечению по программе ВРТ (24 криопротокола в естественном цикле, 41 криопротокол с заместительной гормональной терапией без блокады гипофиза) проведено рандомизированное контролируемое проспективное иммунологическое исследование 65 пациенток 25–40 лет с ПНИ (основная группа). Учитывая эмоциональный фактор неэффективных циклов ВРТ, финансовые затраты, труднореализуемые для жителей нашего региона, длительную продолжительность бесплодия, мы включили в наше исследование супружеские пары с 2 (а не с 3) и более неудачными переносами эмбрионов высокого качества по классификации Д. Гарднера (1999)1. У 8 пациенток эуплоидность эмбрионов была подтверждена методами предимплантационной генетической диагностики. Показаниями к проведению ВРТ были: трубно-перитонеальный фактор бесплодия у 12 (18,46%) пациенток, эндометриоз 2-3 степени у 21 (32,3%) женщины, мужской фактор бесплодия — 32 (49,23%) случая. Женщины с органической патологией эндометрия, аномалиями развития матки были исключены из исследования.
Контрольную группу составили 20 практически здоровых фертильных женщин 25–40 лет.
Данное клиническое исследование выполнено в соответствии с «Правилами клинической практики в Российской Федерации» и Хельсинкской декларацией Всемирной медицинской ассоциации и одобрено этическим комитетом ГОО ВПО «Донецкий национальный медицинский университет имени М. Горького» (протокол № 27/5-1 от 14.04.2021 г.).
Иммунологическое исследование включало анализ отдельных звеньев иммунной системы (T- и B-лимфоцитов (ЛФ)), а также функционального состояния нейтрофилов (НФ). В периферической крови определялись абсолютное число лейкоцитов и ЛФ; осуществлялось иммунофенотипирование лимфоцитов с индикацией абсолютного и относительного количества CD3+ (Т-лимфоцитов), CD3+CD4+ (Т-хелперов), CD3+CD8+ (Т-цитотоксических клеток/супрессоров), CD3+CD20+ (В-лимфоцитов), CD16+ (NK-клеток), а также иммунорегуляторного индекса (Т-хелперы/Т-супрессоры) (CD3+4+/CD3+8+) в прямой реакции поверхностной иммунофлюоресценции с помощью моноклональных антител (МКА) («Becton coulter», Франция) с последующей микроскопией микроскопом (Granum R50) с люминесцентной насадкой (Granum F2). О секреторной активности B-ЛФ судили по концентрации сывороточных иммуноглобулинов (Ig) классов G, A, M методом ИФА («Гранум», Украина). Для определения степени тяжести и активности иммунопатологического процесса в сыворотке крови нефелометрическим методом измеряли уровень общих циркулирующих иммунных комплексов (ЦИК). Метод основан на нефелометрии разной растворимости мономеров Ig в составе иммунных комплексов при наличии в среде полиэтиленгликоля (ПЭГ-6000). Интенсивность кислородозависимого метаболизма нейтрофилов (НФ) изучалась в реакции восстановления нитросинего тетразолия (НСТ) в спонтанном и индуцированном суспензией Serratia marcescens (2*10⁹/мл) НСТ-тесте. При оценке фагоцитарной способности НФ определяли процент клеток, проявивших фагоцитарную активность (ФА) и среднее количество частиц латекса, поглощенных одним НФ (ФЧ).
Исследование проводили во II фазу менструального цикла (19–22-й день).
На этапе планирования программы криопротокола у пациенток исследовались показатели системного иммунитета и в зависимости от выявленных отклонений в иммунном статусе назначались 1, 2 либо 3 индивидуальных курса иммуномодулирующей терапии с учётом достижения положительной динамики или в случае неэффективной последующей имплантации. Интервал между курсами иммунотерапии составлял 6–12 мес. Один курс индивидуальной иммунотерапии получили 37 женщин, два курса потребовались 19 лицам, три курса получили ещё 9 пациенток.
В зависимости от выявленных отклонений в иммунограмме назначались следующие иммуномодуляторы: аминодигидрофталазиндион натрия, аргинил-альфа-аспартил-лизил-валил-тирозил-аргинин диацетат, глюкозаминилмурамилдипептид (ГМДП, синтетический аналог структурного фрагмента оболочки (пептидогликана) бактериальных клеток), азоксимера бромид, аргинил-альфа-кислота рибонуклеиновая, диоксометилтетрагидропиримидин, а также витаминные комплексы, содержащие цинк, селен и медь.
Одной из причин дисфункции иммунной системы обследуемых женщин является хронический стресс, обусловленный проживанием в условиях военных действий. Страх повторной неэффективной попытки также являлся стрессовым раздражителем. Всем пациенткам оcновной группы был назначен седативный фитосбор.
Статистическая обработка данных проводилась методами вариационной статистики в программе «Excell 2016». Достоверность среднегрупповых показателей оценивалась по t-критерию Стьюдента для несвязанных (основная группа — контроль) и связанных (динамика в процессе лечения) выборок.
Результаты
Длительность периода бесплодия в основной группе была от 1 до 20 лет и в среднем составила 7 лет. Первичное бесплодие наблюдалось у 26 (40%) женщин основной группы, вторичное — у 39 (60 %.) Всего лишь у 10 (15,38 %) % женщин с вторичным бесплодием были роды в анамнезе, в 2 (3,08 %) случаях роды были патологическими. В группе женщин с ПНИ обращает на себя внимание высокая частота как искусственных (18–27,69%), так и спонтанных (14–21,54%) абортов, а также внематочных беременностей (16–24,6%).
Показаниями к проведению ВРТ были трубно-перитонеальный фактор бесплодия 12 (18,46%) пациенток, эндометриоз 2–3 степени 21 (32,3%) женщины.
У 32 (49,23%) супружеских пар наблюдался такой мужской фактор бесплодия, как патозооспермия (олиго-, астено-, тератозооспермия и их комбинации), не поддающийся коррекции. Концентрация сперматозоидов — менее ≤2 млн, подвижность — менее ≤5%, морфологически нормальных сперматозоидов — менее ≤5%. При данной патологии получить генетически родной мужчине эмбрион можно только методом интрацитоплазматической инъекции сперматозоида (ИКСИ). У этих пар в анамнезе было 2 цикла ЭКО/ИКСИ с получением морфологически и генетически здоровых эмбрионов, но отсутствовала имплантация, и беременность не наступала. Это объясняется тем, что бесплодие у некоторых супружеских пар обусловлено не одной, а несколькими причинами.
Маточный фактор наблюдался у 54 (83,08%) женщин (гиперплазия, гипоплазия эндометрия, хронический эндометрит, подтверждённый иммуногистохимически, смещение окна имплантации), отклонения функции эндокринной системы выявлены у 41 (63,08%) женщины. Дисфункция щитовидной железы нарушена у 21 (32,31 %) женщины с ПНИ. Соматический анамнез был отягощён у 42 (64%) пациенток. Урогенитальные инфекции в анамнезе отмечало 73% женщин.
От 1 до 4 оперативных вмешательств на органах малого таза имели место у 41 (63,08%) женщины, эндоскопические оперативные вмешательства — у 37 (56,9%). Операции на яичниках были у 25 (38,46%) пациенток, оперативные вмешательства на маточных трубах — у 38 (58,46%).
У всех пациенток в анамнезе было 2 и более неэффективных циклов искусственного оплодотворения. У 57 (87,7%) из них в анамнезе были неэффективные циклы ВРТ, у 8 (12,3%) беременность была биохимической или закончилась самопроизвольным абортом.
Вышеперечисленные анамнестические данные могут явиться причиной хронического стресса и дисбаланса иммунной системы, а высокая частота репродуктивных потерь в анамнезе свидетельствует и о возможных изначальных отклонениях иммунной системы. Перед включением в программу ВРТ была проведена коррекция выявленной гинекологической и соматической патологии.
В основной группе по сравнению с контрольной отмечаются относительный (р=0,026) и абсолютный (р=0,018) лимфоцитоз, снижение процента популяции Т-лимфоцитов (СD3+) (р=0,000001), субпопуляции Т-хелперов (СD3+ СD4+) (р=0,00034), абсолютного числа Т-цитотоксических клеток/супрессоров (СD3+СD8+) (р=0,05), а также значения иммунорегуляторного индекса (р=0,010). При этом относительное (р=0,00004) и абсолютное (р=0,0001) число В-лимфоцитов (СD20+), а также NK-клеток (СD16+) (относительное — р=0,000001, абсолютное — р=0,000001) достоверно превышали значения контрольных показателей (табл. 1).
Таблица / Table 1
Показатели иммунограммы в основной группе женщин с ПНИ и в контрольной группе
Immunogram indicators in the main group of women with recurrent implantation failure and in the control group (X̄±Sx̄)
|
Показатели / Indicators |
Основная группа / Main group |
Контрольная группа / Control group |
р = |
|
Лейкоциты, Г/л / Leukocytes (gigalitre) |
6,01±0,24 |
5,88±0,21 |
0,684 |
|
Лимфоциты / Lymphocytes, % |
37,96±1,25 |
33,9±1,3 |
0,026 |
|
Лимфоциты, Г/л / Lymphocytes (gigalitre) |
2,24±0,1 |
1,96±0,06 |
0,018 |
|
Т-лимфоциты / T-lymphocytes (СD3+), % |
41,90±1,79 |
55,6±1,9 |
0,000001 |
|
Т-лимфоциты, Г/л / T-lymphocytes (СD3+) (gigalitre) |
0,93±0,059 |
1,09±0,08 |
0,113 |
|
Т-хелперы / T-helpers (СD3+СD4+), % |
24,16±1,27 |
35,3±2,7 |
0,00034 |
|
Т-хелперы, Г/л / T-helpers (СD3+СD4+) (gigalitre) |
0,53±0,04 |
0,65±0,05 |
0,050 |
|
Т- цитотоксические клетки/супрессоры / T-cytotoxic cells/suppressors (СD3+СD8+), % |
21,93±1,0 |
21,3±0,9 |
0,640 |
|
Т- цитотоксические клетки/супрессоры, Г/л / T-cytotoxic cells /suppressors (СD3+СD8+) (gigalitre) |
0,49±0,034 |
0,41±0,03 |
0,050 |
|
Т-хелперы/Т-супрессоры / T-helpers/T-suppressors |
1,26±0,082 |
1,64±0,12 |
0,010 |
|
В-лимфоциты (СD20+) / B-lymphocytes, % |
21,60±1,34 |
13,8±1,2 |
0,00004 |
|
В-лимфоциты, Г/л / B-lymphocytes (СD20+) (gigalitre) |
0,50±0,053 |
0,29±0,02 |
0,0001 |
|
NK-клетки / NK-cells (СD16+), % |
26,27±1,54 |
15,7±1,3 |
0,000001 |
|
NK-клетки, Г/л / NK-cells (СD16+) (gigalitre) |
0,59±0,047 |
0,27±0,02 |
0,000001 |
|
Фагоцитарная активность нейтрофилов / Phagocytic activity of neutrophils, % |
49,76±1,85 |
54,3±3,6 |
0,265 |
|
Фагоцитарное число / Phagocytic number |
3,07±0,17 |
2,53±0,19 |
0,037 |
|
Спонтанный НСТ-тест / Spontaneous Nitroblue tetrazolium (NBT) dye reduction test, % |
27,25±1,15 |
15,0±0,8 |
0,000001 |
|
Спонтанный ИАН / Spontaneous neutrophil activation index |
0,33±0,019 |
0,25±0,02 |
0,005 |
|
Индуцированный НСТ-тест / Induced Nitroblue tetrazolium (NBT) dye reduction test, % |
34,46±1,35 |
38,6±1,57 |
0,049 |
|
Индуцированный ИАН / Induced neutrophil activation index |
0,42±0,018 |
0,48±0,09 |
0,516 |
|
Циркулирующие иммунные комплексы, усл. ед. / Circulating immune complexes (standard unit) |
20,21±1,93 |
11,5±2,11 |
0,003 |
|
Иммуноглобулин А, г/л / Immunoglobulin A (g/l) |
2,13±0,104 |
1,9±0,08 |
0,076 |
|
Иммуноглобулин М, г/л / Immunoglobulin M (g/l) |
2,06±0,12 |
1,15±0,06 |
0,000001 |
|
Иммуноглобулин G, г/л / Immunoglobulin G (g/l) |
12,05±0,49 |
11,5±0,5 |
0,434 |
Имела место гипериммуноглобулинемия М (р=0,000001). При этом концентрации иммуноглобулинов А и G находились в пределах физиологической нормы. Общее количество циркулирующих иммунных комплексов было увеличено в сравнении с контролем (р =0,003).
Фагоцитарная активность нейтрофилов как показателя клеточного звена неспецифической реактивности организма у женщин основной группы не имела статистически значимой разницы с контролем (р=0,265). Однако, согласно данным спонтанного НСТ-теста, можно констатировать нарушение гомеостаза организма женщин с ПНИ (НСТ-тест спонт. — 27,25±1,15 %; контроль — 15,0±0,8 %; р=0,000001; ИАН спонт. — 0,33±0,019; контроль — 0,25±0,02; р=0,005). Остальные показатели находились в пределах физиологической нормы.
У 30% пациенток наблюдались сочетание снижения абсолютного числа СD3+ клеток и повышение числа NK-клеток.
В зависимости от ведущего звена нарушения иммунного гомеостаза клиническим иммунологом был предложен следующий алгоритм иммунотропной терапии.
При выраженном иммунодефицитном состоянии по гипо-Т-хелперному, гипо-Т-супрессорному типу со снижением относительного и абсолютного количества Т-клеток, низком значении иммунорегуляторного индекса назначались аргинил-альфа-аспартил-лизил-валил-тирозил-аргинин диацетат по 1 мл 0,005% раствора внутримышечно 1 раз через 2-е суток (курс — 15 инъекций) либо ГМДП (10 мг 1 в сутки, курс — 10 суток) и аргинил-альфа-кислота рибонуклеиновая по 250 мг 4 раза в сутки (курс — 20 дней).
В случае истощения резервов для кислородзависимого метаболизма нейтрофилов пациентки принимали аминодигидрофталазиндион натрия в свечах 1 раз в 3 дня (курс — 15 дней) и диоксометилтетрагидропиримидин по 500 мг 4 раза в сутки (курс — 20 дней).
При дисбалансе иммунной системы, проявляющемся снижением Т-лимфоцитов (СD3+) и их субпопуляций с одновременным увеличением В-лимфоцитов (СD20+), NK-клеток (СD16+), гипериммуноглобулинемией А и М,а также активацией фагоцитарной активности с истощением резервных возможностей нейтрофилов к респираторному взрыву назначался азоксимера бромид по 12 мг 1 раз в сутки внутримышечно (курс — 15 инъекций) либо аминодигидрофталазиндион натрия в свечах 1 раз в сутки через 2 дня на третий (курс — 15 дней).
Все пациентки в течение 2 месяцев принимали комплекс витаминов и микроэлементов (в том числе содержащие цинк, селен и медь).
У большинства пациенток после первого курса наступало улучшение состояния, сопровождавшееся достоверным увеличением как доли (30,30±1,59%, до лечения — 24,16±1,27%, р=0,003), так и абсолютного числа (0,70±0,052 Г/л, до лечения — 0,53±0,04 Г/л, р=0,008) сниженной до лечения субпопуляции Т-хелперов (CD3+) (CD4+) (табл. 2, рис. 1).
Таблица / Table 2
Показатели иммунограммы женщин основной группы до и после курсов иммунотропной терапии, (X̄±Sx̄)
Immunogram indicators of women in the main group before and After courses of immunotropic therapy, (X̄±Sx̄)
|
Показатели / Indicators |
До лечения / Before treatment |
После І курса лечения / After the first course of treatment |
р 0–I |
После ІІ курса лечения / After the second course of treatment |
р 0–II |
После ІІІ курса лечения / After the third course of treatment |
р 0–III |
|
Лейкоциты, Г/л / Leukocytes (gigalitre) |
6,01±0,24 |
5,95±0,22 |
0,850 |
5,88±0,29 |
0,730 |
5,68±0,606 |
0,620 |
|
Лимфоциты / Lymphocytes, % |
37,96±1,25 |
38,69±1,33 |
0,690 |
37,28±1,94 |
0,760 |
41,33±3,78 |
0,390 |
|
Лимфоциты, Г/л /Lymphocytes ((gigalitre) |
2,24±0,1 |
2,28±0,11 |
0,790 |
2,19±0,16 |
0,790 |
2,32±0,303 |
0,800 |
|
Т-лимфоциты / T-lymphocytes (СD3+), % |
41,90±1,79 |
45,93±2,13 |
0,150 |
52,86±3,51 |
0,007 |
56,67±5,81 |
0,017 |
|
Т-лимфоциты, Г/л / T-lymphocytes (gigalitre) (СD3+) |
0,93±0,059 |
1,08±0,079 |
0,136 |
1,16±0,12 |
0,089 |
1,27±0,181 |
0,077 |
|
Т-хелперы / T-helpers (СD4+), % |
24,16±1,27 |
30,30±1,59 |
0,003 |
33,21±2,63 |
0,002 |
36,33±4,12 |
0,006 |
|
Т-хелперы, Г/л / T-helpers (gigalitre) (СD4+) |
0,53±0,04 |
0,70±0,052 |
0,008 |
0,71±0,08 |
0,047 |
0,83±0,136 |
0,042 |
|
Т- цитотоксические клетки/супрессоры / T-cytotoxic cells/suppressors (СD8+), % |
21,93±1,0 |
23,03±0,98 |
0,433 |
24,90±1,76 |
0,145 |
24,00±2,69 |
0,473 |
|
Т-цитотоксические клетки/супрессоры, Г/л / T-cytotoxic cells /suppressors (СD8+) (gigalitre) |
0,49±0,034 |
0,53±0,036 |
0,425 |
0,54±0,058 |
0,457 |
0,58±0,117 |
0,469 |
|
Т-хелперы/Т-супрессоры / T-helpers/T-suppressors |
1,26±0,082 |
1,35±0,065 |
0,398 |
1,50±0,148 |
0,161 |
1,53±0,133 |
0,081 |
|
В-лимфоциты (СD20+) / B-lymphocytes, % |
21,60±1,34 |
22,22±1,19 |
0,729 |
21,62±1,6 |
0,992 |
24,89±3,03 |
0,323 |
|
В-лимфоциты, Г/л / B-lymphocytes (gigalitre) (СD20+) |
0,50±0,053 |
0,52±0,043 |
0,755 |
0,47±0,051 |
0,672 |
0,57±0,089 |
0,498 |
|
NK-клетки / NK-cells (СD16+), % |
26,27±1,54 |
25,13±1,33 |
0,576 |
28,34±2,61 |
0,496 |
27,44±3,63 |
0,767 |
|
NK-клетки, Г/л / NK-cells (gigalitre) (СD16+) |
0,59±0,047 |
0,59±0,05 |
1,000 |
0,62±0,082 |
0,984 |
0,65±0,11 |
0,969 |
|
Фагоцитарная активность нейтрофилов / Phagocytic activity of neutrophils, % |
49,76±1,85 |
50,85±2,07 |
0,696 |
50,28±2,87 |
0,879 |
48,50±3,25 |
0,737 |
|
Фагоцитарное число / Phagocytic number |
3,07±0,17 |
3,36±0,23 |
0,312 |
3,71±0,37 |
0,119 |
2,46±0,265 |
0,050 |
|
Спонтанный НСТ-тест / Spontaneous Nitroblue tetrazolium (NBT) dye reduction test, % |
27,25±1,15 |
27,15±1,17 |
1,000 |
31,55±2,29 |
0,050 |
34,50±4,34 |
0,110 |
|
Спонтанный ИАН / Spontaneous neutrophil activation index |
0,33±0,019 |
0,36±0,037 |
0,503 |
0,41±0,037 |
0,076 |
0,38±0,05 |
0,356 |
|
Индуцированный НСТ-тест / Induced Nitroblue tetrazolium (NBT) dye reduction test, % |
34,46±1,35 |
34,58±1,26 |
0,948 |
38,52±2,12 |
0,109 |
40,00±4,07 |
0,199 |
|
Индуцированный ИАН / Induced neutrophil activation index |
0,42±0,018 |
1,02±0,59 |
0,0001 |
0,48±0,029 |
0,099 |
0,45±0,056 |
0,636 |
|
Циркулирующие иммунные комплексы, усл. ед. / Circulating immune complexes (standard unit) |
20,21±1,93 |
23,24±2,34 |
0,319 |
24,17±3,95 |
0,370 |
15,00±3,29 |
0,176 |
|
Иммуноглобулин А, г/л / Immunoglobulin A (g/l) |
2,13±0,104 |
2,26±0,12 |
0,406 |
2,23±0,191 |
0,642 |
2,59±0,41 |
0,279 |
|
Иммуноглобулин М, г/л / Immunoglobulin M (g/l) |
2,06±0,12 |
2,16±0,12 |
0,556 |
2,28±0,196 |
0,348 |
2,09±0,27 |
0,919 |
|
Иммуноглобулин G, г/л / Immunoglobulin G (g/l) |
12,05±0,49 |
12,73±0,55 |
0,358 |
13,61±0,79 |
0,097 |
11,89±1,18 |
0,900 |
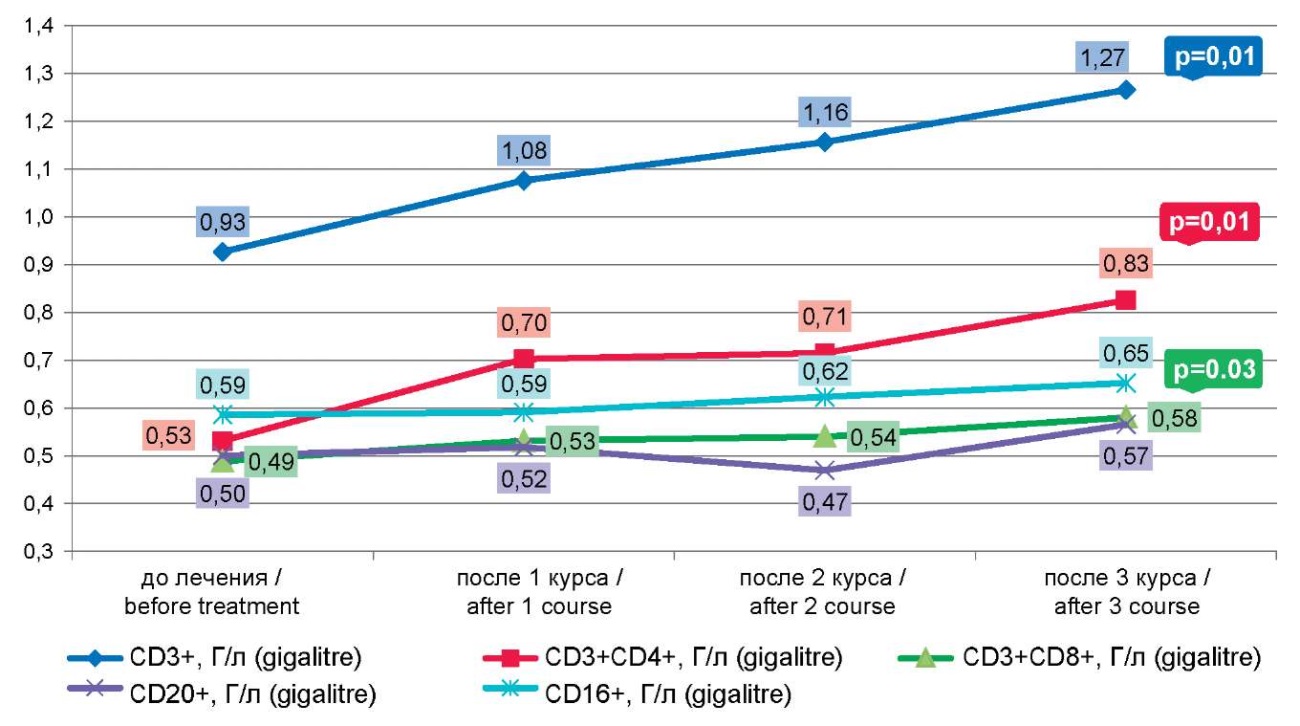
Рисунок 1. Динамика количества CD 3+, 4+, 8+, 16+, 20+ лимфоцитов после курсов иммунокоррекции
Figure 1. Dynamics of the number of CD 3+, 4+, 8+, 16+, 20+ lymphocytes after immunocorrection courses
Повторные курсы приводили к ещё более выраженной стимуляции Т-звена и достоверному увеличению доли Т-лимфоцитов (CD3+): после II курса — 52,86±3,51% (р=0,007), после III курса — 56,67±5,81% (р=0,017) (табл. 2, рис. 1).
Иммунорегуляторный индекс (CD3+4+/CD3+8+) имел тенденцию к повышению с каждым курсом иммунокоррекции, очевидно, за счёт статистически достоверного увеличения доли и абсолютного числа Т-хелперов (CD3+) (CD4+): I курс р=0,003; II курс р= 0,002; III курс р= 0,007.
Количество и функциональная активность В-лимфоцитов (СD20+), как и NK-клеток (СD16+), статистически достоверно не изменялось.
Достоверных изменений фагоцитарной активности нейтрофилов после первого курса лечения не происходило, однако их способность к «респираторному взрыву», по данным индуцированного НСТ-теста, статистически достоверно увеличивалась после первого курса иммунокоррекции (1,02±0,59, до лечения — 0,42±0,018, р=0,0001).
Стимуляция показателей фагоцитарной и метаболической активности нейтрофилов, рассчитанных на 1 клетку, также наблюдалась уже после первого курса иммуномодулирующей терапии (фагоцитарное число и индуцированный индекс активации нейтрофилов) (табл. 2, рис. 3).
Второй курс иммунокоррекции приводил к увеличению показателя спонтанного НСТ-теста (31,55±2,29 %, до лечения — 27,25±1,15 %, р=0,050 (табл. 2, рис. 2). Третий же курс, очевидно, истощал резервные возможности нейтрофилов, поскольку фагоцитарное число статистически достоверно снижалось (табл. 2, рис. 3).
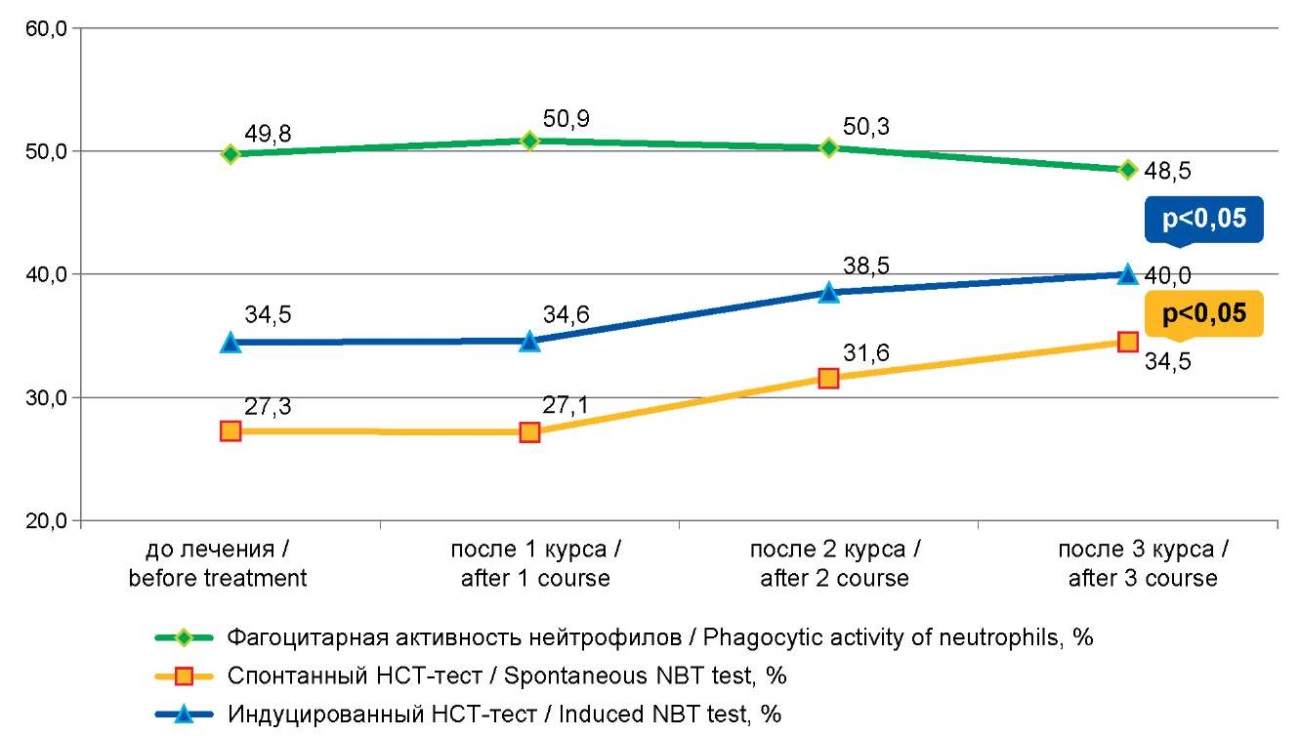
Рисунок 2. Динамика фагоцитарной и метаболической активности нейтрофилов после курсов иммунокоррекции
Figure2. Dynamics of phagocytic and metabolic activity of neutrophils after immunocorrection courses
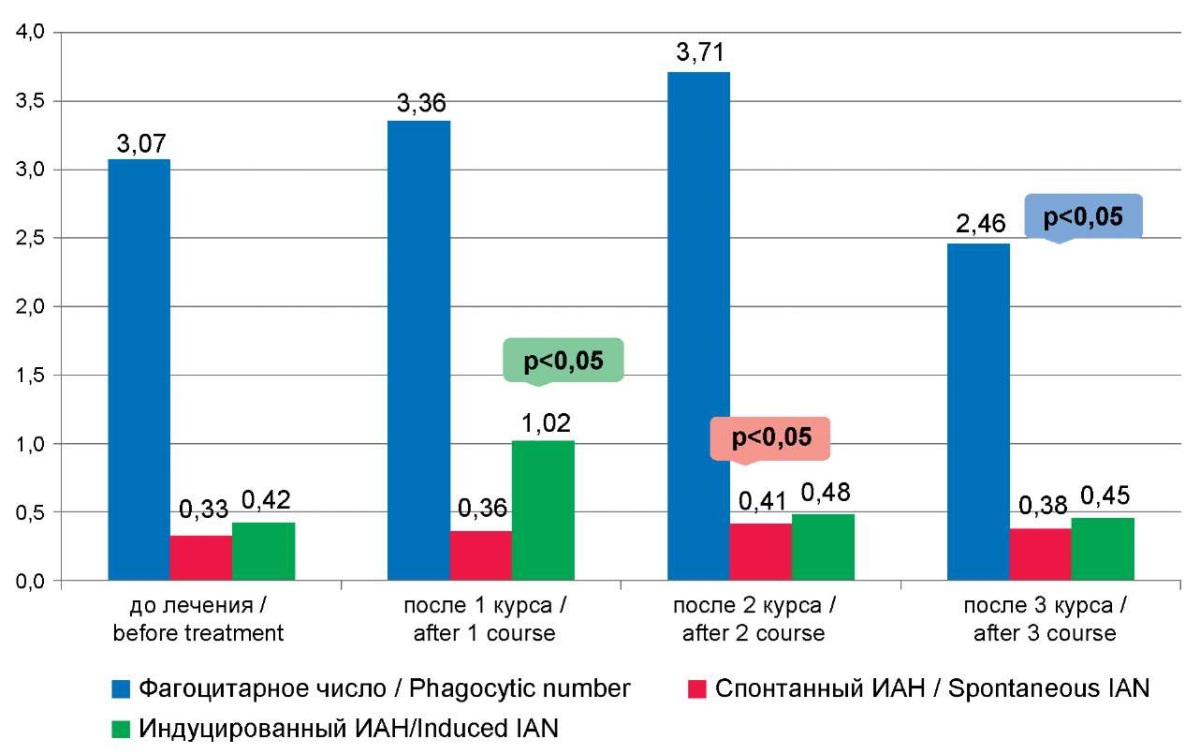
Рисунок 3. Показатели фагоцитарного числа, спонтанного и индуцированного индексов активации нейтрофилов после курсов иммунокоррекции
Figure 3. The indicators of phagocytic number, spontaneous and induced neutrophil activation indices After immunocorrection courses
Курсы индивидуальной иммунокоррекции с применением аргинил-альфа-кислоты рибонуклеиновой приводили к достоверной нормализации процента В-лимфоцитов (р=0,02), концентрации сывороточного Ig М (р=0,01), фагоцитарной активности нейтрофилов (р=0,04). Азоксимера бромид повышал сниженные Т-хелперы (СD3+4+) (р=0,05), а аргинил-альфа-аспартил-лизил-валил-тирозил-аргинин диацетат увеличивал количество сниженных Т-лимфоцитов (СD3+) (р=0,02) и уменьшал до нормы увеличенные ЦИК (р=0,05).
После первого курса индивидуальной иммунокоррекции с последующей ЭКО/ИКСИ процедурой роды наступили в 51,35% случаев (19 из 37 женщин). Два курса привели к успешному родоразрешению 84,2% пациенток (16 из 19 женщин). Три курса позволили стать матерью всем 9 женщинам (100%).
Обсуждение
Данные научной медицинской литературы свидетельствуют о том, что общепринятые методы обследования супружеских пар не позволяют уточнить причину бесплодия в 20–30% случаев. Задачей нашей работы было предложить практическому врачу доступный, эффективный, малоинвазивный метод иммунодиагностики и иммунокоррекции у женщин с ПНИ, в анамнезе которых имелось большое количество лечебно-диагностических вмешательств.
Несмотря на то, что основные события, связанные с нарушением имплантации, происходят в эндометрии, показатели системного иммунитета периферической крови в определенной степени коррелируют с показателями местного иммунитета, а также определяют способность иммунной системы женщины обеспечить необходимую толерантность к «аллотрансплантанту» (эмбриону).
Повышенный уровень самопроизвольных абортов и неудачи с ЭКО в определённой степени обусловлены цитотоксичностью NK-клеток. Обнаружение увеличения уровня и активности циркулирующих NK-клеток полезно для выявления лиц с риском отсутствия имплантации эмбрионов и потери кариотипически нормальной беременности [26]. В.А. Загайновой и соавт. (2022) установлили обратную корреляцию между количеством беременностей в анамнезе и абсолютным содержанием активированных NK-клеток (rs=- 0,55; p<0,01) [27].
В нашем исследовании не были получены данные об эффективной коррекции числа NK-клеток (CD16+). Аналогичный вывод сделан в систематическом обзоре E. Von Woon et al. (2020), посвящённом оценке эффективности иммунотерапии для улучшения исходов беременности у женщин с привычным невынашиванием беременности или неудачей имплантации, специально отобранных на основе аномальных уровней и/или активности NK-клеток. Авторы заключают, что иммунотерапия может иметь некоторую пользу, но необходимы дальнейшие исследования с применением научно подтверждённых иммунологических биомаркеров в хорошо спланированных крупномасштабных рандомизированных контролируемых исследованиях [28].
Полученные нами данные согласуются и с метаанализом из Medline, Embase и Cochrane Library, проведённым A. Mekinian et al. (2016), о преимуществах иммуномодулирующих препаратов при привычных выкидышах и неудачах имплантации, когда была обнаружена умеренная польза прогестерона для рождения живого ребенка с отношением шансов 1,38. Антагонисты TNF-α в сочетании с низкими дозами аспирина, гепарина и внутривенных иммуноглобулинов обеспечили рождаемость в 71%, а назначение Г-КСФ закончилось живорождением в 82,8% [18]. K. Kolanska et al. (2021) сообщает, что применение иммуномодулирующей терапии и стероидов у пациенток с беременностью и необъяснимыми привычными выкидышами в анамнезе помогло улучшить акушерские исходы, поскольку удваивало шансы родить живого ребенка [29].
Заключение
Иммунный статус бесплодных женщин характеризуется вторичным Т-иммунодефицитом и значительной активацией как В-лимфоцитов, так и клеточных факторов неспецифической защиты организма (периферических NK-клеток (CD16+) крови и фагоцитов-нейтрофилов). Такие изменения иммунного профиля возникали у 100% пациенток с вторичным бесплодием и у 36,4% женщин с первичным бесплодием. В случаях, когда эти отклонения достигают критических величин, они негативно влияют на прогноз достижения беременности. Неудачи вспомогательных репродуктивных технологий при наличии эмбрионов хорошего качества обусловлены иммунологическим дисбалансом. Мужской фактор может сочетаться с отклонениями в иммунной системе женщины, что является одной из причин ПНИ. Это сочетание наблюдалось в нашем исследовании и было успешно откорректировано.
Персонифицированный подход к выбору иммуномодулирующих препаратов для каждой пациентки оптимизирует частоту имплантации, наступления и исход беременности.
Таким образом, повторные курсы персонифицированной иммуномодулирующей терапии у женщин с ПНИ в анамнезе привели к нормализации измененных показателей иммунитета и показали свою эффективность у 67,7% пациенток при наличии эмбрионов хорошего качества, увеличив шансы наступления имплантации, возможности вынашивания беременности и родов.
1. Оценка ооцитов и эмбрионов в лаборатории ВРТ: Методические рекомендации. Российская Ассоциация Репродукции Человека Секция «Клиническая эмбриология». 2021.
Список литературы
1. Cheloufi M, Kazhalawi A, Pinton A, Rahmati M, Chevrier L, et al. The Endometrial Immune Profiling May Positively Affect the Management of Recurrent Pregnancy Loss. Front Immunol. 2021;12:656701. https://doi.org/10.3389/fimmu.2021.656701
2. Cimadomo D, Craciunas L, Vermeulen N, Vomstein K, Toth B. Definition, diagnostic and therapeutic options in recurrent implantation failure: an international survey of clinicians and embryologists. Hum Reprod. 2021;36(2):305-317. https://doi.org/10.1093/humrep/deaa317
3. Ata B, Kalafat E, Somigliana E. A new definition of recurrent implantation failure on the basis of anticipated blastocyst aneuploidy rates across female age. Fertil Steril. 2021;116(5):1320-1327. https://doi.org/10.1016/j.fertnstert.2021.06.045
4. Craciunas L, Gallos I, Chu j, Bourne T, quenby S, et al. Conventional and modern markers of endometrial receptivity: a systematic review and meta-analysis. Hum Reprod Update. 2019;25(2):202-223. https://doi.org/10.1093/humupd/dmy044
5. Ramos-Medina R, García-Segovia A, Gil j, Carbone j, Aguarón de la Cruz A, et al. Experience in IVIg therapy for selected women with recurrent reproductive failure and NK cell expansion. Am J Reprod Immunol. 2014;71(5):458-466. https://doi.org/10.1111/aji.12217
6. Von woon E, Greer O, Shah N, Nikolaou D, johnson M, Male V. Number and function of uterine natural killer cells in recurrent miscarriage and implantation failure: a systematic review and meta-analysis. Hum Reprod Update. 2022;28(4):548-582. https://doi.org/10.1093/humupd/dmac006
7. Mor G. Clinical aspect of reproductive immunology. Am J Reprod Immunol. 2011;66(6):451. https://doi.org/10.1111/j.1600-0897.2011.01091.x
8. Saito S, Nakashima A, Shima T, Ito M. Th1/Th2/Th17 and regulatory T-cell paradigm in pregnancy. Am J Reprod Immunol. 2010;63(6):601-610. https://doi.org/10.1111/j.1600-0897.2010.00852.x
9. Liang PY, Diao LH, Huang CY, Lian RC, Chen X, et al. The pro-inflammatory and anti-inflammatory cytokine profile in peripheral blood of women with recurrent implantation failure. Reprod Biomed Online. 2015;31(6):823-826. https://doi.org/10.1016/j.rbmo.2015.08.009
10. Achilli C, Duran-Retamal M, Saab W, Serhal P, Seshadri S. The role of immunotherapy in in vitro fertilization and recurrent pregnancy loss: a systematic review and meta-analysis. Fertil Steril. 2018;110(6):1089-1100. https://doi.org/10.1016/jfertnstert.2018.07.004
11. Laufer N, Simon A. Recurrent implantation failure: current update and clinical approach to an ongoing challenge. Fertil Steril. 2012;97:1019–1020. https://doi.org/10.1016/j.fertnstert.2012.03.033
12. Das M, Holzer HE. Recurrent implantation failure: gamete and embryo factors. Fertil Steril. 2012;97:1021–1027. https://doi.org/10.1016/j.fertnstert.2012.02.029
13. Penzias AS. Recurrent IVF failure: other factors. Fertil Steril. 2012;97:1033–1038. https://doi.org/10.1016/j.fertnstert.2012.03.017
14. Kwak-Kim J, Han AR, Gilman-Sachs A, Fishel S, Leong S, Shoham Z. Current trends of reproductive immunology practices in in vitro fertilization (IVF)—a first world survey using IVF-worldwide.com. Am J Reprod Immunol. 2013; 69:12–20. https://doi.org/10.1111/j.1600-0897.2012.01183.x
15. Polanski LT, Baumgarten MN, Quenby S, Brosens J, Camp-bell BK, RaineFenning NJ. what exactly do we mean by ‘‘recurrent implantation failure’’? A systematic review and opinion. Reprod Biomed Online. 2014;28:409–423. https://doi.org/10.1016/j.rbmo.2013.12.006
16. Plaçais L, Kolanska K, Kraiem YB, Cohen J, Suner L, Bornes M, et al. Intralipid therapy for unexplained recurrent miscarriage and implantation failure: Case-series and literature review. Eur J Obstet Gynecol Reprod Biol. 2020;252:100-104. https://doi.org/10.1016/j.ejogrb.2020.06.017
17. Coulam CB. Intralipid treatment for women with reproductive failures. Am J Reprod Immunol. 2021;85(4):e13290. https://doi.org/10.1111/aji.13290
18. Mekinian A, Cohen j, Alijotas-Reig J, Carbillon L, Nicaise-Roland P, et al. Unexplained Recurrent Miscarriage and Recurrent Implantation Failure: Is There a Place for Immunomodulation? Am J Reprod Immunol. 2016;76(1):8-28. https://doi.org/10.1111/aji.12493
19. Human Fertilisation and Embryology Authority. Fertility treatment 2014—Trends and figures. 2016.
20. Assisted Reproductive Technology. National Summary Report. CDC; 2015.
21. Кречетова Л.В., Вторушина В.В., Инвияева Е.В., Ванько Л.В., Николаева М.А., Тетруашвили Н.К. Влияние иммуноцитотерапии на состояние иммунной системы женщин с идиопатическим привычным выкидышем. Медицинская иммунология. 2020;22(4):751-764. https://doi.org/10.15789/1563-0625-EOI-1860
22. Кречетова Л.В., Вторушина В.В., Ванько Л.В., Николаева М.А., Инвияева Е.В., Тетруашвили Н.К. Значимость оценки экспрессии CD69 лимфоцитами периферической крови для прогноза исходов беременности у женщин с привычным выкидышем. Биомедицинская химия. 2020;66(6):477-484. https://doi.org/10.18097/PBMC20206606477.
23. Менжинская И.В., Ионанидзе Т.Б., Ванько Л.В., Тетруашвили Н.К., Кречетова Л.В. Аутоантитела как факторы риска угрожающего выкидыша у женщин с ранними потерями беременности. Акушерство и гинекология. 2021;8:94-101. https://doi.org/10.18565/aig.2021.8.94-101
24. Вторушина В.В., Кречетова Л.В., Инвияева Е.В., Тетруашвили Н.К. Фактор, in vitro подавляющий миграцию макрофагов, в крови женщин с привычным выкидышем при беременности, развивающейся после иммуноцитотерапии. Российский иммунологический журнал. 2021;24(3):399-408. https://doi.org/10.46235/1028-7221-1040-MIF
25. Николаева М.А., Арефьева А.С., Степанова Е.О., Голубева Е.Л., Вторушина В.В., и соавт. Сроки наступления беременности после предгестационной аллоиммунизации и цитокиновый профиль клеток периферической крови у женщин с привычным выкидышем в анамнезе. Акушерство и гинекология. 2021;(1):79-87. https://doi.org/10.18565/aig.2021.1.79-87.
26. Загайнова В.А., Коган И.Ю., Сельков С.А., Беспалова О.Н., Крихели И.О., и соавт. NK-клетки периферической крови у пациенток с неэффективными протоколами вспомогательных репродуктивных технологий: количество, субпопуляционный состав и маркеры активации. Акушерство и гинекология. 2022;(9):102-113. https://doi.org/10.18565/aig.2022.9.102-113.
27. Kolanska K, Alijotas-Reig J, Cohen J, Cheloufi M, Selleret L, et al. Endometriosis with infertility: A comprehensive review on the role of immune deregulation and immunomodulation therapy. Am J Reprod Immunol. 2021;85(3):e13384. https://doi.org/10.1111/aji.13384
28. Woon EV, Day A, Bracewell-Milnes T, Male V, Johnson M. Immunotherapy to improve pregnancy outcome in women with abnormal natural killer cell levels/activity and recurrent miscarriage or implantation failure: A systematic review and meta-analysis. J Reprod Immunol. 2020;142:103189. https://doi.org/10.1016/j.jri.2020.103189
29. Kolanska K, Dabi Y, Dechartres A, Cohen J, Ben Kraiem Y, et al. Unexplained recurrent miscarriages: predictive value of immune biomarkers and immunomodulatory therapies for live birth. Am J Reprod Immunol. 2021;86(2):e13425. https://doi.org/10.1111/aji.13425
Об авторах
О. А. ТруноваРоссия
Трунова Ольга Арнольдовна, д.и.н., профессор кафедры организации высшего образования, управления здравоохранением и эпидемиологии
Донецк, ДНР
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
И. Д. Гюльмамедова
Россия
Гюльмамедова Ирина Дмитриевна, д.м.н., доцент, профессор кафедры акушерства, гинекологии, перинатологии, детской и подростковой гинекологии
Донецк, ДНР
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Э. А. Майлян
Россия
Майлян Эдуард Апетнакович, д.м.н., доцент, зав. кафедрой микробиологии, вирусологии, иммунологии и аллергологии
Донецк, ДНР
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Рецензия
Для цитирования:
Трунова О.А., Гюльмамедова И.Д., Майлян Э.А. Иммуномодулирующая терапия у пациенток с привычной неэффективной имплантацией. Медицинский вестник Юга России. 2024;15(4):79-89. https://doi.org/10.21886/2219-8075-2024-15-4-79-89
For citation:
Trunova O.A., Gulmamedova I.D., Maylyan E.A. Immunotherapy in patients with recurrent implantation failure. Medical Herald of the South of Russia. 2024;15(4):79-89. (In Russ.) https://doi.org/10.21886/2219-8075-2024-15-4-79-89







































