Перейти к:
Преодоление бедного овариального ответа в программах вспомогательных репродуктивных технологий у пациенток позднего репродуктивного возраста
https://doi.org/10.21886/2219-8075-2024-15-1-98-107
Аннотация
Цель: повышение результативности экстракорпорального оплодотворения у пациенток позднего репродуктивного возраста путём оптимизации предгравидарной подготовки к программе ЭКО.
Материалы и методы: в исследование включены 67 пациенток в позднем репродуктивном возрасте с неудачными попытками ЭКО в анамнезе, разделённые на втором этапе исследования в зависимости от объёма предгравидарной подготовки на две группы: I группа (33 пациентки), II группа (34 пациентки). Контрольную группу (50 пациенток) составили здоровые женщины репродуктивного возраста. Проводились иммуногистохимическое исследование эндометрия и микробиологическое обследование полости матки, определялся гормональный статус периферической крови, исследовались концентрации мелатонина в периферической крови и фолликулярной жидкости, антиоксидантный статус фолликулярной жидкости, экспрессия лейкемия ингибирующего фактора (LIF) в цервикальном секрете.
Результаты: у пациенток на фоне возрастной дизрегуляции гипоталамо-гипофизарно-яичниковой оси и нарушения фертильной функции выявлено системное и локальное (в фолликулах) снижение уровня мелатонина. Изученные эффекты мелатонина позволили предположить, что его применение у пациенток позднего репродуктивного возраста со сниженным фолликулярным резервом и «бедным» ответом на стимуляцию яичников может повысить результативность ЭКО.
Выводы: включение в предгравидарную подготовку комплекса водорастворимых полипептидных фракций эпифиза, стимулирующих выработку эндогенного мелатонина, позволило повысить результативность вспомогательных репродуктивных технологий (ВРТ) у пациенток в среднем в 3,1 раза по критерию «клиническая беременность» и в 4,1 раза по критерию «живорождение».
Для цитирования:
Урюпина К.В., Куценко И.И., Кравцова Е.И., Арзуманян К.А., Мусави М.Н. Преодоление бедного овариального ответа в программах вспомогательных репродуктивных технологий у пациенток позднего репродуктивного возраста. Медицинский вестник Юга России. 2024;15(1):98-107. https://doi.org/10.21886/2219-8075-2024-15-1-98-107
For citation:
Uryupina K.V., Kucenko I.I., Kravczova E.I., Arzumanyan K.A., Musavi M.N. Overcoming poor ovarian response in assisted reproductive technology programs in patients of late reproductive age. Medical Herald of the South of Russia. 2024;15(1):98-107. (In Russ.) https://doi.org/10.21886/2219-8075-2024-15-1-98-107
Введение
Необходимость осуществления репродуктивных планов женщинами в позднем репродуктивном возрасте является одной из актуальных проблем современного акушерства и гинекологии. К доминирующим факторам снижения репродуктивного потенциала у женщин позднего репродуктивного возраста, помимо осложнённого акушерского и гинекологического анамнеза, а также и нарастания частоты соматической патологии, относится падение естественной фертильности. С учётом отложенной реализации фертильной функции, вспомогательные репродуктивные технологии (ВРТ) дают возможность обеспечить деторождение возрастным пациенткам старше 35 лет. Согласно отчетам Российской ассоциации репродукции человека (2020), на долю пациенток позднего репродуктивного возраста приходится около 54,4% стандартных программ экстракорпорального оплодотворения (ЭКО). Возраст, безусловно, является ключевым патогенетическим фактором неудач ЭКО у данной когорты пациенток, так как на фоне прогрессирующей редукции фолликулярного резерва у них наблюдается «бедный» овариальный ответ, определяемый более чем в 50% случаев [1]. При этом сниженный фолликулярный резерв и бедный овариальный ответ у пациенток в позднем репродуктивном возрасте сопровождаются уменьшением частоты оплодотворения ооцитов вследствие их худшего качества, сниженным качеством получаемых эмбрионов, высокой частотой анеуплоидии и уменьшенной вероятностью имплантации эмбрионов [2]. Кроме низкого овариального резерва у пациенток позднего репродуктивного возраста отмечается снижение имплантационного потенциала эндометрия. Дестабилизация гормонального фона и цитокинового ответа, в том числе изменение экспрессии фактора, ингибирующего лейкемию (LIF), десинхронизация фаз маточного цикла свидетельствуют о нарушенной рецептивности эндометрия, что снижает вероятность имплантации даже при хорошем качестве эмбрионов [3][4]. Несмотря на то, что в настоящее время разработано множество методов, улучшающих исходы программ ЭКО и живорождения, у пациенток позднего репродуктивного возраста, продолжается активный поиск средств повышения качества ооцитов и эндометрия.
Исследования последних десятилетий показали, что мелатонин играет важную роль в синхронизации различных репродуктивных процессов. Регуляторные, антиоксидантные, иммуномодуляторные свойства мелатонина рассматривают как значимые патогенетические факторы, влияющие на практически все уровни оси регуляции репродуктивной системы [5][6]. Яйцеклетки, гранулезные клетки и лютеиновые клетки синтезируют мелатонин, который концентрируется в фолликулярной жидкости и, являясь мощным прямым поглотителем свободных радикалов, защищает все компоненты яичника от окислительного стресса, усугубляющегося с возрастом женщины [7].
Таким образом, изученные эффекты мелатонина позволяют предположить, что коррекция его уровня при лечении бесплодия у пациенток позднего репродуктивного возраста со сниженным фолликулярным резервом и «бедным» ответом на стимуляцию яичников может обеспечить увеличение фолликулярного резерва и качества яйцеклеток, а также повысить результативность процедур экстракорпорального оплодотворения.
Цель исследования — повышение результативности экстракорпорального оплодотворения у пациенток позднего репродуктивного возраста путём оптимизации предгравидарной подготовки к программе ЭКО.
Материалы и методы
В проспективное когортное исследование были включены 67 пациенток (основная группа) в позднем репродуктивном возрасте (старше 35 лет) с неудачными попытками ЭКО в анамнезе, обратившихся для проведения вспомогательных репродуктивных технологий в клинику репродукции «Эмбрио» (г. Краснодар и г. Сочи). Критерии включения: поздний репродуктивный возраст, сохраняющийся менструальный цикл, сниженный фолликулярный резерв, наличие «бедного» овариального ответа в предыдущих циклах ЭКО. Критерии невключения: наличие существенных соматических и гинекологических пролиферативных и воспалительных заболеваний, трубно-перинеального бесплодия, эндометриоза, миомы матки, иммуногистохимических критериев хронического эндометрита без аутоиммунного компонента, аутоиммунный хронический эндометрит в стадии обострения, наличие патогенной и условно патогенной микрофлоры в полости матки. Контрольную группу (50 пациенток) составили здоровые женщины репродуктивного возраста, наблюдавшиеся в клиниках по программе суррогатного материнства и донорства ооцитов.
Перед проведением повторных программ ЭКО в объём обследования включили иммуногистохимическое исследование эндометрия и микробиологическое обследование полости матки. Проводилось определение уровня экспрессии LIF в цервикальном секрете (методом твердофазного иммуноферментного анализа (ELISA) с использованием тест-систем фирмы BenderMedsystems (США), исследование концентрации мелатонина в периферической крови (перед и после проведения предгравидарной подготовки в секреторной фазе менструального цикла) и исследование концентрации мелатонина в периферической крови и фолликулярной жидкости в ходе цикла ЭКО проводили методом высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием. Антиоксидантный статус фолликулярной жидкости оценивали путём расчёта коэффициента отношений между супероксиддисмутазой (SOD) и малоновым диальдегитом (MDA) (SOD/MDA/10 у.е.). Активность SOD (ед/мл) измеряли путем ингибирования автоокисления пирогаллола при 420 нм с помощью УФ/видимого спектрофотометра. Уровень малоновогодиальдегида (MDA) (нмоль/мл) измеряли с использованием метода тиобарбитуровой кислоты, методом высокоэффективной жидкостной хроматографии.
На основании исследований, с учётом выявленной нами недостаточности мелатонина как в периферической крови, так и в фолликулярной жидкости, в систему предгравидарной подготовки введён препарат, содержащий комплекс низкомолекулярных водорастворимых полипептидных фракций, выделенных из эпифиза крупного рогатого скота, обладающий стимулирующим действием на синтез эндогенного мелатонина. Для оценки эффективности предлагаемой терапии пациентки основной группы методом простой рандомизации были разделены на две клинические группы. Женщинам первой группы (I группа, 34 женщины) дополнительно к стандартному эстроген-гестагеновому праймингу (эстрадиол-гель трансдермально 2 мг с 1-го по 25-й день менструального цикла и микронизированный прогестерон с 14-го по 25-й день менструального цикла по 400 мг ежедневно интравагинально в течение 3 циклов до цикла стимуляции) назначали внутримышечное введение низкомолекулярных водорастворимых полипептидных фракций эпифиза, ежедневно в дозе 10 мг в течение 10 дней с 5 по 15 день менструального цикла, предшествующего стимуляционному. Пациенткам II группы (33 женщины) назначали стандартный эстроген-гестагеновый прайминг. В цикле ЭКО с целью поддержки лютеиновой фазы использовали эстроген-гестагенный прайминг. Стимуляцию суперовуляции, учитывая сниженный фолликулярный резерв пациенток, проводили с первоначальным введением рекомбинантного фолликулостимулирующего гормона человека (р-чФСГ) 225 МЕ и менопаузального гонадотропина в дозе 75 МЕ. С 7-го по 12-й день стимуляции с целью подавления секреции эндогенных гонадотропинов к терапии присоединялся антагонист рецепторов гонадотропин-релизинг гормона (ГнРГ). В качестве триггера овуляции использовался рекомбинантный хорионический гонадотропин в дозе 250 мкг однократно. Пострансфертный период поддерживали микронизированным прогестероном (600 мг в сутки).
Статистическая обработка проводилась с помощью пакета прикладных программ Microsoft Excel (2010), STATISTICA 10 (USA). Оценка нормальности распределения оценивалась по методу Шапиро-Уилка и Колмогорова-Смирнова. Оценка среднего проводилась путём подсчёта медианы, стандартного отклонения и ошибки среднего, нижнего и верхнего квартиля. Использовали параметрические методы сравнения (T-тест Стьюдента) и непараметрические — Краскела-Уолисса и Майна-Уитни, корреляционный анализ Спирмена и Пирсона. После проведённой математической обработки применяли уровень значимости р<0,05.
Результаты
Средний возраст пациенток составил 39,5±2,1 лет. Средняя длительность бесплодия — 4,6±1,1 лет. В анамнезе (42 (62,6%) пациентки женщины имели одну, а 25 (37,4%) — 2 неудачные попытки ЭКО), в ходе которых проводилось стандартное обследование и подготовка к ЭКО.
Результаты исходного ультразвукового исследования выявили у пациенток основной группы снижение количества антральных фолликулов (КАФ – 3,4±1,9) и несоответствие толщины эндометрия фазе менструального цикла (4,5±1,3 мм в средней секреторной фазе).
По результатам предыдущей неудачной попытки ЭКО у пациенток основной группы зафиксирован бедный овариальный ответ: количество полученных фолликулов составило 4,3±1,6, аспирированных ооцитов — 3,2±1,4, среднее число ооцитов в метафазе — 3,1±1,6. В итоге среднее число нормально оплодотворившихся ооцитов составило 2,6±0,9, частота оплодотворения — 27,3±5,4 и среднее число бластоцист на пациентку — 0,7±0,01. Перенос эмбрионов состоялся у 35 (52,2%) пациенток, биохимическая беременность наступила у 11 (16,4%), клиническая беременность (по данным ультразвукового исследования (УЗИ)) не состоялась у 100% пациенток.
При анализе гормонального фона у пациенток основной группы по сравнению с результатами группы контроля был выявлен более высокий уровень гонадотропных гормонов (ФСГ — 11,9±5,2 МЕ/л, ЛГ — 11,5±2,6 МЕ/л, контроль — 5,5±1,6 МЕ/л, р<0,001 для обоих показателей). Уровни периферических стероидных гормонов (эстрадиол, прогестерон) находились в пределах референсных промежутков для женщин указанного возраста, однако по сравнению с группой контроля были статистически значимо снижены (основная группа: эстрадиол — 154,6±42,8 пг/мл, прогестерон — 28,7±6,4 нг/мл, группа контроля: эстрадиол — 250,6±126,9 пг/мл, прогестерон — 34,9±8,4нг/мл, р<0,001 для обоих показателей). Видовой состав микробиоты эндометрия, полученный путём проведения культурального и ПЦР исследования, не показал наличия патогенной и условно-патогенной микрофлоры в эндометрии, преимущественно выявляемой микрофлорой была Lactobacillus spp. (53 (79,1%) пациентки), степень обсеменённости биоптата составила 4,01/104±1,02/105 КОЕ/мл.
Иммуногистохимических критериев хронического эндометрита без выявления аутоиммунного компонента и аутоиммунного хронического эндометрита в стадии обострения у пациенток основной группы выявлено не было, однако у 32 (47,7%) обнаружены критерии, подтверждающие наличие слабо выраженного аутоимунного хронического эндометрита. При этом у 56 (83,6%) пациенток наблюдалось снижение экспрессии в строме и железах эндометрия рецепторов эстрогенов (ER) и прогестерона (PR). У всех пациенток основной группы выявлено снижение среднего уровня экспрессии LIF (маркер рецептивности эндометрия) в эндометрии (4,6±0,3 балла и 6,0±0,2 балла, р<0,001) и в цервикальном секрете (23,6±3,3 пг/мл против 35,8±7,2 пг/мл, р<0,001) по сравнению с группой контроля. При этом отмечалась сильная положительная корреляция между данными показателями (r(LIF эндометрия/LIF цервикального секрета)=0,91).
По данным исследования, выявлено статистически значимое снижение уровня мелатонина как в периферической крови (10,9±2,4 пг/мл против 28,9±2,4пг/мл в контрольной группе, р<0,001), так и в фолликулярной жидкости (22,9±2,1 пг/мл против 35,6±1,5 пг/мл в контроле, р<0,001).
В нашем исследовании концентрация супероксиддисмутазы (SOD) (основного фермента, входящего в систему антиоксидантной защиты организма) в фолликулярной жидкости в группе пациенток позднего репродуктивного возраста, имеющих овариальную недостаточность, статистически значимо снижена по сравнению с группой контроля (32,4 [ 30,6; 34,1] ед/мл против 56,6 [ 56,5;58,7] ед/мл в контроле, р<0,001). Концентрация малонового диальдегида (MDA), являющегося маркером оксидативного стресса, напротив, была повышена и составила статистически значимую разницу с результатом контрольной группы (0,89 [ 0,85;0,93] нмоль/мл), р<0,001. Наиболее точно уровень антиоксидантной защиты в фолликулярной жидкости отражает расчётный коэффициент соотношений SOD/MDA составивший в группе здоровых женщин 9,3 [ 9,3;9,8] у.е. В группе возрастных пациенток с неудачной попыткой ЭКО в анамнезе данный показатель был статистически значимо ниже за счёт как угнетения антиоксидантных свойств фолликулярной жидкости, так и увеличения прооксидантов (3,6 [ 3,1;4,1] у.е, р<0,001). Показатель уровня оксидативного стресса в фолликуле (SOD/MDA) имел сильную обратную корреляционную связь с концентрацией мелатонина в фолликулярной жидкости (r=0,92).
В результате комплексной предгравидарной подготовки с применением препарата эпифиза уровень мелатонина в периферической крови у пациенток I группы составил статистически значимую разницу с исходными результатами 34,8±1,6 пг/мл (р<0,001) и практически сравнялся с результатами контрольной группы (р=0,066), тогда как уровень мелатонина во II группе без стимуляции эндогенного мелатонина практически не изменился и составил 11,2±2,1 пг/мл (р=0,436) по сравнению с исходными результатами. Аналогичная динамика содержания мелатонина наблюдалась в фолликулярной жидкости: в I группе — статистически значимое увеличение (р<0,001) практически до результатов группы контроля (25,3±1,2 пг/мл, р=0,009), во II группе статистически значимого увеличения уровня мелатонина не наблюдалось (23,5±1,2, р=0,065) (табл. 1).
Таблица / Table 1
Динамика уровня мелатонина периферической крови
и фолликулярной жидкости после предгравидарной подготовки
Dynamics of melatonin levels in peripheral blood
and follicular fluid after pregravidar preparation
Параметры Parameters | I группа, n=34 Group 1, n=34 | II группа, n=33 Group 2, n=33 | III группа (контроль), n=50 Group 3 (control), n=50 | р (I группа) исходно/после ПГ p (group 1) initially/after PG | р (II группа) исходно/после ПГ p (group 1) initially/after PG | |
Мелатонин периферической крови, пг/мл Peripheral blood melatonin, pg/ml | Исходно Initially | 11,2±2,8 | 10,7±2,1 | 28,9±2,4 | <0,001 | 0,436 |
После ПГ After PG | 25,3±1,2 | 11,2±2,1 | ||||
Мелатонин фолликулярной жидкости, пг/мл Melatonin of follicular fluid, pg/ml | Исходно Initially | 23,5±1,2 | 22,7±0,5 | 35,6±1,5 | <0,001 | 0,065 |
После ПГ After PG | 34,8±1,6 | 23,5±1,2 | ||||
Примечание: *ПГ — предгравидарная подготовка.
Note: *PG — pregravidar preparation.
Коэффициент антиоксидантной активности (SOD/MDA/10) у пациенток I группы увеличился в 2 раза за счёт статистически значимого увеличения SOD (52,7 [ 51,2;56,4] ед/мл, р<0,001) по сравнению с исходными данными) и уменьшения MDA (0,67 [ 0,67;0,83] нмоль/мл, р<0,001) по сравнению с исходными данными). При этом, несмотря на значительное и статистически значимое увеличение, коэффициент антиоксидантной активности не достиг результатов группы контроля (7,4 [ 7,3;7,8] у.е., р<0,001) (табл. 2).
Таблица / Table 2
Динамика уровня анти- и прооксидантных ферментов
в фолликулярной жидкости после предгравидарной подготовки
Dynamics of the level of anti- and pro-oxidant enzymes
in the follicular fluid after pregravidar preparation
Параметры Parameters | I группа,n=34 Group 1, n=34 | II группа, n=33 Group 2, n=33 | III группа (контроль), n=50 Group 3 (control), n=50 | р (I группа) исходно/после ПГ p (group 1) initially/after PG | р (II группа) исходно/после ПГ p (group 1) initially/after PG | |
SOD,(ед/мл) SOD, (units/ml) | Исходно Initially | 32,4 [ 30,6;34,1] | 32,4 [ 30,6;34,1] | 56,6 [ 56,8;58,7] | <0,001 | 0,043 |
После ПГ After PG | 52,7 [ 51,2;56,4] | 33,7 [ 29,3;37,7] | ||||
MDA,(нмоль/мл) MDA, (nmol/ml) | Исходно Initially | 0,89 [ 0,85;0,93] | 0,89 [ 0,83;0,92] | 0,59 [ 0,54;0,69] | <0,001 | 0,045 |
После ПГ After PG | 0,67 [ 0,67;0,83] | 0,87 [ 0,84;0,96] | ||||
SOD/MDA/10, (у.е.) SOD/MDA/10, (units) | Исходно Initially | 3,6 [ 3,3;3,9] | 3,6 [ 3,3;3,9] | 9,3 [ 9,3;9,8] | <0,001 | 0,032 |
После ПГ After PG | 7,4 [ 7,3;7,8] | 3,8 [ 3,5;3,9] | ||||
Примечание: *ПГ — предгравидарная подготовка.
Note: *PG — pregravidar preparation.
Уровень ФСГ и ЛГ снизился в I группе до 7,1±1,4 МЕ/л и 7,9±1,7 МЕ/л соответственно против 11,9±3,9 МЕ/л и 11,4±3,4 МЕ/л в исходных измерениях (р<0,001), тогда как во II группе за счёт применения только эстроген-гестагенной терапии тоже произошло статистически значимое снижение, но с меньшей разницей от исходной. Динамика периферических гормонов также была более благоприятна в I группе у пациенток с дополнительным мелатониновым праймингом (табл. 3).
Таблица / Table 3
Динамика уровня гонадотропных и половых гормонов
в периферической крови после предгравидарной подготовки
Dynamics of gonadotropin and sex hormones levels
in peripheral blood after pregravidar preparation
Параметры Parameters | I группа, n=34 Group 1, n=34 | II группа, n=33 Group 2, n=33 | III группа (контроль), n=50 Group 3 (control), n=50 | р (I группа) исходно/после ПГ p (group 1) initially/after PG | р (II группа) исходно/после ПГ p (group 1) initially/after PG | |
ФСГ, МЕ/л FSH, IU/l | Исходно Initially | 11,9±3,9 | 11,8±4,1 | 5,5±1,6 | <0,001 | <0,001 |
После ПГ After PG | 7,1±1,4 | 9,1±1,8 | ||||
ЛГ, МЕ/л LH, ME/l | Исходно Initially | 11,4±3,1 | 11,4±3,4 | 7,6±1,5 | <0,001 | <0,001 |
После ПГ After PG | 7,9±1,7 | 9,9±1,5 | ||||
Е2 (эстрадиол), пг/мл E2 (estradiol), pg/ml | Исходно Initially | 153,2±141,1 | 153,2±41,1 | 250,6±66,9 | <0,001 | <0,001 |
После ПГ After PG | 265,1±23,4 | 208,1±27,2 | ||||
Прогестерон, нг/мл Progesterone, ng/ml | Исходно Initially | 28,5±6,4 | 24,5±3,2 | 34,9±8,4 | <0,001 | <0,001 |
После ПГ After PG | 31,2±5,7 | 30,3±4,8 | <0,001 | <0,001 | ||
Примечание: *ПГ — предгравидарная подготовка.
Note: *PG — pregravidar preparation.
Количество антральных фолликулов, определяемых при ультразвуковом исследовании, увеличилось у пациенток I группы в 2 раза (до 7,6±1,1) по сравнению с КАФ у пациенток II группы (4,6±1,1, p<0,001), однако не достигло результатов группы контроля (12,5±1,8, p<0,001).
Толщина эндометрия в обеих группах увеличилась относительно исходных параметров, однако статистически значимой разницы между I и II группами выявлено не было (I группа — 8,5±1,1 мм, II группа — 8,2±1,3 мм, р=0,326) (табл. 4).
Таблица / Table 4
Динамика параметров ультразвукового исследования
после предгравидарной подготовки
Dynamics of ultrasound parameters after pregravidar preparation
Параметры Parameters | I группа, n=34 Group 1, n=34 | II группа, n=33 Group 2, n=33 | III группа (контроль), n=50 Group 3 (control), n=50 | р (I группа) исходно/после ПГ p (group 1) initially/after PG | р (II группа) исходно/после ПГ p (group 1) initially/after PG | |
Количество антральных фолликулов Number of antral follicles | Исходно Initially | 3,4±1,8 | 3,4±1,8 | 12,5±1,8 | p<0,001 | p<0,001 |
После ПГ After PG | 7,6±1,1 | 4,6±1,1 | ||||
Толщинаэндометрия, мм Endometrial thickness, mm | Исходно Initially | 4,4±1,2 | 4,4±1,2 | 13,4±1,2 | p<0,001 | p<0,001 |
После ПГ After PG | 8,5±1,1 | 8,2±1,3 | ||||
Примечание: *ПГ — предгравидарная подготовка.
Note: *PG — pregravidar preparation.
В обеих группах концентрация LIF статистически значимо увеличилась по сравнению с исходными параметрами (p<0,001), однако статистически значимая разница уровня LIF между группами отсутствовала (29,1±9,4 пг/мл — I группа, 28,9±6,5 пг/мл — II группа, р=0,721) и показатель не достиг результатов группы контроля (35,8±7,2 пг/мл, p<0,001) (табл. 5).
Таблица / Table 5
Динамика LIF в цервикальном секрете после предгравидарной подготовки
Dynamics of LIF in the cervical secretion after pregravidar preparation
Параметры Parameters | I группа, n=34 Group 1, n=34 | II группа, n=33 Group 2, n=33 | III группа (контроль), n=50 Group 3 (control), n=50 | р (I группа) исходно/после ПГ p (group 1) initially/after PG | р (II группа) исходно/после ПГ p (group 1) initially/after PG | |
LIF, пг/мл рg/ml | Исходно Initially | 23,6±3,3 | 22,9±2,9 | 35,8±7,2 | <0,001 | <0,001 |
После ПГ After PG | 29,1±9,4 | 28,9±6,5 | <0,001 | <0,001 | ||
Примечание: *ПГ — предгравидарная подготовка.
Note: *PG — pregravidar preparation.
После проведённой предгравидарной подготовки все пациентки были допущены к циклу стимуляции овуляции по единому протоколу.
В результате у пациенток II группы не наблюдалось статистически значимых изменений параметров индуцированного цикла и параметров оогенеза и эмбриогенеза. У пациенток I группы после дополнительной терапии препаратом, содержащим низкомолекулярные полипептидные фракций эпифиза, более чем в 2 раза увеличилось количество общего числа фолликулов и, соответственно, в 2 раза возросло количество аспирированных фолликулов и среднее число ооцитов в метафазе II (табл. 6).
Таблица / Table 6
Параметры индуцированного цикла после проведения предгравидарной подготовки
Parameters of the induced cycle after pregravidar preparation
Параметры Parameters | I группа, n=34 Group 1, n=34 | II группа, n=33 Group 2, n=33 | III группа (контроль), n=50 Group 3 (control), n=50 | р (I группа) исходно/после ПГ p (group 1) initially/after PG | р (II группа) исходно/после ПГ p (group 1) initially/after PG | |
Общее количество фолликулов Total number of follicles | Исходно Initially | 4,2±1,3 | 4,2±1,5 | 28,3±2,2 | p<0,001 | p=0,34 |
После ПГ After PG | 10,3±1,3 | 4,6±1,3 | ||||
Общее количество аспирированных ооцитов Total number of aspirated oocytes | Исходно Initially | 3,3±1,3 | 3,3±1,3 | 17,3±1,5 | p<0,001 | p=0,53 |
После ПГ After PG | 10,2±2,3 | 3,5±1,5 | ||||
Среднее число ооцитовМII The average number of oocytes MII | Исходно Initially | 3,1±1,1 | 3,1±1,1 | 14,2±1,5 | p<0,001 | p=0,76 |
После ПГ After PG | 8,2±1,4 | 3,2±1,4 | ||||
Примечание: *ПГ — предгравидарная подготовка.
Note: *PG — pregravidar preparation.
В результате у пациенток I группы среднее число нормально оплодотворившихся ооцитов повысилось до 7,5±1,2 и составило двукратную разницу по сравнению с идентичным показателем у пациенток II группы (3,0±1,2, p<0,001). Частота оплодотворения увеличилась в 1 группе до 52,3±6,8%, более чем в 2 раза по сравнению с исходными данными увеличилось среднее число бластоцист и среднее число бластоцист отличного/хорошего качества, что также составило статистически значимую разницу с показателями пациенток II группы (p<0,001) (табл. 7).
Таблица / Table 7
Особенности оогенеза и эмбриогенеза после проведения предгравидарной подготовки
Features of oogenesis and embryogenesis after pregravidar preparation
Параметры Parameters | I группа, n=34 Group 1, n=34 | II группа, n=33 Group 2, n=33 | III группа (контроль), n=50 Group 3 (control), n=50 | р (I группа) исходно/после ПГ p (group 1) initially/after PG | р (II группа) исходно/после ПГ p (group 1) initially/after PG | |
Среднее число нормально оплодотворившихся ооцитов (2PN) The average number of normally fertilized oocytes (2PN) | Исходно Initially | 2,6±0,9 | 2,6±0,9 | 11,3±1,4 | p<0,001 | p=0,5 |
После ПГ After PG | 7,5±1,2 | 3,0±1,2 | ||||
Частота оплодотворения (%) Fertilization rate (%) | Исходно Initially | 27,3±5,4 | 27,3±5,4 | 82,2±8,3 | p<0,001 | p=0,07 |
После ПГ After PG | 52,3±6,8 | 32,3±6,8 | ||||
Морфологическая оценка эмбрионов на 3-и сутки (баллы) Morphological assessment of embryos on day 3 (points) | Исходно Initially | 2,2±0,7 | 2,2±0,7 | 3,1±0,9 | p=0,035 | p=0,35 |
После ПГ After PG | 2,6±0,5 | 2,6±0,5 | ||||
Среднее число бластоцист на пациентку The average number of blastocysts per patient | Исходно Initially | 1,5±0,01 | 0,7±0,01 | 11,3±1,4 | p<0,001 | p=0,15 |
После ПГ After PG | 4,2±0,02 | 0,7±0,02 | ||||
Среднее число бластоцист отличного/хорошего качества The average number of blastocysts of excellent/ good quality | Исходно Initially | 0,5±0,2 | 0,5±0,2 | 10,2±0,7 | p<0,001 | p=0,29 |
После ПГ After PG | 3,5±0,05 | 0,4±0,2 | ||||
Примечание: *ПГ — предгравидарная подготовка.
Note: *PG — pregravidar preparation.
В итоге перенос эмбрионов состоялся у всех пациенток I группы — 33 (100%). Во II группе перенос эмбрионов состоялся у 14 (41,2%) пациенток (p<0,001, ОR=47,1 (5,7–38,8)). Биохимическая беременность в I группе наступила у 22 (66,7%) пациенток на начатый цикл и перенос эмбрионов, тогда как во II группе частота биохимической беременности на начатый цикл составила 26,5%, а на перенос эмбрионов 64,3% (p<0,001, ОR=5,5 (1,9–15,6)).
Частота наступления клинической беременности в I группе составила 12 (36,4%) на начатый цикл и 12 (36,4%) на перенос эмбрионов, что статистически значимо превышало показатели II группы (11,8% и 28,6%), соответственно (p<0,001, ОR=4,2 (1,2–15,2)). В обеих группах произошло по 1 самопроизвольному выкидышу на сроке 6–7 недель. В итоге живорождение в I группе более чем в 4 раза превышало данный показатель во II группе и составило 33,3% случаев на цикл и на перенос, тогда как во второй осталось на минимальных среднестатистических для данного возраста (РАРЧ) уровнях (8,8%) (p<0,001, ОR=5,2 (1,3–20,7)) (рис. 1).
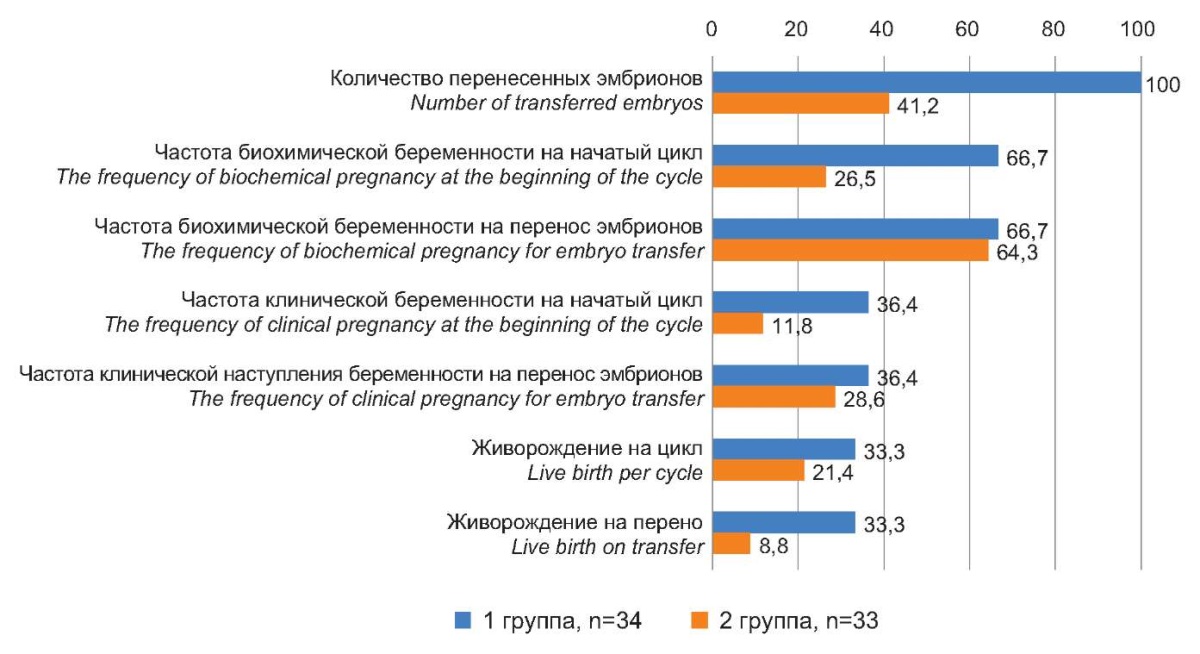
Рисунок 1. Исходы программ ЭКО у пациенток
после проведения различной предгравидарной подготовки, %.
Figure 1. The outcomes of IVF programs in patients
after various pre-pregnancy preparations, %.
В итоге результативность ЭКО у пациентов позднего репродуктивного возраста при проведенной предгравидарной подготовке с коррекцией пинеальной дисфункции (I группа) максимально приблизилась к среднестатистической результативности ЭКО, составляющей (30–35%) (РАРЧ 2021 г.), что является достаточно высоким показателем для пациенток позднего репродуктивного возраста.
Обсуждение
Мелатонин играет важную роль в синхронизации и регуляции фертильности, воздействуя на все уровни регуляторной оси менструально-овариального цикла. Топический мелатонин, содержащийся в фолликулярной жидкости, по данным последних исследований, нейтрализует свободные радикалы и защищает репродуктивный материал от окислительного стресса и митохондриальных дисфункций [8].
В настоящем исследовании у основной группы женщин исходно определялось достоверное снижение уровня мелатонина в периферической крови и в фолликулярной жидкости по сравнению с контрольной группой. Снижение концентрации мелатонина опосредовано влияет на фертильную функцию женщины, поскольку старение яичников, как и многие другие дегенеративные процессы в значительной степени определяется уровнем окислительного стресса, а мелатонин и его метаболиты ингибируют прооксидантные ферменты, предположительно оказывая влияние на созревание и качество яйцеклетки [9].
На фоне проведённого мелатонинового прайминга улучшился оксидантный профиль в фолликулярной жидкости у пациенток позднего репродуктивного возраста. На основании этих данных можно предположить, что одним из дополнительных патогенетических моментов нарушения оогенеза у пациенток позднего репродуктивного возраста, при сочетании ооцитарных дисфункций и имплантационной недостаточности эндометрия, является дефицит пинеальной и экстрапинеальной секреции мелатонина. По этой причине коррекция пинеального дефицита, введённая в комплекс предгравидарной подготовки, может улучшить эффективность программ ЭКО. В качестве стимулятора эндогенного мелатонина пациенткам I группы дополнительно к стандартному эстроген-гестагеновому праймингу вводили внутримышечно низкомолекулярные водорастворимые полипептидные фракции эпифиза. Дополнение стандартной предгравидарной подготовки препаратами эпифиза позволило повысить уровень мелатонина в периферической крови и в фолликулярной жидкости. Вероятно, на фоне увеличения концентрации мелатонина, являющегося модулятором косвенного окислительного повреждения за счёт повышения активности антиоксидантных ферментов и снижения активности прооксидантных ферментов, у пациенток I группы существенно и статистически значимо изменился антиоксидантный статус фолликулярной жидкости.
Стимуляция эндогенного мелатонина, которая привела к его увеличению системно и локально, сопровождалась более выраженными благоприятными изменениями уровня гонадотропных гормонов, что проявлялось в снижении концентраций ФСГ и ЛГ в периферической крови. Максимальное улучшение гормонального фона при стимуляции пениалоцитов эпифиза как на центральном, так и на периферическом уровнях положительно соотносилось с активацией функции яичников и в меньшей степени — с приростом функционального слоя матки. В частности, увеличилось количество антральных фолликулов при ультразвуковом исследовании. Однако влияние мелатонина на имплантационный потенциал эндометрия не было столько позитивным. Достоверного увеличения толщины эндометрия не наблюдалось, и уровень экспрессии LIF в цервикальном секрете также менялся незначительно.
Тем не менее, в итоге общая результативность процедуры ЭКО у женщин в позднем репродуктивном возрасте после предгравидарной подготовки с введением пинеальных полипептидов приблизилась к среднестатистической результативности (30–35%), по данным Российской Ассоциации Репродукции человека от 2021 г.
Заключение
Отрицательные попытки ЭКО у женщин позднего репродуктивного возраста объясняются статистически значимым снижением фолликулярного резерва, уменьшением количества зрелых ооцитов и качественных эмбрионов, а также рецепторной недостаточностью имплантационного фактора эндометрия, даже в когорте условно здоровых женщин. Дефекты функционирования всей оси регуляции репродуктивной системы у пациенток позднего репродуктивного возраста при наличии сочетания ооцитарного фактора («бедный ответ») и имплантационной несостоятельности эндометрия («тонкий эндометрий») сопровождаются снижением уровня мелатонина в периферической крови и фолликулярной жидкости. В фолликулярной жидкости у данной когорты наблюдается увеличение оксидативного стресса, коррелирующего со снижение уровня мелатонина.
Включение в комплекс предгравидарной подготовки комплекса водорастворимых полипептидных фракций эпифиза, стимулирующих выработку эндогенного мелатонина, положительно влияет на нормализацию функционирования гипоталамо-гипофизарно-яичниковой оси регуляции репродуктивной системы. На фоне увеличения уровня мелатонина в периферической крови и фолликулярной жидкости снижается уровень оксидативного стресса, увеличивается количество антральных фолликулов, постстимулированных и аспирированных фолликулов. Вероятно, данный эффект реализуется за счёт доказанного влияния мелатонина на нейроны гонадоингибирующего гормона (GnIH), при этом мелатонин стимулирует не только синтез GnIH, но и его высвобождение, тем самым снижая концентрацию ЛГ в плазме крови, и опосредовано, влияя на уровень ФСГ и периферические гормоны яичников [10]. Известно, что мелатонин также косвенно снижает окислительный стресс, повышая уровень антиоксидантных ферментов, снижая уровень прооксидантных ферментов, и стимулирует синтез других эндогенных антиоксидантов, например, глутатиона [8]. Очевидно, данный механизм и объясняет выявленное нами снижение оксидативного стресса в фолликулах, что способствует увеличению среднего числа ооцитов МII и среднего числа бластоцист отличного/хорошего качества. В итоге коррекция пинеальной недостаточности позволила повысить результативность ВРТ у пациенток позднего репродуктивного возраста в среднем в 3,1 раза по критерию «клиническая беременность», и в 4,1 раза по критерию «живорождение».
Однако, в нашем исследовании мы не обнаружили заметного влияния коррекции пинеального звена на имплантационный фактор эндометрия, несмотря на значимое увеличение уровня эстрадиола и прогестерона, отсутствие патогенной и условно патогенной инфекции в полости матки и наличия лишь у части пациенток слабо выраженного аутоимунного хронического эндометрита. Данная проблема требует дальнейшего исследования с целью уточнения и коррекции преимущественно эндометриальных дисфункций.
Список литературы
1. Сугурова А.Т., Ящук А.Г., Хусаинова Р.И. Клиникогенетические аспекты проблемы овариального ответа при применении вспомогательных репродуктивных технологий. Российский вестник акушера-гинеколога. 2020;20(6):48-55.
2. Долгушина Н.В., Адамян Л.В., Шешко Е.Л. Поздний репродуктивный возраст женщины: риски нарушения репродуктивной функции (обзор литературы). Проблемы репродукции. 2023;29(4):99-106.
3. Посисеева Л.В., Перепечай М.И., Петрова О.А., Петрова У.Л. Возможности прегравидарной подготовки женщин с низким овариальным резервом. Эффективная фармакотерапия. 2020;16(7):6-9.
4. Marron K, Harrity C. Endometrial lymphocyte concentrations in adverse reproductive outcome populations. J Assist Reprod Genet. 2019;36(5):837-846. https://doi.org/10.1007/s10815-019-01427-8
5. Gomes PRL, Motta-Teixeira LC, Gallo CC, Carmo Buonfiglio DD, Camargo LS, et al. Maternal pineal melatonin in gestation and lactation physiology, and in fetal development and programming. Gen Comp Endocrinol. 2021;300:113633. https://doi.org/10.1016/j.ygcen.2020.113633.
6. Yong W, Ma H, Na M, Gao T, Zhang Y, et al. Roles of melatonin in the field of reproductive medicine. Biomed Pharmacother. 2021;144:112001. https://doi.org/10.1016/j.biopha.2021.112001
7. Tamura H, Jozaki M, Tanabe M, Shirafuta Y, Mihara Y, et al. Importance of Melatonin in Assisted Reproductive Technology and Ovarian Aging. Int J Mol Sci. 2020;21(3):1135. https://doi.org/10.3390/ijms21031135
8. Reiter RJ, Sharma R, Romero A, Manucha W, Tan DX, et al. Aging-Related Ovarian Failure and Infertility: Melatonin to the Rescue. Antioxidants (Basel). 2023;12(3):695. https://doi.org/10.3390/antiox12030695
9. Yang D, Mu Y, Wang J, Zou W, Zou H, et al. Melatonin enhances the developmental potential of immature oocytes from older reproductive-aged women by improving mitochondrial function. Heliyon. 2023;9(9):e19366. https://doi.org/10.1016/j.heliyon.2023.e19366
10. Адамян Л.В., Сибирская Е.В., Щерина А.В. Патогенетические аспекты преждевременной недостаточности яичников. Проблемы репродукции. 2021;27(1):6-12.
Об авторах
К. В. УрюпинаРоссия
Урюпина Кристина Владимировна, аспирант кафедры акушерства, гинекологии и перинатологии Краснодар
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
И. И. Куценко
Россия
Куценко Ирина Игоревна, д.м.н., профессор, заведующий кафедрой акушерства, гинекологии и перинатологии
Краснодар
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Е. И. Кравцова
Россия
Кравцова Елена Иосифовна, к.м.н., доцент кафедры акушерства, гинекологии и перинатологии
Краснодар
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
К. А. Арзуманян
Россия
Арзуманян Камилла Артемовна, студентка 6 курса лечебного факультета
Краснодар
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
М. Н. Мусави
Россия
Мусави Маргарита Николаевна, студентка 6 курса лечебного факультета
Краснодар
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Рецензия
Для цитирования:
Урюпина К.В., Куценко И.И., Кравцова Е.И., Арзуманян К.А., Мусави М.Н. Преодоление бедного овариального ответа в программах вспомогательных репродуктивных технологий у пациенток позднего репродуктивного возраста. Медицинский вестник Юга России. 2024;15(1):98-107. https://doi.org/10.21886/2219-8075-2024-15-1-98-107
For citation:
Uryupina K.V., Kucenko I.I., Kravczova E.I., Arzumanyan K.A., Musavi M.N. Overcoming poor ovarian response in assisted reproductive technology programs in patients of late reproductive age. Medical Herald of the South of Russia. 2024;15(1):98-107. (In Russ.) https://doi.org/10.21886/2219-8075-2024-15-1-98-107







































