Перейти к:
Результаты перевязки внутренних подвздошных и яичниковых артерий в эксперименте
https://doi.org/10.21886/2219-8075-2023-14-4-77-82
Аннотация
Цель: изучить в эксперименте на животных патоморфологические изменения в тканях матки, придатков и сосудов после выполнения перевязки внутренних подвздошных и яичниковых артерий.
Материалы и методы: был проведён эксперимент с 6 половозрелыми свиньями: I группа (n=3) – интактные свиньи без оперативного вмешательства, II (n=3) – животные с перевязкой внутренних подвздошных и яичниковых артерий с обеих сторон. Через 12 месяцев после операции были произведены забой и взятие органокомплекса матки с придатками и подвздошных сосудов для электронно-микроскопического патоморфологического исследования.
Результаты: сравнительные результаты исследования матки, придатков установили, что сохранялось нормальное строение половозрелой матки, не было установлено изменений в строении маточных труб, тканях и сосудах яичников. Все изменения были выявлены в зоне перевязки яичниковых и внутренних подвздошных артерий. Хотя артерии и сохраняли свои просвет, но были деформированы и окружены плотной волокнистой соединительной тканью.
Заключение: перевязка яичниковых и внутренних подвздошных артерий рассасывающимся шовным материалом вызывает лишь местные изменения. Достаточность коллатерального кровотока подтверждается отсутствием атрофии матки, маточных труб и яичников, а также деформации органов.
Ключевые слова
Для цитирования:
Канцурова М.Р., Рымашевский А.Н., Волошин В.В., Сапронова Н.Г., Тодоров С.С., Рымашевский М.А., Канцуров Р.Н. Результаты перевязки внутренних подвздошных и яичниковых артерий в эксперименте. Медицинский вестник Юга России. 2023;14(4):77-82. https://doi.org/10.21886/2219-8075-2023-14-4-77-82
For citation:
Kantsurova M.R., Rymashevsky A.N., Voloshin V.V., Sapronova N.G., Todorov S.S., Rymashevsky M.A., Kantsurov R.N. Results of ligation the internal iliac and ovarian arteries in the experiment. Medical Herald of the South of Russia. 2023;14(4):77-82. (In Russ.) https://doi.org/10.21886/2219-8075-2023-14-4-77-82
Введение
Идея сохранения матки при массивных кровотечениях в акушерской и гинекологической практике не является новой [1–5]. Создано большое количество различных методов достижения гемостаза и уменьшения операционной кровопотери [1][6–7]. Накоплено достаточное количество как отечественного, так и зарубежного опыта хирургической остановки кровотечения. К методам деваскуляризации матки относят перевязку маточных артерий (МА), яичниковых артерий (ЯА) и внутренних подвздошных артерий (ВПА), эмболизацию маточных артерий (ЭМА), наложение турникетов, клеммирование и др. [1][8].1
Изучению состояния внутренних половых органов после лигирования сосудов малого таза было посвящено много исследований, начиная с 60-х гг. прошлого века, таких как работы Д.Р. Цицишвили (1961) [9], Н.Н. Рембез и Н.П. Клинской (1964), в которых проводили исследования состояния органов малого таза после перевязки ЯА и ВПА на кроликах и собаках [10].
За прошедшие полвека экспериментальные работы стали редкостью. В целом они были посвящены изучению репродуктивной системы сельскохозяйственных животных. Редкость экспериментальных работ была определена сложностью подбора экспериментальных животных, которые должны соответствовать модели функционирования человека, последующего описания и изучения модулируемого процесса, а также выполнения самого эксперимента. Для человека наилучшей биологической моделью выступают свиньи благодаря их анатомо-физиологическому сходству, удобству содержания и доступности в различных манипуляциях. Репродуктивный аппарат самки свиньи достаточно схож с человеческим.
Стенка матки у свиней состоит из трёх оболочек: слизистой, мышечной и серозной. Рога матки переходят в яйцепроводы (фаллопиевые трубы), представленные в виде выраженных извитых трубочек. Именно там происходит оплодотворение яйцеклеток и продвижение их в матку. Кровоснабжение половых органов у свиней идет из сосудов, отходящих от брюшной части аорты и ВПА (парных ЯА, средней МА и задней МА). ЯА у свиней, как и у человека, отходит от брюшной части аорты, средняя МА очень развита и является продолжением пупочной артерии, задняя маточная берёт начало от парной мочеполовой артерии [11].
В литературе практически отсутствуют экспериментальные работы, посвящённые оценке состояния патоморфологической картины в тканях матки и придатков после выполненного хирургического гемостаза, а именно перевязки ВПА, что и стало для авторов задачей исследования.
Цель исследования — изучить в эксперименте со свиньями патоморфологические изменения в тканях матки, придатков и сосудов после выполнения перевязки ВПА и ЯА и оценить развитие коллатерального кровообращения.
Материалы и методы
Работа выполнялась в соответствии с Хельсинской декларацией Всемирной медицинской ассоциации (2000), основными морально-этическими принципами проведения биомедицинских экспериментов на животных, сформулированными Международным советом медицинских научных обществ (CIOMS), Международными рекомендациями по проведению медико-биологических исследований с использованием животных Этического кодекса (1985), Европейской Конвенцией о защите позвоночных животных, используемых в эксперименте и для других научных целей, включающих основные положения Этического кодекса СММНО (Страсбург, Франция, 1986 г.), Директивой Совета ЕС «О сближении законов, постановлений и административных положений государств ЕС по вопросам защиты животных, используемых для экспериментов и других научных целей»2. Общие правила содержания свиней соблюдались согласно требованию Приказа Министерства сельского хозяйства Российской Федерации от 29.03.2016 г. №114 «Об утверждении Ветеринарных правил содержания свиней в целях производства, выращивания и реализации»3.
В экспериментальные группы вошли 6 свиней женского пола породы «белая крупная». Возраст составил 4 месяца, вес — от 17 до 23 кг. Подопытные животные были разделены на две группы: I группа (n=3) — интактные свиньи без оперативного вмешательства, а II (n=3) — животные, которым была выполнена операция в объёме перевязки ЯА и ВПА с обеих сторон.
За 12 часов до операции животных ограничивали в приёме пищи с сохранением достаточного количества воды для профилактики обезвоживания, а также минимизировали периоперационный стресс и физические нагрузки. Операция выполнялась в условиях ветеринарной клиники. После взвешивания выполняли премедикацию внутримышечным введением атропина 0,1 мг на 1 кг, ксилазина гидрохлорида (ксиланита) 0,1–0,5 мл на 1 кг, тилетамина и золазепама (золетила 100) в дозе 10 мг на 1 кг массы животного. Седативный эффект наступал через 12–14 минут. Животное укладывали на операционный стол в позиции «на спине», проводили катетеризацию наружной вены ушной раковины и обрабатывали кожу спиртсодержащим антисептиком, ограждая операционное поле стерильным бельём.
В асептических условиях послойно вскрывали брюшинную полость нижнесрединным доступом. Далее, после бережного отведения петель кишечника влажной марлевой салфеткой кверху и мочевого пузыря книзу, выставлялись зеркала. В области бифуркации аорты вскрывали париетальную брюшину, дифференцировали общую подвздошную и ВПА, диссектором выделяли и перевязывали с обеих сторон ВПА рассасывающимся шовным материалом (полигликолид). После этого выделяли матку и производили перевязку ЯА также с двух сторон тем же шовным материалом. Проводили контроль гемостаза. Переднюю брюшную стенку ушивали послойно, наглухо, на кожу накладывали асептическую повязку. Кровопотеря не превышала 35 40 мл, среднее время операции составило 25–30 минут. Летальный исход среди животных после хирургического вмешательства не наблюдался. Ранний и поздний послеоперационный период протекал без осложнений.
Спустя 12 месяцев осуществляли забой в специализированном помещении с извлечением органо-комплекса матки с придатками, подвздошных сосудов для электронно-микроскопического патоморфологического исследования. Материал фиксировали в растворе формалина и доставляли в морфологический отдел клиники ФГБОУ ВО РостГМУ Минздрава России. Для гистологического исследования забирались поперечные срезы тела матки на расстоянии 1,0 см от отхождения рогов, маточных труб на расстоянии 3,0 см от ампулы, ВПА и ЯА в зоне перевязки и на расстоянии 1,0 см дистальнее, из яичников забирался продольный срез через всю толщу органа в наибольшем измерении.
Из срезов инцизионно формировались кусочки максимальным размером 2,0×1,5×0,5 см и фиксировались в забуференном 10%-ном растворе формалина с последующей гистологической проводкой в гистопроцессоре закрытого типа STP120-2 (Thermo Scientific, США). В дальнейшем проведенный материал заливался в кассету HistoSafe в парафиновую среду «histomix» с помощью модульной установки EG1150H (Leica, Германия). Полученные парафиновые блоки подвергали резке на ротационном микротоме Rotary 3003 (PFM medical, Германия) с получением серийных срезов толщиной 3,0 мкм. Препараты окрашивались гематоксилином эозином, пикрофуксином по Ван-Гизону и трихромом по Массону для выявления компонентов соединительной ткани. Микроскопию и фотографирование полученных гистологических препаратов осуществляли с помощью микроскопа Leica 1000DM (Германия).
Результаты
При микроскопическом исследовании эндометрия у свиней I группы определялись железистый эпителий в виде нескольких рядов клеток, железы разного калибра от мелких до кистозно-трансформированных, крупные спиралевидные артерии, а также внутренний кольцевой и наружный продольный слои гладкомышечных клеток, между которыми определялся сосудистый слой, характеризующий нормальное строение половозрелой матки. Аналогичное строение имели и рога матки. Гистологическое строение стенок тела матки и рогов у II группы, которым было проведено оперативное вмешательство, не отличалось от I группы (рис. 1 (а, б)).
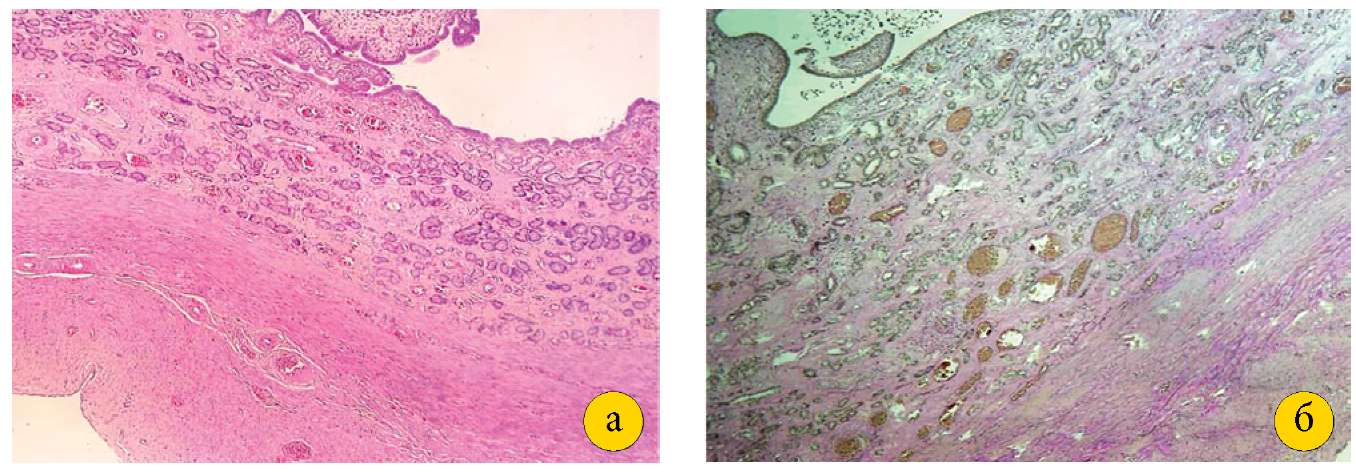
Рисунок 1. А — ткань рога матки свиньи I группы
(увеличение 4×10, окраска гематоксилином и эозином).
Б — стенка рога матки свиньи II группы
(увеличение 4×10, окраска гематоксилином и эозином).
Figure 1. A — tissue of the pig uterine horn of group I
(magnification 4×10, stained with hematoxylin and eosin).
B — wall of the pig uterine horn of group II
(magnification 4×10, stained with hematoxylin and eosin).
В яичниках в корковом веществе I группы располагались многочисленные премордиальные, первичные, вторичные и третичные фолликулы, а также жёлтое тело, что морфологически подтверждало готовность животных к оплодотворению. В мозговом веществе определялось большое количество сосудов спиральных артерий и венозных сплетений. Строение артерий и вен яичников было обычным: адвентициальный слой, мышечный и внутренний слои. Результаты II группы показали следующее: при гистологическом исследовании тканей животных изменения отмечены в местах перевязки сосудов. Перевязанная ЯА (диаметр — 0,1–0,15 см) сохраняла просвет (диаметр — 0,05–0,07 см), но вокруг неё и прилежащих сосудов отмечалось развитие плотной волокнистой соединительно-рубцовой ткани (рис. 2 (а, б)).
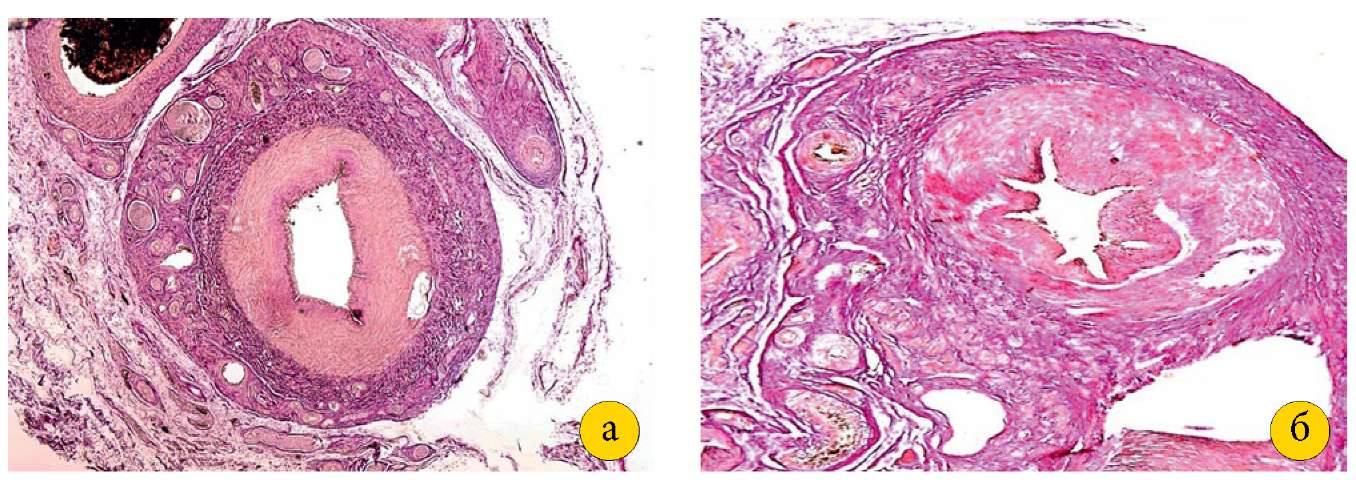
Рисунок 2. А — яичниковая артерия и часть вены интактной свиньи
(увеличение 2,5×10, окраска гематоксилином и эозином).
Б — яичниковая артерия после перевязки,
окруженная плотной волокнистой соединительной тканью
(увеличение 4×10, окраска гематоксилином и эозином)
Figure 2. A — ovarian artery and part of the vein of an intact pig
(magnification 2.5×10, stained with hematoxylin and eosin).
B — ovarian artery after ligation,
surrounded by dense fibrous connective tissue
(magnification 4×10, stained with hematoxylin and eosin).
Рядом с перевязанной артерией, формируя своеобразный «пучок», располагалось несколько артерий меньшего калибра с широким просветом и утолщенной мышечной оболочкой, осуществлявших коллатеральный кровоток (рис. 3).
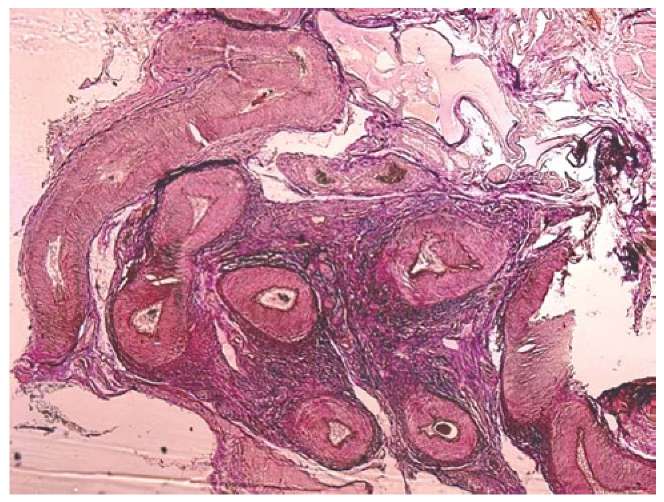
Рисунок 3. Артерии и вены в виде пучка,
окружённые плотной волокнистой соединительной тканью
рядом с перевязанной яичниковой артерией во II группе
(увеличение 2,5×10, окраска пикрофуксином по Ван-Гизону).
Figure 3. Arteries and veins in the form of a bundle,
surrounded by dense fibrous connective tissue
next to the ligated ovarian artery in group II
(magnification 2.5×10, Van Gieson picrofuchsin staining).
Вне зоны вмешательства дистальнее на расстоянии 1,0 см ЯА имела строение, неотличимое от контроля.
В яичниках свиней II группы патологии также выявлено не было. В корковом веществе располагались многочисленные премордиальные, первичные, вторичные и третичные фолликулы, жёлтое и белое тела, что подтверждало готовность животных к оплодотворению.
ВПА из I группы была диаметром 0,3–0,4 см, имела широкий просвет (диаметр — 0,2–0,3 см) и была окружена рыхлой волокнистой соединительной тканью. По результатам материала II группы ВПА имела диаметр 0,25–0,3 см, также сохраняла просвет (диаметр — 0,1–0,15 см), но была деформирована и окружена в радиусе 0,1 см плотной волокнистой соединительной тканью (рис. 4 (а, б)).
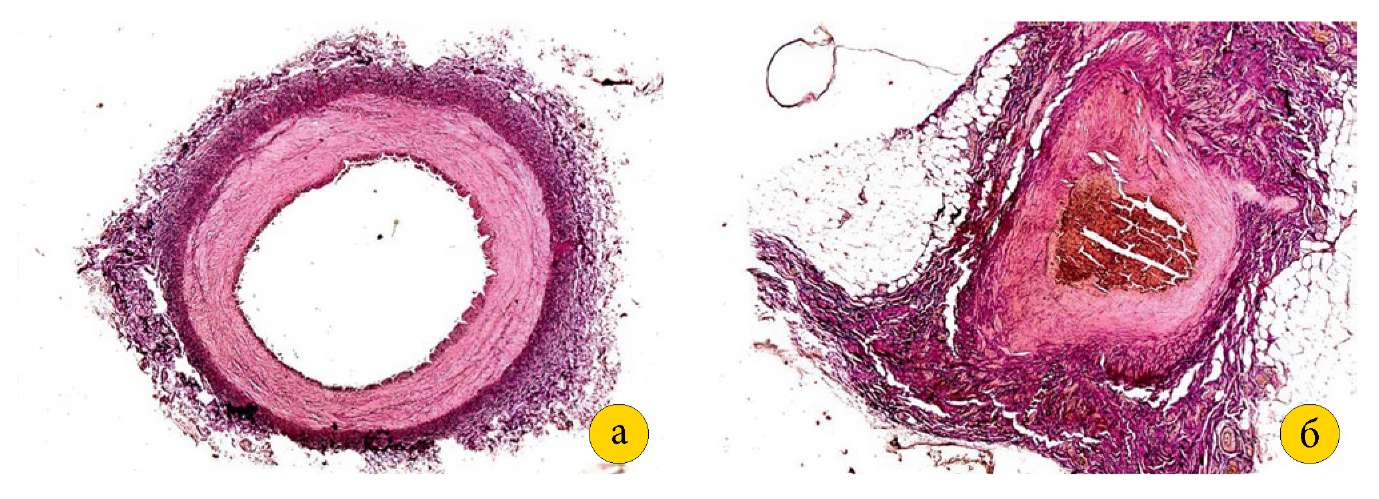
Рисунок 4. А — внутренняя подвздошная артерия свиньи I группы
(увеличение 2,5 х 10, окраска пикрофуксином по Ван-Гизону).
Б — внутренняя подвздошная артерия свиньи II группы с деформацией стенки,
окруженная плотной волокнистой соединительной тканью
(увеличение 2,5×10, окраска пикрофуксином по Ван-Гизону).
Fig. 4. A — internal iliac artery of a group I pig
(magnification 2.5×10, picrofuchsin staining according to Van Gieson).
B — internal iliac artery of a group II pig with wall deformation,
surrounded by dense fibrous connective tissue
(magnification 2.5×10, picrofuchsin staining according to Van Gieson).
Признаки перестройки сосудистого русла для осуществления коллатерального кровотока отмечены в маточных трубах у животных II группы. В серозной оболочке вне зоны прикрепления располагались «пучки» сосудов, содержащие несколько артерий с широким просветом и утолщенной мышечной оболочкой. Строение слизистой оболочки и мышечного слоя не отличалось от контроля.
Обсуждение
Таким образом, при сравнительном анализе микроскопии стенок тела матки и рогов у интактных свиней и у животных с перевязкой ВПА и ЯА с обеих сторон сохранялось нормальное строение половозрелой матки. Также не было установлено изменений в строении маточных труб, тканях и сосудах яичников. Во всех трёх наблюдениях во II группе в корковом веществе яичников располагались многочисленные премордиальные, первичные, вторичные и третичные фолликулы, жёлтое тело и белые тела, что подтверждало готовность животного к оплодотворению. Все изменения были выявлены в зоне перевязки ВПА, хотя артерии и сохраняли свои просвет, но были деформированы и окружены плотной волокнистой соединительной тканью. ЯА также сохраняли просвет, но вокруг них и в прилежащих сосудах были выраженные рубцовые деформации. Особенностью кровоснабжения стало формирование артерий меньшего калибра рядом с перевязанной ЯА, которые осуществляли коллатеральное кровообращение органа. Также признаки перестройки сосудистого русла для осуществления коллатерального кровотока отмечены и в маточных трубах у животных II группы.
Перевязка ВПА и ЯА вызывает лишь местные изменения, такие как периваскулярный фиброз, деформацию стенки, сужение просвета. Облитерации просвета сосудов не наблюдалось. Кроме того, отмечалось развитие коллатералей: увеличение числа артерий мелкого калибра вокруг перевязанной ЯА и в серозной оболочке маточных труб. Коллатеральный кровоток был достаточным, так как атрофии матки, маточных труб и яичников, деформации органов выявлено не было.
Выводы
Перевязка ВПА и ЯА вызывает лишь местные изменения, не влияет на репродуктивную функцию животных. Это подтверждается наличием премордиальных, первичных, вторичных и третичных фолликулов, а также жёлтого и белого тел в яичниках обеих групп. Кровоснабжение органов после лигирования сосудов компенсируется развитием коллатералей, что подтверждено отсутствием атрофии и деформации матки с придатками.
1. Клинические рекомендации (протокол лечения) Министерства здравоохранения Российской Федерации от 24 мая 2021 г. №01-02/366 «Послеродовое кровотечение». Ссылка активна на 28.01.2022 http://www.consultant.ru/document/cons_doc_LAW_410221/
2. Борисенко ЕА, Кисьора ЮК. Биологическая этика: сб. нормативных документов по проведению медико-биологических исследований с использованием животных. 2015:39-47
3. http://publication.pravo.gov.ru/Document/View/0001201607070043
Список литературы
1. Баев О.Р., Приходько А.М., Пестрикова Т.Ю., Федорова Т.А., Шмаков Р.Г. Алгоритм действий при раннем (первичном) послеродовом кровотечении (по материалам клинических рекомендаций МЗ РФ «Профилактика, алгоритм ведения, анестезия и интенсивная терапия при послеродовых кровотечениях, 2019»). Акушерство и гинекология. 2019;(12S):3-8
2. Логинов А.Б., Зайнулина М.С. Золотые страницы истории российского акушерства: от екатерининских времен к современности. Акушерство, Гинекология и Репродукция. 2017;11(2):69-74.
3. Мицюк Н.А., Пушкарева Н.Л. Формирование системы клинического родовспоможения в России (конец XVIII - начало XX в.). История медицины. 2021;7(2):153-160.
4. Хайруллина Г.Р., Дружкова Е.Б., Фаткуллина Л.С., Фаткуллин Ф.И., Будяк Ю.В. Эффективность органосберегающих операций, проведенных по поводу раннего послеродового маточного кровотечения и их влияние на качество жизни женщин. Медицинский вестник Юга России. 2020;11(2):111-116.
5. Цхай В.Б., Бакунина А.А. Спонтанный разрыв маточных кровеносных сосудов во время беременности и родов. Обзор литературы. Женское здоровье и репродукция. 2021;3(50)35-46
6. Савельева Г.М., Сухих Г.Т., Серова В.Н., Радзинский В.Е. Акушерство: национальное руководство. 2019:867-882
7. Мочалова М.Н., Сидоркина А.Г., Мудров В.А. Современные методы прогнозирования и диагностики послеродового кровотечения. Сибирское медицинское обозрение. 2022;(4):13-21.
8. Каменских Г.В., Новикова В.А., Оленев А.С. Современные тенденции профилактики акушерских кровотечений.Практическая медицина. 2018;16(6):26-33.
9. Цицишвили Дж.Р. Перевязка сосудов матки как метод остановки атонического кровотечения. Клинико-экспериментальное исследование. 1961:45-51.
10. Рембез Н.Н., Клинская Н.П. Перевязка магистральных артерий малого таза с целью остановки кровотечения. Конспекты лекций. 1964:67-94.
11. Попеско П. Атлас топографической анатомии сельско-хозяйственных животных. Том 2. Туловище. 1974.
Об авторах
М. Р. КанцуроваРоссия
Мария Руслановна Канцурова – ассистент кафедры акушерства и гинекологии № 1
Ростов-на-Дону
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
А. Н. Рымашевский
Россия
Александр Николаевич Рымашевский – д.м.н., профессор, заведующий кафедрой акушерства и гинекологии № 1
Ростов-на-Дону
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
В. В. Волошин
Россия
Владимир Викторович Волошин – к.м.н., доцент, доцент кафедры патологической анатомии
Ростов-на-Дону
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Н. Г. Сапронова
Россия
Наталия Германовна Сапронова – д.м.н., профессор, заведующий кафедрой хирургических болезней № 1
Ростов-на-Дону
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
С. С. Тодоров
Россия
Сергей Сергеевич Тодоров – д.м.н., доцент, заведующий кафедрой патологической анатомии
Ростов-на-Дону
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
М. А. Рымашевский
Россия
Михаил Александрович Рымашевский – к.м.н., ассистент кафедры акушерства и гинекологии №1
Ростов-на-Дону
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Р. Н. Канцуров
Россия
Роман Николаевич Канцуров – к.м.н., сердечно-сосудистый хирург отделения сосудистой хирургии
Ростов-на-Дону
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Рецензия
Для цитирования:
Канцурова М.Р., Рымашевский А.Н., Волошин В.В., Сапронова Н.Г., Тодоров С.С., Рымашевский М.А., Канцуров Р.Н. Результаты перевязки внутренних подвздошных и яичниковых артерий в эксперименте. Медицинский вестник Юга России. 2023;14(4):77-82. https://doi.org/10.21886/2219-8075-2023-14-4-77-82
For citation:
Kantsurova M.R., Rymashevsky A.N., Voloshin V.V., Sapronova N.G., Todorov S.S., Rymashevsky M.A., Kantsurov R.N. Results of ligation the internal iliac and ovarian arteries in the experiment. Medical Herald of the South of Russia. 2023;14(4):77-82. (In Russ.) https://doi.org/10.21886/2219-8075-2023-14-4-77-82







































