Перейти к:
Система интерферонов при типичных хронических и атипично протекающих хронических активных герпесвирусных инфекциях
https://doi.org/10.21886/2219-8075-2023-14-4-58-65
Аннотация
Цель: изучение особенностей функционирования системы IFN, наличие аутоантител к INFα у пациентов, страдающих атипичными хроническими активными герпесвирусными инфекциями (АХА-ГВИ) в сравнении с пациентами, имеющими типичное течение хронических герпесвирусных инфекций (ХГВИ).
Материалы и методы: под наблюдением находились 485 пациентов обоего пола, от 23 до 70 лет, страдающих хроническими герпесвирусными инфекциями (335 пациентов – с АХА-ГВИ, 150 – с ХГВИ). Группа сравнения – 250 условно здоровых лиц (ГС). В комплекс исследования были включены методы детекции герпесвирусов: серодиагностика, PCR-RT. Методом ИФА было проведено исследование системы IFN (спонтанная и индуцированная продукция, сывороточная концентрация). Исследование было одобрено комиссией по вопросам этики, все пациенты дали информированное согласие.
Результаты: определена частота встречаемости различных моно- и микстгерпесвирусных инфекций у пациентов с АХА-ГВИ (моно – 26,6%; микст – 73,4%) и ХГВИ (моно – 23,1%; микст – 76,9%), при этом показано доминирование ВЭБ у пациентов обеих групп. Выявлен дефицит сывороточного IFNα в 100% случаев в обеих группах, а IFNγ – в 67% при АХА-ГВИ и 57% – при ХГВИ. В то же время выявлены значительные достоверные различия между группами АХА-ГВИ и ХГВИ по уровню снижения IFNα (10 и в 5 раз соответственно), а для IFNγ – в 2,0 и в 2,6 раз соответственно. Показано снижение индуцированной продукции IFNα при АХА-ГВИ в 89,1% и в 47,2% (при ХГВИ). Снижение индуцированной продукции IFNγ характерно для 50% пациентов обеих групп. При этом уровень индуцированной продукции IFNα у пациентов с АХА-ГВИ был в 9 раз ниже, чем в группе контроля, и в 4,75 раза ниже, чем в группе пациентов с ХГВИ. А уровень индуцированной продукции IFNγ был в 2 раза ниже по сравнению с ХГВИ и группой контроля.
Выводы: при оценке состояния системы ИФН у пациентов с различными хроническими герпесвирусными инфекциями выявлены значительные различия. Так, наиболее выраженные проявления интерферонопатии, заключающееся в значительном снижении сывороточных IFNα и IFNγ и дефектах индуцированной продукции IFN обоих типов, наблюдаются статистически достоверно чаще в группе пациентов с атипичным течением болезни, чем в группе пациентов с типичным течением ХГВИ. Наиболее выраженные нарушения в системе IFN и отсутствие восстановления уровней IFNα и IFNγ в межрецидивный период обусловливают атипичность течения и активную вирусную репликацию у пациентов с АХА-ГВИ.
Для цитирования:
Халтурина Е.О., Нестерова И.В., Малиновская В.В., Мяндиев М.С. Система интерферонов при типичных хронических и атипично протекающих хронических активных герпесвирусных инфекциях. Медицинский вестник Юга России. 2023;14(4):58-65. https://doi.org/10.21886/2219-8075-2023-14-4-58-65
For citation:
Khalturina E.O., Nesterova I.V., Malinovskaya V.V., Myandiev M.S. Interferon system in typical chronic and atypically occurring chronic active herpes virus infections. Medical Herald of the South of Russia. 2023;14(4):58-65. (In Russ.) https://doi.org/10.21886/2219-8075-2023-14-4-58-65
Введение
Известно, что дисбаланс системы интерферонов (IFN) является краеугольным камнем иммунопатогенеза атипичных хронических активных герпесвирусных инфекций (АХА-ГВИ). Зачастую он связан не только с врождёнными, генетически обусловленными дефектами, так называемыми врождёнными ошибками иммунитета, но с приобретенными нарушениями регуляции системы IFN на разных уровнях: рецепторном, молекулярном, на уровне ядерного трансмиттера передачи сигнала1,2 [1–5]. Известно, что IFN I типа играют важную роль в развитии и модуляции противовирусного иммунного ответа, осуществляемого посредством индукции генов, стимулируемых IFN (ISG), через янус-киназу (JAK) и преобразователь сигналов и активатор транскрипции сигнальные пути (STAT) [6][7]. За исключением JAK-STAT-зависимого пути (канонический путь) IFN типа I также может активировать передачу сигналов через STAT-независимые пути (так называемая неканоническая активация — через MAPK-митоген-активируемые протеинкиназы и PI3K-фосфатидилинозитол-3-киназы) [7]. Существующие многочисленные клеточные и молекулярные механизмы регуляции системы IFN, которые координируют посттрансляционную модификацию (PTM) сигнальных молекул и эпигенетическую модификацию программ экспрессии генов, являющихся двумя важными механизмами регуляции передачи сигналов IFN и имеющих решающее значение для развития IFN-опосредованно иммунного ответа. Показано, что интервенция вирусов, в частности вирусов семейства Herpesviridae, нарушает функциональную активность системы IFN, что лежит в основе развития иммунопатогенеза как инфекционных заболеваний, так и аутовоспалительных синдромов и процессов, посредством аберрантной активации воспалительных реакций или неадекватного контроля над течением вирусной инфекции [8–10]. Таким образом, адекватность ответа системы IFN на вирусные стимулы определяет эффективность иммунного реагирования, способствуя элиминации вируса.
Именно поэтому изучение особенностей функционирования системы интерферонов и связанные с ними особенности диагностики этих нарушений имеют столь актуальное значение в современной медицине.
Цель исследования — изучение особенностей функционирования системы IFN, наличие аутоантител к INFα у пациентов, страдающих атипичными хроническими активными герпесвирусными инфекциями (АХА-ГВИ) в сравнении с пациентами, имеющими типичное течение хронических герпесвирусных инфекций (ТХГВИ).
Материалы и методы
Под нашим наблюдением находились 485 пациентов обоего пола в возрасте от 23 до 70 лет, страдающих хроническими герпесвирусными инфекциями: 335 пациентов имели атипичное типичное течение хронического вирусного процесса (АХА-ГВИ) и 150 человек страдали хроническими герпесвирусными инфекциями типичного течения (ХГВИ). Критериями атипичного течения ГВИ являлись рецидивирующее или упорное рецидивирующее течение ВПГ1, ВПГ2 с частотой рецидивов от 5 до 20 эпизодов в год и длительностью рецидива от 5 до 12 дней, рекуррентные ОРВИ от 5 до 24 раз в год и длительностью свыше 7 дней (5–10 дней) с длительностью периода клинического благополучия от 3 до 6 месяцев. Кроме того, рекуррентные ОРВИ зачастую осложнялись присоединением бактериальных инфекций дыхательных путей (острый бронхит, острая пневмония и пр.) и ЛОР-органов (острый синусит, острый гнойный аденоидит и пр.). Доминирующими клиническими проявлениями у пациентов этой группы был синдром хронической усталости (СХУ) и разнообразные когнитивные расстройства. При типично протекающих ХГВИ частота рецидивов ВПГ1 и ВПГ2 не превышает 2–4 раз в год, при этом индукторами обострений являются действие стрессоров, травмы, тяжёлые соматические заболевания в стадии обострения, оперативные вмешательства, резкая смена климата, температурного режима и часовых поясов и пр. Рецидивы ХГВИ носят неосложненный характер и их длительность не превышает 3–5 дней. Группу сравнения (ГС) составляли 250 условно здоровых лиц, сопоставимых по полу и возрасту с пациентами ГИ.
Помимо традиционных методов исследования (сбора анамнеза, физикальное обследования, общеклинические исследования), с целью верификации диагноза герпесвирусных инфекций использовались методы серодиагностики (определение антител классов IgM и IgG к VCA ВЭБ, IgG EBNA, IgG ВЧГ6, IgM и IgG к ЦМВ, IgM и IgG к ВПГ1/2 типов) с помощью ИФА тест-систем НПО «Диагностические системы» (Россия), молекулярно-генетические методы исследования (детекция генома герпесвирусов в биоматериалах (кровь, слюна, моча, соскоб с миндалин и задней стенки глотки) методом PCR-Real time тест-системы «АмплиСенс» (Россия)). Для комплексной оценки функционального состояния системы интерферонов проводилось исследование спонтанной и индуцированной продукция IFNα и IFNγ (после их индукции in vitro эталонными индукторами — вирусом болезни Ньюкасла (ВБН) и фитогемагглютинином (ФГА) соответственно), концентрации сывороточных IFNα и IFNγ и определение уровня антител anti-IFNα Ig G проводилось методом ИФА с использованием тест-систем (ЗАО «Вектор-Бест», Новосибирск; ООО «Цитокин» Санкт-Петербург).
Исследование было одобрено комиссией по вопросам этики. Согласно Хельсинкской декларации Всемирной медицинской ассоциации, у всех пациентов было получено информированное согласие на участие в исследовании и на обработку персональных данных.
Для статистической обработки полученных данных использованы компьютерные программы Microsoft Excel. Результаты представляли в виде медианы (верхний и нижний квартиль) Me [Q1;Q3], определялись критерии Манна-Уитни и Вилкоксона. Различия полагали достоверными при p<0,05.
Результаты
У пациентов, страдающих ХГВИ и АХА-ГВИ, была определена частота встречаемости различных моно- и микст-герпесвирусных инфекций, выявляемых методом PCR-RT. Результаты определения этиологической структуры которых представлены на рисунках 1 и 2.
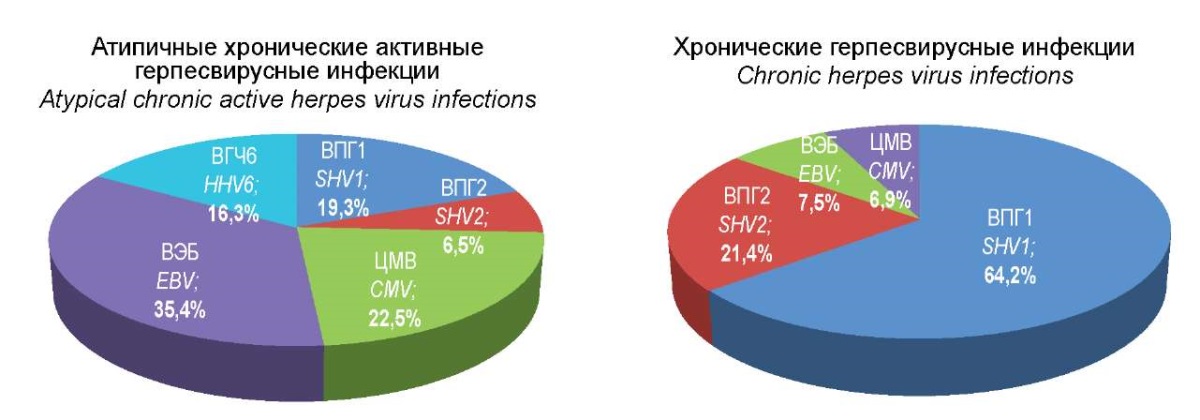
Рисунок 1. Этиологическая структура моно-герпесвирусных инфекций.
Figure 1. Etiological structure of mono-herpesvirus infections.
Анализ полученных данных продемонстрировал, что в группе пациентов с АХА-ГВИ) моноинфекциями страдает 26,6% пациентов, 35,4% которых составляют пациенты с ВЭБ-инфекцией, 22,5% — приходится на долю ЦМВ, 19,3% в этиологической структуре моноинфекций составляют ВПГ 1-го типа, 16,5% — ВГЧ6 и 6,5% — с ВПГ 2-го типа соответственно (рис. 1).
В то же время в группе пациентов с ХГВИ этиологическая структура ГВИ была совершенно иной, хотя общая доля моноинфекций в этой группе практически не отличалась от группы с АХА-ГВИ и составляла 23,1%. Доля ВПГ 1-го типа составляла 62,4%, ВПГ 2-го типа — 21,4%, ВЭБ и ЦМВ — 7,5% и 6,9% соответственно, при этом генома ВГЧ6 типа обнаружено не было.
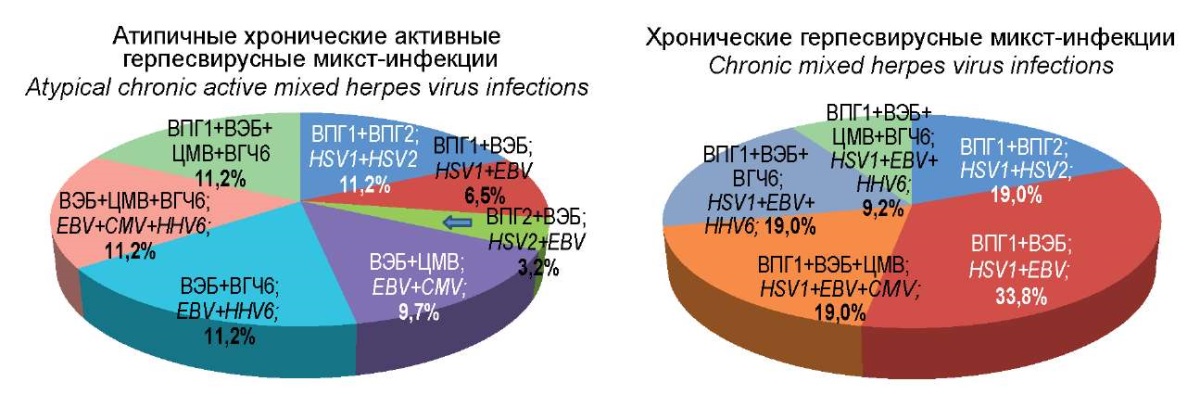
Рисунок 2. Этиологическая структура герпесвирусных микст-инфекций.
Figure 2. Etiological structure of herpes virus mixed infections.
При сравнении этиологической структуры микст-инфекций герпесвирусных инфекций в группе пациентов АХА-ГВИ и группе сравнения ХГВИ типичного течения также были установлены значительные различия.
Так, сочетание ВПГ1+ВПГ2 при ХГВИ регистрировалось в 1,7 раза чаще, а сочетание ВПГ1+ВЭБ — в 5,2 раза чаще, чем при АХА-ГВИ. Таким образом, группа пациентов с ХГВИ имела значительные достоверные отличия от группы пациентов с АХА-ГВИ по частоте встречаемости этих двух сочетаний герпесвирусов. Остальные варианты сочетания двух видов герпесвирусов, включающие в том числе ВПГ2, ЦМВ, ВГЧ6 с различной частотой встречаемости были обнаружены только в группе пациентов с АХА-ГВИ. В отношении одновременной регистрации трёх возбудителей показано, что сочетание ВЭБ+ЦМВ+ВГЧ6 было зарегистрировано только в группе пациентов с АХА-ГВИ (11,2%), а сочетание ВПГ1+ВЭБ+ ЦМВ или ВГЧ6 — только у пациентов в группе сравнения (по 19%). Наконец, сочетание всех четырёх определяемых герпесвирусов встречалось в обеих группах примерно с одинаковой частотой (11,2% и 9,2% соответственно).
Таким образом, в группе пациентов с АХА-ГВИ выявлены характерны особенности этиологической структуры, заключающиеся в более высокой частоте встречаемости ВЭБ, ЦМВ, ВГЧ6 с доминированием ВЭБ, а при микст герпесвирусных инфекциях — большее разнообразие сочетаний герпесвирусов разных видов.
Изучение интерферонового статуса пациентов с АХА-ГВИ проводилось путём анализа содержания IFN α и γ в сыворотке крови пациентов в сравнении с группами пациентов ХГВИ и условно здоровых людей (табл. 1, рис. 3).
Таблица / Table 1
Интерфероновый статус сыворотки крови пациентов с АХА-ГВИ
в сравнении с пациентами с ХГВИ и группой контроля
Status of serum interferon’s on patients with ACA-HVI
versus patients with CHVI and control group
Интерфероны Interferon’s | Медиана [минимум; максимум] Median [minimum; maximum] | р1 р2 р3 | ||
АХА-ГВИ ACA-HVI (n=335) | ХГВИ CHVI (n=150) | Контроль Control (n=250) | ||
IFNα, пг/мл IFNα, pg/ml | 20,8 [ 9,0; 32,3] | 29,9 [ 23,9; 42,6] | 31,0 [ 28,2; 46,4] | <0,001* <0,001* 0,002* |
IFNγ, пг/мл IFNγ, pg/ml | 29,5 [ 10,3; 46,1] | 53,6 [ 40,3; 122,3] | 51,8 [ 40,7; 82,1] | <0,001* 0,006* 0,885 |
Примечание: n — число обследованных лиц в каждой группе;
p1 — вероятность различий в группах АХА-ГВИ и контроля;
p2 — вероятность различий в группах ХГВИ и контроля;
p3 — вероятность различий при АХА-ГВИ и ХГВИ;
* — достоверность различий по критерию Манна-Уитни при р<0,05.
Note: n — the number of examined persons in each group;
p1 — probability of differences in the groups of ACA-HVI and control;
p2 — probability of differences in the CHVI and control groups;
p3 — probability of differences in ACA-HVI and CHVI;
* — reliability of Mann-Whitney differences at p < 0,05.
В группе пациентов с АХА-ГВИ показано значительное снижение концентраций в сыворотке крови как IFNα, так и IFNγ. Аналогичная тенденция наблюдалась и в группе пациентов с ХГВИ, однако если по уровню снижения уровня IFNα различия между двумя группами были достоверными, хотя в обоих случаях снижение было очень выраженным –(примерно в 10 и в 5 раз соответственно), то для IFNγ степень снижения была значительно меньшей (в 2 и в 2,6 раза соответственно ) и достоверных различий между группами не выявлено не было.
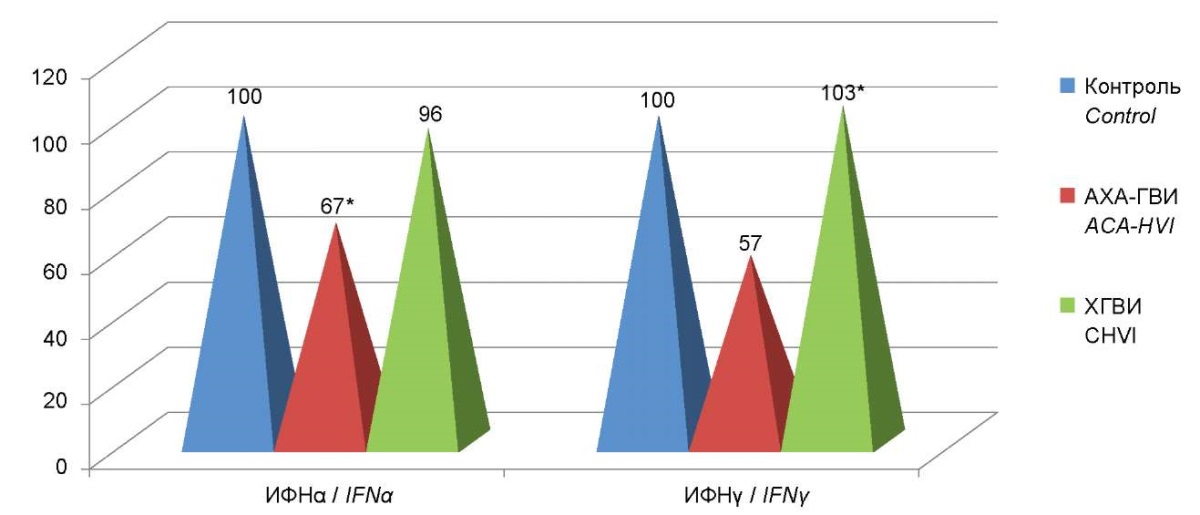
Рисунок 3. Проценты отклонения от контроля интерферонов сыворотки крови
в группе с АХА-ГВИ по сравнению с пациентами с ХГВИ.
Figure 3. Percent deviation from serum interferon control
in the AСA-HVI group compared to patients with CHVI.
Интересно отметить факт, что достоверных корреляций между уровнями интерферонов и наличием антиинтерфероновых антител в сыворотке крови пациентов обеих групп отмечено не было, то есть механизм с участием аутоантител не был обнаружен.
При определении диагностической значимость уровней IFN α и γ в сыворотках крови пациентов из групп исследования и здоровых людей (рис. 4 и 5) наглядно показана обособленность 95% доверительных интервалов уровней IFN у пациентов с АХА-ГВИ в диапазоне низких значений: для ИФНα — <23,5 пг/мл, для ИФНγ — <37 пг/мл. Диагностическая значимость этих отклонения для АХА-ГВИ в обоих случаях была очень высокой (AUC — соответственно 0,888 и 0,865).
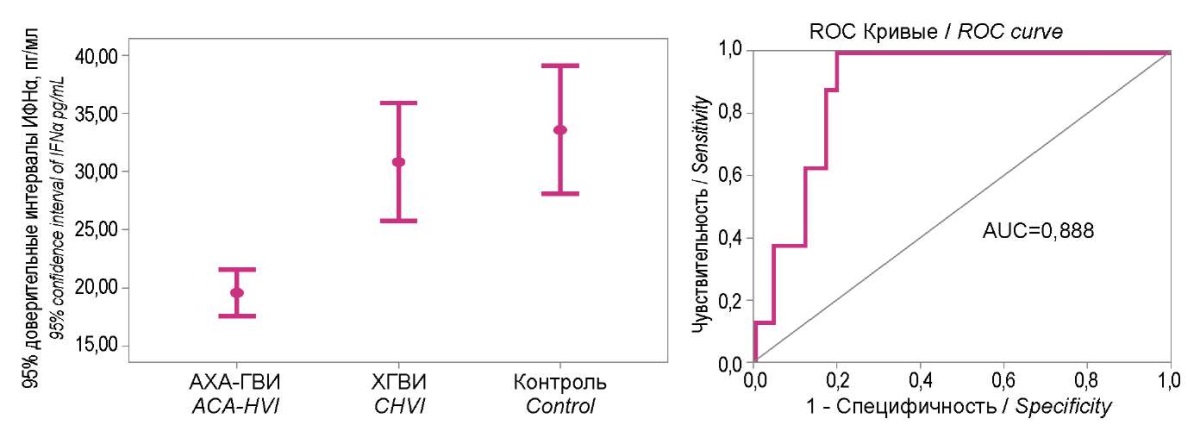
Рисунок 4. 95% доверительные интервалы уровня интерферона α
в группах исследования и их диагностическое значение по данным ROC-анализа.
Figure 4. 95% confidence intervals of interferon α level
in study groups and their diagnostic significance ROC analysis.
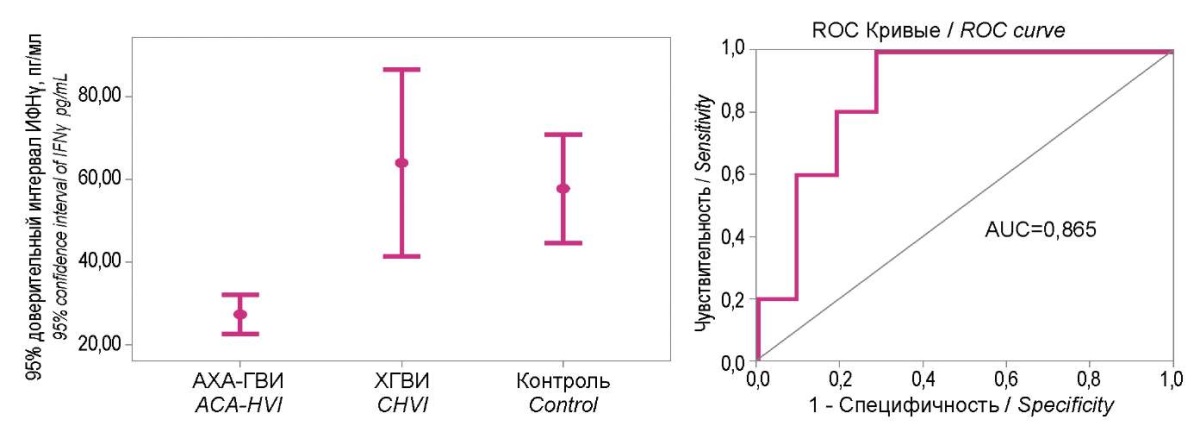
Рисунок 5. 95% доверительные интервалы уровня интерферона γ
в группах исследования и их диагностическое значение по данным ROC-анализа.
Figure 5. 95% confidence intervals of interferon γ level
in study groups and their diagnostic significance ROC analysis.
Принимая во внимание выявленные особенности изменения концентраций интерферонов обоих типов в сыворотке крови пациентов с АХА-ГВИ нами была проведена сравнительная оценка содержания IFN обоих типов в сыворотке у пациентов, страдающих моно и микст – АХА-ГВИ. Установлено достоверное снижение уровня сывороточного интерферона α в 1,7 раза в обеих группах пациентов: моно — 18,94 (13,2; 28,1), микст — 20,89 (18,7;21,9) пг/мл против 31,05 (29,2;35,0) пг/мл в группе сравнения (p<0,05). Уровень сывороточного IFNγ у пациентов с моно-ГВИ составил 31,89 (20,83;39,44) пг/мл и 40,0 (23,4;40,0) пг/мл в группе пациентов с микст-ГВИ, что имеет статистически значимые различия с показателями группы сравнения (p˂0,05). Статистически значимых отличий по уровню сывороточного IFNγ между группами пациентов с моно- и микст-АХА-ГВИ выявлено не было (рис. 6).
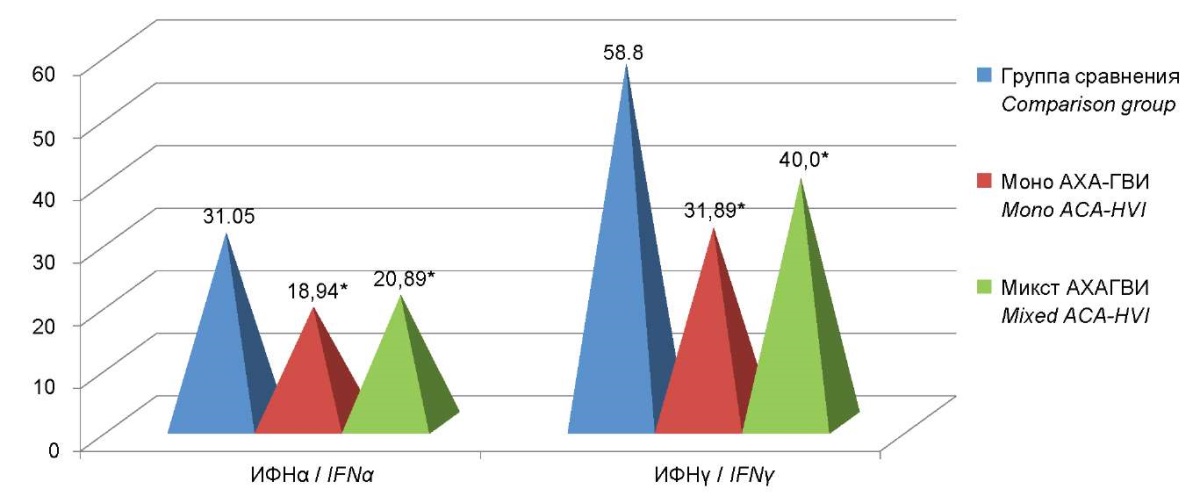
Рисунок 6. Уровни сывороточных интерферонов
у пациентов, страдающих моно- и микст-АХА-ГВИ.
Примечание: * — статистически значимые различия
по отношению к группе сравнения (p<0,05).
Figure 6. The levels of serum interferon in patients with mono and mixed-ACA-HVI.
Note: * — statistically significant differences compared to the comparison group (p<0.05).
Изучение особенностей индуцированной продукции IFN α и γ выявило снижение продукции индуцированного интерферона α у 100% пациентов с АХА-ГВИ, в то время как снижение индуцированной продукции интерферона γ было зафиксировано только у 48% пациентов этой группы.
Полученные результаты демонстрируют, что у пациентов с АХА-ГВИ и ХГВИ уровень индуцированной продукции IFNα и IFNγ достоверно отличается от показателей как в группе контроля. При этом между двумя группами также выявлены выраженные статистически значимые различия. Показано, что уровень индуцированной продукции IFN α у пациентов с АХА-ГВИ был в 9 раз ниже, чем в группе контроля, и в 4,75 раза ниже, чем в группе пациентов с ХГВИ. А уровень индуцированной продукции IFNγ был в 2 раза ниже показателей группы контроля и ХГВИ (рис. 7).
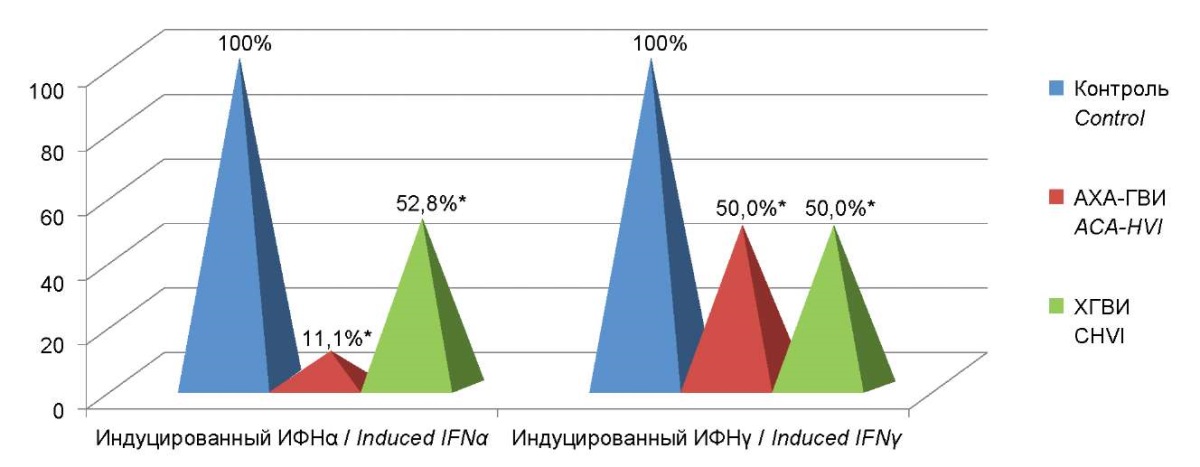
Рисунок 7. Проценты отклонения от контроля
уровней индуцированной продукции интерферонов α и γ
в группе пациентов с АХА-ГВИ
по сравнению с группой сравнения и группой контроля.
Примечание: * — статистически значимые различия
по отношению к группе сравнения (p<0,05).
Figure 7. Percentage deviations from control
of levels of induced interferon’s α and γ production
in the group of patients with ACA-HVI
compared to comparison group and control group.
Note: * — statistically significant differences
with respect to the comparison group (p<0.05).
Обсуждение
Таким образом, у пациентов с АХА-ГВИ выявлены различные дефекты функционирования системы интерферонов — интерферонопатии, такие как достоверное снижение индуцированной продукции интерферонов обоих типов, выраженное снижение сывороточного IFNα по отношению как к аналогичным показателям пациентов с ХГВИ, так и к группе условно здоровых лиц, что обусловливает неполноценность ответа иммунной системы на вирусный инфекционный процесс и снижение эффективности противовирусной иммунной защиты. Можно предположить, что выявленные нарушения в системе интерферонов могут быть обусловлены наследственными изменениями в генах интерферона, а также носить приобретенный характер. Убедительно доказано, что герпесвирусы способны оказывать негативное, супрессорное влияние на систему интерферона, используя при этом различные стратегии подавления и антигенной мимикрии, что является одной из основ иммунопатогенеза атипичного хронического активного течения этой инфекции.
Так, наиболее выраженные проявления интерферонопатии, заключающееся в значительном снижении сывороточных IFNα и IFNγ и дефектах индуцированной продукции IFN обоих типов, наблюдаются статистически достоверно чаще в группе пациентов с атипичным течением болезни, чем в группе пациентов с типичным течением ХГВИ. Важно отметить, что в межрецидивном периоде в группе пациентов с ХГВИ происходит восстановление функционирования системы IFN и уровни IFNα и IFNγ достигают показателей условно здоровых лиц. В то же время у пациентов с АХА-ГВИ наблюдаются наиболее выраженные нарушения в системе IFN: уровень IFNα и IFNγ изначально более низок, чем у пациентов с типичным течением герпесвирусной инфекции, не достигая показателей условно здоровых лиц вне периода обострения, что связано с более серьёзным поражением системы IFN и обусловливает атипичность течения этой инфекции и активную вирусную репликацию у пациентов этой группы.
Выводы
Определена частота встречаемости различных моно- и микст-герпесвирусных инфекциях у пациентов с АХА-ГВИ ( моно — 26, 6%, микст — 73,4%) и ХГВИ (моно — 23,1%, микст — 76,9%). Установлено доминирование ВЭБ в различных комбинациях микст-герпесвирусных инфекций у пациентов обеих групп.
У всех пациентов, страдающих хроническими герпесвирусными инфекциями типичного и атипичного течения, выявлены различные дефекты функционирования системы интерферонов (интерферонопатии) различной степени выраженности: дефекты индуцированной продукции интерферонов обоих типов, выраженное снижение сывороточного IFNα.
Показано достоверно значимое выраженное снижение концентраций в сыворотке крови пациентов с АХА-ГВИ и ХГВИ как IFNα (в 100 % случаях в обеих группах), так и IFNγ (в 67% и 57%). В то же время выявлены значительные достоверные различия между группами АХА-ГВИ и ХГВИ по уровню снижения уровня IFNα, которое соответствовало снижению концентрации в 10 и в 5 раз соответственно. Для IFNγ степень снижения была значительно меньше — в 2 и в 2,6 раза соответственно. Достоверных различий между группами не выявлено не было.
Установлено, что у 89,1% пациентов с АХА-ГВИ имеется статистически значимое выраженное снижение индуцированной продукции IFNα в 9 раз по отношению к группе контроля и в 4,75 раза по сравнению с группой пациентов с ХГВИ. В то время как снижение индуцированной продукции IFNγ наблюдается у 50% пациентов как в группе пациентов с АХА-ГВИ, так и ХГВИ по сравнению с группой условно здоровых лиц, что обусловливает неполноценность ответа иммунной системы на вирусный инфекционный процесс и снижение эффективности противовирусной иммунной защиты.
Показано, что у пациентов с АХА-ГВИ и ХГВИ аутоантитела Ig G к IFNα в сыворотке крови не обнаружены, что исключает аутоиммунный генез дефицита сывороточного IFNα.
1. Исакова В.А., Исаков Д.В., Архипова Е.И. Герпесвирусные инфекции человека. Руководство для врачей. СПб.; 2015.
2. Нестерова И.В., Ковалева С.В., Чудилова Г.А., Халтурина Е.О., Малиновская В.В. Врождённые и приобретённые интерферонопатии, ассоциированные с нетипично протекающими вирусными инфекциями и с COVID-19 (монография). Спб.: Издательство «Диалог»; 2022.
Список литературы
1. Дюдюн А.Д., Полион Н.Н., Нагорный А.Е. Герпесвирусная инфекция. Клинико-иммунологические особенности. Клиническая лекция. Дерматовенерология. Косметология. Сексопатология. 2015;(3-4):119–125.
2. Горейко Т.В., Калинина Н.М., Дрыгина Л.Б. Современные представления об иммунопатогенезе инфекции, вызванной вирусом Эпштейна–Барр. Инфекция и иммунитет. 2014;1(2):121-130.
3. Новикова И.А., Романива О.А. Особенности продукции цитокинов при рецидивирующей герпетической инфекции. Медицинская иммунология. 2013;15(6):571-576.
4. Blaszczyk K, Nowicka H, Kostyrko K, Antonczyk A, Wesoly J, Bluyssen HA. The unique role of STAT2 in constitutive and IFN-induced transcription and antiviral responses. Cytokine Growth Factor Rev. 2016;29:71-81. https://doi.org/10.1016/j.cytogfr.2016.02.010
5. Samarajiwa SA, Forster S, Auchettl K, Hertzog PJ. INTERFEROME: the database of interferon regulated genes. Nucleic Acids Res. 2009;37(Database issue):D852-7. https://doi.org/10.1093/nar/gkn732
6. Chen K, Liu J, Cao X. Regulation of type I interferon signaling in immunity and inflammation: A comprehensive review. J Autoimmun. 2017;83:1-11. https://doi.org/10.1016/j.jaut.2017.03.008
7. Fallet B, Narr K, Ertuna YI, Remy M, Sommerstein R, et al. Interferon-driven deletion of antiviral B cells at the onset of chronic infection. Sci Immunol. 2016;1(4):eaah6817. https://doi.org/10.1126/sciimmunol.aah6817
8. Li W, Lv S, Liu G, Lu N, Jiang Y, et al. Epstein-Barr virus DNA seropositivity links distinct tumoral heterogeneity and immune landscape in nasopharyngeal carcinoma. Front Immunol. 2023;14:1124066. https://doi.org/10.3389/fimmu.2023.1124066
9. Crow MK, Ronnblom L. Type I interferons in host defence and inflammatory diseases. Lupus Sci Med. 2019;6(1):e000336. https://doi.org/10.1136/lupus-2019-000336
10. Xia C, Anderson P, Hahm B. Viral dedication to vigorous destruction of interferon receptors. Virology. 2018;522:19-26. https://doi.org/10.1016/j.virol.2018.06.017
Об авторах
Е. О. ХалтуринаРоссия
Евгения Олеговна Халтурина – к.м.н., доцент, доцент кафедры микробиологии, вирусологии и иммунологии им. ак. А.А. Воробьева
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
И. В. Нестерова
Россия
Ирина Вадимовна Нестерова – д.м.н., профессор, профессор кафедры клинической иммунологии, аллергологии и адаптологии ФНМО Медицинского института
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
В. В. Малиновская
Россия
Валентина Васильевна Малиновская – д.б.н., профессор, руководитель лаборатории онтогенеза и коррекции системы интерферона
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
М. С. Мяндиев
Россия
Морис Садикович Мяндиев – к.м.н., ассистент кафедры
пропедевтики стоматологических заболеваний
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Рецензия
Для цитирования:
Халтурина Е.О., Нестерова И.В., Малиновская В.В., Мяндиев М.С. Система интерферонов при типичных хронических и атипично протекающих хронических активных герпесвирусных инфекциях. Медицинский вестник Юга России. 2023;14(4):58-65. https://doi.org/10.21886/2219-8075-2023-14-4-58-65
For citation:
Khalturina E.O., Nesterova I.V., Malinovskaya V.V., Myandiev M.S. Interferon system in typical chronic and atypically occurring chronic active herpes virus infections. Medical Herald of the South of Russia. 2023;14(4):58-65. (In Russ.) https://doi.org/10.21886/2219-8075-2023-14-4-58-65







































