Перейти к:
Эффективность дифференцированной таргетной интерферонои иммуномодулирующей терапии, ориентированной на патологические иммунофенотипы, у пациентов с атипичными хроническими активными герпесвирусными инфекциями
https://doi.org/10.21886/2219-8075-2024-15-1-165-175
Аннотация
Цель: в рамках проспективного когортного исследования оценить клинико-иммунологическую эффективность дифференцированной таргетной интерфероно- и иммуномодулирующей терапии, ориентированной на выявленные патологические иммунофенотпы и ассоциированные с ними клинические проявления у иммунокомпрометированных пациентов, страдающих атипичными хроническими активными герпесвирусными инфекциями (АХА-ГВИ).
Материалы и методы: обследованы 335 пациентов, страдающих микст-АХА-ГВИ. В комплекс исследования были включены методы детекции герпесвирусов (серодиагностика, ПЦР-РВ), иммунологические методы (исследование субпопуляционного состава лимфоцитов крови методом проточной цитометрии), определение спонтанной и индуцированной продукции ИФНα и ИФНγ, уровней сывороточных цитокинов и иммуноглобулинов (ИЛ-1β, ИЛ-6, ИЛ-17, ФНОα и ИФНα и ИФНγ, Ig A, M, G) методом иммуноферментными исследованиями (ИФА). Исследование было одобрено комиссией по вопросам этики, все пациенты дали информированное согласие.
Результаты: Созданы интегральные формулы нарушений в системе противовирусной иммунной защиты, позволившие выделить 3 патологических иммунофенотипа (ПИФ), а именно ПИФ1 (НГ↓+индуц.ИФНα/ИФНγ↓+ЦТЛ↓+ЕКК↓+IgM↑+гиперцитокинемия (ИЛ-1β↑+ИЛ-6↑+ФНОα↑)), ПИФ2 (НГ↓+ индуц. ИФНα/ИФНγ↓ + ЕКК↓+ IgG↓+гиперцитокинемия (ИЛ-1β↑+ИЛ-6↑+ФНОα↑)) и ПИФ3 (НГ↓+индуц. ИФНα/ИФНγ↓+гиперцитокинемия (ИЛ-1β↑+ИЛ-6↑+ФНОα↑)). С учётом выявленных нарушений для каждого ПИФ разработана программа таргетной интерфероно- и иммуномодулирующей терапии: для ПИФ1 — локальная и системная ИФН-терапия+гексапептид, для ПИФ2 — локальная и системная ИФН-терапия+глюкозаминилмурамилдипептид, для ПИФ3 — локальная и системная ИФН- терапия.
Выводы: продемонстрирована высокая клиническая эффективность терапии у 100% пациентов с АХА-ГВИ трёх групп. Иммунологическая эффективность программ таргетной интерфероно- и иммуномодулирующей терапии составила для ПИФ1 — 89,5%, для ПИФ — 2–57,6% и для ПИФ3 — 37,5% случаев.
Для цитирования:
Нестерова И.В., Халтурина Е.О. Эффективность дифференцированной таргетной интерферонои иммуномодулирующей терапии, ориентированной на патологические иммунофенотипы, у пациентов с атипичными хроническими активными герпесвирусными инфекциями. Медицинский вестник Юга России. 2024;15(1):165-175. https://doi.org/10.21886/2219-8075-2024-15-1-165-175
For citation:
Nesterova I.V., Khalturina E.O. Efficacy of differentiated targeted interferon and immunomodulatory therapy focused on pathological immunophenotypes in patients with atypical chronic active herpesvirus infections. Medical Herald of the South of Russia. 2024;15(1):165-175. (In Russ.) https://doi.org/10.21886/2219-8075-2024-15-1-165-175
Введение
Актуальной проблемой сегодняшних дней является рост инфекционных заболеваний с атипичным течением [1–3]. По данным ВОЗ, наблюдается ежегодный неуклонный рост числа герпесвирусных инфекций, которые принимают характер пандемии и относятся к неконтролируемым инфекциям [3–7]. Кроме того, появляются новые, мало изученные атипичные клинические формы этих инфекций: атипичные хронические активные герпесвирусные инфекции (АХА-ГВИ) [8]. Они представляют большие сложности с диагностической точки зрения, а существующие методы терапии мало эффективны. [8][9][11]. Поскольку трансляционная иммунология — это процесс использования иммунологических открытий для разработки практических решений человеческих проблем и в результате для обеспечения высокой эффективности оказания медицинской помощи, то значимость исследований, проводимых в рамках трансляционной иммунологии, заключается в получении новых данные об иммунопатогенезе АХА-ГВИ, что может послужить основой для разработки новых диагностических подходов и создания дифференцированных методов коррекции нарушений противовирусной иммунной зашиты [10]. Таким образом, на базе получения новых научных данных об иммунопатогенезе АХА-ГВИ возможно получить практическое решение актуальной проблемы повышения эффективности лечения пациентов с АХА-ГВИ.
Цель исследования — в рамках проспективного когортного исследования оценить клинико-иммунологическую эффективность дифференцированной таргетной интерфероно- и иммуномодулирующей терапии, ориентированной на выявленные патологические иммунофенотпы и ассоциированные с ними клинические проявления, у иммунокомпрометированных пациентов, страдающих атипичными хроническими активными герпесвирусными инфекциями (АХА-ГВИ).
Материалы и методы
В исследуемую когорту вошли 335 пациентов, страдающих микст-АХА-ГВИ, с давностью анамнеза заболевания от 3 лет до 12 лет (группа исследования — ГИ). Диагноз АХА-ГВИ устанавливался на основании наличия лабораторных критериев и клинических признаков иммунокомпрометированности, оцениваемых при помощи разработанных нами ранее клинических критериев I и II порядка [11].
Комплексное обследование включало традиционные методы (сбор жалоб и анамнеза, физикальное обследование, общеклинические лабораторные исследования и пр). Методы серологической диагностики ГВИ включали определение антител IgM и IgG к различным антигенам ВЭБ (VCA, EBNA, NA), ЦМВ, ВПГ-1/2 типа, ВЧГ 6 типа методом ИФА с использованием тест-систем НПО «Диагностические системы» (Россия), молекулярно-генетический метод исследования с применением ПЦР-РВ (тест-система «АмплиСенс» (Россия) для детекции генома герпес-вирусов в биоматериалах (кровь, слюна, моча, соскоб с миндалин и задней стенки глотки). Объём иммунологического исследования включал определение спонтанной и индуцированной продукции ИФНα и ИФНγ, уровней сывороточных цитокинов и иммуноглобулинов (ИЛ-1β, ИЛ-1RA, ИЛ-6, ИЛ-17А, ФНОα и ИФНα и ИФНγ, Ig A, M, G) методом ИФА (тест-системы ЗАО «Вектор-Бест», Новосибирск; ООО «Цитокин» Санкт-Петербург), определение субпопуляционного состава лимфоцитов крови (метод проточной цитометрии (Beckman Coulter International, США).
Группу сравнения (ГС) составили 30 условно здоровых лиц сопоставимых по полу и возрасту с пациентами ГИ.
Исследование одобрено комиссией по вопросам этики, у всех пациентов получено информированное согласие на участие в исследовании и на обработку персональных данных, согласно Хельсинкской декларации Всемирной медицинской ассоциации (WMA Declaration of Helsinki, 2013).
Для статистической обработки полученных данных использована компьютерная программа Microsoft Excel. Результаты представляли в виде медианы (верхний и нижний квартиль) Me [Q1;Q3], определялись критерии Манна-Уитни и Вилкоксона. Различия полагали достоверными при p<0,05.
Результаты
При изучении особенностей клинического течения герпесвирусных инфекций у пациентов ГИ нами были использованы разработанные ранее клинические критериальные признаки иммунокомпрометированности I и II порядка [11]. В соответствии с клиническими критериями I порядка все пациенты ГИ имели высокую частоту рецидивов ГВИ (более 6 эпизодов в год) и высокую частоту рекуррентных ОРВИ (более 7 эпизодов в год — от 10 до 20 эпизодов в год или 1–2 эпизода в месяц). Клинически у этих пациентов рецидивы ГВИ носили преимущественно неосложненный характер, но имели длительное течение, трудно поддающееся стандартной терапии. Продолжительность периода возникающих в течение года клинических проявлений ОРВИ составляла от 5 до 10 дней — 7,5 (7,0; 8,0) дней, — а длительность клинически благополучного периода не превышала 6,3 месяца в год. Кроме того, рекуррентные ОРВИ зачастую осложнялись присоединением бактериальной инфекции, такой как острые заболевания верхних и нижних дыхательных путей (острый бронхит, острая пневмония и пр.) и ЛОР-органов (острый синусит, острый гнойный аденоидит и пр.).
Необходимо отметить, что патогномоничными клиническими проявлениями, наиболее характерными для пациентов с АХА-ГВИ, являлись длительное ощущение выраженной слабости, хронической усталости (синдром хронической усталости — СХУ), пациентов беспокоила потливость, непостоянные боли в горле, мигрирующие боли и дискомфорт в мышцах и суставах (фибромиалгии и артралгии), цефалгии, длительный субфебрилитет, регионарная лимфоаденопатия, нарушение структуры сна и процесса засыпания, снижение памяти, внимания, интеллекта, реже — психогенная депрессия. У части пациентов, страдающих АХА-ГВИ, наблюдались клинические проявления периферических нейро- и сенсопатий, миалгии и артралгии (по типу фибромиалгий), выраженные и прогрессирующие когнитивные и мнестические расстройства, что косвенным образом свидетельствует о развитии нейроиммуновоспаления с локализацией процесса как в периферических, так и центральных отделах нервной системы. Эти симптомы, относящиеся к критериальным клиническим признакам иммунокомпрометированности II порядка, были оценены по разработанной нами 5-бальной шкале оценки выраженности критериальных признаков/симптмов СХУ и когнитивных расстройств [11]. Выраженность симптомов по этой шкале при микст — АХА-ГВИ составила 54,5 [ 46,75; 62,25] баллов.
При изучении показателей, характеризующих состояние иммунной системы пациентов c АХА-ГВИ, выявлены различные дефекты функционирования противовирусной иммунной защиты, которые позволили уточнить особенности иммунопатогенеза этой инфекции, а именно: дефицит ИФНα, ИФНγ с нарушением их индуцированной продукции и снижением концентрации в сыворотке крови, дефицит ЕКК, ЦТЛ, дисиммуноглобулинемия, гиперцитокинемия провоспалительных цитокинов. Детальное изучение и уточнение вариативности различных комбинаций этих нарушений позволило выделить три основных патологических иммунофенотипа.
Для первого иммунофенотипа характерны дефекты в иммунной системе, где наряду с нарушением индуцированной продукции ИФНα и ИФНγ имелся дефицит цитотоксических Т-лимфоцитов (CD3+CD8+) в 76,4%, дефицит ЕКК — в 36,6%, нейтропения — у 83,7% пациентов, гиперпродукция всех изучаемых провоспалительных цитокинов, повышение уровня антител класса IgM у 84,2%. Значительные дефекты в системе интерферонов проявлялись нарушением индуцированной продукции ИФНα в 100% случаев и ИФНγ у 48% пациентов наряду со снижением уровня спонтанной продукции ИФНα в 1,7 раз и ИФНγ в 1,6 раз по отношению к группе условно здоровых лиц. Таким образом, интегральная формула нарушений в системе противовирусной иммунной защиты для этого иммунофенотипа выглядит следующим образом: НГ↓ + индуц. ИФНα/ИФНγ↓ + ЦТЛ↓ + ЕКК↓ + IgM↑ + гиперцитокинемия (ИЛ-1β↑ + ИЛ-6↑ + ФНОα↑). Клиническими особенностями пациентов, оцениваемых с помощью критериев иммунокомпрометированности I и II порядка, являлись следующие установленные особенности: частота рецидивов ГВИ 10,0 (9,5;12,5) случаев в год, продолжительность рецидивов ГВИ 8,0 (6,5;10,5) дней, длительность периода клинического благополучия (межрецидивный период) 6,5 (4,5;8,5), частота ОРВИ 11, 0 (8,5; 13,5) случаев в год, длительность ОРВИ 7,5 (6,5; 19,5) дней. При оценке клинических критериальных признаков иммунокомпрометированности II порядка по «Шкале оценки клинических критериев/признаков синдрома хронической усталости/миалгического энцефаломиелита (СХУ/МЭ) и когнитивных расстройств» количество набранных баллов соответствовало 54,5 [ 46,75; 62,25], при максимальной оценке 65,0 баллов.
Для второго иммунофенотипа были характерны вторичные интерферонопатии: дефицит индуцированной продукции ИФН альфа и ИФН гамма, дефицит количества нейтрофильных гранулоцитов (вторичная нейтропения), дефицит ЕКК. При изучении особенностей функционирования системы интерферонов у этих пациентов были выявлены значительные дефекты, проявляющиеся нарушением индуцированной продукции ИФНα в 100% случаев и ИФНγ — у 38% пациентов наряду со снижением уровня спонтанной продукции ИФНα у 21,4% и ИФНγ — у 8,4% ИФНγ пациентов этой группы Показано достоверное снижение абсолютного содержания CD3-CD16+CD56+ лимфоцитов в 76,6% случаев, а субпопуляций CD3+CD8+ — в 41,1%, что свидетельствует о несостоятельности противовирусной иммунной защиты от патогенов с клиническими проявлениями в виде частых рецидивов ГВИ и заболеваемости рекуррентными ОРВИ. На фоне отсутствия изменений абсолютных значений CD3-CD19+-лимфоцитов установлены нормальные уровни IgA и IgM (р<0,05) в крови и уменьшение концентрации IgG в 1,2 раза (р<0,05), что может свидетельствовать о недостаточности антительного иммунного ответа на патогены. Для этой группы пациентов была также характерна гиперпродукция всех изучаемых провоспалительных цитокинов. Интегральная формула нарушений в системе противовирусной иммунной защиты второго иммунофенотипа — НГ↓ + индуц.ИФНα/ИФНγ↓ + ЕКК↓ + IgG↓ + гиперцитокинемия (ИЛ-1β↑ + ИЛ-6↑ + ФНОα↑). Клиническими особенностями пациентов, оцениваемых с помощью критериев иммунокомпрометированности I и II порядка, являлись частота рецидивов ГВИ 10,0 (8,0;14,5) случаев в год, продолжительность рецидивов ГВИ 8,0 (6,5;10,5) дней, длительность периода клинического благополучия (межрецидивный период) 6,5 (4,5;8,5), частота ОРВИ — 11, 5 (10,5; 14,5) случаев в год, длительность ОРВИ — 7,5 (6,5; 10,5) дней. При оценке клинических критериальных признаков иммунокомпрометированности II порядка по «Шкале оценки клинических критериев/признаков СХУ/МЭ и когнитивных расстройств» количество баллов соответствовало 46,0 [ 33,0;55,5] при максимальной оценке 65,0 баллов.
Для пациентов с третьим иммунофенотипом характерны изолированные нарушения в системе интерферонов, проявляющиеся снижением концентрации сывороточного интерферона обоих типов и индуцированной продукции преимущественно ИФНα. Выявленные нарушения в системе интерферонов имели характер значительных дефектов, проявляющихся нарушением индуцированной продукции ИФНα в 100,0% случаев и ИФНγ — у 85,7% пациентов наряду со снижением уровня спонтанной продукции ИФНα у 100,0% и ИФНγ — у 79,5% пациентов этой группы. Необходимо подчеркнуть, что при исследовании количественных характеристик нейтрофильных гранулоцитов у пациентов этой группы исследования частота встречаемости нейтропений составляла порядка 18% и была значительно ниже по сравнению с выше описанными иммунофенотипами. Достоверных различий по показателям клеточного и гуморального иммунитета по отношению к группе сравнения не выявлено. В отношении провоспалительных цитокинов также была характерна гиперпродукция всех изучаемых показателей. Интегральная формула нарушений в системе противовирусной иммунной защиты третьего иммунофенотипа — НГ↓ + индуц.ИФНα/ИФНγ↓ + гиперцитокинемия (ИЛ-1β↑ + ИЛ-6↑ + ФНОα↑). При оценке клинических особенностей пациентов с этим иммунофенотипом в соответствии с клиническими критериями иммунокопрометированности I и II порядка были установлены следующие особенности: частота рецидивов ГВИ — 12,0 (10,5;14,5) случаев в год, продолжительность рецидивов ГВИ — 9,5 (7,5;12,5) дней, длительность периода клинического благополучия (межрецидивный период) — 3,0 (2,5;5,5), частота ОРВИ — 12, 5 (10,5; 14,5) случаев в год, длительность ОРВИ — 8,5 (5,5; 10,5) дней. При оценке клинических критериальных признаков иммунокомпрометированности II порядка по «Шкале оценки клинических критериев/признаков СХУ/МЭ и когнитивных расстройств» количество баллов соответствовало 52,5 [ 45,0;50,5] при максимальной оценке 65,0 баллов.
С учётом изученных и описанных клинические особенности пациентов с АХА-ГВИ, а также выявленного в ходе клинико-иммунологического обследования одного из трёх доминирующих патологических иммунофенотипов, определяющихся характером и степенью выраженности нарушений в иммунной системе и в системе интерферонов, нами были разработаны три программы дифференцированной таргетной интерфероно- и иммуномодулирующей терапии (табл. 1).
Таблица / Table 1
Программы дифференцированной таргетной
интерфероно- и иммуномодулирующей терапии
Targeted interferon and immunomodulatory therapy programs
Молекулярные и клеточные механизмы терапии Molecular and cellular mechanisms of therapy | Программа 1 Program 1 | Программа 2 Program 2 | Программа 3 Program 3 |
Системная интерферонотерапия Для восстановления уровня индуцированной продукции ИФН альфа и ИФН гамма, количества ЕКК рекИФНα2b — в комбинации с антиоксидантами препарат «Виферон®» в форме суппозиториев по схеме: 3 млн МЕ в день в течение 1 месяца, далее 2 млн МЕ в день (1 мес.), далее 1 млн МЕ (1мес.), далее 1 млн МЕ в режиме 3 раза в неделю в течение 2 недель, далее в дозе 1 млн МЕ дважды в неделю в течение 2 недель. Общий курс — 4 месяца. Systemic interferon therapy: to restore the level of induced production of IFN alpha and IFN gamma, the amount of EКК: reсIFNα2b in combination with antioxidants — the preparation "Viferon®" in the form of suppositories according to the scheme: 3 million IU per day for — 1 month, then 2 million IU per day — 1 month, then 1 million ME — 1 month, then 1 million IU in the mode 3 times a week for 2 weeks; then at a dose of 1 million IU twice a week for 2 weeks. The total course was 4 months. |
|
|
|
Локальная интерферонотерапия «Виферон®»-гель в виде аппликаций на слизистую оболочку носовых ходов, заднюю стенку глотки и дужки миндалин. Local interferon therapy "Viferon®" gel in the form of applications on the mucous membrane of the nasal passages, the back wall of the pharynx and the arms of the tonsils. |
|
|
|
Иммуномодулирующая терапия Для восстановления ЦТЛ и EKТ — препарат «Имунофан®» 45 мкг/мл 1 раз в день, в/м. Три десятидневных курса с перерывом в 20 дней в течении 3 месяцев. Курсы препаратов Имунофан и Изопринозин чередовали с перерывом 5 дней между курсами. Immunomodulatory therapy For the recovery of CTL and EKT — Imunofan® 45 μg/mL 1 once a day, IM. Three ten-day courses with a break of 20 days for 3 months. The courses of Imunofan and Isoprinosine were alternated with a break of 5 days between courses. |
|
|
|
Для восстановления НГ и ЕКК — глюкозаминилмурамилдипептида (ГМДП) «Ликопид» 3мг/сут. 3 10-дневных курса ежемесячно в течении 3 месяцев в перерывом в 20 дней. Курсы препаратов Ликопид® и Изопринозин чередовали с перерывом 5 дней между курсами. For the recovery of NG and EKK — glucosaminylmuramyl dipeptide (GMDP) "Lycopide" 3 mg/day three 10-day courses monthly for 3 months at a break of 20 days. Courses of Lycopid® and Isopinosine were alternated with a break of 5 days between courses. |
|
|
|
Противовирусная терапия Фамцикловир (препарат Фамвир®) 1500 мг/сут., длительность приёма 10 дней 1 раз в месяц или Ацикловир/Валцикловир в дозе 1500 мг в день в течение 10 дней при инфекции, вызванной ВПГ 1и 2 типов. А также Инозин пранобекс («Изопринозин») 1500 мг/сут., ежедневно в течение 10–14 дней с повторением 2–3 курсов с интервалом в 20 дней. Общая длительность терапии — 3 мес. Antiviral therapy Famciclovir (Famvir®) 1500 mg/day is the duration of administration of 10 days 1 times a month or Aciclovir/Valciclovir at a dose of 1500 mg per day, for 10 days in case of infection caused by HSV of types 1 and 2. As well as Inosine pranobex ("Isoprinosine") 1500 mg/day, daily for 10-14 days with a repetition of 2–3 courses with an interval of 20 days. The total duration of therapy is 3 months. |
|
|
|
Эффективность каждой разработанной программы оценивалась с помощью предложенных нами ранее диагностически значимых иммунологических критериев — определение в сыворотке крови уровней ИЛ-1β, ИЛ-17А, ФНОα, сывороточных ИФНα, ИФНγ, процентного содержания естественных киллерных клеток (CD16+CD56+) среди лимфоцитов периферической крови пациентов с АХА-ГВИ.
Для сравнительной оценки иммунологической эффективности программ дифференцированной таргетной интерфероно- и иммуномодулирующей терапии нами была применена методика оценки тенденции изменения показателя на основе сравнения его значения с исходным значением до терапии. Позитивная тенденция в изменении каждого из изучаемых показателей крови пациента с АХА-ГВИ в процессе лечения оценивалась в 1 балл. За положительную тенденцию нами принималось следующее:
- для провоспалительных цитокинов — снижение их концентрации в сыворотке периферической крови не менее, чем в 1,5 раза;
- для интерферонов α и γ — увеличение их концентрации в сыворотке периферической крови не менее, чем в 1,5 раза;
- для процентного содержания ЕКК — увеличение количества ЕКК в периферической крови не менее, чем в 1,5 раза.
Исходя из этих предпосылок, анализу были подвергнуты следующие величины:
- значения каждого показателя до и после лечения в абсолютных величинах и статистическая оценка этих сдвигов по критерию Манна-Уитни (табл. 2);
- процент позитивных сдвигов (% эффективности) каждого показателя в процессе лечения и статистическое сравнение результатов лечения при использовании разных программ по критерию χ² (табл. 2);
- проценты отклонения от контроля величины сдвига каждого показателя до и после лечения (рис. 1 и 2), при этом контрольные значения для каждого показателя и представлены в таблице 3;
- суммарная оценка в баллах сдвигов всех 6 показателей для каждой программы лечения и сопоставление 95% доверительных интервалов этой суммарной оценки по каждой программе с построением ROC-кривых их диагностической значимости (рис. 3).
Таблица / Table 2
Сравнительная иммунологическая эффективность программ
таргетной интерфероно- и иммуномодулирующей терапии
Comparative immunological efficacy
of targeted interferon and immunomodulatory therapy programs
Критериальный показатель Criteria indicator | Медиана [минимум; максимум] Median [minimum; maximum] | р1 р2 р3 | |||
Программа 1 Program 1 (n = 156) | Программа 2 Program 2 (n =100) | Программа 3 Program 3 (n = 79) | |||
ИЛ-1β, пг/мл IL-1β, pg/mL | До лечения Before therapy | 69,0 [ 34,2; 100,8] | 86,9 [ 68,3; 127,3] | 96,2 [ 65,2; 165,8] | - - - |
после лечения after therapy | 39,5 [ 21,7; 73,3] | 59,7 [ 34,7; 87,4] | 58,6 [ 14,7; 87,4] | <0,001* <0,001* <0,001* | |
% эффективности % efficiency | 79,2% | 25% | 87,5% | <0,001* 0,009* 0,226 | |
ИЛ-17A, пг/мл IL-17A, pg/mL | До лечения Before therapy | 0,60 [ 0,44; 0,69] | 0,58 [ 0,45; 0,69] | 0,64 [ 0,20; 0,91] | - - - |
После лечения After therapy | 0,56 [ 0,39; 0,71] | 0,63 [ 0,40; 0,71] | 0,61 [ 0,21; 0,75] | 0,204 0,052 0,223 | |
% эффективности % efficiency | 100% | 100% | 100% | 1,000 1,000 1,000 | |
ФНОα, пг/мл TNFα, pg/mL | До лечения Before therapy | 29,3 [ 16,1; 48,7] | 27,6 [ 16,1; 48,7] | 28,1 [ 13,3; 48,7] | - - - |
После лечения After therapy | 29,9 [ 13,9; 39,5] | 34,0 [ 19,5; 48,7] | 34,0 [ 20,3; 48,7] | 0,726 0,065 0,149 | |
% эффективности % efficiency | 41,7% | 20,8% | 25% | 0,123 0,226 0,734 | |
ИФНα, пг/мл IFNα, pg/mL | До лечения Before therapy | 17,8 [ 10,2; 26,7] | 20,2 [ 14,1; 25,4] | 13,4 [ 2,1; 48,6] | - - - |
После лечения After therapy | 34,1 [ 23,9; 56,2] | 26,8 [ 12,5; 45,4] | 18,6 [ 7,1; 45,2] | <0,001* 0,004* 0,190 | |
% эффективности % efficiency | 100% | 54,2% | 37,5% | <0,001* <0,001* 0,252 | |
ИФНγ, пг/мл IFNγ, pg/mL | До лечения Before therapy | 29,8 [ 15,8; 46,1] | 25,0 [ 18,4; 32,4] | 36,6 [ 10,8; 45,9] | - - - |
После лечения After therapy | 62,5 [ 33,2; 101,2] | 43,2 [ 39,4; 49,7] | 43,3 [ 23,5; 49,7] | <0,001* <0,001* <0,001* | |
% эффективности % efficiency | 87,5% | 100% | 91,7% | 0,077 0,640 0,153 | |
Естественные киллеры, % EKK % | До лечения Before therapy | 8,0 [ 5,2; 21,2] | 5,1 [ 2,0; 11,0] | 12,2 [ 9,2; 20,0] | - - - |
После лечения After therapy | 10,2 [ 4,8; 16,5] | 6,8 [ 3,1; 12,6] | 13,0 [ 9,3; 20,0] | 0,224 <0,001* 0,687 | |
Баллы эффективности Efficiency | 54,2% | 33,3% | 83,3% | 0,150 0,031* 0,001* | |
Примечание: n — число обследованных лиц в каждой группе;
p1 — вероятность различий в группах с программами лечения 1 и 2;
p2 — вероятность различий в группах с программами лечения 1 и 3;
p3 — вероятность различий в группах с программами лечения 2 и 3;
* — достоверность различий по критерию Манна-Уитни
для абсолютных величин и по критерию χ² для относительных величин при р<0,05.
Note: n is the number of examined persons in each group;
p1 — probability of differences in groups with treatment programs 1 and 2,
p2 — probability of differences in groups with treatment programs 1 and 3;
p3 — probability of differences in groups with treatment programs 2 and 3;
* — reliability of differences by Mann-Whitney criterion
for absolute values and by χ2 criterion for relative values at p<0.05.
При изучении уровней провоспалительных цитокинов (ИЛ-1β, ИЛ-6 и ФНОα) периферической крови пациентов с АХА-ГВИ было установлено достоверное их повышение во всех группах пациентов- гиперцитокинемия. Показано, что проведение трёх дифференцированных программ таргетной интерфероно- и иммуномодулирующей терапии имело неоднозначное влияние на концентрации исследуемых цитокинов. Так, концентрация провоспалительного цитокина ИЛ-1β, участие которого в иммунопатогенезе герпесвирусной инфекции, в том числе в развитии нейроиммуновоспаления, является наиболее выраженным, были достоверно высокими в крови пациентов с АХА-ГВИ и значительно отличались от показателей группы сравнения (p ≤0,05) (рис. 1) После проведения терапии, независимо от используемой программы терапии, уровень этого цитокина достоверно снижался во всех трёх группах пациентов, однако так и не достигал референсных значений и оставался на достоверно высоком уровне.
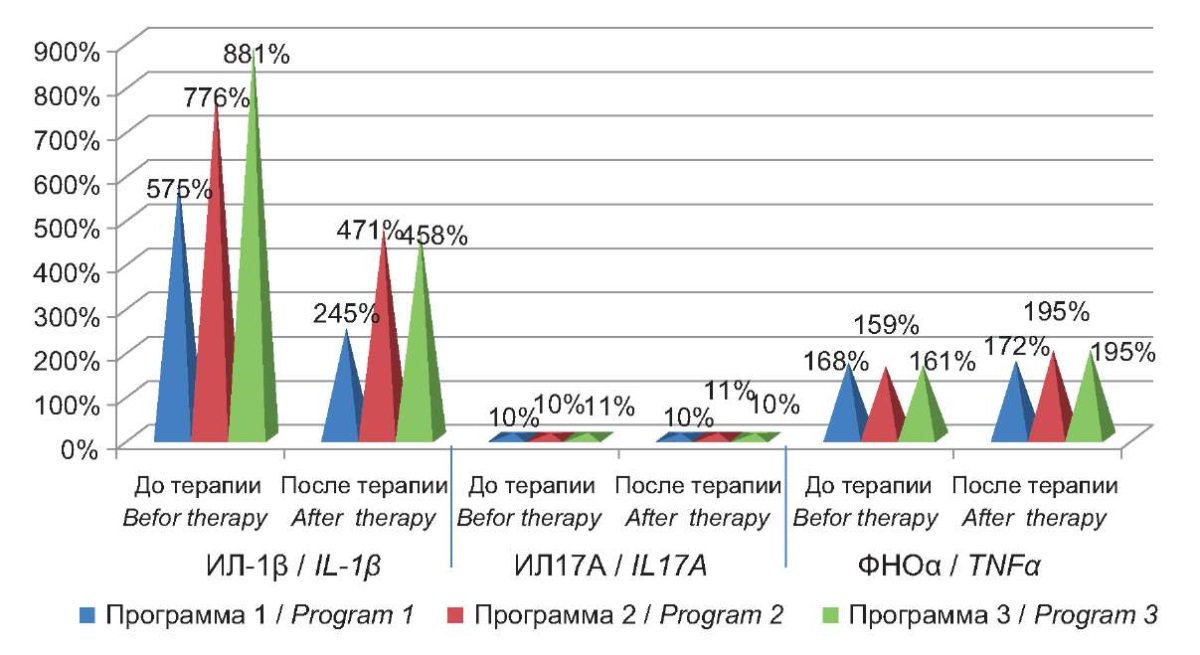
Рисунок 1. Проценты отклонения от контроля уровней провоспалительных цитокинов
в крови пациентов с АХА-ГВИ до и после терапии.
Figure 1. Percentage deviation from control of proinflammatory cytokine levels
in the blood of patients with ACA-HVI before and after therapy.
Показано, что концентрация ИЛ-17А, продуцируемого Т-хелперами-17, у пациентов с АХА-ГВИ не имела достоверной динамики при использовании любой из предлагаемых программ лечения. При анализе концентрации провоспалительного ФНОα было выявлено достоверное его повышение в сыворотке крови пациентов всех трех групп до начала терапии, однако ИПКИС с включением предлагаемых программам иммуномодулирующей терапии достоверно не сказывалась на динамике этого показателя.
Установленное до начала терапии снижение концентрации сывороточных ИФНα и ИФНγ у пациентов с АХА-ГВИ после проведения терапии достоверно возрастало в ответ на проведение Программ 1 и 2 в отношении ИФНα и в ответ на все три программы — в отношении ИФНγ (рис. 2).
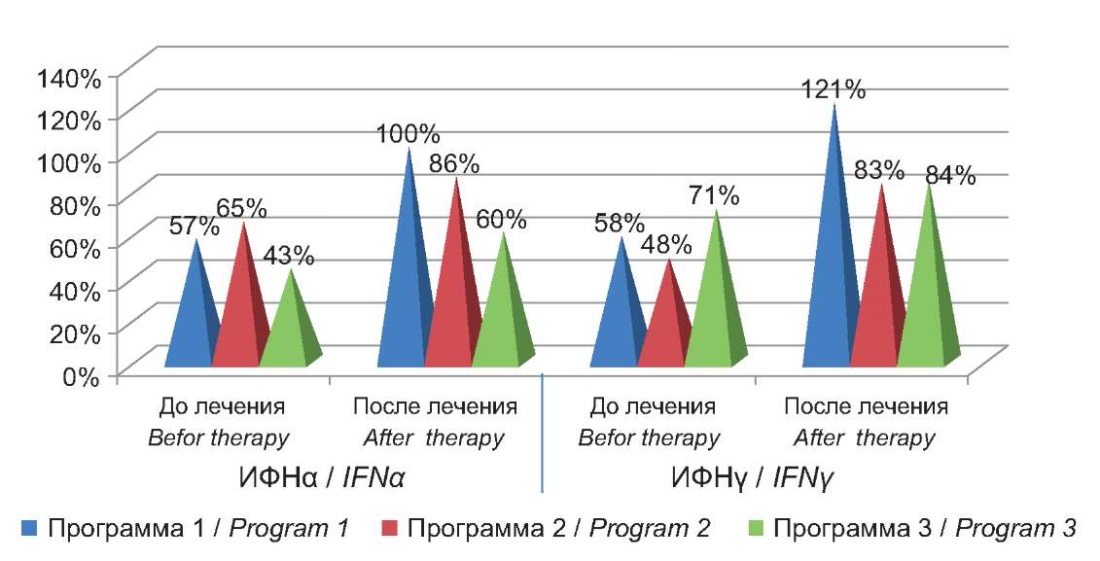
Рисунок 2. Проценты отклонения от контроля уровней интерферонов
в крови пациентов с АХА-ГВИ до и после проведения терапии.
Figure 2. Percentage deviation from the control of interferon levels
in the blood of patients with AСA-HVI before and after therapy.
При оценке динамики относительного количества естественных киллерных клеток (ЕКК), которые при АХА-ГВИ в той или иной степени были достоверно снижены в ГИ1 и ГИ2 по сравнению с группой контроля, показано, что проведение терапии с включением Программы 2 привело к достоверному увеличению количества ЕКК по сравнению с их уровнем до начала терапии, однако оставалось в диапазоне низких значений (рис. 3).
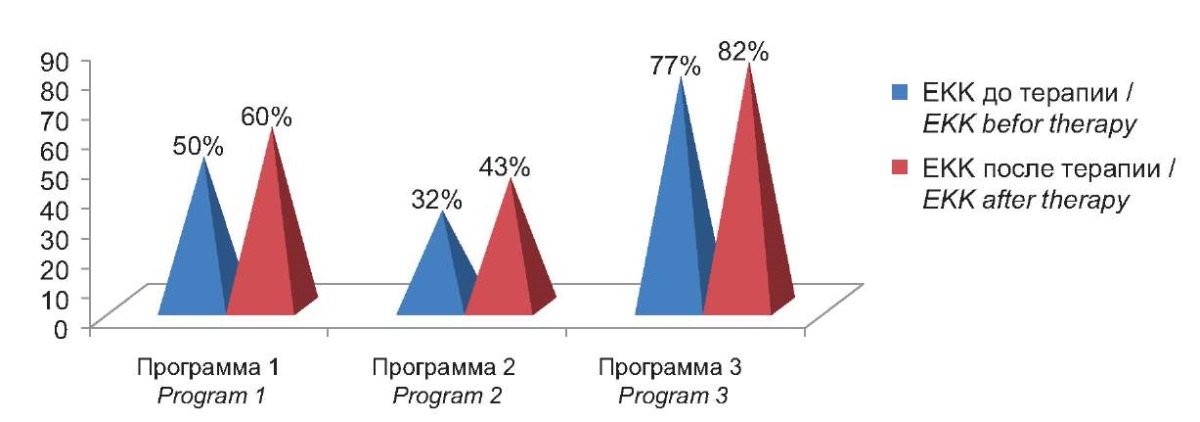
Рисунок 3. Проценты отклонения от контроля
содержания естественных киллерных клеток
в крови пациентов с АХА-ГВИ до и после проведения терапии.
Figure 3. Percentage deviation from control of natural killer cells
in the blood of patients with ACA-HVI before and after therapy.
Таким образом, применение трёх программ дифференцированной таргетной интерфероно- и иммуномодулируюшей терапии в соответствии с выявленным преобладающим иммунофенотипом оказывало истинное модулирующее воздействие на все звенья иммунопатогенеза при АХА-ГВИ, которое в наибольшей степени проявлялось в виде коррекции дисбаланса в системе интерферонов (увеличение индуцированной продукции ИФНα и ИФНγ и их концентрации в сыворотке крови), а также снижением уровня провоспалительного цитокина ИЛ-1β наряду с увеличением количества ЕКК.
В то же время степень наблюдаемых модулирующих воздействий у разных программ была различной. Это устанавливалось путём анализа суммарных баллов, отражающих наблюдаемые сдвиги критериальных показателей при использовании разных программ интерфероно- и иммуномодулирующей терапии. Статистическая обработка данных показала, что суммарный балл эффективности терапии с использованием Программы 1 составлял 5,0 [ 3,0; 6,0] при максимальном возможном значении, равном 6 баллам. Программе 2 соответствовал суммарный балл 3,0 [ 2,0; 6,0], то есть он был значительно ниже, чем в Программе 1. Суммарный балл эффективности терапии для Программы 3 составлял 4,0 [ 2,0; 6,0]. 95% доверительные интервалы суммарных баллов оценки эффективности предлагаемых программ интерфероно- и иммуномодулирующей терапии и их ROC-анализ представлены на рисунке 4.
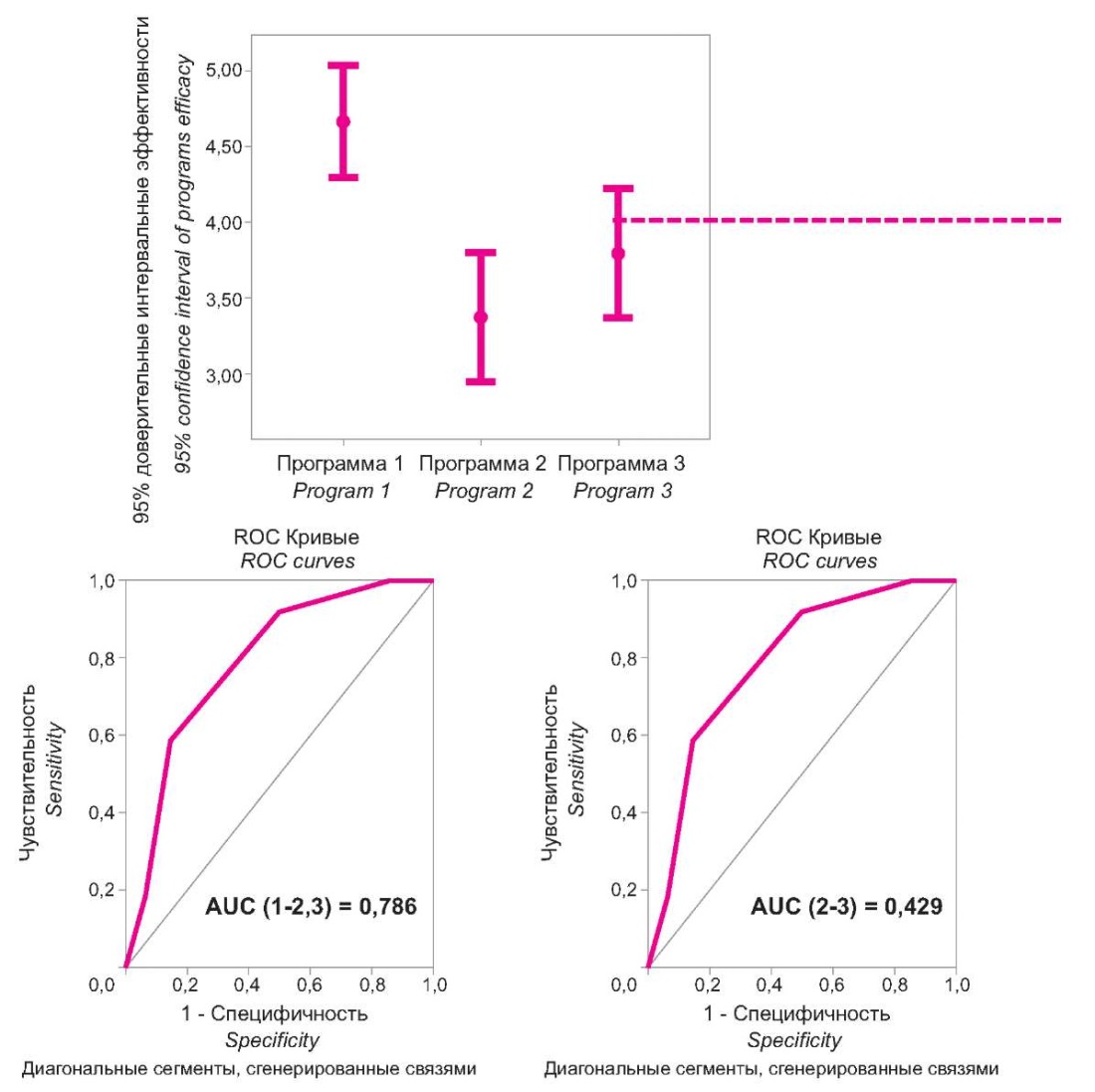
Рисунок 4. 95% доверительные интервалы суммарной оценки эффективности лечения
по каждой из предложенных программ и ROC-кривые их диагностической значимости.
Figure 4. 95% Confidence Intervals of Summary Efficacy Assessment treatment
for each of the proposed programs and ROC curves their diagnostic significance.
Представленные графики отчетливо демонстрируют, что эффективность Программы 1 наиболее высока, а значения суммарного балла выше 4,25 являются её характерным признаком. Программы 2 и 3 оцениваются в более низком диапазоне суммарного балла. При проведении ROC-анализа выявлено, что значимость отличия эффективности Программы 1 довольно высока и по величине АUC (1-2,3), отражающей сравнение этой программы с двумя другими программами, составляет 0,786. При сравнении между собой эффективности Программ 2 и 3 достоверных различий выявлено не было, поскольку по величине AUC = 0,429 суммарные баллы их оценки различий не показали.
Для сравнительной оценки клинической эффективности программ дифференцированной интерфероно- и иммуномодулирующей терапии проводился анализ динамики клинических критериальных признаков I и II до и после проведения терапии (рис. 5).
Таблица / Table 5
Оценка клинической эффективности программ
таргетной интерфероно- и иммуномодулирующей терапии
Evaluation of clinical effectiveness
of targeted interferon and immunomodulatory therapy programs
Критериальный признак Criteria indicator | Медиана [минимум; максимум] Median [minimum; maximum] | |||
Программа 1 Program 1 (n = 156) | Программа 2 Program 2 (n =100) | Программа 3 Program 3 (n = 79) | ||
Частота рецидивов ГВИ (в год) Rate of HVI (per year) | До лечения Before therapy | 10,0 [ 8,5;14,5] | 10,5 [ 8,0;14,5] | 12,0 [ 10,5;14,5] |
После лечения After therapy | 4,5 [ 2,5;6,5] * | 3,5 [ 2,5;5,5] * | 7,5 [ 5,5;9,5] * | |
Длительность рецидива ГВИ (в днях) Duration of HVI (in days) | До лечения Before therapy | 8,0 [ 6,5;10,5] | 8,0 [ 6,5;10,5] | 9,5 [ 7,5;12,5] |
После лечения After therapy | 4,5 [ 3,5; 6,5] * | 5,5 [ 4,5; 6,5] * | 5,5 [ 3,5; 7,5] * | |
Частота ОРВИ (в год) Rate of ARVI (per year) | До лечения Before therapy | 11,0 [ 9,5; 12,0] | 11,5 [ 10,0; 12,0] | 12,5 [ 11,0;13,5] |
После лечения After therapy | 5,5 [ 4,0; 6,5] * | 6,0 [ 4,5;7,0] * | 7,5 [ 6,0;8,0] * | |
Длительность ОРВИ (в днях) Duration of ARVI (in days) | До лечения Before therapy | 7,5 [ 6,0;8,5] | 7,5 [ 6,0;8,5] | 8,5 [ 7,0;9,5] |
После лечения After therapy | 4,5 [ 4,0;5,5] * | 3,5 [ 3,0;4,5] * | 5,5 [ 5,0;7,0] * | |
Длительность периода клин благополучия (в мес.) Duration of well-being period (in months) | До лечения Before therapy | 6,5 [ 4,5;8,5] | 6,5 [ 4,5;8,5] | 3,0 [ 2,5;5,5] |
После лечения After therapy | 10,0 [ 9,5; 12,5] * | 9,5 [ 8,5; 11,5] * | 6,0 [ 5,0; 7,5] * | |
Суммарный балл по Шкале Summary Scale Score | До лечения Before therapy | 54,5 [ 46,8;62,3] | 46,0 [ 33,0; 55,5] | 52,5 [ 45,0; 50,5] |
После лечения After therapy | 30,5 [ 23,0;33,5] * | 21,5 [ 14,0;28,0] * | 31,5 [ 30,5;43,5] * | |
Примечание: * — достоверность отличий значений до и после проведения терапии.
Note: * — accuracy of differences in values before and after therapy.
Обсуждение
Полученные данные продемонстрировали высокую клиническую эффективность терапии с использованием программ дифференцированной таргетной интерфероно- и иммуномодулирующей терапии у 100 % пациентов. Для пациентов ГИ1 была характерна наиболее выраженная позитивная клиническая эффективность, оцениваемая согласно клиническим критериальным признакам I и II порядка, среди которых доминирующими были снижение длительности рецидивов герпесвирусных инфекций (ГВИ) в 1,8 раза и снижение частоты ОРВИ в 2 раза по отношению к аналогичным показателям до терапии. В то время как у пациентов ГИ2 доминировали снижение частоты рецидивов ГВИ (в 2,9 раза), длительности ОРВИ (в 2,1 раз) наряду с максимальным регрессом критериальных признаков II порядка (в 2,1 раза по сравнению с показателями до терапии). Для пациентов ГИ3 доминирующим клиническим эффектом было увеличение длительности периода клинического благополучия (в 2,1 раза). Во всех группах пациентов был отмечен выраженный регресс клинических признаков синдрома хронической усталости и когнитивных дисфункций, в основе развития которых лежит нейроиммуновоспаление.
Таким образом, в результате проведённого исследования была продемонстрирована высокая клинико-иммунологическая эффективность трёх программ дифференцированной таргетной интерфероно- и иммуномодулирующей терапии, ориентированных на выявленные патологические иммунофенотипы и ассоциированные с ними клинические проявления, у иммунокомпрометированных пациентов, страдающих АХА-ГВИ.
Выводы
Полученные данные иммунологического исследования позволили выделить варианты патологических иммунофенотипов (ПИФ), которые характеризуются вариабельностью выявленных нарушений ПИФ1 (НГ↓ +индуц. ИФНα/ИФНγ↓ + ЦТЛ↓ + ЕКК↓ + IgM↑ + гиперцитокинемия (ИЛ-1β↑ + ИЛ-6↑ + ФНОα↑)), ПИФ2 (НГ↓+ индуц. ИФНα/ИФНγ↓ + ЕКК↓ + IgG↓ + гиперцитокинемия (ИЛ-1β↑ + ИЛ-6↑ + ФНОα↑) и ПИФ3 (НГ↓ + индуц. ИФНα/ИФНγ↓ + гиперцитокинемия (ИЛ-1β↑ + ИЛ-6↑ + ФНОα↑)). Выявленные нарушения в иммунной системе и системе интерферонов в каждом патологическом иммунофенотипе сопряжены с определёнными проявлениями симптоматики АХА-ГВИ, характерными для ГИ1, ГИ2, ГИ3.
Показано, что доминирующими клиническими особенностями ГИ1 была максимальная степень выраженности симптомов СХУ/МЭ и когнитивных расстройств 54,5 [ 46,8;62,3] балла. Для пациентов ГИ3 доминирующими клиническими особенностями являлись высокая частота (12,0 [ 10,5;14,5] случаев в год) и длительность рецидивов ГВИ (9,5[ 7,5;12,5] дней), частота эпизодов ОРВИ (12,5[ 11,0;13,5] в год) и их длительность (8,5[ 7,0;9,5] дней) наряду с минимальным периодом клинического благополучия, длительность которого не превышала 3,0 [ 2,5;5,5] месяцев в год.
Пациентам ГИ1, ориентированной на ПИФ1, показана эффективность таргетной локальной и системной интерферонотерапии с использованием рекИФНα2b в комплексе с антиоксидантами в сочетании с таргетной иммуномодулирующей терапией, направленной на восстановление дефицита ЦТЛ и ЕКК с применением синтетического иммунотропного гексапептида, являющего аналогом активного центра гормона тимуса тимопоэтина. Клиническая эффективность проводимой терапии была получена у 100% пациентов; иммунологическая эффективность в 89,5% случаев.
Для пациентов ГИ2, ориентированной на ПИФ2, показана эффективность таргетной локальной и системной интерферонотерапии рекИФНα2b в комплексе с антиоксидантами в сочетании с иммуномодулирующей терапией, направленной на восстановление количества ЕКК и коррекцию нейтропении (глюкозаминилмурамилдипептид — ГМДП). Клиническая эффективность проводимой терапии была получена у 100% пациентов; иммунологическая эффективность в 57,6% случаев.
Для пациентов ГИ3, ориентированной на ПИФ3, показана эффективность таргетной локальной и системной интерферонотерапии рекИФНα2b в комплексе с антиоксидантами. Клиническая эффективность проводимой терапии была получена у 100% пациентов; иммунологическая эффективность в 37,5 % случаев.
Список литературы
1. Баскакова Д.В., Халдин А.А., Бирко Н.И. Клиникоэпидемиологические характеристики заболеваний, вызванных вирусом простого герпеса. Российский журнал кожных и венерических болезней. Приложение «Герпес». 2006;(2):26-30.
2. Исакова В.А., Исаков Д.В., Архипова Е.И. Герпесвирусные инфекции человека. Руководство для врачей. СПб., 2015.
3. Дюдюн А.Д., Полион Н.Н., Нагорный А.Е. Герпесвирусная инфекция. Клинико-иммунологические особенности. Клиническая лекция. Дерматовенерология. Косметология. Сексопатология. 2015;3-4:119–125.
4. Калинина Н.М., Дрыгина Л.Б., Горейко Т.В. Современные представления об иммунопатогенезе инфекции, вызванной вирусом Эпштейна-Барр. Инфекция и иммунитет. 2011;1(2):121-130.
5. Новикова И.А., Романива О.А. Особенности продукции цитокинов при рецидивирующей герпетической инфекции. Медицинская иммунология. 2013;15(6):571-576.
6. Нестерова И.В., Ковалева С.В., Чудилова Г.А., Халтурина Е.О., Малиновская В.В. Врождённые и приобретённые интерферонопатии, ассоциированные с нетипично протекающими вирусными инфекциями и с COVID-19 (монография). Спб.: Издательство «Диалог»; 2022.
7. Zhou J, Li J, Ma L, Cao S. Zoster sine herpete: a review. Korean J Pain. 2020;33(3):208-215. https://doi.org/10.3344/kjp.2020.33.3.208
8. Ariza ME. Myalgic Encephalomyelitis/Chronic Fatigue Syndrome: The Human Herpesviruses Are Back! Biomolecules. 2021;11(2):185. https://doi.org/10.3390/biom11020185
9. Shikova E, Reshkova V, Kumanova А, Raleva S, Alexandrova D, et al. Cytomegalovirus, Epstein-Barr virus, and human herpesvirus-6 infections in patients with myalgic еncephalomyelitis/chronic fatigue syndrome. J Med Virol. 2020;92(12):3682-3688. https://doi.org/10.1002/jmv.25744
10. Buckner JH. Translational immunology: Applying fundamental discoveries to human health and autoimmune diseases. Eur J Immunol. 2023;53(12):e2250197. https://doi.org/10.1002/eji.202250197.
11. Халтурина Е.О., Нестерова И.В., Маркова Т.П. Оптимизированная программа таргетной комбинированной интерфероно- и иммунотерапии в лечении атипичных хронических активных герпесвирусных ко-инфекций. Эффективная фармакотерапия. 2022;18(1):44-49.
Об авторах
И. В. НестероваРоссия
Нестерова Ирина Вадимовна, д.м.н., профессор, профессор кафедры клинической иммунологии, аллергологии и адаптологии
Москва
Е. О. Халтурина
Россия
Халтурина Евгения Олеговна, к.м.н., доцент, доцент кафедры микробиологии, вирусологии и иммунологии им. ак. А.А. Воробьева
Москва
Рецензия
Для цитирования:
Нестерова И.В., Халтурина Е.О. Эффективность дифференцированной таргетной интерферонои иммуномодулирующей терапии, ориентированной на патологические иммунофенотипы, у пациентов с атипичными хроническими активными герпесвирусными инфекциями. Медицинский вестник Юга России. 2024;15(1):165-175. https://doi.org/10.21886/2219-8075-2024-15-1-165-175
For citation:
Nesterova I.V., Khalturina E.O. Efficacy of differentiated targeted interferon and immunomodulatory therapy focused on pathological immunophenotypes in patients with atypical chronic active herpesvirus infections. Medical Herald of the South of Russia. 2024;15(1):165-175. (In Russ.) https://doi.org/10.21886/2219-8075-2024-15-1-165-175
JATS XML









































