Перейти к:
Фиксированная лекарственная эритема на флуконазол
https://doi.org/10.21886/2219-8075-2023-14-4-11-16
Аннотация
Цель: охарактеризовать группу пациентов с фиксированной лекарственной эритемой (ФЛЭ) на флуконазол для определения чувствительности и специфичности местного провокационного аппликационного теста (МПАТ) и оценки перекрестной аллергенной реактивности с другими противогрибковыми препаратами группы азолов.
Материалы и методы: проведено проспективное исследование в период с 2012 по 2022 гг. Проконсультировано 347 пациентов с лекарственной аллергией замедленного типа (ЛАЗТ), ФЛЭ можно предположить у 86 пациентов (24,8%), из них у 23 на флуконазол (26,8%). В исследовании приняли участие пациенты с предполагаемой ФЛЭ на флуконазол (n=23). МПАТ с флуконазолом проведен 12 пациентам, провокационный тест (ПТ) с кетоконазолом – 17, ПТ с итраконазолом – 15, ПТ с флуконазолом – 1.
Результаты: соотношение мужчин и женщин – 1:6,3, средний возраст – 30,39±10,23 лет. У 1 пациента диагноз ФЛЭ на флуконазол снят. Количество реакций: 1 – у 2 пациентов (9,1%), более одной реакции – у 20 (90,9%). Сопутствующая атопия выявлена у 4 пациентов (18,2%). Чувствительность МПАТ для диагностики ЛАЗТ при ФЛЭ на флуконазол составила 41,7%, специфичность – 100%, частота ложноотрицательных результатов – 58,3%, положительная предсказательная ценность – 100%. ПТ с кетоконазолом, итраконазолом отрицательный в 100% случаев.
Заключение: полученные результаты позволяют сделать вывод о том, что ФЛЭ на флуконазол в подавляющем большинстве случаев развивается у женщин в возрасте от 19 до 30 лет. Так как пациенты с ФЛЭ на флуконазол хорошо переносят кетоконазол и итраконазол, для них с высокой степенью вероятности возможна замена флуконазола на один из этих препаратов. МПАТ целесообразно применять для диагностики ФЛЭ на флуконазол, так как он абсолютно безопасен для пациента, позволяет избежать проведения ПТ у 42% пациентов. Важно отметить, что при своевременной постановке правильного диагноза более, чем в 90% случаев, можно профилактировать развитие повторной реакции на флуконазол.
Ключевые слова
Для цитирования:
Мясникова Т.Н., Латышева Т.В., Романова Т.С., Смирнов В.В. Фиксированная лекарственная эритема на флуконазол. Медицинский вестник Юга России. 2023;14(4):11-16. https://doi.org/10.21886/2219-8075-2023-14-4-11-16
For citation:
Myasnikova T.N., Latysheva T.V., Romanova T.S., Smirnov V.V. Fixed drug eruption caused by fluconazole. Medical Herald of the South of Russia. 2023;14(4):11-16. (In Russ.) https://doi.org/10.21886/2219-8075-2023-14-4-11-16
Введение
Лекарственная аллергия замедленного типа (ЛАЗТ) — это гетерогенная группа аллергических реакций, как по патогенезу, так и по клинической картине. В отличие от немедленных реакций в случаях с ЛАЗТ не всегда легко установить связь между приёмом лекарственного препарата (ЛП) и появлением симптомов, особенно, если интервал между этими двумя событиями составил более 24 часов. Нередко ни пациенты, ни врачи не связывают течение кожного процесса с ЛАЗТ, особенно при фиксированной лекарственной эритеме (ФЛЭ), которая среди поражений кожи при ЛАЗТ встречается в 14–22% случаев [1], по данным Романовой Т.С. — в 27%1.
Клинически ФЛЭ всегда проявляется эритемой или отечной бляшкой с чёткими границами. Высыпания единичные, не сливающиеся. Цвет бляшки — от эритематозного до фиолетового, в центре может образоваться булла. Характерными признаками ФЛЭ является то, что при последующих эпизодах высыпания возникают на одном и том же месте, на их месте сохраняется поствоспалительная пигментация, как правило, в течение нескольких месяцев. С каждым последующим эпизодом высыпаний становится больше. Возможно поражение слизистых (глаз, рта, половых). При этом ФЛЭ относится к нетяжёлым проявлениям ЛАЗТ, но редко может возникать генерализованная буллезная форма ФЛЭ. После повторного приёма ЛС клинические проявления возникают через промежуток времени от 30 минут до 8 часов [2]. Наиболее частыми ЛП-триггерами являются барбитураты, флуконазол, метамизол натрия, нестероидные противовоспалительные препараты (НПВП) (чаще коксибы, оксикамы), антибактериальные сульфаниламиды, карбамазепин и другие. Ранее в нашей стране наиболее частым ЛП-триггером был димеркаптопропансульфонат натрия (унитиол)2.
В настоящее время противогрибковые ЛП группы азолов широко применяются в клинической практике. В этой группе выделяют ЛП группы триазолов (флуконазол, итраконазол, вариконазол), имидазолы (кетоконазол, миконазол, клотримазол). К группе азолов также относятся нитроимидазолы (метронидазол, тинидазол, орнидазол и другие), бензимидазолы (албендазол, мебендазол и другие).
Как правило, лекарственная аллергия на флуконазол проявляется ФЛЭ [3][4][5][6][7][8][9], но описаны единичные случаи острого генерализованного экзантематозного пустулеза [10], синдрома Свита [11]. В настоящее время нет системных обзоров по ФЛЭ на флуконазол, так как это очень редко встречающаяся патология. В литературе, как правило, описаны единичные случаи, при этом данные о перекрёстных реакциях внутри группы азолов противоречивы. Описаны единичные случаи перекрестных реакций между флуконазолом и другими азолами (с тинидазолом [4], орнидазолом [3], итраконазолом [7]). Но описаны и клинические примеры с отсутствием перекрестной аллергии между флуконазолом и другими азолами (с итраконазолом, кетоконазоолом, метронидазолом [3], итраконазолом [5], кетоконазолом [7]).
Для выявления предположительного причинно-значимого ЛП, характера лекарственной аллергии собирают фармакологический анамнез, изучают медицинскую документацию, клиническую картину заболевания в острую фазу или фотографии высыпаний после перенесенной реакции. Для подтверждения причинно-значимого ЛП применяется местный провокационный аппликационный тест (МПАТ), который проводят только на участках поствоспалительной пигментации, так как проведение его на интактной коже неинформативно. Показано, что чувствительность данного метода при ФЛЭ составляет 43% [12]. По литературным данным, МПАТ с противогрибковыми препаратами проведены в 5 случаях, из них в 3 случаях получен положительный результат [5][6][9], а в 2 — отрицательный [3][8].
Таким образом, необходимо изучение перекрестной аллергенной реактивности внутри группы азолов, оценка информативности кожного тестирования для диагностики ЛАЗТ на азолы.
Цель исследования — охарактеризовать группу пациентов с фиксированной лекарственной эритемой (ФЛЭ) на флуконазол для определения чувствительности и специфичности местного провокационного аппликационного теста (МПАТ) и оценки перекрестной аллергенной реактивности с другими противогрибковыми препаратами группы азолов.
Материалы и методы
Проспективное исследование проведено после получения разрешения локального этического комитета. В период за 2012–2022 гг. в отделении иммунопатологии ФГБУ «ГНЦ Института иммунологии» ФМБА России было проконсультировано 347 пациентов с ЛАЗТ, у 86 пациентов (24,8%) можно было предположить ФЛЭ, у 23 пациентов — ФЛЭ на флуконазол (26,8%). В исследовании приняли участие пациенты с предполагаемой ФЛЭ на флуконазол (n=23).
Тестирование с ЛП проводилось после получения письменного информированного согласия. МПАТ с флуконазолом (15%-ный раствор в вазелиновом масле) проведён 12 пациентам, с кетоконазолом (20%-ный раствор в вазелиновом масле) — 7, с итраконазолом (10%-ный раствор в вазелиновом масле) — 8 (нераздражающая концентрация ЛП для проведения МПАТ предварительно отработана на 10 здоровых добровольцах после получения письменного информированного согласия). Остальным 10 пациентам МПАТ с флуконазолом не проведён из-за отсутствия поствоспалительной пигментации (прошло длительное время после перенесенной реакции) или из-за отказа пациента.
Методика проведения МПАТ: на поствоспалительную пигментацию накладывается кусочек марли размером 1×1 см, смоченный суспензией ЛП в вазелиновом масле (15%-ный раствор флуконазола / 20%-ный раствор кетоконазола / 10%-ный раствор итраконазола). Сверху покрывают калькой размером 1×1 см. Фиксируют лейкопластырем. Оценивают реакцию через 48–72 часа. Если раньше 24 часов появлялись такие симптомы, как зуд, жжение, отёк, местное повышение температуры, то оценку теста проводили раньше. Отрицательный контроль (вазелиновое масло) ставился на другое поствоспалительное пятно, если это было возможно. В большинстве случаев отрицательного контроля не было (небольшое количество пятен поствоспалительной пигментации, неудобная локализация пятен и т.д.). Положительного контроля нет. Критерии оценки аппликационных тестов представлены в таблице 1.
Таблица / Table 1
Критерии оценки аппликационных тестов
Criteria for evaluating application tests
Символ Symbol | Клиническая картина Clinical picture | Оценка реакции Type of reaction |
— | нет изменений no change | отрицательная реакция negative reaction |
+ | эритема, инфильтрация, папулы, везикулы, сливные везикулы erythema, infiltration, papules, vesicles, confluent vesicles | положительная реакция positive reaction |
РР IR | пузырь, некроз bulla, necrosis | раздражающая реакция irritant reaction |
Для оценки информативности МПАТ с флуконазолом использовались следующие данные, которые рассчитывались по соответствующим формулам:
чувствительность = (число истинно положительных результатов / общее число больных) × 100%;
специфичность = (число истинно отрицательных результатов / число больных без данного заболевания) × 100%;
частота ложноотрицательных результатов = (число ложноотрицательных результатов / общее число больных) × 100%;
положительная предсказательная ценность = (число истинно положительных результатов / (число истинно положительных результатов + число ложноположительных результатов)) × 100%.
Провокационный тест (ПТ) с кетоконазолом проведен 17 пациентам, ПТ с итраконазолом — 15, ПТ с флуконазолом — 1.
Методика проведения ПТ: в 1 день — перорально 1/3 дозы (кетоконазол — 67 мг, итраконазол — 33 мг, флуконазол — 16 мг); на 4 день — перорально 2/3 дозы (кетоконазол — 134 мг, итраконазол — 66 мг, флуконазол — 32 мг).
Результаты
У 1 пациента проведённые тесты с флуконазолом (в том числе и ПТ) — отрицательные, то есть диагноз ФЛЭ на флуконазол снят. Среди пациентов было 19 женщин, 3 мужчины (соотношение — 6,3:1). Средний возраст возникновения первой аллергической реакции на флуконазол — 30,39±10,23 (минимальный возраст — 19 лет, максимальный — 60). Наиболее часто ФЛЭ на флуконазол отмечена у пациентов в возрасте от 19 до 30 лет (63,6%) (рис. 1).
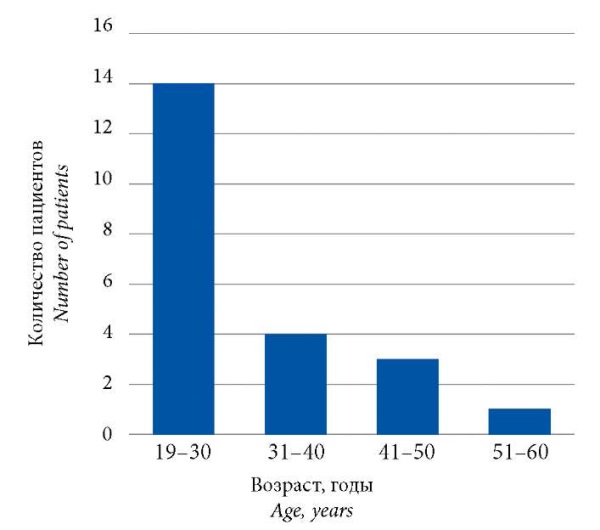
Рис. 1. Возраст первого эпизода ФЛЭ на флуконазол (n=22)
Fig. 1. Age of first episode of FDE caused by fluconazole (n=22)
У 2 пациентов отмечалась одна реакция, у 20 – более одной реакции (2 реакции – у 4, 3 – у 9, 4 – у 4, 5 – у 1, 7 – у 1, 10 – у 1), то есть у 20 (90,9%) пациентов ФЛЭ на флуконазол развивалась неоднократно (рис. 2).
У 17 (77,3%) пациентов ФЛЭ сопровождалась поражением слизистых оболочек. Сопутствующая атопия выявлена у 4 пациентов (18,2%). У всех пациентов с ФЛЭ на флуконазол не выявлено лекарственной аллергии на другие группы ЛП. У 3 пациентов сопутствующей патологией был первичный иммунодефицит (у 2 – общая вариабельная иммунная недостаточность, у 1 - наследственный ангионевротический отек).
У всех пациентов клинические проявления последующих реакций ФЛЭ на флуконазол становились тяжелее (увеличение количества пятен, образование булл), но трансформации в другие более тяжелые буллезные дерматозы не отмечалось.
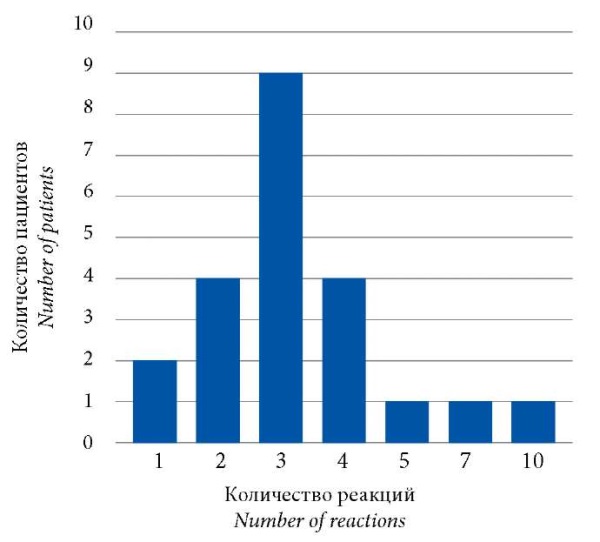
Рисунок 2. Количество реакций ФЛЭ на флуконазол (n=22).
Figure 2. Number of FDE reactions caused by fluconazole (n=22).
Время между последней перенесенной реакцией и МПАТ с флуконазолом составило 2,21±1,78 месяца. Положительный результат МПАТ с флуконазолом получен у 5 (41,7%) пациентов. Таким образом, чувствительность МПАТ для диагностики ФЛЭ на флуконазол составила 41,7%, специфичность — 100%, частота ложноотрицательных результатов — 58,3%, положительная предсказательная ценность — 100%.
ПТ с кетоконазолом (n=17) и итраконазолом (n=15) — отрицательный у всех пациентов, то есть в 100% случаев (табл. 2).
Обсуждение
Результаты нашего исследования показывают, что ФЛЭ на флуконазол встречается в 6 раз чаще у женщин, чем у мужчин, что, вероятнее всего, объясняется более частым применением флуконазола женщинами. Наиболее часто ФЛЭ на флуконазол встречается у пациентов молодого возраста (19-30 лет). У детей ФЛЭ на флуконазол не отмечена, что можно объяснить редким применением противогрибковых препаратов, в том числе флуконазола, у детей.
Как правило, при ФЛЭ на флуконазол вовлекаются слизистые, что обусловливает более тяжёлое течение. Неоднократные реакции ФЛЭ на флуконазол у 90,9% пациентов свидетельствуют о несвоевременной постановке диагноза. По данным зарубежных коллег, последующая реакция ФЛЭ не трансформируется в более тяжёлые буллезные дерматозы, такие как синдром Стивенса-Джонсона, токсический эпидермальный некролиз [2], что подтверждено и нашими результатами.
Таблица / Table 2
ФЛЭ на флуконазол (n=22)
FDE caused by fluconazole (n=22)
№ | Пол Sex | Возраст первой реакции Age of first reaction | Клинические проявления Clinical manifestations | Количество реакций Number of reactions | Время между тестированием и реакцией (мес) Time between testing and reaction (month) | Аппликационный тест Application test | ПТ DPT | |||
Кет Ket | Флу Flu | Итр Itr | Кет Ket | Итр Itr | ||||||
1 | м / m | 42 | ФЛЭ+слиз / FDE+muc. | 5 | 1 | нп / nd | + | нп / nd | - | нп / nd |
2 | Ж / F | 30 | ФЛЭ+слиз / FDE+muc. | 3 | 1,5 | - | + | - | - | нп / nd |
3 | Ж / F | 27 | ФЛЭ / FDE | 3 | нп / nd | нп / nd | нп / nd | нп / nd | нп / nd | нп / nd |
4 | Ж / F | 35 | ФЛЭ / FDE | 3 | нп / nd | нп / nd | нп / nd | нп / nd | нп / nd | нп / nd |
5 | м / m | 30 | ФЛЭ+слиз / FDE+muc. | 4 | нп / nd | нп / nd | нп / nd | нп / nd | нп / nd | нп / nd |
6 | Ж / F | 46 | ФЛЭ+слиз / FDE+muc. | 3 | 5 | нп / nd | + | нп / nd | - | - |
7 | Ж / F | 60 | ФЛЭ+слиз / FDE+muc. | 2 | 6 | нп / nd | - | - | - | - |
8 | Ж / F | 25 | ФЛЭ+слиз / FDE+muc. | 3 | 4 | - | - | - | - | - |
9 | Ж / F | 29 | ФЛЭ+слиз / FDE+muc. | 2 | 2 | нп / nd | + | нп / nd | - | - |
10 | Ж / F | 19 | ФЛЭ+слиз / FDE+muc. | 2 | нп / nd | нп / nd | нп / nd | нп / nd | нп / nd | нп / nd |
11 | Ж / F | 23 | ФЛЭ+слиз / FDE+muc. | 3 | нп / nd | нп / nd | нп / nd | нп / nd | нп / nd | нп / nd |
12 | Ж / F | 29 | ФЛЭ+слиз / FDE+muc. | 1 | 1 | - | - | - | - | - |
13 | Ж / F | 26 | ФЛЭ+слиз / FDE+muc. | 4 | 24 | нп / nd | нп / nd | нп / nd | - | - |
14 | Ж / F | 41 | ФЛЭ / FDE | 2 | 1 | - | - | - | - | - |
15 | м / m | 30 | ФЛЭ+слиз / FDE+muc. | 1 | 1 | - | - | - | - | - |
16 | Ж / F | 39 | ФЛЭ+слиз / FDE+muc. | 3 | 12 | нп / nd | нп / nd | нп / nd | - | - |
17 | Ж / F | 22 | ФЛЭ+слиз / FDE+muc. | 4 | 2 | - | - | - | - | - |
18 | Ж / F | 35 | ФЛЭ+слиз / FDE+muc. | 10 | 1 | нп / nd | + | нп / nd | - | - |
19 | Ж / F | 29 | ФЛЭ / FDE | 3 | 12 | нп / nd | нп / nd | нп / nd | - | - |
20 | Ж / F | 27 | ФЛЭ+слиз / FDE+muc. | 4 | 14 | нп / nd | нп / nd | нп / nd | - | - |
21 | Ж / F | 23 | ФЛЭ | 3 | 18 | нп / nd | нп / nd | нп / nd | - | - |
22 | Ж / F | 19 | ФЛЭ+слиз / FDE+muc. | 7 | 1 | - | - | - | - | - |
Примечания: + — положительный результат,
- — результат отрицательный,
нп — тест не проведён;
Итр — итраконазол,
Кет — кетоконазол,
ПТ — провокационный тест,
слиз — слизистые,
Флу — флуконазол,
ФЛЭ — фиксированная лекарственная эритема.
Notes: Сonventions: «+» - positive result,
«-» - negative result,
nd – test not done.
Abbreviation: Itr – Itraconazole,
Кет – Ketoconazole,
DPT – drug provocation test,
muc. – mucous,
Flu – Fluconazole,
FDE – fixed drug erythema.
Несмотря на то, что чувствительность кожного тестирования для диагностики ФЛЭ на флуконазол — невысокая (41,7%), что соответствует проведённым ранее исследованиям при ФЛЭ [12], МПАТ показан, так как он абсолютно безопасен для пациента.
Если мы на этапе кожного тестирования подтвердим диагноз и выявим причинно-значимый ЛП даже у 42% больных, это позволит избежать проведения более опасного ПТ. Следует отметить, что специфичность и положительная предсказательная ценность МПАТ высока (100%), то есть при чётком следовании методике получение ложноположительных результатов невозможно.
По нашим данным и по данным зарубежных коллег [3][5][7], перекрёстной лекарственной аллергии между противогрибковыми препаратами группы азолов, в том числе имидазолов, к которым относятся как флуконазол, так и итраконазол, при ФЛЭ не выявлено, то есть можно сделать вывод о том, что в данном случае развивается ФЛЭ на конкретное действующее вещество.
Заключение
Полученные результаты позволяют сделать вывод о том, что ФЛЭ на флуконазол в подавляющем большинстве случаев развивается у женщин в возрасте от 19 до 30 лет. Так как пациенты с ФЛЭ на флуконазол хорошо переносят кетоконазол и итраконазол, для них с высокой степенью вероятности возможна замена флуконазола на один из этих препаратов. МПАТ целесообразно применять для диагностики ФЛЭ на флуконазол, так как он абсолютно безопасен для пациента, позволяет избежать проведения ПТ у 42% пациентов. Важно отметить, что при своевременной постановке правильного диагноза более, чем в 90% случаев, можно профилактировать развитие повторной реакции на флуконазол. Несмотря на то, что выявленные тенденции и закономерности согласуются с литературными данными, из-за того, что ФЛЭ на флуконазол является довольно редкой патологией и количество проанализированных случаев недостаточно велико, чтобы сделать однозначные выводы относительно данной проблемы, требуется её дальнейшее изучение.
1. Романова ТС. Особенности диагностики in vivo лекарственной аллергии, протекающей по замедленному типу: специальность 14.00.36: автореферат диссертации на соискание ученой степени кандидата медицинских наук / Романова Татьяна Сергеевна. — Москва, 2018. — с.24.
2. Романова ТС. Особенности диагностики in vivo лекарственной аллергии, протекающей по замедленному типу: специальность 14.00.36: автореферат диссертации на соискание ученой степени кандидата медицинских наук / Романова Татьяна Сергеевна. — Москва, 2018. — с.24.
Список литературы
1. Patel S, John AM, Handler MZ, Schwartz RA. Fixed Drug Eruptions: An Update, Emphasizing the Potentially Lethal Generalized Bullous Fixed Drug Eruption. Am J Clin Dermatol. 2020;21(3):393–9. https://doi.org/10.1007/s40257-020-00505-3
2. Brockow K, Ardern-Jones MR, Mockenhaupt M, Aberer W, Barbaud A, et al. EAACI position paper on how to classify cutaneous manifestations of drug hypersensitivity. Allergy Eur J Allergy Clin Immunol. 2019;74(1):14–27. https://doi.org/10.1111/all.13562
3. Bavbek S, Yilmaz I, Sözener ZÇ. Fixed drug eruption caused by ornidazole and fluconazole but not isoconazole, itraconazole, ketoconazole and metronidazole. J Dermatol. 2013;40(2):134–5. https://doi.org/10.1111/1346-8138.12023
4. Mithari HS, Gole PV., Kharkar VD, Mahajan SA. Generalized bullous fixed drug eruption to fluconazole; with cross-reactivity to tinidazole. Indian J Dermatol. 2019;64(4):335–7. https://doi.org/10.4103/ijd.IJD_431_18
5. Makris M, Fokoloros C, Syrmali A, Tsakiraki Z, Damaskou V, Papadavid E. Generalized bullous fixed drug eruption to fluconazole with positive patch testing and confirmed tolerance to itraconazole. Iran J Allergy, Asthma Immunol. 2021;20(2):255–8. https://doi.org/10.18502/ijaai.v20i2.6081
6. Demir S, Cetin EA, Unal D, Coşkun R, Olgac M, et al. Generalized Fixed Drug Eruption Induced by Fluconazole Without Cross-Reactivity to Itraconazole: Lymphocyte Transformation Test Confirms the Diagnosis. Drug Saf - Case Reports. 2018;5(1):2–4. https://doi.org/10.1007/s40800-017-0067-7
7. Gupta R, Thami GP. Fixed drug eruption caused by itraconazole: reactivity and cross reactivity. J Am Acad Dermatol. 2008;58:521–2. https://doi.org/10.1016/j.jaad.2006.06.013
8. Quint T, Wöhrl S, Kinaciyan T. Fixed drug eruption caused by fluconazole—An underdiagnosed but recurrent problem. Contact Dermatitis. 2019;80(3):172–3. https://doi.org/10.1111/cod.13149
9. Tavallaee M, Rad MM. Fixed drug eruption resulting from fluconazole use: A case report. J Med Case Rep. 2009;3:1–4. https://doi.org/10.4076/1752-1947-3-7368
10. Saliba E, Chrabieh R, Tannous Z. Fluconazole-induced acute generalized exanthematous pustulosis. Am J Emerg Med. 2021;39:254.e5-254.e7. https://doi.org/10.1016/j.ajem.2020.06.061
11. Adler NR, Lin MJ, Cameron R, Gin D. Fluconazole-induced Sweet’s syndrome: A novel association. Australas J Dermatol. 2018;59(2):160–1. https://doi.org/10.1111/ajd.12709
12. Barbaud A, Gonçalo M, Bruynzeel D, Bircher A. Guidelines for performing skin tests with drugs in the investigation of cutaneous adverse drug reactions. Contact Dermatitis. 2001;45(6):321–8. https://doi.org/10.1034/j.1600-0536.2001.450601.x
Об авторах
Т. Н. МясниковаРоссия
Татьяна Николаевна Мясникова – к.м.н., старший научный сотрудник, врач аллерголог-иммунолог
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Т. В. Латышева
Россия
Татьяна Васильевна Латышева – проф., д.м.н., заведующая отделением интенсивной терапии
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Т. С. Романова
Россия
Татьяна Сергеевна Романова – к.м.н., врач аллерголог-иммунолог
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
В. В. Смирнов
Россия
Валерий Валерьевич Смирнов – д.фарм.н., заведующий научно-производственным комплексом
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Рецензия
Для цитирования:
Мясникова Т.Н., Латышева Т.В., Романова Т.С., Смирнов В.В. Фиксированная лекарственная эритема на флуконазол. Медицинский вестник Юга России. 2023;14(4):11-16. https://doi.org/10.21886/2219-8075-2023-14-4-11-16
For citation:
Myasnikova T.N., Latysheva T.V., Romanova T.S., Smirnov V.V. Fixed drug eruption caused by fluconazole. Medical Herald of the South of Russia. 2023;14(4):11-16. (In Russ.) https://doi.org/10.21886/2219-8075-2023-14-4-11-16







































