Перейти к:
Клинико-биохимические фенотипы при кардиореспираторной коморбидности
https://doi.org/10.21886/2219-8075-2023-14-2-67-75
Аннотация
Цель: оценить частоту развития повторного инфаркта миокарда, инсульта и летальности у больных с разными фенотипами инфаркта миокарда на фоне хронической обструктивной болезни лёгких.
Материалы и методы: обследованы 325 больных инфарктом миокарда (195 больных инфарктом на фоне хронической обструктивной болезни легких, 130 — без хронической обструктивной болезни лёгких). Исследовались маркеры эндогенной интоксикации: молекулы средней массы, гематологические индексы интоксикации, показатели газового состава крови, апоптоза, перекисного окисления белков, липидов и антиоксидантной защиты, воспаления и функции почек. Статистическую обработку данных проводили с помощью пакета программ SPSS 26.0.
Результаты: При проведении двухэтапного кластерного анализа сформировалось четыре кластера, которые были обозначены как «полимаркерно-ретенционный», «некротически-воспалительный», «гипоксически-воспалительный» и кластер с отсутствием синдрома эндогенной интоксикации. Среди больных инфарктом миокарда на фоне хронической обструктивной болезни лёгких у 53,3 % больных преобладал гипоксически-воспалительный фенотип. Некротически-воспалительный фенотип отмечался у 8,2 % больных, полимаркерно-ретенционный — у 36,9 %, фенотип с отсутствием синдрома эндогенной интоксикации – у 1,5 % больных. Повторный инфаркт миокарда, инсульт и летальность составили комбинированную конечную точку. Наибольшая частота достижения комбинированной конечной точки отмечалась при полимаркерно-ретенционном фенотипе у 37 (55,2 %) больных.
Заключение: сосудистые жизнеугрожающие и фатальные события (повторный инфаркт миокарда, инсульт, смертность от кардиальных причин) в процессе 12-месячного наблюдения наиболее характерны для полимаркерно-ретенционного фенотипа. Клиническими особенностями данного фенотипа являлись частое наличие Q-образующего ИМ, трансмуральное повреждение миокарда, наличие осложнений в остром периоде. ХОБЛ у этих пациентов характеризовалась длительным течением, высоким индексом курильщика, преимущественно 3-й степенью бронхообструкции, частыми обострениями. Итоги данного исследования позволяют осуществлять персонифицированный подход к оценке годового прогноза у больных с острым инфарктом миокарда на фоне ХОБЛ.
Ключевые слова
Для цитирования:
Прокофьева Т.В., Башкина О.А., Полунина О.С., Севостьянова И.В., Гриценко Е.Л. Клинико-биохимические фенотипы при кардиореспираторной коморбидности. Медицинский вестник Юга России. 2023;14(2):67-75. https://doi.org/10.21886/2219-8075-2023-14-2-67-75
For citation:
Prokofyeva T.V., Bashkina O.A., Polunina O.S., Sevostyanova I.V., Gritsenko E.L. Clinical and biochemical phenotypes in cardiorespiratory comorbidity. Medical Herald of the South of Russia. 2023;14(2):67-75. (In Russ.) https://doi.org/10.21886/2219-8075-2023-14-2-67-75
Введение
Коморбидность является актуальной проблемой современного здравоохранения, так как больной с наличием нескольких заболеваний на амбулаторном приёме или в стационаре является скорее правилом, чем исключением [1]. В связи с этим актуализируются вопросы диагностики, ведения коморбидных больных и прогнозирования исходов имеющихся у них заболеваний [2].
Одной из наиболее распространённых является кардиореспираторная коморбидность, в ряду которой особое место занимает инфаркт миокарда (ИМ) на фоне хронической обструктивной болезни лёгких (ХОБЛ) [3][4]. В условиях данной коморбидности повышается вероятность атипичного течения инфаркта, связанной с этим поздней диагностики, ухудшается прогноз как в остром периоде, так и на постстационарном этапе [5–7]. Это обусловливает важность выделения среди коморбидных больных ИМ лиц с высоким риском жизнеугрожающих сосудистых осложнений (повторного ИМ, инсульта) и летального исхода, а также своевременной коррекции модифицируемых предикторов неблагоприятных событий.
На сегодняшний день в работах многих авторов показано, что для патологических состояний характерен синдром эндогенной интоксикации (СЭИ). В основе его лежит избыточное накопление эндотоксинов вследствие их гиперпродукции или нарушенного выведения. СЭИ увеличивает тяжесть патологического процесса и ухудшает прогноз заболевания [8][9]. Оценка эндотоксикоза может лечь в основу прогнозирования течения и исхода ИМ у больных с ХОБЛ.
Существует множество лабораторных маркеров СЭИ, что несколько затрудняет его изучение. Одним из решений данной проблемы может стать фенотипирование больных [10][11]. Выделение клинико-биохимических фенотипов и анализ исходов ИМ на фоне ХОБЛ может помочь в прогнозировании исходов инфаркта.
Цель исследования — оценить частоту развития повторного инфаркта миокарда, инсульта и летальности у больных с разными фенотипами инфаркта миокарда на фоне хронической обструктивной болезни лёгких.
Материалы и методы
Обследованы 325 больных ИМ, получавших лечение в региональном сосудистом центре ГБУЗ АО АМОКБ г. Астрахани (2016–2019 гг.). Из них основную группу составили 195 больных ИМ на фоне ХОБЛ. 130 больных ИМ не имели ХОБЛ и составили группу сравнения. Диагноз ИМ выставлялся на основании клинических рекомендаций «Четвёртое универсальное определение инфаркта миокарда» от 2018 г. [12]. Всем пациентам выполнялась коронароангиография. Лечение больных ИМ осуществлялось в соответствии с Клиническими рекомендациями [13][14]. Медиана возраста составила 56,0 [ 52,0; 60,0] лет. Среди больных ИМ на фоне ХОБЛ было 189 мужчин и 6 женщин. Q-ИМ имел место у 146 (74,9%) пациентов, не-Q-ИМ — у 49 (25,1%). У 84 человек (43,1%) течение ИМ было осложнённым (острая сердечная недостаточность, нарушения ритма и проводимости).
Диагноз ХОБЛ устанавливался по клиническим рекомендациям, представленным программой «Глобальной стратегии диагностики, лечения и профилактики хронической обструктивной болезни лёгких», пересмотр 2020 г. [15]. Выраженность бронхообструкции у больных ИМ на фоне ХОБЛ была распределена следующим образом: II степень — 68 (34,9%), III — 88 (45,1%), IV — 39 (20,0%) человек. Стаж курения составил 35 [ 30; 40] лет, индекс курения — 18,85 [ 16,0; 22,7] пачка/лет.
Медиана возраста больных ИМ без ХОБЛ составила 56,0 [ 50,0; 62,0] лет. В этой группе было 89 мужчин и 41 женщина. Q-ИМ развился у 101 (77,7%) пациентов, не-Q-ИМ — у 29 (22,3%). Осложнения острого периода ИМ развились у 32 (24,6%) больных.
Данное исследование является когортным проспективным. Проведение его было одобрено Региональным Независимым Этическим комитетом (от 18.01.2016, протокол № 12).
Критерии включения — наличие документированного ИМ I типа, развившегося в течение 2 часов от момента ангинозного приступа, наличие информированного согласия на участие в исследовании. Критерии исключения — возраст старше 65 лет, наличие соматической патологии, способной оказать влияние на результаты исследования (сахарный диабет, печёночная, почечная недостаточность, онкологические заболевания).
Всем больным выполнялись стандартные общеклинические исследования. Помимо этого, проводились специальные методы обследования, направленные на определение маркеров СЭИ. Уровень молекул средней массы (МСМ) оценивался посредством прямой спектрометрии (на спектрофотометре Cary 50 Scan UV VS, производство «Varian», Австралия), маркеры оксидативного стресса определялись при помощи иммуно-флюоресцентного анализа (на анализаторе иммуноферментных реакций «Униплан» АИФР-01, производство ЗАО «Пикон»), содержание клеток в апоптозе определялось методом проточной цитофлоуметрии (на проточном цитофлуориметре «Navious» «Beckman Coulter», США).
Анализ полученных данных проводился при помощи программы SPSS, версия 26.0. Проверка на нормальность распределения количественных признаков в группах и отдельных подгруппах осуществлялась с использованием критериев Колмогорова-Смирнова. Поскольку во всех случаях имело место непараметрическое распределение данных, значения оценивались в виде медианы и интерквартильного размаха (Q1-Q3). Для выявления статистической значимости в трёх и более исследуемых группах использовался критерий Краскела-Уоллиса с поправкой Бонферрони с последующими попарными апостериорными сравнениями групп между собой. Критический уровень значимости при проверке статистических гипотез в данном исследовании принимали равным 0,05. При сопоставлении групп по категориальному признаку использовался χ2 Пирсона. Кластеризация больных осуществлялась посредством двухэтапного кластерного анализа. Для отнесения больного к тому или иному кластеру был осуществлён дискриминантный анализ с шаговым отбором предикторов.
Результаты
На первом этапе исследования нами были определены маркеры синдрома эндогенной интоксикации с последующей кластеризацией полученного массива данных. В качестве маркеров СЭИ выступили молекулы средней массы (МСМ) в плазме, эритроцитах и моче, гематологические индексы интоксикации (лейкоцитарный индекс интоксикации, индекс сдвига лейкоцитов крови, нейтрофильно-лимфоцитарный индекс), сатурация, удельный вес циркулирующих мононуклеаров крови на стадии раннего апоптоза, маркеры перекисного окисления липидов и белков (малоновый диальдегид, продукты перекисного окисления белков) и антиоксидантной защиты (общая супероксиддисмутаза), воспаления (высокочувствительный С-реактивный белок и лактоферрин), маркеры функции почек (мочевина, креатинин, скорость клубочковой фильтрации, наличие протеинурии). Исходом двухэтапного кластерного анализа полученных лабораторных данных стало формирование четырех кластеров. Они были обозначены как «полимаркерно-ретенционный», «некротически-воспалительный», «гипоксически-воспалительный» и кластер с отсутствием СЭИ. Полимаркерно-ретенционный тип СЭИ характеризовался наиболее высокими уровнями маркеров эндотоксикоза, апоптоза, воспаления, перекисного окисления липидов и белков и низкими уровнями антиоксидантной защиты, наиболее высокими значениями креатинина и низкими значениями скорости клубочковой фильтрации. Полученные результаты свидетельствовали о выраженности СЭИ с нарушением элиминации эндотоксинов. Доля данного кластера составила 16,8%. При некротически-воспалительном и гипоксически-воспалительном типах СЭИ отмечалось умеренное повышение показателей, характеризующих эндотоксикоз. Приниципиальным различием между этими классами было соотношение маркеров перекисного окисления липидов и белков и антиоксидантной защиты. Для некротически-воспалительного типа СЭИ было характерно повышение маркеров перекисного окисления липидов и белков при низком значении маркеров антиоксидантной защиты. Это характерно для острых стрессовых ситуаций, когда ещё не запущен каскад адаптационных процессов. При гипоксически-воспалительном фенотипе уровни маркеров перекисного окисления липидов и белков были ниже, а антиоксидантной защиты — более высокими, чем при некротически-воспалительном типе СЭИ. Такая ситуация характерна для хронических воспалительных процессов, когда в ответ на активацию процессов перекисного окисления включаются механизмы антиоксидантной защиты. Удельный вес некротически-воспалительного и гипоксически-воспалительного кластеров составил 11% и 40,7% соответственно. В четвертом кластере значения всех показателей не выходили за рамки референсных и были идентичными значениям в группе контроля, что позволило обозначить его как тип с отсутствием СЭИ. Удельный вес данного кластера составил 31,5%.
Далее с целью формирования фенотипов больных ИМ мы сопоставили полученные ранее кластеры в группе больных ИМ с ХОБЛ и без ХОБЛ по клинико-анамнестическим параметрам и данным инструментальных исследований. Результаты сопоставления представлены в таблице.
Таблица / Table 1
Сравнение кластеров в группе больных ИМ+ХОБЛ (n=195)
Cluster comparison in the group of patients with MI + COPD (n=195)
|
Показатель Indicator |
Первый кластер The first cluster (n=72) |
Второй кластер The second cluster (n=16) |
Третий кластер The third cluster (n=104) |
Четвертый кластер The fourth cluster (n=3) |
p |
|
Возраст, полных лет Age, full years |
52 [ 48-59] |
52 [ 47-54] |
50 [ 47-54] |
54 [ 51,5-57,5] |
p=0,303 |
|
Мужской пол, n (%) Male gender, n (%) |
71 (98,6) |
16 (100) |
99 (95,2) |
3 (100) |
p=0,575 |
|
Наличие зубца Q Presence of Q tooth |
66 (91,7) |
10 (62,5) |
69 (66,3) |
1 (33,3) |
p<0,001 p1-4=0,003 |
|
Элевация ST, n (%) ST elevation, n (%) |
60 (83,3) |
8 (50) |
59 (56,7) |
1 (33,3) |
p<0,001 p2-3=0,012 p2-4=0,001 |
|
Множественное поражение коронарных артерий, n (%) Multiple coronary artery lesions, n (%) |
65 (90,3) |
10 (62,5) |
69 (66,3) |
1 (33,3) |
p<0,001 p1-2=0,006 |
|
Наличие осложнений Presence of complications |
72 (100) |
8 (50) |
53 (51) |
0 (0) |
p<0,001 |
|
Локализация ИМ, n (%) Localization MI, n (%) i.21.0 Острый трансмуральный передней стенки Acute transmural anterior wall i.21.1 Острый трансм. нижней стенки Acute transmural lower wall i.21.2 Острый трансм. других уточненных локализаций Acute transmural of other specified localizations i.21.4 Острый субэндокардиальный Acute subendocardial |
30 (41,7)
18 (25,0)
5 (6,9)
19 (26,4) |
13 (81,3)
0
0
3 (18,7) |
44 (42,3)
21 (20,2)
13 (12,5)
26 (25,0) |
1 (25,0)
1 (25,0)
0
4 (50,0) |
|
|
Клинический вариант ИМ, n (%) Clinical variant of MI, n (%) Типичный Typical Абдоминальный Abdominal Церебральный Cerebral Аритмический Arrhythmic Астматический Asthmatic |
55 (76,4)
1 (1,4)
5 (7,0)
5 (7,0)
6 (8,2) |
14 (87,6)
0
1 (6,2)
1 (6,2)
0 |
90 (86,5)
0
0
4 (3,8)
10 (9,6) |
3 (100)
0
0
0
0 |
p=0,16 |
|
СН по Killip, n (%) I II III IV |
43 (59,7) 23 (31,9) 2 (2,8) 4 (5,6) |
8 (50,0) 6 (37,4) 1 (6,3) 1 (6,3) |
74 (71,2) 22 (21,2) 3 (2,9) 5 (4,7) |
3 (100) 0 0 0 |
p=0,515 |
|
Наличие тахикардии, n (%) Presence of tachycardia, n (%) |
66 (91,7) |
7 (43,8) |
57 (54,8) |
0 |
p<0,001 p1-2<0,001 p1-3<0,001 |
|
Наличие нарушений ритма и проводимости, n (%) Presence of rhythm and conduction abnormalities, n (%) |
32 (44,4) |
5 (31,3) |
27 (26,0) |
0 |
p=0,032 p1-3=0,021 |
|
ФВ по данным Эхо-КС, % EF according to Echo-CS, % |
49 [ 41,5-53,5] |
52 [ 48-56] p1=0,029 |
49 [ 45-53] p1=0,906 p2=0,225 |
55 [ 53-57] p1=0,19 p2=1,0 p3=0,445 |
p=0,009
|
|
Длительность ХОБЛ, лет Duration of COPD, years |
7 [ 5-10] |
4 [ 3-5] p1=0,005 |
5 [ 4-7] p1=0,001 p2=1,0 |
5 [ 4,5-6] p1=1,0 p2=1,0 p3=1,0 |
p<0,001 |
|
Кол-во выкуриваемых сигарет в сутки, n Number of cigarettes smoked per day, n |
13 [ 10-15] |
10 [ 10-10] p1=0,004 |
10 [ 10-10] p1<0,001 p2=1,0 |
10 [ 10-10] p1=0,326 p2=1,0 p3=1,0 |
p<0,001 |
|
Стаж курения, лет Smoking history, years |
35 [ 30-40] |
35 [ 33-37] |
35 [ 30-40] |
35 [ 31,5-39] |
p=0,631 |
|
Индекс пачка/лет Index pack/year |
22,3 [ 17,5-30,0] |
17,5 [ 16,8-18,5] p1=0,013 |
17,8 [ 15,5-21,6] p1<0,001 p2=1,0 |
17,5 [ 15,8-19,5] p1=0,685 p2=1,0 p3=1,0 |
p<0,001 |
|
Степень бронхообструкции, % Degree of bronchoobstruction, % |
3 [ 2-4] |
3 [ 2-3] |
3 [ 2-3] |
3 [ 3-3] |
p=0,058 |
|
ОФВ1, % VFE1, % |
44,0 [ 26,5-54,5] |
47,5 [ 43,5-54,0] |
45,0 [ 39,0-55,0] |
45,0 [ 41,0-46,0] |
p=0,09 |
|
Результаты КАТ-теста CAT test results |
18,5 [ 14-33] |
16 [ 13,5-19] p1=0,266 |
18 [ 13-19] p1=0,036 p2=1,0 |
22 [ 20-22,5] p1=1,0 p2=0,833 p3=1,0 |
p=0,017 |
|
Результаты mMRS-теста Results of the mMRS test |
2 [ 2-4] |
2 [ 1-2] p1=0,01 |
2 [ 1-2] p1<0,001 p2=1,0 |
2 [ 1,5-2] p1=0,544 p2=1,0 p3=1,0 |
p<0,001 |
|
Высокая частота обострений, n (%) High frequency of exacerbations, n (%) |
55 (76,4) |
13 (81,3) |
82 (78,8) |
0 (0) |
p=0,966 |
|
Группа ХОБЛ, n (%) COPD Group, n (%) А В С Д |
17 (23,6) 8 (11,1) 16 (22,2) 31 (40,8) |
3 (18,8) 7 (43,8) 6 (37,5) 0 (0) |
22 (21,2) 32 (30,8) 42 (40,4) 8 (7,7) |
0 (0) 2 (66,7) 1 (33,3) 0 (0) |
p<0,001 |
|
Фенотип ХОБЛ, n (%) COPD phenotype, n (%) Эмфизематозный Emphysematous Бронхитический Bronchitic Смешанный Mixed |
17 (23,6)
20 (27,8)
35 (48,6) |
4 (25,0)
3 (18,8)
9 (56,3) |
28 (26,9)
35 (33,7)
41 (39,4) |
0 (0)
1 (33,3)
2 (66,7) |
p=0,736 |
Примечание: p — уровень статистической значимости при сравнении 4 групп (Kruskai-Wallis test), р1 — уровень статистической значимости с кластером 1, р2 — уровень статистической значимости различий с кластером 2, р3 — уровень статистической значимости различий с кластером 3. Различия статистически значимы при p<0,05.
Note: p is the level of statistical significance when comparing 4 groups (Kruskai-Wallis test), p1 is the level of statistical significance with cluster 1, p2 is the level of statistical significance of differences with cluster 2, p3 is the level of statistical significance of differences with cluster 3. Differences are statistically significant at p<0.05.
Полимаркерно-ретенционный фенотип представлен преимущественно лицами мужского пола и среднего возраста. ИМ у них характеризовался в 83,3% случаев подъёмом сегмента ST, в 91,7% — наличием зубца Q на ЭКГ. Для лиц с данным фенотипом характерно множественное поражение коронарных артерий (90,3%) и наличие осложнений в остром периоде (100%). Наиболее часто встречается трансмуральное поражение передней стенки левого желудочка. Хотя доминирующим является ангинозный вариант ИМ, стоит отметить, что при данном фенотипе встречаются все клинические варианты заболевания. У 91,7% лиц с данным фенотипом отмечалась тахикардия, у 44,4% — нарушения ритма и проводимости.
Пациенты с данным фенотипом имели наиболее длительный стаж ХОБЛ, наибольшее количество выкуриваемых за сутки сигарет и индекс «пачка/лет». Превалировала 3-я степень бронхообструкции, группа D и смешанный фенотип ХОБЛ. У большинства лиц (76,4%) ХОБЛ протекала с частыми обострениями.
Лабораторно выраженность эндотоксикоза, апоптоза, воспаления, оксидативного стресса и гипоксии при данном фенотипе максимальна. Имелись лабораторные признаки нарушения работы почек, что свидетельствовало не только о гиперпродукции эндотоксинов, но и о нарушении их элиминации.
Некротически-воспалительный фенотип представлен лицами мужского пола (100%), среднего возраста. Элевация сегмента ST при поступлении и наличие осложнений в остром периоде ИМ имелись в половине случаев (по 50%). ИМ с зубцом Q и многосососудистое поражение наблюдались несколько чаще (по 62,5% случаев). Доминировало трансмуральное поражение передней стенки ЛЖ (81,3%). Наиболее часто встречался ангинозный клинический вариант заболевания (у 87,6%). Тахикардия и нарушения сердечного ритма встречались менее чем у половины больных (43,8 и 31,3% соответственно).
Стаж ХОБЛ у больных с данным фенотипом был относительно непродолжительным — от 4 до 7 лет с медианой в 5 лет, индекс пачка/лет был умеренным и составил 17,8 [16,8-18,5], наблюдалась 2–3 степень бронхообструкции. Преобладали пациенты групп B и С со смешанным фенотипом ХОБЛ.
Лабораторно у лиц с некротически-воспалительным фенотипом наблюдался умеренно выраженный эндотоксикоз, апоптоз, воспаление, дисбаланс про- и антиоксидантов с повышением прооксидантов при низком значении антиоксидантов, что характеризует остроту процесса.
Гипоксически-воспалительный фенотип характеризовался средним возрастом больных преимущественно мужского пола (95,2%). Такие признаки, как элевация сегмента ST при поступлении, наличие зубца Q на ЭКГ, осложнённое течение ИМ и многососудистое поражение не были значимыми, так как наблюдались в половине случаев или несколько чаще. По этим признакам данный фенотип был аналогичен некротически-воспалительному фенотипу. Следует отметить, что наряду с превалированием клинической симптоматики в виде ангинозного приступа (86,5%) при данном фенотипе чаще, чем при других, встречался астматический клинический вариант ИМ (9,6%).
Стаж ХОБЛ у больных с данным фенотипом был наименее продолжительным, индекс пачка/лет — умеренным, составив 17,5 [15,5-21,6], также наблюдалась 2–3-я степень бронхообструкции. Превалировали пациенты групп B и С, с бронхитическим и смешанным фенотипом ХОБЛ.
Лабораторно при данном фенотипе отмечались умеренный эндотоксикоз по уровням МСМ, невыраженный апоптоз и дисбаланс про- и антиоксидантов с относительно небольшим повышением маркеров перекисного окисления липидов и белков и умеренным снижением маркеров антиоксидантной защиты, что характеризует хронический воспалительный процесс с активацией механизмов антиоксидантной защиты.
Для фенотипа с отсутствием СЭИ характерен средний возраст и преобладание лиц мужского пола. В 2/3 случаев наблюдался ИМ без зубца Q и без элевации сегмента ST, а поражение КА было однососудистым. Осложнения острого периода ИМ отсутствовали. Локализация поражения была различной, клиническая симптоматика — типичной, тахикардия и нарушения сердечного ритма отсутствовали.
Со стороны ХОБЛ отмечалась небольшая продолжительность заболевания — 5 [ 4, 5–6] лет, умеренный стаж курения и индекс «пачка/лет». Преобладала 3-я степень бронхообструкции. Значения ОФВ1 результаты КАТ-теста и mMRS-теста свидетельствовали об удовлетворительном самочувствии и качестве жизни. Обращало на себя внимание течение заболевания: у всех больных ХОБЛ протекала с редкими обострениями. Преобладали пациенты группы B, а также смешанный фенотип ХОБЛ (66,7%).
Лабораторно не наблюдалось признаков эндотоксикоза, воспаления, было сбалансированным соотношение маркеров перекисного окисления липидов и белков и маркеров антиоксидантной защиты, отсутствовали признаки гипоксии и нарушения работы почек.
На следующем этапе исследования мы проанализировали частоту исходов ИМ в процессе 12-месячного наблюдения за больными. За годовой период наблюдения было цензурировано 30 человек (19 — в группе больных ИМ на фоне ХОБЛ, 11 — в группе больных ИМ без ХОБЛ). Таким образом, удалось оценить исходы ИМ у 176 больных ИМ на фоне ХОБЛ и у 119 больных ИМ без ХОБЛ. Как следует из таблицы 2, у больных ИМ на фоне ХОБЛ отмечалось 36 летальных исходов, связанных с патологией сердечно-сосудистой системы (20,5%). Это было статистически значимо (р=0,038) больше, чем среди больных ИМ без ХОБЛ, где наблюдалось 13 летальных исходов (10,9%). Риск наступления летального исхода у больных ИМ на фоне ХОБЛ был в 2,1 раза выше, чем у больных ИМ в отсутствие ХОБЛ (95% ДИ 1,06–4,14). Что касается частоты развития повторного ИМ, инсульта и летальности от некардиальных причин, то различия в сравниваемых подгруппах не имели статистической достоверности (р=0,051, р=0,325 и р=0,418 соответственно), хотя и встречались чаще среди коморбидных больных.
Таблица / Table 2
Исходы 12-месячного наблюдения за больными ИМ и ИМ+ХОБЛ
Outcomes of 12-month follow-up of patients with MI and MI+COPD
|
Исходы Outcomes |
ИМ MI, n=119 |
ИМ+ХОБЛ MI+COPD, n=176 |
р |
ОШ; 95% ДИ OR; 95% CI |
|
Летальность от кардиальных причин Lethality from cardiac causes, n (%) |
13 (10,9) |
36 (20,5) |
р=0,038 |
2,1; 1,06-4,15 Крамер 0,126 |
|
Повторный ИМ с нелетальным исходом Recurrent MI with nonfatal outcome, n (%) |
7 (5,9) |
23 (13,1) |
р=0,051 |
|
|
Инсульт Stroke, n (%) |
2 (1,7%) |
8 (4,5%) |
р=0,325 |
|
|
Летальность от некардиальных причин Lethality from noncardiac causes, n (%) |
4 (3,4%) |
11 (6,3%) |
р=0,418 |
|
Этиопатогенетическая связь таких исходов, как повторный ИМ, инсульт и сосудистая летальность, позволили объединить их в комбинированную конечную точку (ККТ).
Частота развития ККТ при разных фенотипах представлена на рисунке.
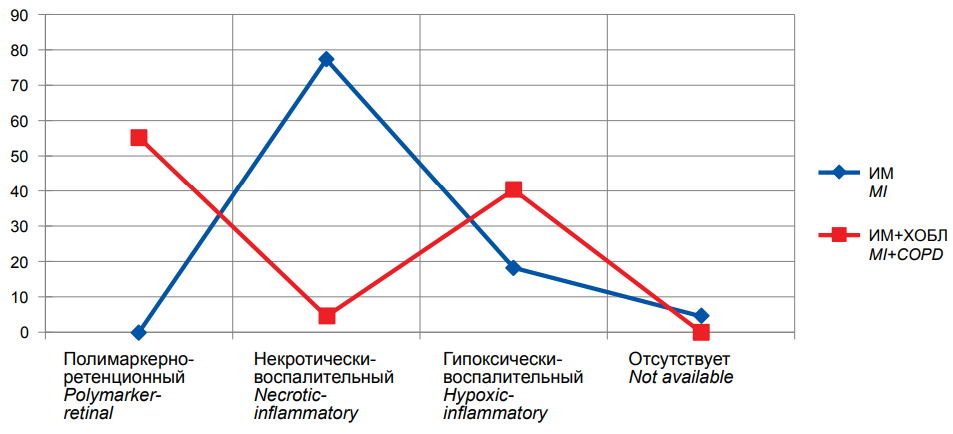
Рисунок. Частота развития комбинированной конечной точки (повторный ИМ, инсульт, сосудистая смертность) у больных ИМ на фоне ХОБЛ в процессе 12-месячного наблюдения (n=176).
Figure. Frequency of Combined Endpoint (Recurrent MI, Stroke, Vascular Mortality) in COPD patients at 12-month follow-up (n=176).
Как следует из рисунка, в группе больных ИМ на фоне ХОБЛ доминирующим по частоте развития ККТ оказался полимаркерно-ретенционный фенотип: здесь она развивалась у 37 (55,2%) человек. При некротически-воспалительном фенотипе ККТ развивалась у 3 (4,5%) человек, при гипоксически-воспалительном — у 27 (40,3%), при фенотипе с отсутствием СЭИ ККТ не развивалась.
Обсуждение
Результаты нашего исследования позволяют говорить о влиянии коморбидной патологии на течение постинфарктного периода у больных ИМ. По итогам 12-месячного наблюдения у больных ИМ на фоне ХОБЛ частота развития таких жизнеугрожающих состояний, как повторный ИМ и инсульт, а также наступление летального исхода была статистически значимо выше, чем при ИМ без ХОБЛ. Полученные данные согласуются с результатами исследования Шишкиной Е.А. (2020), в котором высокая коморбидность (индекс Чарлсона > 4) явилась значимым предиктором годовой летальности у больных ИМ молодого и среднего возраста. Другими предикторами стали ФВ ЛЖ ≤40% при выписке, наличие острой сердечной недостаточности II класса и выше по классификации Killip, частота сердечных сокращения свыше 100 в минуту при поступлении, кардиогенный шок, постинфарктный кардиосклероз, нейтрофильно-лимфоцитарный индекс ≥4,52, митральная регургитация, уровень гемоглобина <130 г/л [16].
Барабаш О.Л. с соавт. (2017) также предприняла попытку определить основные рискообразующие факторы, задействованные в развитии повторного ИМ. Таковыми стали старший возраст, гиподинамия, мультифокальный атеросклероз, низкий уровень образования и социальной обеспеченности [17].
По данным Митьковской Н.П. с соавт. (2015), вероятность развития неблагоприятного исхода (повторного ИМ либо смерти) в течение года после перенесённого крупноочагового ИМ существенно возрастает при наличии артериальной гипертензии, повышенной концентрации триглицеридов в сыворотке крови, многососудистого поражения коронарных артерий, больших значений конечно-систолического размера левого желудочка, депрессивных проявлений [18].
Артериальная гипертензия, сахарный диабет и низкая комплаентность стали значимыми факторами риска развития повторного ИМ в исследовании Новиковой Р.А. с соавт. (2017) [19].
Несмотря на то, что преобладающим в группе больных ИМ на фоне ХОБЛ являлся гипоксически-воспалительный фенотип, наиболее часто жизнеугрожающие сосудистые события (повторный ИМ, инсульт), а также летальные исходы отмечалась при полимаркерно-ретенционном фенотипе. Это представляется логичным, поскольку именно при полимаркерно-ретенционном фенотипе отмечаются наиболее высокие уровни биохимических маркеров эндотоксикоза, нарушение функции почек, множественное поражение коронарных артерий, подъём сегмента ST и наличие зубца Q на ЭКГ, трансмуральное поражение миокарда, клинически — наличие осложнений в остром периоде. На роль дисфункции почек в качестве предиктора развития повторного ИМ указывает и Горбунова Н. [20]. Другими значимыми предикторами в работе автора стали сахарный диабет и мультифокальный атеросклероз [20].
Со стороны ХОБЛ для больных с полимаркерно-ретенционным фенотипом в нашем исследовании было характерно длительное течение заболевания, максимальный среди всех фенотипов индекс курильщика, преимущественно 3-я степень бронхообструкции, частые обострения.
Заключение
Полученные результаты позволяют сделать вывод, что выделение клинико-биохимических фенотипов является наиболее обоснованным в плане прогнозирования развития поздних жизнеугрожающих сосудистых осложнений инфаркта (повторный ИМ, инсульт) и летальных исходов у больных с ХОБЛ в процессе 12-месячного наблюдения. Наиболее частое развитие повторного инфаркта миокарда, инсульта и летального исхода вследствие кардиальных причин характерно для полимаркерно-ретенционного фенотипа. Итоги данного исследования позволяют осуществлять персонифицированный подход к оценке годового прогноза при инфаркте миокарда, развивающемся у больных с хронической обструктивной болезнью легких.
Список литературы
1. Оганов Р. Г., Денисов И. Н., Симаненков В. И., Бакулин И. Г., Бакулина Н. В., и др. Коморбидная патология в клинической практике. Клинические рекомендации. Кардиоваскулярная терапия и профилактика. 2017; 16 (6): 5-56.
2. Драпкина О. М., Шутов А. М., Ефремова Е. В. Коморбидность, мультиморбидность, двойной диагноз – синонимы или разные понятия? Кардиоваскулярная терапия и профилактика. 2019; 18 (2): 65-69.
3. Козлова И. В., Рябова А. Ю., Осадчук М. А., Дворецкий Л. И., Шаповалова Т. Г. Подходы к терапии обострения хронической обструктивной болезни легких при коморбидной артериальной гипертензии. Пульмонология. 2021; 31 (4): 439-445.
4. Канорский С. Г., Мамедов М. Н. О. Реваскуляризация коронарных и периферических артерий при сахарном диабете: взгляд кардиолога. Международный журнал сердца и сосудистых заболеваний. 2021; 9 (21): 4-13.
5. Кузьмичев Б. Ю., Воронина Л. П., Тарасочкина Д. С., Полунина О. С., Прокофьева Т. В., и др. Гипергомоцистеинемия как фактор риска осложненного течения инфаркта миокарда на фоне хронической обструктивной болезни легких. Астраханский медицинский журнал. 2019; 14 (3): 79-87.
6. Григорьева Н. Ю., Майорова М. В., Королёва М. Е., Самолюк М. О. Особенности формирования и развития сердечно-сосудистых заболеваний у больных хронической обструктивной болезнью легких. Терапевтический архив. 2019; 91 (1): 43-47.
7. Чаулин А. М., Дупляков Д. В. Коморбидность хронической обструктивной болезни легких и сердечно-сосудистых заболеваний. Кардиоваскулярная терапия и профилактика. 2021; 20 (3): 2539.
8. Пашина Е. В., Золотавина М. Л. Комплекс биохимических показателей в оценке формирования стадий эндогенной интоксикации в клетке. Современные проблемы науки и образования. 2019; 6: 200.
9. Золотавина М. Л., Пашина Е. В. Современные методологические проблемы оценки эндогенной интоксикации. Наука и мир. 2014; 11 (15): 38-41.
10. Алексеева Я. В., Вышлов Е. В., Павлюкова Е. Н., Усов В. Ю., Марков В. А., Рябов В. В. Влияние разных фенотипов микрососудистого повреждения миокарда на сократительную функцию левого желудочка у пациентов с инфарктом миокарда с подъемом сегмента ST. Кардиология. 2021; 61 (5): 23-31.
11. Мустафина С. В., Винтер Д. А., Рымар О. Д., Щербакова Л. В., Гафаров В. В., и др. Фенотипы ожирения и риск развития инфаркта миокарда, по данным проспективного когортного исследования. Российский кардиологический журнал. 2019; (6): 109-114.
12. Thygesen K., Alpert J. S., Jaffe A. S., Chaitman B. R., Bax J. J., et al. Fourth Universal Definition of Myocardial Infarction (2018). Circulation. 2018; 138 (20): e618-e651. Erratum in: Circulation. 2018; 138 (20): e652. PMID: 30571511. doi: 10.1161/CIR.0000000000000617.
13. Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы. Клинические рекомендации. Министерство здравоохранения Российской Федерации, Общество специалистов по неотложной кардиологии. 2016.
14. Диагностика и лечение больных с острым коронарным синдромом без подъема сегмента ST электрокардиограммы. Клинические рекомендации. Министерство здравоохранения Российской Федерации, Общество специалистов по неотложной кардиологии. 2015.
15. Global Initiative for Chronic Obstructive Lung Disease. Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. 2020.
16. Шишкина Е. А., Хлынова О. В., Черемных А. Б. Прогнозирование постгоспитальной летальности у больных инфарктом миокарда молодого и среднего возраста. Доктор.Ру. 2020; 19 (5): 24–29.
17. Барбараш О. Л., Седых Д. Ю., Горбунова Е. В. Основные факторы, определяющие риск развития повторного инфаркта миокарда. Сердце : журнал для практикующих врачей. 2017; 16 (1): 10-50.
18. Митьковская Н. П., Пинчук А. Ф., Павлович Т. П., Статкевич Т. В., Балыш Е. М. Прогнозирование неблагоприятных исходов у пациентов с постинфарктным кардиосклерозом. Кардиология в Беларуси. 2015; 5 (42): 44-50.
19. Новикова Р. А., Алексейчик С. Е., Гончарик Т. А., Алексейчик Д. С., Санкович Е. В. Повторный инфаркт миокарда, причины его развития, трудности диагностики и профилактика. Экстренная медицина. 2017; 6 (2): 229-234.
20. Горбунова Н., Седых Д., Брюханова И., Крестова О., Ведерникова А. Повторный инфаркт миокарда: факторы риска и профилактика. Врач. 2017; 9: 84-86.
Об авторах
Т. В. ПрокофьеваРоссия
Татьяна Васильевна Прокофьева, к. м. н., доцент
педиатрический факультет
кафедра внутренних болезней
Астрахань
О. А. Башкина
Россия
Ольга Александровна Башкина, д. м. н., проф., ректор, заведующая кафедрой
кафедра факультетской педиатрии
Астрахань
О. С. Полунина
Россия
Ольга Сергеевна Полунина, д. м. н., проф., заведующая кафедрой
педиатрический факультет
кафедра внутренних болезней
Астрахань
И. В. Севостьянова
Россия
Ирина Викторовна Севостьянова, к. м. н., доцент
педиатрический факультет
кафедра внутренних болезней
Астрахань
Е. Л. Гриценко
Россия
Елена Леонидовна Гриценко, врач-анестезиолог-реаниматолог
отделение кардиологии № 2
Астрахань
Рецензия
Для цитирования:
Прокофьева Т.В., Башкина О.А., Полунина О.С., Севостьянова И.В., Гриценко Е.Л. Клинико-биохимические фенотипы при кардиореспираторной коморбидности. Медицинский вестник Юга России. 2023;14(2):67-75. https://doi.org/10.21886/2219-8075-2023-14-2-67-75
For citation:
Prokofyeva T.V., Bashkina O.A., Polunina O.S., Sevostyanova I.V., Gritsenko E.L. Clinical and biochemical phenotypes in cardiorespiratory comorbidity. Medical Herald of the South of Russia. 2023;14(2):67-75. (In Russ.) https://doi.org/10.21886/2219-8075-2023-14-2-67-75







































