Перейти к:
Микробиота влагалища и миоматозных узлов при миоме матки
https://doi.org/10.21886/2219-8075-2022-13-2-50-58
Аннотация
Цель: изучить микробиоту влагалища, миоматозных узлов, их ложа у пациенток с миомой.
Материалы и методы: проведено комплексное обследование 83 пациенток в возрасте от 26 до 50 лет с диагностированной интерстициальной, интерстициально-субсерозной миомой матки. По возрасту все женщины распределены на три группы. Были выполнены стандартные клинические и клинико-лабораторные исследования, кольпоскопия, микробиологическое исследование отделяемого заднего свода влагалища, биоптатов миоматозных узлов и их ложа, а также морфологическое исследование биоптатов миоматозных узлов и их ложа, полученных при оперативном лечении опухоли.
Результаты: в структуре клинических проявлений миомы матки ведущим являлся болевой синдром. Количество миоматозных узлов у пациенток варьировалось от 1 до 22. Продолжительность операции и объём кровопотери в группах значимо не различались (p>0,05). У пациенток II группы в отделяемом заднего свода влагалища выявлено снижение частоты обнаружения и количества лактобацилл по сравнению с I группой, а у женщин в III группе данные микроорганизмы отсутствовали. Среди анаэробных микроорганизмов в I и II группах доминировали Eubacterium spp., в III — Peptostreptococcus spp. У пациенток III группы значимо повышена (p<0,05) частота обнаружения Bacteroides spp. Среди аэробного спектра микроорганизмов во всех группах преобладали коагулазоотрицательные стафилококки. При бактериологическом исследовании биоптатов отсутствие роста микроорганизмов в миоматозных узлах наблюдали в 7,2% случаев, в ткани ложа миоматозных узлов — в 17,7%. Микробиота миоматозных узлов и их ложа в большинстве случаев была представлена анаэробными таксонами. По результатам морфологического исследования биоптатов, воспалительной реакции тканей не выявлено.
Выводы: У женщин с миомой матки различных возрастных групп выявлены разнонаправленные изменения в микробиоте влагалища. В большинстве случаев миоматозный узел (92,8%) и его ложе (82,3%) нестерильны с доминированием анаэробных таксонов микробиоты. Выявленные значимые корреляционные связи в локусах «влагалище – миоматозный узел – ложе миоматозного узла» свидетельствуют об их взаимосвязи. Обнаружение различных таксонов микроорганизмов в миоматозном узле и его ложе, по данным морфологических исследований, не сопряжены с наличием инфекционно-воспалительных процессов в тканях.
Ключевые слова
Для цитирования:
Никитина Е.С., Рымашевский А.Н., Набока Ю.Л., Рымашевский М.А., Гудима И.А., Свирава Э.Г. Микробиота влагалища и миоматозных узлов при миоме матки. Медицинский вестник Юга России. 2022;13(2):50-58. https://doi.org/10.21886/2219-8075-2022-13-2-50-58
For citation:
Nikitina E.S., Rymashevsky A.N., Naboka Y.L., Rymashevsky M.A., Gudima I.A., Svirava E.G. Microbiota of the vagina and myoma nodes in uterine myoma. Medical Herald of the South of Russia. 2022;13(2):50-58. (In Russ.) https://doi.org/10.21886/2219-8075-2022-13-2-50-58
Введение
Миома матки (ММ) во всех странах не теряет доминирующей позиции в структуре опухолей малого таза [1–9]. Этиология и патогенез данной патологии является не только предметом пристального изучения, но и широким полем для дискуссий. В ряде работ доказано значение половых гормонов, влияющих на рост миоматозных узлов (МУ) [10–19]. Причём роль эстрогенов и прогестерона в развитии ММ является практически равнозначной, однако наблюдается вариабельность как клинических симптомов, так и течения заболевания [10]. В частности, МУ у одной и той же пациентки нередко характеризуются различными темпами роста и/или регрессии при наличии общих эффектов половых гормонов [20]. Однако нельзя игнорировать роль ангиогенеза и васкуляризации, контролирующих рост опухолей [21]. Обсуждается также значение клеток предшественников, наличие которых может приводить к манифестации ММ, в частности верификация стволовых клеток (SSCs) в миометрии [22].
В настоящее время роль микробного фактора в развитии ММ практически не изучена. Единичные работы по данному вопросу [23] свидетельствуют о том, что инфекционно-воспалительные процессы органов малого таза и придатков матки могут являться в некоторых случаях триггерами развития данной патологии. При морфологическом исследовании препаратов матки, полученных от пациенток с подтверждённым диагнозом «эндометрит», верифицируются «зачатки» МУ, расположенные вокруг зоны воспаления. Методом ПЦР в биоптатах МУ были обнаружены ДНК хламидий, микоплазм или их сочетаний. Различные нарушения [24] микробиоценоза влагалища могут влиять на развитие ММ. Однако практически отсутствуют данные о микробиоте и/или микробиоме МУ. Можно предположить, что они имеют собственные, уникальные микробные паттерны, наличие которых не определяет развитие воспалительного процесса в матке.
Цель исследования — изучить микробиоту влагалища, миоматозных узлов, их ложа у пациенток с миомой.
Материалы и методы
Работа проведена на базе гинекологического отделения, клинико-диагностической лаборатории, морфологического отдела ЦНИЛ, кафедр акушерства и гинекологии № 1 и микробиологии и вирусологии № 1 ФГБОУ ВО РостГМУ Министерства здравоохранения Российской Федерации в период с 2016 по 2019 гг. Исследование одобрено на заседании локального независимого этического комитета (протокол № 19/16 от 04.10.2016 г.). Дизайн исследования включал комплексное обследование 83 женщин с диагностированной миомой матки в возрастном диапазоне от 26 до 50 лет (средний возраст — 36,6±0,8 лет).
Критерии включения — ММ, диагностированная по результатам бимануального и УЗИ-исследований; интерстициальная, интерстициально-субсерозная локализация МУ; размер МУ ≥ 5 см; наличие menses; письменное согласие пациентки на участие в исследовании.
Критерии исключения — приём гормональных (в течение 6 месяцев до исследования) и антибактериальных (в течение 1 месяца до исследования) препаратов, онкологические заболевания органов малого таза, отказ пациентки от участия в исследовании.
Пациентки были разделены по возрасту на три группы: I группа (n=19) — пациентки в возрасте 26–34 года, II группа (n=48) — 35–44 года, III группа (n=16) — 45–50 лет.
Офисная оценка пациенток включала стандартные клинические и клинико-лабораторные исследования, а также проведение простой и расширенной кольпоскопии.
Для проведения микробиологического исследования в соответствии с Методическими указаниями 4.2.2039-05 (2006) от каждой пациентки был произведен забор отделяемого заднего свода влагалища (ОЗСВ) за 24 ч. до операции, интраоперационно — биоптаты МУ и их ложа (лМУ). ОЗСВ забирали стерильным тампоном (Sterile Pure Viscose Swab w/Polypropylene Stick), помещали в среду (Hiculture Transport Swabs w/Alternative Thioglycollate Medium) и транспортировали в лабораторию (30–60 минут). Культуральное исследование проводили по соответствующей методике [25] с использованием питательных сред как для аэробных (MacConkey Agar, HiCrome Klebsiella Selective Agar Base, HiCrome Candida Differential Agar, HiCrome Enterococci Agar, HiCrome Aureus Agar Base, Blood Agar Base, Streptococcus Selection Agar), так и анаэробных (плотные питательные среды Bifidobacterium Agar, MRS Agar, Anaerobic Agar, Shaedler Agar, Bacteroides Bile Esculinum Agar, жидкие — Shaedler Broth и полужидкие питательные среды Блаурокка) таксонов микробиоты. Культивирование проводили в аэробных (t –37 ºC, 24–48 ч.) и анаэробных (AnaeroHiGas Pak, t –37ºC, 48–72 ч.) условиях. Идентификацию выделенных микроорганизмов проводили по общепринятым методикам.
Интраоперационно проводили забор биоптатов (0,5×0,5 см) МУ, лМУ в пробирки «Eppendorf» в которых находился тиогликолевый буфер (1 мл) и в течение не более 60 минут транспортировали в лабораторию. Затем исследуемый материал гомогенизировали (Becton Picrinson Mediamachine System). Бактериологическое исследование проводили на питательных средах для аэробных и анаэробных микроорганизмов, описанных выше в соответствующих условиях культивирования. Идентификацию микроорганизмов, выделенных из биоптатов, также проводили по общепринятым методикам.
Морфологическое исследование проводили традиционным методом с приготовлением парафиновых срезов исследуемого материала (МУ, лМУ) и окрашивали гематоксилином-эозином, пикрофуксином по Ван Гизону. Для микроскопического исследования препаратов использовали микроскоп «Micros» (Австрия) при 300-хкратном увеличении.
Статистический анализ результатов выполнен в среде статистической обработки и визуализации данных «R ver 3.2» (R Foundation for Statistical Computing», Вена, Австрия). Количественные характеристики микроорганизмов, верифицированных в различных локусах, представлены в виде Медиана, а также нижних и верхних квартилей (для сравнения применялся тест Краскала-Уоллиса). Критерии Пирсона с2 и Фишера использовали для сравнения достоверности различий. Коэффициент ранговой корреляции Спирмена использован для оценки тесноты взаимосвязей между определенными признаками.
Результаты
В структуре клинических проявлений ММ доминировал болевой синдром, который чаще (p<0,05) регистрировали у пациенток III группы (рис. 1). В этой же группе более, чем в 1/3 случаев, выявляли дизурические расстройства (p<0,05).
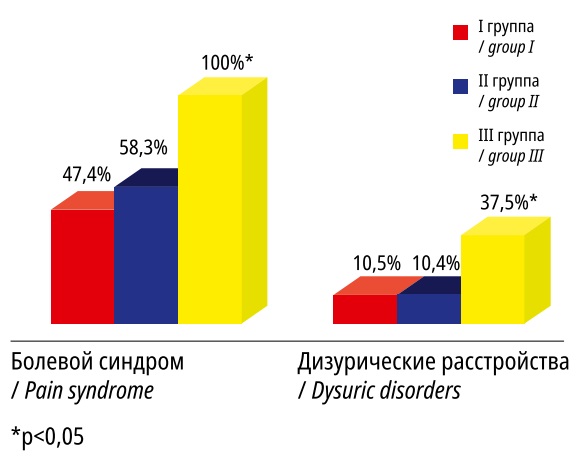
Рисунок 1. Значимые отличия в клинических проявлениях миомы матки у пациенток I–III групп
Figure 1. Significant differences in the clinical manifestations of uterine fibroids in patients of groups I–III.
Количество МУ у пациенток исследуемых групп колебалось от min 1 до max 22. Данный показатель в I группе в среднем составил 2,4±0,5, во II — 5,2±0,8, в III — 3,3±0,6. Множественная ММ была верифицирована в I группе у 42,1% пациенток, во II — 70,8%, в III — 81,3%. При одиночной миоме средний размер узла составил 10,9±0,7 см, при множественной — средний размер минимальных узлов 2,3±0,5 см, средний размер максимальных узлов — 9,7±0,7 см. Значимых отличий по времени продолжительности операций и объёму кровопотери в исследуемых группах не обнаружено (p>0,05).
У пациенток III группы при бактериологическом исследовании ОЗСВ основные симбионты данного биотопа (лактобациллы) отсутствовали. Во II группе частоты обнаружения (p<0,05) и количественные характеристики (p>0,05) данных микроорганизмов были ниже по сравнению с аналогичными показателями в I группе (табл. 1). Обращает внимание более узкий спектр микроорганизмов, верифицированных в ОЗСВ в III группе, с отсутствием не только лактобацилл, но и бифидобактерий, пептококков, дрожжеподобных грибов рода Candida.
В кластере анаэробных микроорганизмов в I и II группах доминировали Eubacterium spp., в III — Peptostreptococcus spp. У пациенток III группы значимо повышена (p<0,05) частота обнаружения Bacteroides spp. по сравнению с результатами, полученными в I и II группах. Среди аэробного компонента микробиоценоза влагалища во всех группах преобладали коагулазоотрицательные стафилококки (КОС) со 100,0% выделением в III группе. В данной группе достоверно чаще (p<0,05) верифицировали Streptococcus spp. (81,3%) по сравнению с аналогичными показателями в I и II группах (42,1% и 50,0% соответственно). Дрожжеподобные грибы рода Candida отсутствовали во влагалищном биотопе в 3-ей группе, но их частота обнаружения была достоверно (p<0,05) выше в I группе. E.coli регистрировали только у пациенток II группы. Наиболее стабильными ассоциантами влагалищного биотопа у пациенток исследуемых групп были Eubacterium spp., Peptostreptococcus spp. и КОС.
При анализе количественных показателей обращает на себя внимание следующее обстоятельство: у пациенток II группы было значимо повышено (p<0,05) среднее значение (Медиана) для Peptostreptococcus spp., Bacteroides spp., Candida spp., а в III — снижено (p<0,05) Corynebacterium spp. по сравнению с аналогичными показателями в других группах.
Таблица / Table 1
Микробный спектр влагалища при миоме матки у пациенток I–III групп
Microbial spectrum of the vagina with uterine myoma in patients of groups I–III
|
Микроорганизмы Microorganisms |
I группа I group |
II группа II group |
III группа III group |
|||
|
Частота обнаружения Detection frequency (%) |
Концентрация Concentration (lg КОЕ/т) |
Частота обнаружения Detection frequency (%) |
Концентрация Concentration (lg КОЕ/т) |
Частота обнаружения Detection frequency (%) |
Концентрация Concentration (lg КОЕ/т) |
|
|
Lactobacillus spp. |
42,1* |
3,4 [ 3; 6] |
16,7 |
2,5 [ 2; 3] |
0 |
0 |
|
Eubacterium spp. |
94,7 |
6,2 [ 5; 8] |
91,7 |
5,8 [ 3; 8] |
25,0* |
5,7 [ 3; 8] |
|
Peptostreptococcus spp. |
84,2 |
3,9 [ 2; 7] |
66,7* |
5,1* [ 3; 7] |
75,0 |
4,2 [ 2; 8] |
|
Peptococcus spp. |
57,9* |
5,3 [ 3;7,5] |
20,8 |
4,8 [ 3; 6] |
0 |
0 |
|
Propionibacterium spp. |
42,1* |
4,1 [ 2; 6] |
29,2 |
4,8 [ 2,5;6] |
31,3 |
5,2* [ 3; 7] |
|
Bacteroides spp. |
15,8 |
3,0 [ 2; 4] |
4,2 |
6,0* [ 4; 7] |
56,3* |
3,0 [ 2; 4] |
|
Bifidobacterium spp. |
10,5 |
2,5 [ 2; 3] |
20,8* |
2,0 [ 2;3,5] |
0 |
0 |
|
КОС |
73,7 |
3,3 [ 2; 6] |
70,8 |
2,8 [ 2; 4] |
100,0* |
2,9 [ 2; 5] |
|
Streptococcus spp. |
42,1 |
2,1 [ 2; 3] |
50,0 |
3,5 [ 2; 6] |
81,3* |
4,0 [ 3; 5] |
|
Corynebacterium spp. |
36,8 |
4,0 [ 3; 5] |
45,8 |
3,4 [ 2,5;6,5] |
31,3* |
2,4* [ 2; 4] |
|
Candida spp. |
26,3* |
5,2 [ 3,5;7] |
4,2 |
7,0* [ 6; 8] |
0 |
0 |
|
E.сoli |
0 |
0 |
20,8 |
3,8 [ 2; 6] |
0 |
0 |
Примечание: *p<0,05 — достоверное отличие между группами, в таблице средние значения представлены в виде Медиана [Нижний квартиль; Верхний квартиль]; сравнение осуществлялось с помощью теста Краскала-Уоллиса.
Note: *p<0.05 — significant difference between groups, mean values are presented in the table as Median [Lower quartile; Upper quartile]; the comparison was carried out using the Kruskal-Wallis test.
При бактериологическом исследовании МУ (размер ≥5 см) пациенток трёх групп отсутствие роста микроорганизмов наблюдали в 7,2% случаев, что, на наш взгляд, связано не со стерильностью данных локусов, а с отсутствием технических возможностей культивирования. Микроорганизмы из МУ выделяли в моновариантах (20,8%), а также в составе бактериальных ассоциаций — 2-х (57,1%) и 3-х (22,1%) компонентных.
Необходимо отметить, что микробиота МУ в подавляющем большинстве случаев была представлена анаэробными таксонами (рис. 2). Исключение составили E.coli, которые регистрировали как в МУ, так и в ОЗСВ у пациенток II группы. В I группе в исследуемом локусе доминировали Peptococcus spp. (68,4%), во II — Peptococcus spp. и Peptostreptococcus spp. (45,8% и 41,7% соответственно), в III — Bacteroides spp. (56,3%). Propionibacterium spp. отсутствовали в МУ у пациенток III группы, но их регистрировали в ОЗСВ (31,3%). Veillonella spp. отсутствовали в ОЗСВ в исследуемых группах, но их выделяли из МУ в I и II группах.
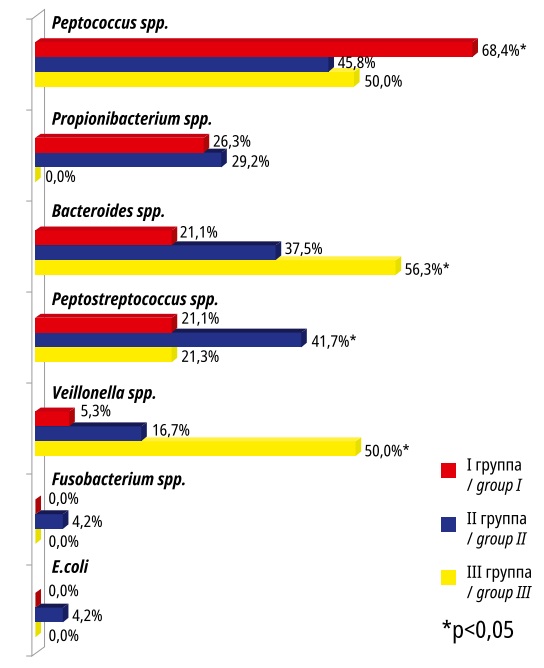
Рисунок 2. Микробные паттерны миоматозных узлов в исследуемых группах
Figure 2. Microbial patterns of myomatous nodes in the studied groups
Количественные характеристики обсемененности МУ (Медиана) достоверно (p>0,05) не различались в исследуемых группах со средним показателем (lg 2,0±0,5 КОЕ/биоптат) и интерквартильным значением от 2,0 [нижний квартиль] до 3,0 [верхний квартиль].
При бактериологическом исследовании лМУ отсутствие роста микроорганизмов регистрировали в 17,7%, моноварианты — в 26,6%, 2-хкомпонентные бактериальные ассоциации — в 43,0%, 3-х- и более компонентные — в 12,7%. Таксономическая характеристика микроорганизмов, выделенных из лМУ была аналогична таковой для МУ, но с некоторыми вариациями частот обнаружения определенных таксонов микроорганизмов (рис. 3).
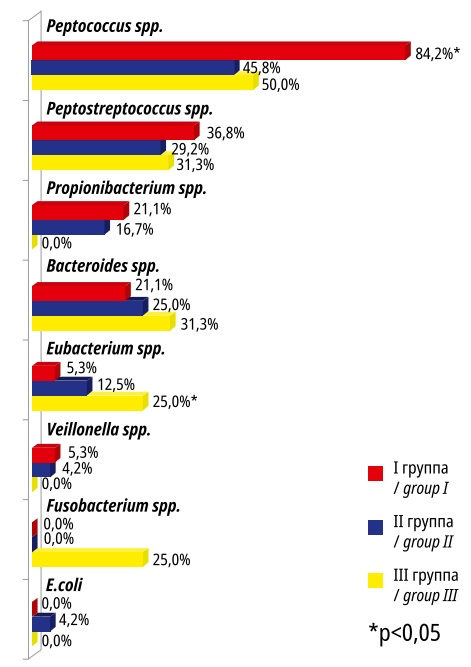
Рисунок 3. Микробиота ложа миоматозных узлов в исследуемых группах
Figure 3. Microbiota of the bed of myomatous nodes in the studied groups
В лМУ в исследуемых группах доминировали Peptococcus spp. В III группе была значимо (p<0,05) повышена частота обнаружения Eubacterium spp. по сравнению с аналогичными показателями в I и II группах и отсутствовали Propionibacterium spp. и Veillonella spp. E.coli аналогично МУ регистрировали только во II группе.
Обсемененность лМУ (Медиана) в исследуемых группах достоверно не отличалась (p>0,05), составив lg 2,4±0,6 КОЕ/биоптат.
Были изучены корреляционные связи (КС) между микроорганизмами, верифицированными в локусах «влагалище – миоматозный узел», «влагалище – ложе миоматозного узла», значимые представлены в табл. 2. Полученные КС в большинстве случаев были прямыми и только в III группе для Eubacterium spp. и Peptostreptococcus spp. — обратными, что косвенно свидетельствует о взаимосвязи исследуемых локусов. Но возникает вопрос — является ли факт обнаружения микроорганизмов в МУ и его ложе сопряженным с инфекционно-воспалительным процессом в тканях? Для ответа на этот вопрос было проведено морфологическое исследование биоптатов, которое доказало отсутствие воспалительной реакции тканей (рис. 4, рис. 5).
Таблица/ Table 2
Корреляционные связи в биотопах «влагалище – миоматозный узел», «влагалище – ложе миоматозного узла»
Correlations in biotopes "vagina – myomatous node", "vagina – bed of myomatous node"
|
Микроорганизмы Microorganisms |
I группа I group |
II группа II group |
III группа III group |
||||||||||
|
r1 |
p1 |
r2 |
p2 |
r1 |
p1 |
r2 |
p2 |
r1 |
p1 |
r2 |
p2 |
||
|
E.coli |
- |
- |
- |
- |
0,79 |
<0,001 |
0,79 |
<0,001 |
- |
- |
- |
- |
|
|
Eubacterium spp. |
- |
- |
0,86 |
<0,001 |
0,66 |
<0,001 |
0,57 |
<0,001 |
-0,34 |
>0,05 |
0,05 |
>0,05 |
|
|
Peptostreptococcus spp. |
0,63 |
<0,01 |
0,59 |
<0,01 |
0,4 |
<0,01 |
0,46 |
<0,001 |
-0,07 |
>0,05 |
-0,07 |
>0,05 |
|
|
Peptococcus spp. |
0,69 |
<0,01 |
0,49 |
<0,05 |
0,28 |
>0,05 |
0,39 |
<0,01 |
- |
- |
- |
- |
|
|
Propionibacterium spp. |
0,8 |
<0,001 |
0,62 |
<0,01 |
0,24 |
>0,05 |
0,38 |
<0,01 |
- |
- |
- |
- |
|
|
Bacteroides spp. |
0,88 |
<0,001 |
0,41 |
>0,05 |
0,54 |
<0,001 |
0,78 |
<0,001 |
0,3 |
>0,05 |
0,71 |
<0,01 |
|
Note: r1, p1 - indicators for the locus "vagina - myomatous node", r2, p2 - indicators for the locus "vagina - bed of the myomatous node"
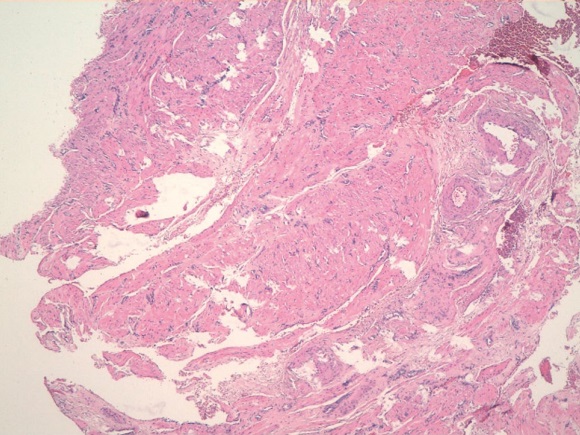
Рисунок 4. Миоматозный узел. Клеточная лейомиома. Опухоль представлена пучками разнонаправленно идущих гладкомышечных волокон. Окраска гематоксилином-эозином. Ув.100
Figure 4. Myomatous node. Cellular leiomyoma. The tumor is represented by bundles of multidirectional smooth muscle fibers. Stained with hematoxylin-eosin. Magnification 100
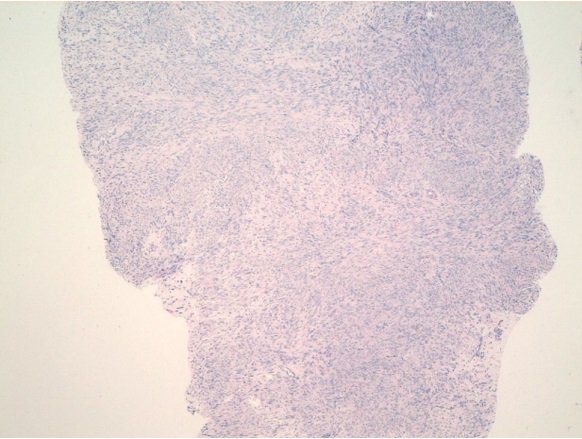
Рисунок 5. Ложе узла. Пласты мышечных волокон, расположенных в циркулярном и косом направлении. Между мышечной тканью грубоволокнистая соединительная ткань, крупные толстостенные артерии. Окраска гематоксилином-эозином. Ув.100
Figure 5. Knot bed. Layers of muscle fibers located in the circular and oblique direction. Between the muscle tissue coarse fibrous connective tissue, large thick-walled arteries. Stained with hematoxylin-eosin. Magnification 100
Необходимо отметить, что у пациенток I, II и III групп в послеоперационном периоде инфекционно-воспалительные осложнения отсутствовали.
Обсуждение
У пациенток исследуемых групп были получены разнонаправленные данные по частотам обнаружения различных таксонов микробиоты влагалища, в частности лактобацилл. Данные микроорганизмы отсутствовали у пациенток III группы, которые были в возрастном диапазоне 45–50 лет, то есть в пременопаузе, но у которых в кластере анаэробных микроорганизмов доминировали Bacteroides spp., что корреспондирует с данными Muhleisen A., Herbst-Kralovetz M. (2016) [26]. Несмотря на то, что лактобациллы, в подавляющем большинстве случаев, доминируют во влагалищном биотопе и выполняют ряд позитивных функций [27][28], у пациенток с ММ I и II групп частоты их обнаружения были снижены. Вагинальная микробиота очень пластична и любое патологическое состояние, в частности ММ, меняет композиции микробных сообществ у женщин различных возрастных групп.
На сегодняшний день имеются данные о микробиоте и/или микробиоме матки, плаценты, маточных труб, яичников [29–31]. Описаны таксоны бактерий, которые превалируют при различных типах влагалищной микробиоты [27][28]. Однако практически не изученным остается вопрос о микробиоте миоматозных узлов. Проведённое исследование лишь приоткрывает завесу над этим интригующим и интересным вопросом, ибо полученные данные свидетельствуют о нестерильности миоматозных узлов и их ложа, а также отсутствии признаков инфекционно-воспалительного процесса в данной когорте обследуемых. Но ведь сценарий развития инфекционно-воспалительных осложнений может развернуться по другому вектору, когда нормальные симбионты влагалищного биотопа, МУ, лМУ могут при определенных условиях состояться как манифестанты инфекционно-воспалительных осложнений.
Дальнейшие исследования должны быть направлены на расширение когорты обследуемых различных возрастов с миомой матки, включая беременных с данной патологией. Вычленением пациенток, если таковые будут, с различными инфекционно-воспалительными осложнениями в послеоперационном периоде и проведением всестороннего сравнительного анализа микробиоты изучаемых локусов в группах с отсутствием осложнений и наличием оных.
Выводы
- У женщин с ММ различных возрастных групп выявлены разнонаправленные изменения в микробиоте влагалища.
- В большинстве случаев МУ (92,8%) и его ложе (82,3%) не стерильны с доминированием анаэробных таксонов микробиоты. Выявленные значимые корреляционные связи в локусах «влагалище – миоматозный узел – ложе миоматозного узла» свидетельствуют об их взаимосвязи.
- Обнаружение различных таксонов микроорганизмов в МУ и его ложе, по данным морфологических исследований, не сопряжены с наличием инфекционно-воспалительных процессов в тканях.
Список литературы
1. Goldenberg RL, Klebanoff MA, Nugent R, Krohn MA, Hillier S, Andrews ww. Bacterial colonization of the vagina during pregnancy in four ethnic groups. Vaginal Infections and Prematurity Study Group. Am J Obstet Gynecol. 1996;174(5):1618-21. Doi: 10.1016/s0002-9378(96)70617-8.
2. Бебнева Т.Н., Летуновская А.Б. Лактобактерии и эстриол в коррекции биоценоза влагалища. Фарматека. 2010;(9):24–28. eLIBRARY ID: 15192731
3. Климанов А.Ю. Особенности органосохраняющего хирургического лечения миомы матки лапароскопическим доступом у женщин репродуктивного возраста: автореф. дис. … канд. мед. наук. Самара. 2012. – 24 с.
4. Gajer P, Brotman RM, Bai G, Sakamoto j, Schütte UM, et al. Temporal dynamics of the human vaginal microbiota. Sci Transl Med. 2012;4(132):132ra52. DOI: 10.1126/scitranslmed.3003605.
5. Hickey Rj, Zhou x, Pierson jD, Ravel j, Forney Lj. Understanding vaginal microbiome complexity from an ecological perspective. Transl Res. 2012;160(4):267-82. DOI: 10.1016/j.trsl.2012.02.008.
6. Доброхотова Ю.э., Ибрагимова Д.М., Сапрыкина Л.В. Миома матки. М.: ГэОТАР-Медиа, 2018.
7. Доброхотова Ю.э., Ильина И.Ю., Ибрагимова Д.М., Нариманова М.Р. Миома матки: альтернативные методы лечения. Проблемы репродукции. 2018; 24; 2:83-87. DOI: 10.17116/repro201824283-87
8. Yu O, Scholes D, Schulze-Rath R, Grafton j, Hansen K, Reed SD. A US population-based study of uterine fibroid diagnosis incidence, trends, and prevalence: 2005 through 2014. Am J Obstet Gynecol. 2018;219(6):591.e1-591.e8. DOI: 10.1016/j.ajog.2018.09.039.
9. Алтухова О.Б., Радзинский В.Е., Полякова И.С., Чурносов М.И. Роль генов факторов роста в развитии миомы матки в сочетании с гиперплазией эндометрия. Акушерство и гинекология. 2021;4:104-110. DOI: 10.18565/aig.2021.4.104-110
10. Mäkinen N, Heinonen HR, Moore S, Tomlinson IP, van der Spuy ZM, Aaltonen LA. MED12 exon 2 mutations are common in uterine leiomyomas from South African patients. Oncotarget. 2011;2(12):966-9. DOI: 10.18632/oncotarget.370.
11. Самсонов А.Е., Рымашевский А.Н., Волков А.Е., Терехина Л.А. Особенности влияния миомы матки на течение беременности. Таврический медикобиологический вестник. 2013;16:2(1):205-207. eLIBRARY ID:22807263
12. Радзинский В.Е., Тотчиев Г.Ф. Миома матки: курс на органосохранение. Информационный бюллетень. М.: Редакция журнала StatusPraesens; 2014.
13. Biglia N, Carinelli S, Maiorana A, D'Alonzo M, Lo Monte G, Marci R. Ulipristal acetate: a novel pharmacological approach for the treatment of uterine fibroids. Drug Des Devel Ther. 2014;8:285-92. DOI: 10.2147/DDDT.S54565.
14. Киселев В.И., Радзинский В.Е., Шалаев О.Н., Есенеева Ф.М., Полозников А.А., и др. Особенности ДНКметилирования при миоме матки. Молекулярная медицина. 2017;15(3):45-50. eLIBRARY ID:29328837
15. Mas A, Tarazona M, Dasí Carrasco j, Estaca G, Cristóbal I, Monleón j. Updated approaches for management of uterine fibroids. Int J Womens Health. 2017;9:607-617. DOI: 10.2147/IjwH.S138982.
16. Боричева Д.А., Мацарская М.Д., Шеповалова Н.С. Миома матки как следствие гормонального дисбаланса. Синергия Наук. 2018;20:650-663. eLIBRARY ID:32484393
17. Воскресенский С.Л., Грудницкая Е.Н., Тесакова М.Л., Небышинец Л.М., Шорох И.Г., Куницкая О.А. Клинические и гормональные изменения при миоме матки в репродуктивном возрасте. Репродуктивное здоровье Восточная Европа. 2018;8(2):155-162. eLIBRARY ID:32792719
18. Алтухова О.Б., Радзинский В.Е., Полякова И.С., Чурносов М.И. Вовлеченность полиморфизма генов рецепторов эстрогенов и прогестерона в развитие миомы матки. Акушерство и гинекология. 2020;3:127-132. DOI: 10.18565/aig.2020.3.127-132
19. Ярмолинская М.И., Поленов Н.И., Куница В.В. Миома матки — роль сигнальных путей в патогенезе заболевания (обзор литературы). Журнал акушерства и женских болезней. 2020;69(5):113-124. DOI: 10.17816/jOwD695113-124
20. Reis FM, Bloise E, Ortiga-Carvalho TM. Hormones and pathogenesis of uterine fibroids. Best Pract Res Clin Obstet Gynaecol. 2016;34:13-24. DOI: 10.1016/j.bpobgyn.2015.11.015.
21. Faerstein E, Szklo M, Rosenshein NB. Risk factors for uterine leiomyoma: a practice-based case-control study. II. Atherogenic risk factors and potential sources of uterine irritation. Am J Epidemiol. 2001;153(1):11-9. DOI: 10.1093/aje/153.1.11.
22. Sośnik H, jeleń M, Kosiński M, Sośnik K. Research on genesis of adipocytic metaplasia in uterine fibroids. Pol J Pathol. 2015;66(4):403-9. DOI: 10.5114/pjp.2015.57254.
23. Тихомиров А.Л., Гришин Г.П., Лубнин Д.М., Зинин Д.С., Кочарян А.А. Современное органосохраняющее лечение миомы матки. Consilium medicum. 2013;10(6):19–23. eLIBRARY ID: 20267593
24. Табарина Е.П., Потатуркина-Нестерова Н.И. Ассоциация миомы матки с инфицированностью уреаплазмами. Казанский медицинский журнал. 2009; 90(3):408-411. eLIBRARY ID: 12906435
25. Меньшиков В.В. Методики клинических лабораторных исследований: Справочное пособие. Т. 3. М.: Лабора; 2009.
26. Muhleisen AL, Herbst-Kralovetz MM. Menopause and the vaginal microbiome. Maturitas. 2016;91:42-50. DOI: 10.1016/j.maturitas.2016.05.015.
27. Kroon Sj, Ravel j, Huston wM. Cervicovaginal microbiota, women's health, and reproductive outcomes. Fertil Steril. 2018;110(3):327-336. DOI: 10.1016/j.fertnstert.2018.06.036.
28. Peelen Mj, Luef BM, Lamont RF, de Milliano I, jensen jS, et al. The influence of the vaginal microbiota on preterm birth: A systematic review and recommendations for a minimum dataset for future research. Placenta. 2019;79:30-39. DOI: 10.1016/j.placenta.2019.03.011.
29. Godha K, Tucker KM, Biehl C, Archer DF, Mirkin S. Human vaginal pH and microbiota: an update. Gynecol Endocrinol. 2018;34(6):451-455. DOI: 10.1080/09513590.2017.1407753.
30. Peric A, weiss j, Vulliemoz N, Baud D, Stojanov M. Bacterial Colonization of the Female Upper Genital Tract. Int J Mol Sci. 2019;20(14):3405. DOI: 10.3390/ijms20143405.
31. Калинкина О.Б., Тезиков Ю.В., Липатов И.С., Аравина О.Р., Морозова О.Н. Исследование микробиоты урогенитального тракта и кишечника у женщин с III-IV стадиями эндометриоза яичников. Пермский медицинский журнал. 2020;37(1):14-21. DOI: 10.17816/pmj37114-21
Об авторах
Е. С. НикитинаРоссия
Никитина Екатерина Сергеевна, к.м.н., ассистент кафедры акушерства и гинекологии №1
Ростов-на-Дону
А. Н. Рымашевский
Россия
Рымашевский Александр Николаевич, д.м.н., проф., заведующий кафедрой акушерства и гинекологии №1
Ростов-на-Дону
Ю. Л. Набока
Россия
Набока Юлия Лазаревна, д.м.н., проф., заведующая кафедрой микробиологии и вирусологии №1
Ростов-на-Дону
М. А. Рымашевский
Россия
Рымашевский Михаил Александрович, к.м.н., ассистент кафедры акушерства и гинекологии №1
Ростов-на-Дону
И. А. Гудима
Россия
Гудима Ирина Александровна, д.м.н., доц., профессор кафедры микробиологии и вирусологии №1
Ростов-на-Дону
Э. Г. Свирава
Россия
Свирава Этери Гонериевна, к. м. н., ассистент кафедры микробиологии и вирусологии №1
Ростов-на-Дону
Рецензия
Для цитирования:
Никитина Е.С., Рымашевский А.Н., Набока Ю.Л., Рымашевский М.А., Гудима И.А., Свирава Э.Г. Микробиота влагалища и миоматозных узлов при миоме матки. Медицинский вестник Юга России. 2022;13(2):50-58. https://doi.org/10.21886/2219-8075-2022-13-2-50-58
For citation:
Nikitina E.S., Rymashevsky A.N., Naboka Y.L., Rymashevsky M.A., Gudima I.A., Svirava E.G. Microbiota of the vagina and myoma nodes in uterine myoma. Medical Herald of the South of Russia. 2022;13(2):50-58. (In Russ.) https://doi.org/10.21886/2219-8075-2022-13-2-50-58







































