Перейти к:
Предикция поражения центральной нервной системы в неонатальном периоде у недоношенных новорожденных детей
https://doi.org/10.21886/2219-8075-2022-13-2-122-133
Аннотация
Цель: разработать систему прогнозирования вероятности развития поражения центральной нервной системы (ЦНС) в неонатальном периоде у детей, рождённых недоношенными.
Материалы и методы: основная группа – недоношенные новорождённые дети с гестационным возрастом (ГВ) 36 недель и менее включительно (n = 60), контрольная группа – доношенные новорожденные дети (n = 35). В процессе наблюдения основная группа разделена на подгруппы в зависимости от диагностированного в неонатальном периоде по данным нейросонографии поражения центральной нервной системы (ЦНС) (внутрижелудочковые кровоизлияния (ВжК), перивентрикулярная лейкомаляция (ПВЛ): I подгруппа (недоношенные с поражением ЦНС) – 25 человек, II подгруппа (недоношенные без поражения ЦНС) – 35 человек. Оценивали клинико-анамнестические, лабораторно-инструментальные показатели детей при рождении и в динамике, показатели антиоксидантной защиты (содержание марганецсодержащей супероксиддисмутазы (Mn-СОД), медь, цинк-содержащей супероксиддисмутазы (Cu,Zn-СОД), глутатиона в восстановленном (GSH), окисленном (GSSG) состояниях, общую антиоксидантную способность крови (TAS/ TAC), окислительный стресс (TOS/TOC), 4 полиморфизма гена Mn-СОД.
Результаты: разработаны две прогностические модели, позволяющие определять вероятность развития ВжК и ПВЛ в неонатальном периоде у недоношенных новорождённых детей. Модели включают ГВ, оценку по шкале Апгар на 1-й и 5-й минутах жизни, наличие синдрома дыхательной недостаточности при рождении, проведение инвазивной искусственной вентиляции лёгких в неонатальном периоде, наличие внутриутробной инфекции в периоде новорождённости и показатели антиоксидантной защиты (GSH, TAS/TAC; модель 2).
Заключение: комплексная оценка клинико-анамнестических данных недоношенных новорождённых детей при рождении, а также определение показателей, учитывающих уровень антиоксидантной защиты, позволит идентифицировать недоношенного ребенка группы риска по органическому поражению ЦНС, скорректировать терапевтическую тактику ведения в неонатальном периоде.
Ключевые слова
Для цитирования:
Павлинова Е.Б., Губич А.А., Савченко О.А. Предикция поражения центральной нервной системы в неонатальном периоде у недоношенных новорожденных детей. Медицинский вестник Юга России. 2022;13(2):122-133. https://doi.org/10.21886/2219-8075-2022-13-2-122-133
For citation:
Pavlinova E.B., Gubich A.A., Savchenko O.A. Prediction injury of the central nervous system in the neonatal period in preterm newborns. Medical Herald of the South of Russia. 2022;13(2):122-133. (In Russ.) https://doi.org/10.21886/2219-8075-2022-13-2-122-133
Введение
На сегодняшний день достигнуты большие успехи в выхаживании недоношенных новорождённых детей. Оттачиваются до автоматизма методики оказания реанимационной помощи при рождении, улучшаются методы выхаживания в отделениях реанимации и интенсивной терапии (ОРИТ), отделениях недоношенных новорождённых детей. Совершенствуются терапевтические стратегии в отношении респираторного дистресс-синдрома (РДСН), бронхолёгочной дисплазии (БЛД), ретинопатии недоношенных (РН), некротизирующего энтероколита (НЭК) — заболеваний, преимущественно связанных с недоношенностью. Однако стоит отметить, что, несмотря на накопленный опыт, остаётся не до конца решённой проблема предупреждения или минимизации органического повреждения головного мозга.
Внутрижелудочковые кровоизлияния (ВЖК) — это группа внутричерепных кровоизлияний различной этиологии, возникающих в субэпендимарной таламокаудальной зоне с возможным распространением в желудочки и паренхиму головного мозга1.
Перивентрикулярная лейкомаляция (ПВЛ) представляет собой некроз и/или глиоз белого мозгового вещества, обусловленный перинатальными причинами и локализующийся преимущественно в областях, прилегающих дорзально и латерально по отношению к наружным краям боковых желудочков, при незначительном поражении более отдаленных от этих очагов участков белого вещества [1].
Данные состояния по большей части характерны для недоношенных новорождённых в силу имеющихся анатомо-физиологических особенностей, к которым можно отнести наличие герминального матрикса, особенности кровоснабжения в перивентрикулярной области (терминальный тип кровоснабжения), особенности венозного оттока и процессов ауторегуляции в головном мозге, действие свободных радикалов, факторов неспецифического воспаления на клетки мозга и другое1 [1–8]. Несостоятельность церебрального кровотока больного новорождённого, возникающая вследствие ряда причин, недостаточное обеспечение ткани мозга кислородом могут привести как к гипоксическим, так и к геморрагическим структурным изменениям головного мозга. Нередко при проведении нейросонографии (НСГ) можно обнаружить, что у одного и того же ребенка одновременно имеется как ВЖК, так и ПВЛ. Также стоит отметить, что, несмотря на наличие анатомо-физиологических предпосылок, не у всех недоношенных детей в итоге развиваются ВЖК или ПВЛ. Можно предположить, что существуют определенные факторы риска, индивидуальные особенности, которые в ряде случаев могут способствовать повреждению ткани мозга. Наряду с факторами риска можно говорить о наличии протективных особенностей у конкретного недоношенного новорождённого, препятствующих реализации структурных изменений головного мозга.
В неонатальной практике не существует стандартного способа прогнозирования развития тяжёлого органического поражения центральной нервной системы (ЦНС) у недоношенных новорождённых. Имеются сведения о роли инфекционного процесса в реализации ВЖК и ПВЛ, если таковой имелся во время беременности у матери или у ребенка [9–14]. Часть исследований посвящена оценке особенностей соматического статуса беременной, течению настоящей беременности [15][16], реанимационным мероприятиям и стабилизации состояния ребенка после рождения, клинической симптоматике и значимости этих факторов в развитии ВЖК и ПВЛ [17–19]. Актуальным направлением является поиск ранних предикторов органического поражения ЦНС из перечня лабораторно-инструментальных показателей, различных нейрохимических маркеров [20–22]. Поиск прогностических показателей, с помощью которых возможно будет определить вероятность развития ВЖК и ПВЛ у недоношенных детей, принципиально важен, поскольку это может способствовать новым подходам к дальнейшему снижению частоты неблагоприятных неврологических исходов за счёт ранней коррекции проводимого лечения.
Цель исследования — разработать систему прогнозирования вероятности развития поражения ЦНС в неонатальном периоде у детей, рождённых недоношенными, для совершенствования медицинской помощи новорождённым.
Материалы и методы
Проведено клиническое обсервационное (наблюдательное), аналитическое, комбинированное исследование, так как часть исследования проведена по типу продольного, а часть — по типу «случай-контроль». Исследование было одобрено этическим комитетом Омского государственного медицинского университета, проведено в соответствие с международными стандартами Guideline for Good Clinical Practice (GCP).
В исследование вошли 95 новорожденных детей, получивших лечение на первом и втором этапе выхаживания в БУЗОО «Клинический родильный дом №1» (г. Омск) и БУЗОО «Областная детская клиническая больница» (г. Омск) в период с ноября 2019 г. по ноябрь 2020 г. Основную группу составили недоношенные новорождённые с гестационным возрастом (ГВ) менее 36 недель включительно (n=60), которые соответствовали следующим критериям включения: а) ГВ до 36 недель (включительно); б) наличие информированного добровольного согласия законных представителей ребёнка на участие в исследовании. Критериями исключения являлись следующие: а) врождённые пороки развития ЦНС; б) наличие наследственных заболеваний; в) отсутствие информированного добровольного согласия законных представителей ребёнка на участие в исследовании. В процессе регулярного наблюдения за детьми основной группы в условиях стационара группа была разделена на две подгруппы в зависимости от наличия или отсутствия структурных изменений головного мозга (ВЖК, ПВЛ) по данным НСГ (I подгруппа и II подгруппа соответственно).
Контрольная группа, включавшая доношенных новорождённых (n=35), была набрана с целью контроля специфических биохимических и генетических показателей антиоксидантной системы. Критерии включения детей в контрольную группу: а) ГВ более 37 недель (включительно); б) условно-здоровые доношенные новорождённые, не имеющие в неонатальном периоде органического поражения ЦНС, врождённых пороков развития ЦНС, по данным методов нейровизуализации; в) наличие информированного добровольного согласия законных представителей ребёнка на участие в исследовании. Критерии исключения: а) наличие органического поражения ЦНС, врождённых пороков развития ЦНС, по данным методов нейровизуализации; б) наличие наследственных заболеваний; в) отсутствие информированного добровольного согласия законных представителей ребёнка на участие в исследовании.
В ходе исследования оценивали состояние недоношенных новорождённых после рождения, согласно оценке по шкале Апгар, ведущие синдромы при рождении, объём реанимационных мероприятий при рождении. Динамически отслеживали состояние ребенка после его перевода из родильного зала в отделения недоношенных новорождённых или в ОРИТ, а также, требовалась ли в дальнейшем респираторная поддержка.
Лабораторная часть исследования включала оценку следующих показателей: общего антиоксидантного статуса/антиоксидантной способности плазмы крови и общего оксидативного статуса/оксидативного стресса по образцам плазмы крови с помощью наборов реагентов «ImAnOx (TAS/TAC) Kit» (Immundiagnostik, Германия) и «PerOx (TOS/TOC) Kit» (Immundiagnostik, Германия) соответственно, содержание в крови меди, цинк-содержащей супероксиддисмутазы (Cu,Zn-СОД; набор реагентов Human Cu/ZnSOD, Elisa Kit, eBioscience, США), супероксиддисмутазы, содержащей марганец (митохондриальная, манганинсупероксиддисмутаза, Mn-СОД, SOD2; набор реагентов Human Superoxide Dismutase 2, ELISA, AbFrontier, Корея) и глутатиона в восстановленном (GSH) и окисленном (GSSG) состояниях (Glutation Assay Kit, Cayman Chemical, США). В ходе исследования определяли полиморфизм 4-х генов: гена SOD2 rs4880 (47С>Т, Ala16Val), гена SOD2 rs1141718 (58T>C, Thr58Ile), гена SOD2 rs11575993 (60С>Т, Leu60Phe), гена GCLC rs17883901 (-129С>Т). Взятие образцов крови проводилось из периферической вены в объёме 2 мл однократно в раннем неонатальном периоде (первые 7 дней жизни ребенка) до манифестации структурных изменений головного мозга, по данным НСГ.
Статистический анализ полученных данных проводился с помощью программ Statistica (версия 6.1), IBM SPSS Statistics 24. Установление типа распределения полученных данных (нормальное или отличное от нормального) осуществлялось с помощью построения гистограмм и с использованием критерия Шапиро-Уилка. Распределение всех количественных признаков в исследовании было отличным от нормального, следовательно, количественные данные в последующем были представлены в виде Me [QL; QU], где Ме — медиана, QL — нижний квартиль, QU — верхний квартиль. Проверка статистических гипотез проводилась с помощью U-критерия Манна-Уитни (при сравнении двух независимых переменных), Н-критерия Краскела-Уоллиса (при сравнении трёх и более независимых переменных). Для сравнения групп по качественным признакам применялся точный критерий Фишера; данные представлялись в виде абсолютных чисел с указанием долей (%) и с расчётом относительного риска (ОР) и 95% доверительного интервала (ДИ), границы которого представлялись в виде верхнего и нижнего квартилей. Для определения направления и силы связи между явлениями применялся коэффициент корреляции Спирмена. При статистических расчётах критический уровень ошибки р принимался равным 0,05; также с учётом поправки Бонферрони применялся скорректированный уровень статистической значимости р<0,017 с учётом проведённых трёх попарных сравнений. Для построения математических моделей, позволяющих вычислять вероятность поражения ЦНС у недоношенных детей в неонатальном периоде был использован метод логистического регрессионного анализа в программе NCSS2021 с дальнейшим проведением ROC-анализа, с исследованием площади под ROC-кривой (Area Under Curve, AUC) с целью оценки качества разработанных моделей.
Результаты
В I подгруппу были включены 25 недоношенных детей с наличием структурных изменений головного мозга в виде ВЖК, ПВЛ. В данной подгруппе у 15 детей были обнаружены ВЖК различной степени тяжести, односторонние/двусторонние (60%), у 5 детей была диагностирована ПВЛ (20%), 5 детей имели одновременно ПВЛ и ВЖК различной степени тяжести, односторонние/двусторонние (20%).
Вo II подгруппу вошли недоношенные новорождённые, которые никогда не имели структурных изменений головного мозга, по данным НСГ, в процессе регулярного наблюдения. Всего таких пациентов было 35 человек.
Нами было проведено сравнение I подгруппы и II подгруппы, по различным клинико-анамнестическим данным. ГВ детей в I подгруппе составил 29 недель [ 26;33], вo II подгруппе — 34 недели [ 31;35], таким образом, срок гестации недоношенных новорождённых с выявленным поражением ЦНС был статистически ниже, чем у недоношенных новорождённых без поражения ЦНС (М-У, p=0,0013).
Далее проводилась оценка структуры ведущих синдромов у недоношенных новорождённых при рождении. Полученные данные представлены в таблице 1.
Таблица / Table 1
Характеристика ведущих синдромов при рождении в подгруппах I и II
Characteristics of leading syndromes at birth in subgroups 1 and 2
|
Показатель Indicator |
Недоношенные новорожёенные с поражением ЦНС (I подгруппа, n=25) Preterm infants with injury of the CNS (subgroup 1, n=25) |
Недоношенные новорождённые без поражения ЦНС (II подгруппа, n=35) Preterm infants without injury of the CNS (subgroup 2, n=35) |
Уровень значимости различий, p Significance level of differences, p |
||
|
Абс. Abs. |
% |
Абс. Abs. |
% |
||
|
Угнетение Depression |
14 |
56,0 |
23 |
65,71 |
0,5910 |
|
Возбуждение Arousal |
0 |
0 |
2 |
5,71 |
0,5056 |
|
Асфиксия Asphyxia |
2 |
8,0 |
5 |
14,29 |
0,6882 |
|
Период адаптации Period of adaptation |
1 |
4,0 |
6 |
17,14 |
0,2216 |
|
Дыхательная недостаточность/ дыхательные нарушения Respiratory failure/ respiratory disorders |
21 |
84,0 |
18 |
51,43 |
0,0132* |
Note: *differences between groups are statistically significant (p<0,05); comparison using the Fisher test two-sided.
В I подгруппе превалировал синдром дыхательной недостаточности при рождении, что было статистически значимо (критерий Фишера двусторонний, p=0,0132, ОР 1,63; 95% ДИ 1,13; 2,35).
Оценки по шкале Апгар на 1-й и 5-й минутах жизни у детей со структурными изменениями головного мозга были статистически ниже, чем у детей без ВЖК и ПВЛ. Апгар на 1-ой минуте жизни в первой подгруппе была 5 баллов [ 3;5], во второй подгруппе 2 — 6 баллов [ 4;7] (М-У, р=0,0052). Оценка по шкале Апгар на 5-ой минуте жизни в первой подгруппе составила 6 баллов [ 5;7], во второй подгруппе — 7 баллов [ 7;7] (М-У, p=0,0057).
Некоторым пациентам в обеих подгруппах проводились реанимационные мероприятия, объём которых представлен в таблице 2.
Таблица / Table 2
Объём реанимационных мероприятий при рождении в подгруппах I и II
Resuscitation at birth in subgroups 1 and 2
|
Показатель Indicator |
Недоношенные новорождённые с поражением ЦНС (I подгруппа, n=25) Preterm infants with injury of the CNS (subgroup 1, n=25) |
Недоношенные новорождённые без поражения ЦНС (II подгруппа, n=35) Preterm infants without injury of the CNS (subgroup 2, n=35) |
Уровень значимости различий, p Significance level of differences, p |
||
|
Абс. Abs. |
% |
Абс. Abs. |
% |
||
|
Искусственная вентиляция лёгких маской при рождении Artificial ventilation of the lungs with a mask at birth |
12 |
48,0 |
16 |
45,71 |
1,0000 |
|
Методика Constant positive airway pressure при рождении Constant positive airway pressure technique at birth |
11 |
44,0 |
16 |
45,71 |
1,0000 |
|
Интубация при рождении Intubation at birth |
9 |
36,0 |
4 |
11,43 |
0,0297* |
|
Непрямой массаж сердца Indirect cardiac massage |
0 |
0 |
0 |
0 |
1,0000 |
|
Введение лекарственных препаратов The administration of medicines |
0 |
0 |
0 |
0 |
1,0000 |
Note: *differences between groups are statistically significant (p<0,05); comparison using the Fisher test two-sided.
Подгруппы статистически значимо различались по частоте проведения интубации трахеи при рождении (критерий Фишера двусторонний, p=0,0297, ОР 3,15; 95% ДИ 1,09; 9,09).
При динамическом наблюдении за детьми основной группы было отмечено, что недоношенным новорождённым с ВЖК и ПВЛ в большем проценте случаев (22 ребенка в I подгруппе (88,0%) против 17 детей вo II подгруппе (48,57%) требовалась респираторная поддержка после перевода из родильного зала (критерий Фишера двусторонний, p=0,0022, ОР 1,81; 95% ДИ 1,25; 2,62) и статистически значимо чаще была необходима именно инвазивная респираторная поддержка в ОРИТ (14 детей в I подгруппе (56,0%) против 6 детей вo II подгруппе (17,14%), критерий Фишера двусторонний, p=0,0024, ОР 3,27; 95% ДИ 1,46; 7,32). Неинвазивная респираторная поддержка в условиях ОРИТ была проведена 13 детям в I подгруппе (52,0%) и 11 детям вo II подгруппе (31,43%). Статистически значимых различий по данному параметру обнаружено не было (критерий Фишера двусторонний, p=0,1204).
Структура диагнозов детей основной группы в раннем неонатальном периоде была представлена следующими состояниями: судорожный синдром, РДСН, транзиторное тахипноэ, врождённая пневмония, легочная гипертензия, желтуха, связанная с укорочением срока гестации, конъюгационная гипербилирубинемия, гемолитическая болезнь новорождённого, открытое овальное окно, открытый артериальный проток, аномальные хорды левого желудочка, врождённые пороки сердца, концентрическая гипертрофия левого желудочка, пиелоэктазия, врождённые пороки развития, анемии различного генеза, гипогликемия, электролитные нарушения, полицитемия, геморрагический синдром, синдром диссеминированного внутрисосудистого свертывания, гематома печени, кривошея, пупочная грыжа, диабетическая фетопатия, холодовая травма, малый к сроку гестации, маловесный к сроку гестации, крупный к сроку гестации. У 7 детей в первой подгруппе (28,0%) и у 1 ребенка во второй подгруппе (2,86%) были обнаружены клинико-лабораторные данные, указывающие на наличие внутриутробной инфекции (ВУИ). По данному параметру обнаружены статистические различия между подгруппами (критерий Фишера двусторонний, p=0,007, ОР 9,8; 95% ДИ 1,29; 74,73).
При выполнении корреляционного анализа (корреляция Спирмена) были обнаружены следующие значимые взаимосвязи: установлена отрицательная связь средней силы между наличием ВЖК и ПВЛ и ГВ ребенка (r=-0,41, p<0,05), массой тела при рождении (r=-0,38, p<0,05), оценкой по шкале Апгар на 1-й и 5-й минутах жизни (r=-0,35, p<0,05 и r=-0,34, p<0,05 соответственно). Установлена прямая корреляционная связь средней силы между наличием органическим поражением ЦНС у новорождённых недоношенных и синдромом дыхательной недостаточности при рождении (r=0,34, p<0,05), проведением этой категории пациентов инвазивной искусственной вентиляции лёгких (ИВЛ) в условиях ОРИТ (r=0,41, p<0,05), клинико-лабораторными данными, указывающими на ВУИ в неонатальном периоде (r=0,39, p<0,05).
Нами была проведена оценка некоторых показателей антиоксидантной системы. Полученные данные представлены в таблице 3.
Таблица / Table 3
Показатели антиоксидантной системы у новорождённых основной и контрольной групп, Ме [QL; QU]
Indicators of the antioxidant system in newborns in the main and control groups, Me [QL; QU]
|
Показатель Indicator |
Основная группа (n=60) Main group (n=60) |
Контрольная группа (n=35) Control group (n=35) |
Уровень значимости различий между I подгруппой, II подгруппой и контрольной группами, p Significance level of differences between subgroup 1, subgroup 2 and control groups, p |
Уровень значимости различий между I подгруппой и II подгруппой, p Significance level of differences between subgroup 1 and subgroup 2, p |
Уровень значимости различий между контрольной группой и II подгруппой, p Significance level of differences between the control group and subgroup 2, p |
|
|
Недоношенные новорождённые с поражением ЦНС (I подгруппа, n=25) Preterm infants with injury of the CNS (subgroup 1, n=25) |
Недоношенные новорождённые без поражения ЦНС (II подгруппа, n=35) Preterm infants without injury of the CNS (subgroup 2, n=35) |
Доношенные новорождённые Full-term newborns |
||||
|
Cu,Zn-СОД, нг/мл Cu,Zn-SOD, ng/ml |
136 [ 86;250] |
264 [ 170;432] |
235 [ 176;356] |
0,0045* |
0,0021** |
0,5049 |
|
Mn-СОД, нг/мл Mn-SOD, ng/ml |
48,56 [ 42,20; 63,36] |
50,73 [ 35,06; 70,48] |
59,19 [ 42,80; 72,51] |
0,5559 |
0,8396 |
0,3104 |
|
GSH, мкмоль GSH, µmol |
3,88 [ 2,28;7,26] |
14,78 [ 9,32;17,82] |
14,37 [ 9,30;17,39] |
<0,0001* |
0,0001** |
0,9700 |
|
GSSG, мкмоль GSSG, µmol |
1,94 [ 1,14;3,63] |
7,39 [ 4,66;8,91] |
7,19 [ 4,65;8,70] |
<0,0001* |
0,0001** |
0,9700 |
|
TAS/TAC, мкмоль/л TAS/TAC, µmol/l |
320,65 [ 253,81;384,09] |
391,65 [ 381,52;393,94] |
370,28 [ 348,34;390,82] |
0,0002* |
0,0001** |
0,0806 |
Notes: *differences between groups are statistically significant (p<0,05); comparison of several groups of variables using the Kruskal-Wallis test; **differences between groups are statistically significant, comparison of two independent variables using the Mann-Whitney test (p<0,017, adjusted level of statistical significance, taking into account the Bonferroni correction).
В подгруппе недоношенных новорождённых с ВЖК и ПВЛ показатели Cu,Zn-СОД, GSH, GSSG, общая антиоксидантная способность (TAS/TAC) были ниже, чем в группе с отсутствием органического поражения ЦНС (М-У, р<0,017). Контрольная группа и недоношенные дети без структурных изменений со стороны ЦНС статистически значимо не различались по вышеперечисленным параметрам (М-У, р>0,017).
В I подгруппе при анализе показателя TOS/TOC было обнаружено, что 18 недоношенных детей испытывали низкий окислительный стресс (72,0%), у 7 детей этот показатель был средним или высоким (28,0%). У всех недоношенных новорождённых без ВЖК и ПВЛ (n=35) был низкий уровень окислительного стресса (100%). 24 доношенных новорождённых имели низкий уровень окислительного стресса (96,0%) и только у 1 ребенка он был средним (4,0%). Недоношенные дети с поражением ЦНС испытывали бóльший окислительный стресс, чем дети без поражения ЦНС в неонатальном периоде (точный критерий Фишера двусторонний, p=0,0012, 95% ДИ Infinity; NaN; Infinity). Доношенные новорождённые дети и недоношенные дети без поражения ЦНС не различались по данному показателю (точный критерий Фишера двусторонний, p=0,4167).
Далее проводилось сравнение показателей антиоксидантной системы попарно в сформированных группах в зависимости от ГВ: недоношенные новорождённые с ГВ до 31-й недели (включительно) и недоношенные новорождённые с ГВ 32 недели и более. Полученные результаты представлены в таблице 4.
Таблица / Table 4
Показатели антиоксидантной системы у детей основной группы в зависимости от гестационного возраста, Ме [QL; QU]
Indicators of the antioxidant system depending on gestational age in children in the main group, Me [QL; QU]
|
Показатель Indicator |
Недоношенные новорожденные с поражением ЦНС, ГВ менее 31 недели включительно (n=14) Preterm infants with injury of the CNS, |
Недоношенные новорожденные без поражения ЦНС, ГВ менее 31 недели включительно (n=9) Preterm infants without injury of the CNS, GA less than 31 weeks inclusive (n=9) |
Уровень значимости различий, p Significance level of differences, p |
Недоношенные новорожденные с поражением ЦНС, ГВ 32 недели и более (n=11) Preterm infants with injury of the CNS, GA 32 weeks or more (n=11) |
Недоношенные новорожденные без поражения ЦНС, ГВ 32 недели и более (n=26) Preterm infants without injury of the CNS |
Уровень значимости различий, p Significance level of differences, p |
|
Cu,Zn-СОД, нг/мл Cu,Zn-SOD, ng/ml |
137,00 [ 92,00;168,00] |
180 [ 164;336] |
0,1386 |
136,00 [ 84,00;326,00] |
296,00 [ 210,00;440,00] |
0,0249* |
|
GSH, мкмоль GSH, µmol |
2,9 [ 2,06;4,84] |
12,58 [ 2,6;14,78] |
0,1227 |
6,32 [ 2,94;10,14] |
15,84 [ 10,7;17,95] |
0,0055* |
|
GSSG, мкмоль GSSG, µmol |
1,45 [ 1,03;2,42] |
6,29 [ 1,3;7,39] |
0,1227 |
3,16 [ 1,47;5,07] |
7,92 [ 5,35;8,97] |
0,0055* |
|
TAS/TAC, мкмоль/л TAS/TAC, µmol/l |
294,17 [ 246,80; 340,71] |
372,01 [ 296,98;391,65] |
0,1388 |
371,59 [ 253,81;391,17] |
392,62 [ 386,17;395,19] |
0,0019* |
Note: *differences between groups are statistically significant (p<0,05); comparison of two independent variables using the Mann-Whitney test.
Обсуждение
Исследуемые показатели у детей с поражением и без поражения ЦНС со сроком гестации менее 31 недели (включительно) статистически значимо не различались (М-У, p>0,05 для всех исследуемых показателей), однако они были ниже в группе детей с ВЖК и ПВЛ. При сравнении этих же групп, но с ГВ 32 недели и более, были установлены статистически значимые различия: в группе детей с ВЖК и ПВЛ исследуемые показатели были ниже (М-У, p<0,05 для всех исследуемых показателей).
При выполнении корреляционного анализа (корреляция Спирмена) были обнаружены следующие значимые взаимосвязи: установлена отрицательная связь средней силы между вероятностью возникновения ВЖК и ПВЛ и уровнем GSSG и GSH (r=-0,40, p<0,05 и r=-0,44, p<0,05 соответственно), показателем общей антиоксидантной способности крови и наличием органического поражения ЦНС (r=-0,50, p<0,05). Между показателем окислительного стресса и наличием органического поражения ЦНС связь была прямой и средней силы (r=0,40, p<0,05). Для уровня Cu, Zn-СОД связь была отрицательной слабой (r=-0,20, p<0,05).
Проведённое исследование показало, что статистически значимых различий по частоте встречаемости исследуемых генотипов и аллелей среди недоношенных детей с ВЖК и ПВЛ и без поражения ЦНС, а также между доношенными и недоношенными новорождёнными не было обнаружено.
В результате проведённого исследования нами были разработаны две прогностические модели, позволяющие определять вероятность развития ВЖК и ПВЛ в неонатальном периоде у недоношенных новорождённых (модель 1 и модель 2). Данные модели включают такие параметры как ГВ, оценка по шкале Апгар на 1-й и 5-й минутах жизни, наличие синдрома дыхательной недостаточности при рождении, проведение инвазивной ИВЛ ребенку в неонатальном периоде в условиях ОРИТ, наличие клинико-лабораторных данных, указывающих на ВУИ в неонатальном периоде (рис. 1).
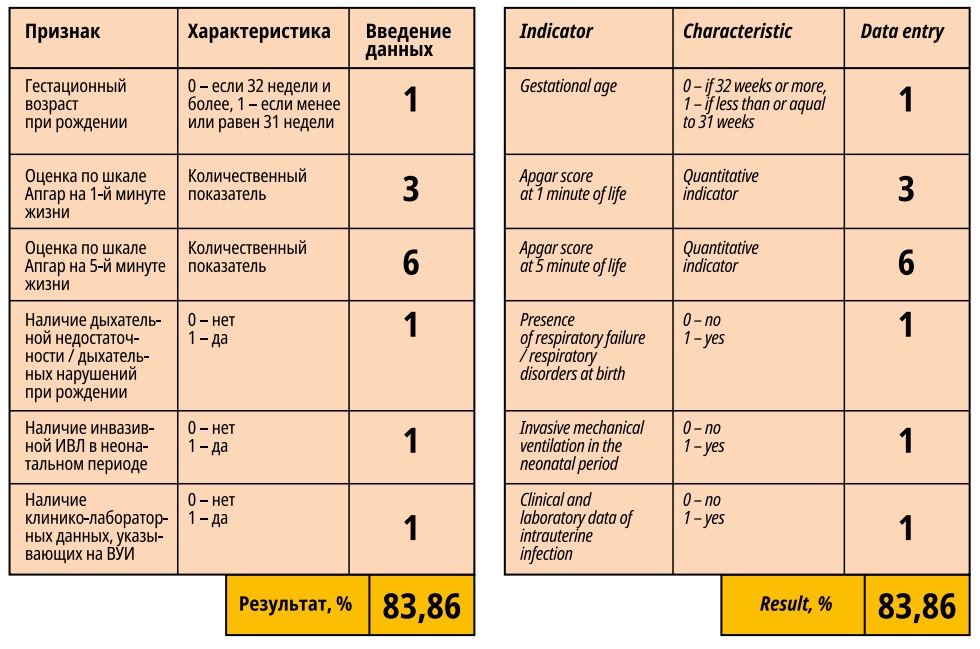
Рисунок 1. Программа для оценки вероятности развития органического поражения центральной нервной системы в неонатальном периоде у недоношенных новорождённых. Модель 1.
Figure 1. Program for assessing the probability of developing an organic injury of the central nervous system in the neonatal period in premature newborns. Model 1.
Расширенный вариант модели (модель 2) учитывает уровень глутатиона в восстановленном состоянии (GSH) и показатель общей антиоксидантной способности крови (TAS/TAC), определённые в раннем неонатальном периоде (рис. 2).

Рисунок 2. Программа для оценки вероятности развития органического поражения центральной нервной системы в неонатальном периоде у недоношенных новорождённых. Модель 2.
Figure 2. Program for assessing the probability of developing an organic injury of the central nervous system in the neonatal period in premature newborns. Model 2.
При оценке качества разработанных моделей площадь под ROC-кривой составила 0,84345 для модели 1 и 0,87202 — для модели 2, то есть качество обеих моделей — «очень хорошее».
Обсуждение
Как правило, частота органического поражения ЦНС у недоношенных новорождённых детей обратно пропорциональна ГВ. Морфофункциональное созревание структур головного мозга, имеющих значение в реализации органического поражения ЦНС, происходит вплоть до окончания третьего триместра беременности, поэтому дети, рождённые преждевременно, — особенно уязвимая категория пациентов.
Оценка по шкале Апгар является рутинным методом обследования в практике врача-неонатолога. Низкая оценка указывает на несостоятельность процесса адаптации к внеутробной жизни и на необходимость проведения определённого объёма реанимационных мероприятий этой категории пациентов, что также может внести свой вклад в реализацию ВЖК и ПВЛ в неонатальном периоде.
Этиология синдрома дыхательной недостаточности у недоношенных детей в периоде новорождённости может быть связана с большим перечнем состояний, но наиболее актуальными являются РДСН, пневмонии. При дыхательной недостаточности развивается застой в верхней полой вене, ведущий к замедлению тока крови, венозному застою в вене Галена (перивентрикулярные зоны боковых желудочков мозга), агрегации форменных элементов крови. Формирующиеся сладжи обтурируют капилляры, появляются запустевшие капилляры, которые впоследствии спадаются. Всё это приводит к затруднению кровотока в микроциркуляторном русле и может способствовать состоянию гипоперфузии головного мозга, что играет роль в возникновении ПВЛ. Отмечается, что при проведении ИВЛ возможна флюктуация мозгового кровотока, повышение церебрального венозного давления, что в условиях несовершенства процессов ауторегуляции мозгового кровотока у недоношенных детей может привести к реализации ВЖК.
Взаимосвязь между формированием ВЖК и ПВЛ у пациентов и «наличием клинико-лабораторных данных, указывающих на ВУИ», также была обнаружена. Данный параметр был включён в модели. Инфекционные агенты могут различным образом воздействовать на сосудистую стенку, процессы ауторегуляции мозгового кровотока у новорождённых, активировать микроглию, воздействовать на предшественников олигодентроцитов [7][23][24].
Окислительный стресс — состояние, которое возникает в результате физиологического дисбаланса между уровнями антиоксидантов и оксидантов в пользу оксидантов.
В проведённом исследовании общая антиоксидантная способность крови (TAS/TAC) в группе недоношенных новорождённых с различными вариантами органического поражения ЦНС была ниже. Одновременно данная категория пациентов испытывала бóльший окислительный стресс, чем дети без структурных изменений головного мозга. То есть имелся дисбаланс между факторами защиты, с одной стороны, и повреждающими факторами — с другой, что в результате могло привести к реализации ВЖК и ПВЛ.
Глутатион — это трипептид (L-γ-глутамил-L-цистеинилглицин, L-γ-glutamyl-L-cysteinylglycine), выполняющий множество функций в живых организмах: он действует как антиоксидант, либо напрямую взаимодействуя с активными формами кислорода или азота и электрофилами, либо работая в качестве кофактора для различных ферментов. Роль глутатиона была описана для заболеваний, в патогенезе которых основную роль играют процессы ишемии-реперфузии, что также актуально в контексте органического поражения ЦНС у недоношенных детей [25].
Таким образом, анализ особенностей клинико-анамнестических и лабораторных показателей недоношенных детей с ВЖК и ПВЛ позволяет установить наиболее значимые факторы риска развития последних и их прогностическую значимость. Недоношенные новорождённые с низкими показателями GSH, GSSG, общей антиоксидантной способностью крови и подвергающиеся среднему или высокому воздействию окислительного стресса в раннем неонатальном периоде имеют значимый риск развития структурных изменений головного мозга. Комплексная оценка клинико-анамнестических данных недоношенных новорождённых при рождении, а также определение показателей, учитывающих уровень антиоксидантной защиты, таких как GSH, общая антиоксидантная способность крови, позволит идентифицировать недоношенного ребенка группы риска по органическому поражению ЦНС и скорректировать терапевтическую тактику ведения в неонатальном периоде.
Выводы
- Недоношенные новорождённые со структурными изменениями головного мозга имели более низкие ГВ, массу тела при рождении, оценки по шкале Апгар на 1-й и 5-й минутах жизни, чаще развивали синдром дыхательной недостаточности (дыхательных нарушений) в родильном зале, в большей части случаев требовали выполнения интубации трахеи в рамках реанимационных мероприятий, нуждались в респираторной поддержке после перевода из родильного зала и в проведении инвазивной респираторной поддержки в ОРИТ, чаще имели признаки ВУИ в неонатальном периоде. Выявленные корреляционные связи свидетельствуют о значимой роли в генезе органического поражения ЦНС вышеперечисленных данных.
- Распределение частот аллелей и генотипов по исследованным полиморфизмам генов ферментов антиоксидантной системы статистически значимо не различалось при сравнении детей с органическим и без органического поражения ЦНС в неонатальном периоде, равно как и при сравнении их с группой доношенных новорождённых.
- Недоношенные новорождённые с органическим поражением ЦНС имели более низкие показатели Cu,Zn-СОД, GSH, GSSG, общей антиоксидантной способности крови и испытывали больший окислительный стресс, чем дети без поражения ЦНС в неонатальном периоде. Показатели Cu,Zn-СОД, GSH, GSSG, общей антиоксидантной способности крови у недоношенных детей с ВЖК и ПВЛ в группе детей со сроком гестации менее 31 недели (включительно) и 32 недели и более были ниже, чем в соответствующих по сроку гестации группах детей, но без органического поражения ЦНС, однако статистически значимые различия были подтверждены только для группы недоношенных с ГВ 32 недели и более. Выявленные корреляционные связи свидетельствуют о значимой роли в генезе структурных изменений головного мозга у недоношенных детей уровня GSSG и GSH, показателя общей антиоксидантной способности крови и окислительного стресса.
- Разработаны прогностические модели, позволяющие определять вероятность развития ВЖК и ПВЛ в неонатальном периоде у недоношенных новорождённых на основании клинико-анамнестических данных и показателей, учитывающих состояние антиоксидантной защиты.
1. Внутрижелудочковые кровоизлияния у недоношенных новорожденных. Основы персонализированной медицинской помощи : учебное пособие. Под ред. А.С. Иова. - Санкт-Петербург : СпецЛит; 2020.
Список литературы
1. Гузева В.И., Иванов Д.О., Александрович Ю.С. [и др.]. Неотложная неврология новорожденных и детей раннего возраста. Санкт-Петербург : СпецЛит; 2017.
2. Granger D.N., Kvietys P.R. Reperfusion injury and reactive oxygen species: The evolution of a concept. Redox Biol. 2015;6:524-551.DOI: 10.1016/j.redox.2015.08.020.
3. Gano D. White matter injury in premature newborns. Neonatal Netw. 2016;35(2):73-77.DOI: 10.1891/0730-0832.35.2.73.
4. Bennet L., Dhillon S., Lear C.A., van den Heuij L., King V. [et al.] Chronic inflammation and impaired development of the preterm brain. J Reprod Immunol. 2018;125:45-55.DOI: 10.1016/j.jri.2017.11.003.
5. Novak C.M., Ozen M., Burd I. Perinatal brain injury: mechanisms, prevention, and outcomes. Clin Perinatol. 2018;45(2):357-375.DOI: 10.1016/j.clp.2018.01.015.
6. Perrone S., Santacroce A., Longini M., Proietti F., Bazzini F. [et al.] The free radical diseases of prematurity: from cellular mechanisms to bedside. Oxid Med Cel Long.2018.Vol.2018:1-15.
7. van Tilborg E., de Theije C.G.M., van Hal M., Wagenaar N., de Vries L.S. [et al.] Origin and dynamics of oligodendrocytes in the developing brain: Implications for perinatal white matter injury. Glia. 2018;66(2):221-238.DOI: 10.1002/glia.23256.
8. Volpe J.J. Dysmaturation of premature brain: importance, cellular mechanisms, and potential interventions. Pediatr Neurol. 2019 Jun;95:42-66.DOI: 10.1016/j.pediatrneurol.2019.02.016.
9. Boyle A.K., Rinaldi S.F., Norman J.E., Stock S.J. Preterm birth: Inflammation, fetal injury and treatment strategies. J Reprod Immunol. 2017;119:62-66.DOI: 10.1016/j.jri.2016.11.008.
10. Elders P.N.D., In 't Veld J., Termote J., de Vries L.S., Hemels M.A.C. [et al.] Congenital cytomegalovirus infection and the occurrence of cystic periventricular leukomalacia. Pediatr Neurol. 2018;79:59-60. DOI:10.1016/j.pediatrneurol.2017.10.016.
11. Lawrence S.M., Wynn J.L. Chorioamnionitis, IL-17A, and fetal origins of neurologic disease. Am J Reprod Immunol. 2018;79(5):e12803.DOI: 10.1111/aji.12803.
12. Poryo M., Boeckh J.C., Gortner L., Zemlin M., Duppré P. [et al.] Ante-, peri- and postnatal factors associated with intraventricular hemorrhage in very premature infants. Early Hum Dev. 2018;116:1-8.DOI: 10.1016/j.earlhumdev.2017.08.010.
13. Huang J., Meng J., Choonara I., Xiong T., Wang Y. [et al.] Antenatal infection and intraventricular hemorrhage in preterm infants: A meta-analysis. Medicine (Baltimore). 2019;98(31):e16665.DOI: 10.1097/MD.0000000000016665.
14. Schneider J., Miller S.P. Preterm brain Injury: White matter injury. Handb Clin Neurol. 2019;162:155-172.DOI: 10.1016/B978-0-444-64029-1.00007-2.
15. Pai V.V., Carmichael S.L., Kan P., Leonard S.A., Lee H.C. Maternal body mass index and risk of intraventricular hemorrhage in preterm infants. Pediatr Res. 2018;83(6):1146-1151.DOI: 10.1038/pr.2018.47.
16. Polavarapu S.R., Fitzgerald G.D., Contag S., Hoffman S.B. Utility of prenatal Doppler ultrasound to predict neonatal impaired cerebral autoregulation. J Perinatol. 2018;38(5):474-481.DOI: 10.1038/s41372-018-0050-x.
17. Vesoulis Z.A., Ters N.E., Foster A., Trivedi S.B., Liao S.M. [et al.] Response to dopamine in prematurity: a biomarker for brain injury? J Perinatol. 2016;36(6):453-458.DOI: 10.1038/jp.2016.5.
18. Handley S.C., Passarella M., Lee H.C., Lorch S.A. Incidence trends and risk factor variation in severe intraventricular hemorrhage across a population based Cohort. J Pediatr. 2018;200:24-29.e3.DOI: 10.1016/j.jpeds.2018.04.020.
19. He L., Zhou W., Zhao X., Liu X., Rong X. [et al.] Development and validation of a novel scoring system to predict severe intraventricular hemorrhage in very low birth weight infants. Brain Dev. 2019;41(8):671-677.DOI: 10.1016/j.braindev.2019.04.013.
20. Нейробиологические основы возникновения и восстановительного лечения перинатального поражения центральной нервной системы у детей. ФГАУ «Науч. центр здоровья детей» Минздрава России, Союз педиатров России; под ред. Намазовой-Барановой Л. С. М.: ПедиатрЪ, 2016.
21. Lee J., Hong M., Yum S.K., Lee J.H. Perinatal prediction model for severe intraventricular hemorrhage and the effect of early postnatal acidosis. Childs Nerv Syst. 2018;34(11):2215-2222.DOI: 10.1007/s00381-018-3868-9.
22. Glover Williams A., Odd D., Bates S., Russell G., Heep A. Elevated international normalized ratio (INR) is associated with an increased risk of intraventricular hemorrhage in extremely preterm infants. J Pediatr Hematol Oncol. 2019;41(5):355-360.DOI: 10.1097/MPH.0000000000001509.
23. Stark M.J., Hodyl N.A., Belegar V.K.K., Andersen C.C. Intrauterine inflammation, cerebral oxygen consumption and susceptibility to early brain injury in very preterm newborns. Arch Dis Child Fetal Neonatal Ed. 2016;101(2):137-142. DOI: 10.1136/archdischild-2014-306945.
24. Софронова Л. Н., Федорова Л. А. Недоношенный ребенок. Справочник. М.: Редакция журнала StatusPraesens; 2020.
25. Ighodaro O. M. First line defence antioxidants superoxide dismutase (SOD), catalase (CAT) and glutathione peroxidase (GPX): Their fundamental role in the entire antioxidant defence grid. Alexandria J. Med.2018;54(4):287-293. DOI: 10.1016/j.ajme.2017.09.001.
Об авторах
Е. Б. ПавлиноваРоссия
Павлинова Елена Борисовна, д.м.н., доцент, заведующая кафедрой госпитальной педиатрии с курсом ДПО, проректор по учебной работе
Омск
Scopus ID 57208394473
AuthorID в РИНЦ 546836
А. А. Губич
Россия
Губич Анастасия Андреевна, аспирант кафедры госпитальной педиатрии с курсом ДПО, ассистент кафедры госпитальной педиатрии с курсом ДПО
Омск
SPIN-код: 2311-9908, AuthorID в РИНЦ: 1059151
О. А. Савченко
Россия
Савченко Ольга Анатольевна, к.м.н., доцент кафедры госпитальной педиатрии с курсом ДПО
Омск
Scopus ID 57208394005
AuthorID в РИНЦ 810097
Рецензия
Для цитирования:
Павлинова Е.Б., Губич А.А., Савченко О.А. Предикция поражения центральной нервной системы в неонатальном периоде у недоношенных новорожденных детей. Медицинский вестник Юга России. 2022;13(2):122-133. https://doi.org/10.21886/2219-8075-2022-13-2-122-133
For citation:
Pavlinova E.B., Gubich A.A., Savchenko O.A. Prediction injury of the central nervous system in the neonatal period in preterm newborns. Medical Herald of the South of Russia. 2022;13(2):122-133. (In Russ.) https://doi.org/10.21886/2219-8075-2022-13-2-122-133







































