Перейти к:
Самоконтроль гликемии у больных сахарным диабетом 2 типа с позиций доказательной медицины
https://doi.org/10.21886/2219-8075-2022-13-1-43-51
Аннотация
Согласно клиническим рекомендациям, проведение самоконтроля гликемии пациентами в настоящее время является важной составляющей лечения сахарного диабета 2 типа. Однако самоконтроль гликемии ассоциирован со значительными затратами. Возможно ли сократить использование самоконтроля гликемии с целью оптимизации затрат на лечение сахарного диабета? И если это возможно, то у каких пациентов? Так как, согласно исследованию United Kingdom Prospective Diabetes Study (UKPDS), снижение уровня гликированного гемоглобина на каждый 1% приводит к снижению риска микрососудистых осложнений на 37% и макрососудистых осложнений на 14%, а также к снижению смертности, в статье преимущественно рассмотрено влияние самоконтроля на уровень гликированного гемоглобина в различных клинических ситуациях.
Для цитирования:
Закиев В.Д., Мустафина В.Р. Самоконтроль гликемии у больных сахарным диабетом 2 типа с позиций доказательной медицины. Медицинский вестник Юга России. 2022;13(1):43-51. https://doi.org/10.21886/2219-8075-2022-13-1-43-51
For citation:
Zakiev V.D., Mustafina V.R. Self-monitoring of blood glucose in patients with type 2 diabetes mellitus from the standpoint of evidence-based medicine. Medical Herald of the South of Russia. 2022;13(1):43-51. (In Russ.) https://doi.org/10.21886/2219-8075-2022-13-1-43-51
Введение
Согласно «Алгоритмам специализированной медицинской помощи больным сахарным диабетом», проведение самоконтроля гликемии пациентами в настоящее время является важной составляющей лечения сахарного диабета (СД) 2 типа наряду с диетотерапией, физической активностью и фармакологическим лечением [1]. Термин «самоконтроль» подразумевает учёт больными СД субъективных ощущений, уровня гликемии, глюкозурии, особенностей питания, физической активности и других показателей с целью принятия самостоятельных терапевтических решений. В более узком смысле, это самостоятельное определение пациентами в условиях повседневной жизни уровня глюкозы в крови и поддержание этого показателя близким к целевому значению. Современные портативные тест-системы дают возможность людям с диабетом самостоятельно оценивать важнейшие параметры обмена веществ в условиях повседневной жизни с точностью, близкой к лабораторной [2], что имеет большое значение для подбора терапии. Самоконтроль — это самостоятельный вклад больного в лечебный процесс, материал для совместного обсуждения с врачом, собственный опыт, основа для понимания пациентом течения заболевания и эффективности терапии [3].
В то же время лечение больного СД является большой финансовой нагрузкой для пациента и системы здравоохранения различных стран мира [4-9]. В России средние затраты на лечение одного больного СД 2 типа, согласно исследованию ФОРСАЙТ-СД2, составляют 279 609 рублей, из которых более 105 тыс. рублей — прямые медицинские затраты (табл. 1) [6]. Согласно проведённому нами расчёту, для обеспечения средствами самоконтроля (глюкометрами для лиц с впервые выявленным СД и тест-полосками всех пациентов) только пациентов СД2 типа города Москвы необходимо затратить 1,2 млрд рублей в год (рис. 1) [10]. В Великобритании Национальной службой здравоохранения на самоконтроль уровня глюкозы в 2011 году было затрачено 158 млн фунтов стерлингов, что составляет 21% от всех затрат на лечение СД, выписываемое врачами (prescribing costs) [11]. При этом программы, направленные на сокращение использования самоконтроля гликемии, могут уменьшить экономическое бремя СД. Например, одна из таких программ позволила бы сохранить 21,8 млн фунтов стерлингов [12]. Кроме значительных затрат, имеются данные о том, что самоконтроль ассоциирован с уменьшением качества жизни у пациентов с СД 2 типа, не получающих инсулин [13], однако не все авторы согласны с этим [14].
Таблица / Table 1
Средние затраты на 1 пациента СД 2 типа в России, согласно исследованию ФОРСАЙТ-СД2 [6]
Mean costs per 1 person with Type 2 Diabetes Mellitus in Russia according to FORSIGHT-Т2DM trial [6]
|
Виды затрат |
Сумма, руб. / Amount, Rub. |
% |
|
Прямые медицинские затраты Direct medical costs |
105 337 |
38 |
|
Прямые немедицинские затраты Direct non-medical costs |
24 528 |
9 |
|
Непрямые (косвенные) затраты Indirect costs |
149 754 |
54 |
|
Общие затраты Total costs |
279 609 |
100 |
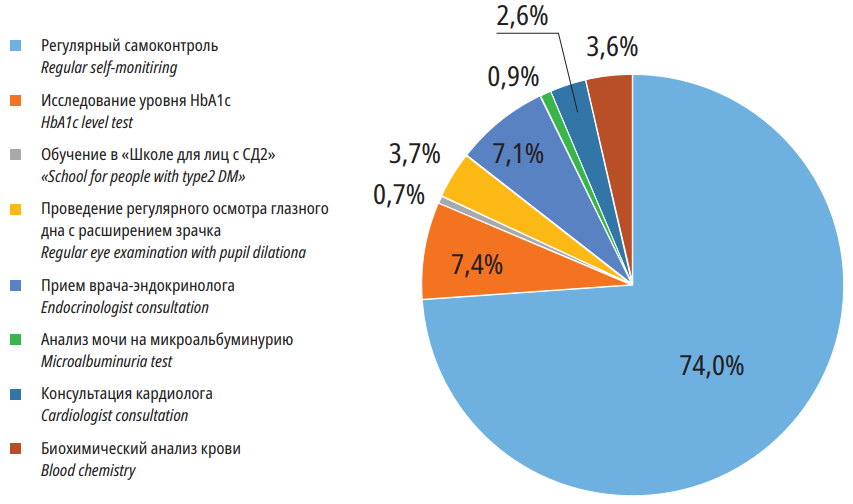
Рисунок 1. Структура затрат на профилактику осложнений СД 2 типа в г. Москве в 2016 г. [10]
Figure 1. Structure of costs for the prevention of Type 2 Diabetes Mellitus complications in Moscow in 2016 [10]
Dозможно ли сократить использование самоконтроля гликемии с целью оптимизации затрат на лечение СД? Если возможно, то у каких пациентов? Так как, согласно исследованию United Kingdom Prospective Diabetes Study (UKPDS), снижение уровня гликированного гемоглобина (HbA1c) на каждый 1% приводит к снижению риска микрососудистых осложнений на 37%, макрососудистых осложнений — на 14%, снижению смертности [15], а также к снижению риска гипогликемий у пациентов, принимающих пероральные сахароснижающие препараты (ПССП) за исключением препаратов сульфонилмочевины и глинидов [16][17]. В статье рассмотрено преимущественно влияние самоконтроля на уровень HbA1c.
Обзор клинических исследований
Для ответа на вопрос о том, насколько самоконтроль уровня глюкозы у пациентов, получающих только пероральную сахароснижающую терапию, влияет на контроль гликемии с позиций доказательной медицины, нами была проанализирована литература не старше 2000 г. Было обнаружено 9 проспективных рандомизированных контролируемых исследований (РКИ) (табл. 2), 3 мета-анализа и 1 Кокрейновский обзор, а также 1 статья, посвящённая данным реальной клинической практике.
Таблица 2 / Table 2
Результаты рандомизированных клинических исследований.
Results of randomized clinical trials
|
Автор, год публикации Author, year of publication |
Количество пациентов Number of patients |
Исходный уровень HbA1c Baseline HbA1c level |
Уровень HbA1c в конечной точке HbA1c level at the end point
|
Продолжительность исследования Study duration |
Средняя разница HbA1c по сравнению с исходным Mean HbA1c difference from baseline |
Значимость отличия среднего изменения HbA1c по сравнению с исходным в группах (эффект самоконтроля) Significance of difference in average changes in HbA1c compared to baseline in groups (self-control effect) |
||||
|
в группе самоконтроля Self-monitoting group |
в контрольной группе Control group |
в группе самоконтроля Self-monitoting group |
в контрольной группе Control group |
в группе самоконтроля Self-monitoting group |
в контрольной группе Control group |
в группе самоконтроля Self-monitoting group |
в контрольной группе Control group |
|||
|
Schwedes et al, 2002 [18] |
113 чел. |
110 чел. |
8,47 ± 0,86 |
8,35 ± 0,75 |
7,47 ± 1,27% |
7,81 ± 1,52% |
6 месяцев |
- 1,0 ± 1,08% |
- 0,54 ± 1,41% |
Разница между группами значима Difference significant (p = 0,0086) |
|
Guerci et al, 2003 [19] |
345 чел. |
344 чел. |
9,0 ± 1,3 |
8,9 ± 1.3 |
8,1 ± 1,6% |
8,4 ± 1,4% |
6 месяцев |
– 0,88 ± 1,54% |
– 0,60 ± 1,54% |
Разница между группами значима Difference significant (p = 0,009) |
|
Davidson et al, 2005 [20] |
43 чел. |
45 чел. |
8,5 ± 2,2 |
8,4 ± 2,1 |
7,7% ± 1,6 |
7,8% ± 1,5 |
6 месяцев |
- 0,8 ± 1,6% |
- 0,6 ± 2,1 % |
Разница между группами не значима Difference significant (p = 0,58) |
|
Farmer et al, 2007 [21] |
151 чел. – более интенсивный самоконтроль 150 чел. – менее интенсивный самоконтроль |
152 чел. |
7,53 ± 1,12 и 7,41 ± 1,02
|
7,49 ± 1,09 |
7,36 ± 1,05 и 7,28 ± 0,88 |
7,49 ± 1,20 |
12 месяцев |
- 0,17 ± 0,73 % и - 0,14 ± 0,82 % |
0,00 ± 1,02% |
Разница между группами не значима Difference significant (р = 0,12) |
|
Barnett et al, 2008 [22] |
311 чел. |
299 чел. |
8,12 ± 0,89 |
8,12 ± 0,84 |
6,95 ± 0,97 |
7,20 ± 1,22 |
6 месяцев |
- 1,15 ± 1,14% |
- 0, 91 ± 1,29% |
Разница между группами значима Difference significant (p = 0,0265) |
|
O’Kane et al, 2008 [23] |
96 чел. |
88 чел. |
8,8 ± 2,1% |
8,6 ± 2,3% |
6,9 ± 0,8% |
6,9 ± 1,2% |
12 месяцев |
В исследовании не определялась разница HbA1c по сравнению с исходным |
Разница в уровне HbA1c между группами через 12 мес. не значима Difference in HbA1c levels between groups after 12 months. insignificant (р = 0,69) |
|
|
N. Kleefstra et al, 2008 [24] |
22 чел. |
19 чел. |
7,6 ± 0,5
|
7,7 ± 0,4
|
7,5 ± 0,8 |
7,5 ± 0,5 |
12 месяцев |
- 0,1 ± 0,9 |
- 0,1 ± 0,8 |
Разница между группами не значима Difference significant (р = 0,51) |
|
Harashima et al, 2012 [25] |
46 чел. – группа самоконтроля из пальца 45 чел. – группа самоконтроля из ладони |
46 чел. |
7,25 ± 0,77% и 7,35 ± 0,7% |
7,44 ± 0,74% |
7,02 ± 0,59% и 7,19 ± 0,67% |
7,75 ± 0,85% |
6 месяцев |
- 0,23 ± 0,10% и - 0,16 ± 0,06% |
+ 0,31 ± 0,07% |
Разница значима Difference significant: - 0,54% (95%ДИ: - 0,77; - 0,31, p < 0.05) и - 0,48% (95%ДИ: - 0,69; - 0,29, p < 0.05). |
|
Young et al, 2017[26] |
150 чел. – в группе без автоматических сообщений 142 чел. – группе с автоматическими сообщениями |
152 чел. |
7,55 ± 1,10% и 7,61 ± 0,97% |
7,52 ± 1,12% |
7,49 ± 1,12% и 7,51 ± 1,13% |
7,55 ± 1,24% |
13 месяцев |
- 0,05 ± 1,00% и - 0,10 ± 1,14% |
+ 0,04 ± 1,12% |
Разница не значима Difference significant: - 0,05% (95%ДИ: - 0,27%; 0,17%, р = 0,74) и - 0,09% (95%ДИ: - 0,31%; 0,14%, р = 0,74) |
В шестимесячное исследование Schwedes et al., 2002 г., было включено 223 пациента с СД 2 типа, со значениями HbA1c от 7,5 до 10%. Пациенты, получающие только диету или диету в сочетании с препаратами сульфонилмочевины или метформином, были распределены на дв группы: одна группа использовала устройство для мониторинга уровня глюкозы, вела дневник измерения уровня глюкозы, приёма пищи и получала консультирование; другая группа не была активно вовлечена в процесс самоконтроля, только консультировалась по вопросам питания и образа жизни. Выяснилось, что активное вовлечение в управление заболеванием, а также частый самоконтроль уровня глюкозы в крови снижал уровень HbA1С на 1,0 ± 1,08% по сравнению с исходным против 0,54 ± 1,41% в контрольной группе (р = 0,0086) [18].
Исследование Guerci et a.l, опубликованное в 2003 г., охватывало 689 пациентов с СД 2 типа, не получающих инсулинотерапию, в возрасте от 40 до 75 лет, с уровнем HbA1c в пределах 7,5 – 11%. Пациенты были рандомизированы в группу мониторинга и контрольную группу. Они наблюдались каждые 6 недель в течение 6 месяцев. Пациенты в группе мониторинга получали одно и то же устройство для мониторинга гликемии и должны были выполнять не менее 6 анализов в неделю. Ведение пациентов было стандартизировано, включая лекарства, диету и физическую активность. В конечном итоге, HbA1с был ниже в группе мониторинга (8,1 ± 1,6%) по сравнению с группой традиционного лечения (8,4 ± 1,4%, р = 0,012) при этом улучшения уровня гликемии происходило в основном в первые 3 месяца. Средняя разница уровня HbA1с по сравнению с исходным в группе самоконтроля составила –я0,88 ± 1,54% и – 0,60 ± 1,54% в контрольной группе (p = 0,009) [19].
В исследование, проводившееся Davidson et al., 2005 г., было включено 88 пациентов с СД 2 типа, не получающих инсулин, также рандомизированных в группу мониторинга и группу контроля. Через 6 месяцев наблюдалось достоверное снижение уровня HbA1c в обеих группах, однако его уровень в группах был схожим: 7,7 ± 1,6% в группе самоконтроля (р < 0,001) и 7,8 ± 1,5% в контрольной группе (р = 0,05). При этом снижение достоверно не различалось между группами (группа мониторинга: – 0,8% (95%ДИ : – 1,1; + 0,6%); группа контроля: – 0,6% (95%ДИ: – 1,1; + 0,6%, p = 0,58) [20].
В исследовании Farmer et al., 2007 г., было включено 453 пациента, которые были разделены на три группы: контрольная группа (только контроль уровня HbA1c ), группа менее интенсивного самоконтроля (использование глюкометра и рекомендации интерпретации результатов с лечащим врачом) и группа более интенсивного самоконтроля (использование глюкометра, обучение по интерпретации результатов и применения полученных результатов на измените диеты, физической активности и приверженности к терапии). Через 12 месяцев различия в уровне HbA1c в трех группах не были достоверными (подробнее — см. табл. 2) [21].
В международном многоцентровом исследовании DINAMIC 1, опубликованном в 2008 г., приняли участие 610 пациентов, получавших гликлазид с модифицированным высвобождением. Пациентов наблюдали в течение 27 недель. Через 27 недель уровень HbA1c был значительно ниже в группе самоконтроля (с 8,12% ±0,89% до 6,95% ± 0,97%) по сравнению с контрольной группой (с 8,12% ± 0,84% до 7.20% ± 1.22%), различие в снижении уровня HbA1c в группах статистически значимо (p = 0,0265). В обеих группах наиболее частым нежелательным событием была легкая и умеренная гипогликемия (8,7% и 7,0% пациентов в группе мониторинга и контрольной группе соответственно), при этом частота симптомной гипогликемии была ниже в группе мониторинга [22].
В исследовании ESMON продолжительностью 12 мес., проведённом в Северной Ирландии, также опубликованном в 2008 г., изучалось влияние самоконтроля глюкозы у пациентов не старше 70 лет (n = 184) с вновь диагностированным СД 2 типа, без терапии инсулином. Несмотря на то, что уровень HbA1c достоверно снижался в каждой группе во всех трёхмесячных временных точках, не было достоверного различия между группой самоконтроля и контрольной группой ни в одной из временных точек, при этом самоконтроль был ассоциирован с увеличением уровня депрессии на 6%, по данным опросника благополучия (well-being questionnaire) [23].
В городе Зволле, Нидерланды, в рамках проекта ZODIAC (Zwolle Outpatient Diabetes project Integrating Available Care) проведено исследование, включившее 41 пациента с СД 2 типа, получавших пероральную сахароснижающую терапию. Было сформировано две группы, одна из которых включала контроль гликемии 4 раза в день 2 раза в неделю дополнительно к привычному лечению, а в контрольной группе пациенты не измеряли самостоятельно уровень глюкозы во время исследования. В результате исследования не отмечалось значительного уменьшения уровня HbA1c как в группе самоконтроля, так и в контрольной группе. Такой результат, вероятно, связан не только с относительно небольшой выборкой, но и с тем, что в исследование изначально включались пациенты с умеренно контролируемым СД (7,6 ± 0,5% в группе самоконтроля и 7,7 0,4% в контрольной группе) и достаточно большим стажем заболевания [24].
Harashima et al. провели исследование SMBG-OHA (Self-Monitoring of Blood Glucose (SMBG) Improves Glycemic Control in Oral Hypoglycemic Agents), которое продолжалось 6 месяцев, в него были включены 137 пациентов с СД 2 типа, находящиеся на пероральной сахароснижающей терапии. Пациенты были распределены в три группы — группа отсутствия мониторинга, группа мониторинга гликемии из кончика пальца, группа мониторинга гликемии из ладони. Спустя 6 месяцев среднее значение HbA1с уменьшилось с 7,25 ± 0,77% до 7,02 ± 0,59% в группе самоконтроля из пальца (p < 0,05) и с 7,35 ± 0,7% до 7,19 ± 0,67% — в группе самоконтроля из ладони (p < 0.05). С другой стороны, среднее значение HbA1с достоверно увеличилось в группе контроля с 7,44 ± 0,74% до 7,75 ± 0,85% (p < 0,05). Таким образом, самоконтроль из пальца и самоконтроль из ладони приводили к дополнительному уменьшению уровня HbA1с по сравнению с контрольной группой на — 0,54% (95%ДИ: – 0,77; – 0,31, p < 0,05) и – 0,48% (95%ДИ: – 0,69; – 0,29, p < 0.05) соответственно [25].
В 2015 г. Young et al. было опубликовано РКИ, в котором 450 пациентов с СД 2 типа без терапии инсулином были рандомизированы в три группы — группа без контроля гликемии, контроль гликемии один раз в сутки, группа контроля гликемии один раз в сутки с использованием автоматических сообщений через глюкометр. Через 12 месяцев значимого различия между уровнем HbA1c обнаружено не было, при этом уровень HbA1c остался примерно на том же уровне, что и был исходно (подробнее — см. табл. 2). Помимо этого, не было обнаружено статистически значимой разницы между качеством жизни пациентов, частотой таких нежелательных явлений, как частота гипогликемии [26].
Отдельно следует отметить другое исследование, проведённое в Нидерландах, в которое было включено 58 пациентов с СД 2 типа, использовавших пероральную сахароснижающую терапию и инсулин сверхдлительного действия один раз в сутки, при этом в исследование были включены только пациенты с удовлетворительным контролем HbA1C (не более 7,5%) на протяжении не менее 12 месяцев. Участникам необходимо было измерять гликемию перед основными приемами пищи, а также перед сном с различной частотой в зависимости от рандомизации в одну из трех групп: измерение 4-х точек гликемии 1 раз в неделю, 1 раз в 2 недели, или 1 раз в месяц. Исследование продолжалось 9 месяцев, по истечении которых не было обнаружено значимых различий в HbA1С в трёх группах. Таким образом, вопрос о частоте мониторинга гликемии у пациентов с СД 2 типа, принимающих инсулин сверхдлительного действия один раз в сутки, остаётся открытым [27].
Мета-анализ Welschen et al., опубликованный в 2005 г., включил 6 РКИ для оценки эффектов мониторинга уровня глюкозы крови у пациентов с диабетом 2 типа, которые не используют инсулин. Было обнаружено статистически значимое снижение HbA1c — на 0,39% (95%ДИ: – 0,56%; – 0,21) в пользу мониторинга по сравнению с контрольной группой [28].
Систематический обзор McIntosh et al, 2010 г., включил 9 РКИ, в котором сравнивался самоконтроль уровня глюкозы в крови с отсутствием самоконтроля среди пациентов, принимающих пероральную сахароснижающую лекарственную терапию, средняя разница между группой мониторинга и контрольной группой составила – 0,25% (95%ДИ: – 0,36%; – 0,15%). Однако самоконтроль уровня глюкозы в крови не продемонстрировал преимуществ, с точки зрения качества жизни, удовлетворённости пациентов, предотвращения гипогликемии или долгосрочных осложнений диабета или снижения смертности [29].
Кокрейновский обзор, опубликованный в 2012 г., включил 12 РКИ (3259 пациентов со стажем СД 2 типа > 1 года) с продолжительностью наблюдения 6 – 12 мес.) показал, что самоконтроль достоверно снижает уровень HbA1С на 0,3% (95%ДИ: – 0,4%; – 0,1%) по сравнению с контрольной группой при наблюдении в течение 6 месяцев у пациентов со стажем СД не менее 1 года, однако при наблюдении 12 месяцев эта разница не была достоверной. У пациентов с вновь диагностированным СД 2 типа без терапии инсулина самоконтроль статистически достоверно снижал уровень HbA1c на 0,5% по сравнению с контрольной группой в течение 12 мес. Не было обнаружено доказательств влияния самоконтроля на удовлетворённость пациентов, их общего благополучия и качество жизни. Авторы обзора отмечали следующие недостатки исследований, включенных в обзор: небольшая продолжительность вмешательства, относительно небольшая выборка, низкое качество РКИ, открытый характер многих исследований [12].
Однако, в 2016 г. вышел обзор Zhu et al., который включил уже 15 РКИ (3383 пациента). В этом обзоре был показан положительный эффект самоконтроля уровня глюкозы не только в течение 6 месяцев, но и при наблюдении больше 12 месяцев у больных с вновь выявленным СД 2 типа, так и у больных со стажем. В субгруппе, где за пациентами наблюдали в течение 6 мес. (11 РКИ, 2249 пациентов), отмечалось достоверное снижение HbA1c – 0,36 (95%ДИ: – 0,47; – 0,25). В субгруппе, где за пациентами наблюдали более 12 мес. (9 РКИ, 1358 пациентов), это снижение было выражено меньше – 0,28 (95%ДИ: – 0,48; – 0.08). При этом анализ подгрупп показал, что у больных с вновь выявленным диагнозом самоконтроль более эффективно влияет на уровень гликированного гемоглобина, чем у пациентов со стажем заболевания больше года (– 0,54 (95%ДИ: – 0,75; – 0,33) против – 0,28 (95%ДИ: – 0,4; – 0,17). Таким образом, несмотря на сохраняющийся положительный эффект самоконтроля, с увеличением стажа заболевания этот эффект снижается [30].
С другой стороны, ретроспективный анализ данных 2988 пациентов с СД 2 типа, находящихся на ПСПП или диете, немецко-австрийской базы данных DPV-Wiss, отображающей реальную клиническую практику, показал что каждое дополнительное измерение уровня глюкозы в день при самоконтроле приводит к увеличению уровня HbA1c на 0,14% (p < 0,0001) [31].
Заключение
Если для пациентов на инсулине самоконтроль в первую очередь необходим для подбора дозы инсулина, то для тех пациентов, кто не получает инсулин, самоконтроль может использоваться для изменения образа жизни и диеты. По-видимому, самоконтроль влияет на психологическое состояние пациентов и их комплаенс. В онлайн-опросе более 500 пациентов СД 2 типа в Великобритании, 80% респондентов ответили, что самоконтроль уровня глюкозы позволяет им быть более уверенным, что их заболевание находится под контролем [32]. В то же время многие исследователи обращают внимание на то, что пациенты не знают, что делать с результатами самоконтроля при их отклонении от нормы [20][26].
Данные рассмотренных выше РКИ и систематических обзоров свидетельствуют о том, что самоконтроль у пациентов СД 2 типа, находящихся только на пероральной сахароснижающей терапии, важен и необходим пациентам c вновь диагностированным СД или не проводившим ранее регулярного самоконтроля. С увеличением стажа заболевания положительный эффект самоконтроля, по-видимому, уменьшается, что, вероятно, связано со снижением его психологического эффекта. Таким образом, у пациентов с длительным стажем диабета, достигших целевых значений HbA1c, проведение ежедневного самоконтроля может быть нецелесообразно и остаётся на усмотрение самого пациента и лечащего врача, в качестве альтернативного метода может быть использован контроль HbA1c каждые 3 мес.
Список литературы
1. Дедов И.И., Шестакова М.В., Майоров А.Ю., Викулова О.К., Галстян Г.Р., и др. «Алгоритмы специализированной медицинской помощи больным сахарным диабетом» Под редакцией И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова. 9-й выпуск. Сахарный диабет. 2019;22(1S1):1144. DOI: 10.14341/DM221S1
2. Freckmann G, Schmid C, Baumstark A, Pleus S, Link M, Haug C. System accuracy evaluation of 43 blood glucose monitoring systems for self-monitoring of blood glucose according to DIN EN ISO 15197. J Diabetes Sci Technol. 2012;6(5):106075. DOI: 10.1177/193229681200600510.
3. Анциферов М.Б., Котешкова О.М. Управление сахарным диабетом: организация и значение самоконтроля. Трудный пациент. 2009;7(10):41–46. eLIBRARY ID: 16908683
4. Peters ML, Huisman EL, Schoonen M, Wolff enbuttel BHR. Th e current total economic burden of diabetes mellitus in the Netherlands. Neth J Med. 2017;75(7):281-297. PMID: 28956787.
5. de Lagasnerie G, Aguadé AS, Denis P, Fagot-Campagna A, Gastaldi-Menager C. Th e economic burden of diabetes to French national health insurance: a new cost-of-illness method based on a combined medicalized and incremental approach. Eur J Health Econ. 2018;19(2):189-201. DOI: 10.1007/s10198-017-0873-y.
6. Дедов И.И., Калашникова М.Ф., Белоусов Д.Ю., Колбин А.С., Рафальский В.В., и др. Анализ стоимости болезни сахарного диабета 2 типа в Российской Федерации: результаты Российского многоцентрового наблюдательного фармакоэпидемиологического исследования ФОРСАЙТ-СД2. Сахарный диабет. 2017;20(6):403-419. DOI: 10.14341/DM9278
7. American Diabetes Association. Economic costs of diabetes in the U.S. in 2012. Diabetes Care. 2013;36(4):1033-46. DOI: 10.2337/dc12-2625.
8. Ulrich S, Holle R, Wacker M, Stark R, Icks A, et al. Cost burden of type 2 diabetes in Germany: results from the population-based KORA studies. BMJ Open. 2016;6(11):e012527. DOI: 10.1136/bmjopen-2016-012527.
9. Javanbakht M, Baradaran HR, Mashayekhi A, Haghdoost AA, Khamseh ME, et al. Cost-of-illness analysis of type 2 diabetes mellitus in Iran. PLoS One. 2011;6(10):e26864. DOI: 10.1371/journal.pone.0026864.
10. Закиев В.Д. Стоимость профилактики осложнений сахарного диабета 2 типа. Сборник тезисов XIII Международной (XXII Всероссийской) Пироговской научной медицинской конференции студентов и молодых ученых. Москва: ФГБОУ ВО РНИМУ им. Н.И. Пирогова, 2018 г.
11. National Prescribing Centre. Data focused commentary: type 2 diabetes: self-monitoring blood glucose 2012. Доступна по: http://www.npc.nhs.uk/therapeutics/cardio/diabetes_2/resources/dfc_self_monitoring_of_blood_glucose.pdf Ссылка активна на 10.12.2021.
12. Robson J, Smithers H, Chowdhury T, Bennett-Richards P, Keene D, et al. Reduction in self-monitoring of blood glucose in type 2 diabetes: an observational controlled study in east London. Br J Gen Pract. 2015;65(633):e256-63. DOI: 10.3399/bjgp15X684421.
13. Simon J, Gray A, Clarke P, Wade A, Neil A, et al. Cost eff ectiveness of self monitoring of blood glucose in patients with non-insulin treated type 2 diabetes: economic evaluation of data from the DiGEM trial. BMJ. 2008;336(7654):1177-80. DOI: 10.1136/bmj.39526.674873.BE.
14. Malanda UL, Welschen LM, Riphagen II, Dekker JM, Nijpels G, Bot SD. Self-monitoring of blood glucose in patients with type 2 diabetes mellitus who are not using insulin. Cochrane Database Syst Rev. 2012;1:CD005060. DOI: 10.1002/14651858.CD005060.pub3.
15. Stratton IM, Adler AI, Neil HA, Matthews DR, Manley SE, et al. Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): prospective observational study. BMJ. 2000;321(7258):40512. DOI: 10.1136/bmj.321.7258.405.
16. Дедов И.И., Шестакова М.В., Аметов А.С., Анциферов М.Б., Галстян Г.Р., и др. Инициация и интенсификация сахароснижающей терапии у больных сахарным диабетом 2 типа: обновление консенсуса совета экспертов Российской ассоциации эндокринологов (2015). Сахарный диабет. 2015;18(1):5-23. DOI: 10.14341/DM201515-23
17. Holstein A, Egberts EH. Risk of hypoglycaemia with oral antidiabetic agents in patients with Type 2 diabetes. Exp Clin Endocrinol Diabetes. 2003;111(7):405-14. DOI: 10.1055/s-2003-44287.
18. Schwedes U, Siebolds M, Mertes G; SMBG Study Group. Meal-related structured self-monitoring of blood glucose: eff ect on diabetes control in non-insulin-treated type 2 diabetic patients. Diabetes Care. 2002;25(11):1928-32. DOI: 10.2337/diacare.25.11.1928.
19. Guerci B, Drouin P, Grangé V, Bougnères P, Fontaine P, et al. Self-monitoring of blood glucose signifi cantly improves metabolic control in patients with type 2 diabetes mellitus: the Auto-Surveillance Intervention Active (ASIA) study. Diabetes Metab. 2003;29(6):587-94. DOI: 10.1016/s1262-3636(07)70073-3.
20. Davidson MB, Castellanos M, Kain D, Duran P. Th e eff ect of self monitoring of blood glucose concentrations on glycated hemoglobin levels in diabetic patients not taking insulin: a blinded, randomized trial. Am J Med. 2005;118(4):422-5. DOI: 10.1016/j.amjmed.2004.12.006.
21. Farmer A, Wade A, Goyder E, Yudkin P, French D, et al. Impact of self monitoring of blood glucose in the management of patients with non-insulin treated diabetes: open parallel group randomised trial. BMJ. 2007;335(7611):132. DOI: 10.1136/bmj.39247.447431.BE.
22. Barnett AH, Krentz AJ, Strojek K, Sieradzki J, Azizi F, et al. Th e effi cacy of self-monitoring of blood glucose in the management of patients with type 2 diabetes treated with a gliclazide modifi ed release-based regimen. A multicentre, randomized, parallel-group, 6-month evaluation (DINAMIC 1 study). Diabetes Obes Metab. 2008;10(12):1239-47. DOI: 10.1111/j.1463-1326.2008.00894.x.
23. O’Kane MJ, Bunting B, Copeland M, Coates VE; ESMON study group. Efficacy of self monitoring of blood glucose in patients with newly diagnosed type 2 diabetes (ESMON study): randomised controlled trial. BMJ. 2008;336(7654):1174-7. DOI: 10.1136/bmj.39534.571644.BE.
24. Kleefstra N, Hortensius J, Logtenberg SJ, Slingerland RJ, Groenier KH,. Self-monitoring of blood glucose in tablettreated type 2 diabetic patients (ZODIAC). Neth J Med. 2010;68(1):311-6. PMID: 20739728.
25. Harashima S, Fukushima T, Sasaki M, Nishi Y, Fujimoto S, et al. Self-monitoring of blood glucose (SMBG) improves glycaemic control in oral hypoglycaemic agent (OHA)treated type 2 diabetes (SMBG-OHA study). Diabetes Metab Res Rev. 2013;29(1):77-84. DOI: 10.1002/dmrr.2363.
26. Young LA, Buse JB, Weaver MA, Vu MB, Mitchell CM, et al. Glucose Self-monitoring in Non-Insulin-Treated Patients With Type 2 Diabetes in Primary Care Settings: A Randomized Trial. JAMA Intern Med. 2017;177(7):920-929. DOI: 10.1001/jamainternmed.2017.1233.
27. Hortensius J, Kleefstra N, Landman GWD, Houweling BT, Groenier KH, et al. Eff ects of three frequencies of selfmonitored blood glucose on HbA1c and quality of life in patients with type 2 diabetes with once daily insulin and stable control: a randomized trial. BMC Res Notes. 2018;11(1):26. DOI: 10.1186/s13104-018-3138-7.
28. Welschen LM, Bloemendal E, Nijpels G, Dekker JM, Heine RJ, et al Self-monitoring of blood glucose in patients with type 2 diabetes who are not using insulin: a systematic review. Diabetes Care. 2005;28(6):1510-7. DOI: 10.2337/diacare.28.6.1510.
29. McIntosh B, Yu C, Lal A, Chelak K, Cameron C, et al. Efficacy of self-monitoring of blood glucose in patients with type 2 diabetes mellitus managed without insulin: a systematic review and meta-analysis. Open Med. 2010;4(2):e102-13. PMID: 21686299; PMCID: PMC3116681.
30. Zhu H, Zhu Y, Leung SW. Is self-monitoring of blood glucose eff ective in improving glycaemic control in type 2 diabetes without insulin treatment: a meta-analysis of randomised controlled trials. BMJ Open. 2016;6(9):e010524. DOI: 10.1136/bmjopen-2015-010524.
31. Schütt M, Kern W, Krause U, Busch P, Dapp A, et al. Is the frequency of self-monitoring of blood glucose related to long-term metabolic control? Multicenter analysis including 24,500 patients from 191 centers in Germany and Austria. Exp Clin Endocrinol Diabetes. 2006;114(7):384-8. DOI: 10.1055/s-2006-924152.
32. Barnard KD, Young AJ, Waugh NR. Self monitoring of blood glucose - a survey of diabetes UK members with type 2 diabetes who use SMBG. BMC Res Notes. 2010;3:318. DOI: 10.1186/1756-0500-3-318.
Об авторах
В. Д. ЗакиевРоссия
Закиев Вадим Дмитриевич - врач-кардиолог консультативного отделения.
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
В. Р. Мустафина
Россия
Мустафина Виолетта Рафаэлевна - врач-эндокринолог терапевтического отделения.
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Рецензия
Для цитирования:
Закиев В.Д., Мустафина В.Р. Самоконтроль гликемии у больных сахарным диабетом 2 типа с позиций доказательной медицины. Медицинский вестник Юга России. 2022;13(1):43-51. https://doi.org/10.21886/2219-8075-2022-13-1-43-51
For citation:
Zakiev V.D., Mustafina V.R. Self-monitoring of blood glucose in patients with type 2 diabetes mellitus from the standpoint of evidence-based medicine. Medical Herald of the South of Russia. 2022;13(1):43-51. (In Russ.) https://doi.org/10.21886/2219-8075-2022-13-1-43-51
JATS XML







































