Перейти к:
Оценка эффектов терапии иДПП4 на функциональное состояние α- и β-клеток у пациентов с сахарным диабетом 2 типа
https://doi.org/10.21886/2219-8075-2022-13-1-88-97
Аннотация
Цель: оценить эффекты иДПП4 на секрецию инсулина, глюкагона натощак и постпрандиально, изучив базальную секрецию и ответ на пищевую нагрузку.
Материалы и методы: пациенты (n=54) были разделены по группам в зависимости от характера терапии (длительный (более года) приём иДПП4 в комбинации с Метформином, Метформин+препарат сульфонилмочевины, впервые начатая терапия иДПП4). Были исследованы биохимические показатели, уровни инсулина, глюкагона, С-пептида до и после стандартного завтрака, рассчитаны индексы НОМА IR и НОМА β.
Результаты: мы получили значимую разницу между группами приема иДПП4 более года и Метформином+СМ по уровню глюкагона и инсулина натощак, однако показатели инсулина были в пределах нормы в обеих группах. Кроме того, после 6 месяцев впервые начатой терапии иДПП4 снижались уровни инсулина как до, так и после стандартного завтрака, С-пептида после стандартного завтрака и глюкагона натощак.
Выводы: полученные данные свидетельствуют о способности иДПП4 положительно влиять на два наиболее ранних и высокозначимых звена патогенеза СД2 типа.
Ключевые слова
Для цитирования:
Тучина Т.П., Колчанова Я.А., Мелтонян А.Р., Абрамян Л.К., Бабенко А.Ю., Галагудза М.М. Оценка эффектов терапии иДПП4 на функциональное состояние α- и β-клеток у пациентов с сахарным диабетом 2 типа. Медицинский вестник Юга России. 2022;13(1):88-97. https://doi.org/10.21886/2219-8075-2022-13-1-88-97
For citation:
Tuchina T.P., Kolchanova I.A., Meltonyan A.R., Abramyan L.K., Babenko A.Yu., Galagudza M.M. Evaluation eff ects of IDPP4 therapy diff erent duration on the functional state of α- and β- cells in patients with type 2 diabetes mellitus. Medical Herald of the South of Russia. 2022;13(1):88-97. (In Russ.) https://doi.org/10.21886/2219-8075-2022-13-1-88-97
Введение
В настоящее время число пациентов с сахарным диабетом 2 типа (СД 2 типа) продолжает увеличиваться во всем мире. Как известно, СД 2 типа является одним из социально значимых заболеваний, которые непосредственно или при развитии осложнений могут привести к смерти пациента. Одни из основных патогенетических факторов СД 2 типа – инсулинорезистентность и гиперинсулинемия. [1]
Согласно современным данным, не только инсулинорезистентность, оценённая по индексу НОМА-IR, но и гиперинсулинемия (уровень инсулина выше 15 мЕ/л) ассоциирована с повышением риска сердечно-сосудистых заболеваний и событий. Одной из современных групп препаратов, оказывающих многоплановое влияние на механизмы развития и прогрессирования СД 2 типа, являются ингибиторы дипептидилпептидазы-4 (иДПП4). Для данной группы препаратов показано положительное влияние на секрецию инсулина, однако, кроме доказанного в ряде экспериментальных и клинических исследований положительного влияния на секреторную функцию β-клеток, обсуждалось и снижение активности α-клеток через улучшение секреции инкретинов. [2]
Эти эффекты изучались в нескольких рандомизированных клинических исследованиях, в которых иДПП4 назначались как монотерапия или в добавление к другим классам сахароснижающих препаратов. Часто оценка затрагивала только изучение концентрации инсулина и глюкагона натощак. В реальной клинической практике такие работы не проводились, поэтому мы провели исследование, в котором оценили эффекты иДПП4 на секрецию инсулина, глюкагона натощак и постпрандиально, изучив таким образом как базальную секрецию, так и ответ на пищевую нагрузку. Известно, что поспрандиальные метаболические нарушения оказывают влияние на прогрессирование эндотелиальной дисфункции, поэтому коррекция именно поспрандиальных изменений имеет большое клиническое значение. [3][4] Кроме того, мы оценивали эффекты терапии иДПП4 разной длительности, включая в исследование пациентов на старте терапии иДПП4 и при длительном приеме данной группы препаратов.
Мы изучали секреторную функцию β-клеток путем оценки динамики уровня инсулина и С-пептида до и после пищевой нагрузки, а также по индексу НОМА-β. Использование различных методов определяется тем, что индексы НОМА позволяют достаточно корректно оценивать инсулинрезистентность и резерв β-клетки у пациентов на додиабетических стадиях. У пациентов с СД 2 типа, получающих различные варианты терапии, имеющие крайне вариабельный уровень глюкозы, точность этих методов низка, что определило необходимость оценки динамики инсулина и С-пептида в пробе со стандартным завтраком в нашем исследовании. Для оценки функции α-клеток определяли уровень глюкагона до и после стандартного завтрака.
Как уже было сказано выше, инсулинорезистентность — один из основных патогенетических факторов развития СД 2 типа и его осложнений, и ее оценка также была запланирована в нашем исследовании. Мы оценивали инсулинорезистентность по индексу НОМА-IR.
Цель исследования — оценить эффекты иДПП4 на секрецию инсулина, глюкагона натощак и постпрандиально, изучив базальную секрецию и ответ на пищевую нагрузку.
Материалы и методы
Все участники исследования подписывали информированное согласие. Протокол исследования был одобрен Этическим Комитетом НМИЦ им. В.А. Алмазова.
В период с апреля 2019 г. по декабрь 2020 г. в одномоментное поперечное исследование было включено 54 больных СД 2 типа, соответствующих критериям включения. Пациенты первой группы получали терапию иДПП4 длительностью более года. Пациенты второй группы впервые начинали терапию иДПП4 в добавление к терапии Метформином. Группа контроля получала комбинацию Метформина и препарата сульфонилмочевины(СМ) более года. Дизайн клинического исследования представлен на рис. 2.
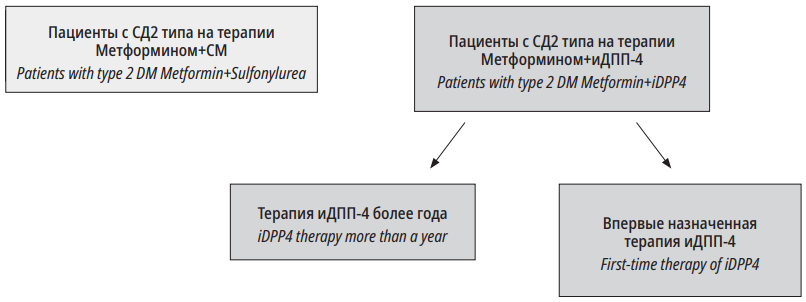
Рисунок 1. Дизайн исследования
Figure 1. Research design
У пациентов оцениваются биохимические показатели, представленные в табл. 1.
Таблица / Table 1
Дизайн исследования
Research design
|
Исследования / Researches Группы / Groups |
Глюкоза крови, гликированный гемоглобин, инсулин, глюкагон, С-пептид натощак и после стандартного завтрака Blood glucose, glycated hemoglobin, insulin, glucagon, C-peptide on an empty stomach and after a standard breakfast |
||
|
Исходно 1st visit |
6 мес. 6 months |
12 мес. 12 months |
|
|
Метформин+СМ, n=18 Metformin+sulfonylurea, n=18 |
+ |
|
|
|
Метформин+иДПП4(более года), n=18 Metformin+IDPP4(more than a year), n=18 |
+ |
|
|
|
Метформин+иДПП4(впервые), n=18 Metformin+IDPP4(for the first time), n=18 |
+ |
+ |
|
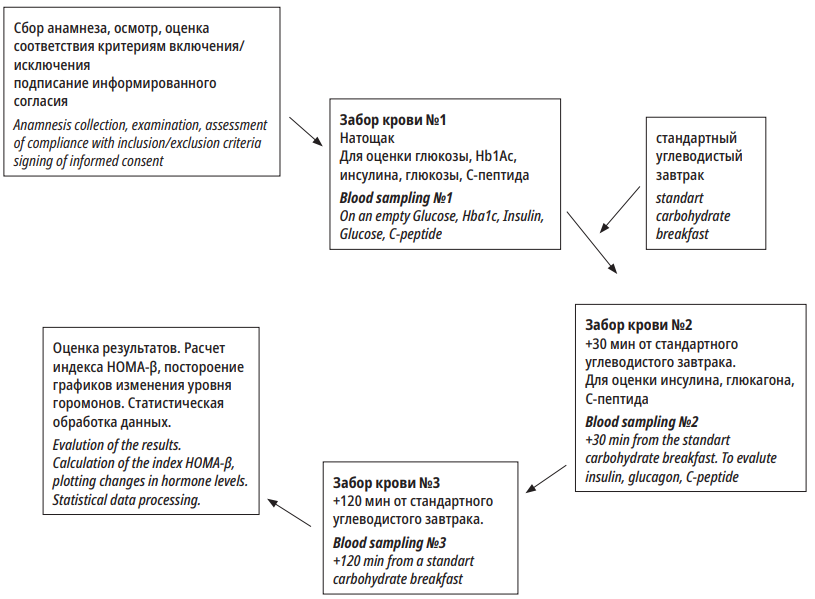
Рисунок 2. Схема визита
Figure 2. Visit plan
Общая характеристика обследованных участников и дизайн исследования
Критерии включения в исследование:
- Длительность СД 2 типа более 3 лет.
- Возраст пациентов 45–75 лет.
- Стабильная гипотензивная, гиполипидемическая терапия в течение трёх месяцев до включения в исследование.
Для группы Метформин+иДПП4 (более года) — пациенты с СД 2 типа, которые получают терапию препаратами группы бигуанидов в комбинации с препаратами иДПП4 более года.
Для группы Метформин+иДПП4 (впервые) — пациенты на монотерапии Метформином, которым впервые назначен иДПП4.
Для группы Метформин+СМ — пациенты с СД 2 типа на терапии препаратами группы бигуаниды в комбинации с препаратами сульфонилмочевины более года, никогда не получавшие иДПП4.
Критерии исключения:
- Серьёзная декомпенсация сопутствующих заболеваний.
- Абсолютная инсулинопения (С-пептид менее 0,25 нг/мл).
- Инсулинотерапия, долговременная терапия другими группами АДП (более трёх месяцев и в период менее 6 месяцев до включения в исследование).
- Некорректируемая дислипидемия.
- Указания на злоупотребление алкоголем.
- ИМТ ≥40 кг/м².
- Онкологические заболевания в анамнезе без стойкой ремиссии в течение двух лет.
- Системные аутоиммунные заболевания; терапия иммуносупрессантами, иммуномодуляторами, биологическими препаратами и т.п.
- Низкая комплаентность пациента.
- Беременность, лактация.
- Указания на непереносимость компонентов препаратов Метформина/СМ/иДПП4.
Критерии досрочного исключения в ходе проспективного исследования:
- Большие хирургические вмешательства, обширные травмы, тяжёлые инфекции, острые состояния.
- Назначение/смена антигипертензивной, гиполипидемической терапии в течение всего срока исследования.
Обследование пациентов включало сбор анамнеза, жалоб, оценку медицинской документации, анализ постоянной медикаментозной терапии, статус курения. Анализировался самоконтроль гликемии пациентом, компенсация СД 2 типа.
Пациенты с сопутствующими заболеваниями, в том числе с сердечно-сосудистой патологией, продолжили получать ранее назначенную соответствующую терапию.
Производилось измерение АД с помощью измерителя тонометра Healthcare CS-105 (Россия) после 5 мин. отдыха дважды с десятиминутным интервалом. В анализ включалось среднее значение. Осуществлялось измерение роста при помощи ростомера РМ-1 «Диакомс». Масса тела измерялась на медицинских электронных весах ВЭМ-150-«Масса-К» однократно с точностью до 100 г.
Лабораторные методы обследования
Лабораторные исследования выполняли в лаборатории ЛРК-1/КПК ФГБУ НМИЦ им. В.А. АлмазоваЗабор крови из локтевой вены осуществлялся натощак, через 30 мин. и 2 часа после углеводной нагрузки (стандартный завтрак, эквивалентный 75г глюкозы) на каждом визите (3 точки) (табл. 2). Забор крови на гликированный гемоглобин осуществлялся в вакутейнер с ЭДТА-К2, на биохимическом анализаторе Cobas Integra 400 plus (Roche Diagnostics, США) с использованием коммерческих наборов Cobas Integra, Roche (Германия).
Забор крови на инсулин, глюкагон, С-пептид осуществлялся в вакутейнеры с К3ЭДТА и апротинином. Транспортировка крови от процедурного кабинета до лаборатории осуществлялась с помощью аккумулятора холода (хладоэлемент) (Северок 400, Россия). Для получения сыворотки кровь центрифугировали 15 мин. при 3000 об./мин. при температуре 4°C. Получившуюся сыворотку хранили при -70°C. После размораживания производили определение в сыворотке инсулина, глюкагона, С-пептида (производство Peninsula, метод Elisa). Норма гликированного гемоглобина — до 6%. Уровень инсулина натощак в норме — 22–123 пмоль/л.
Норм для постпрандиального уровня инсулина нет, однако считается, что повышение уровня инсулина в 2 раза по сравнению с базальным уровнем является признаком сохранного резерва β-клеток. Нормальными значениями для С-пептида являются 0,78–1,89 нг/мл. Референсные значения глюкагона — 75–140 пг/мл.
Для расчета индекса НОМА IR пользовались формулой инсулин н/т*глюкозу натощак/22,5. Для оценки резерва функции β-клеток использовались индекс НОМА β = 20×инсулин натощак/(глюкоза натощак — 3,5).
Считается, что норма индекса HOMA β у здорового человека старше 35 лет — 100%, норма HOMA IR в таких же условиях — -1,0, о наличии инсулинорезистентности свидетельствует HOMA IR более 2,5.
Статистический анализ
После окончания исследования проводилась обработка полученных данных c использованием программной системы IBM SPSS STATISTICA для Windows. Для сравнения данных использовался критерий Манна-Уитни. Результаты представлены в виде медианы и квартилей (Ме, 25% квартиль – 75% квартиль). Статистически значимыми считаются результаты для которых р<0,05 с учетом поправки Бонферрони. Для многофакторного анализа была использована модель линейной регрессии.
Результаты
Сравнение секреции гормонов, характеризующих функцию поджелудочной железы, уровня гликированного гемоглобина, показателей индексов HOMA β и HOMA IR проводилось у пациентов длительно получающих иДПП4+Метформин и контрольной группой пациентов, получающих Метформин+СМ. Кроме того, проводилось изучение динамики изменения секреции гормонов, уровня гликированного гемоглобина, показателей индексов HOMA β и HOMA IR в группе пациентов, начавших прием иДПП4 впервые. В табл. 2 представлены сводные данные по группам и по времени измерения показателя.
Таблица / Table 2
Полученные результаты измерения уровней инсулина, глюкагона, С-пептида, гликированного гемоглобина, индексов HOMA β и HOMA IR по группам, до и через 30 и 120 мин. после стандартного завтрака
The obtained results of measuring the levels of insulin, glucagon, c-peptide, glycated hemoglobin, HOMA β and HOMA IR indices by groups, before and after 30 and 120 minutes after a standard breakfast
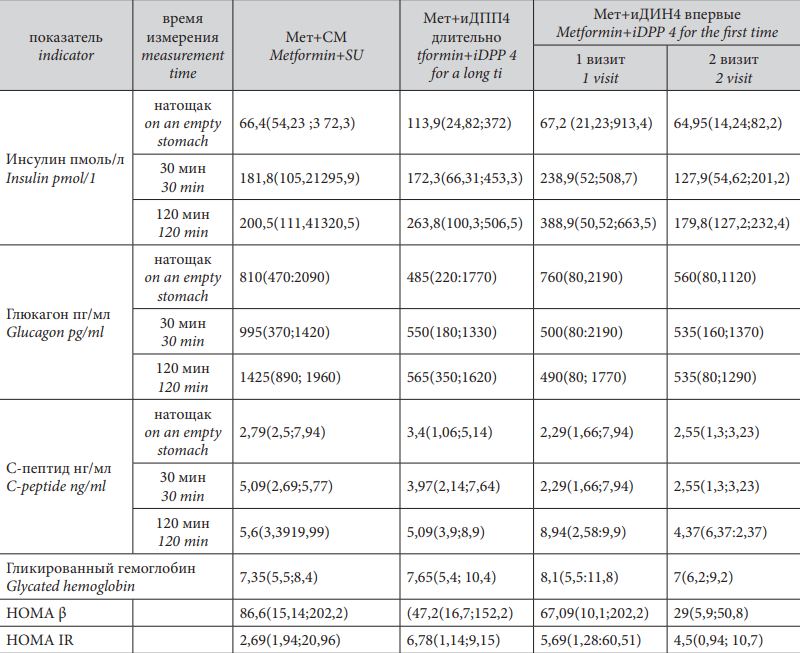
Уровни гликированного гемоглобина не различались в группах Метформин+СМ (7,35(5,5;8,4)) и Метформин+иДПП4 (7,65(5,4;10,4)), р>0,05.
В группе пациентов, впервые начавших прием иДПП4 в дополнение к монотерапии Метформином, уровень гликированного гемоглобина на первом визите составил 8,1(5,5;11,8), а к второму визиту отмечено значимое снижение его уровня 7(6,2;9,2), p<0,05.
Оценка секреции инсулина
Выявлены значимые различия показателей инсулина натощак в группах, получавших Метформин и иДПП4 длительное время (113,9(24,82;372 пмоль/л) и Метформин+СМ(66,4(54,23;372,3 пмоль/л) (р<0,05). Однако следует отметить, что в обеих группах показатели находятся в норме.
Значимых различий в постпрандиальном уровне инсулина выявлено не было.
В то же время при сравнении динамики уровня инсулина натощак и после стандартного завтрака до добавления иДПП4 и через шесть месяцев терапии были выявлены статистически значимые различия как в уровне инсулина натощак, так и в постпрандиальной динамике. При этом уровень инсулина натощак стал значимо ниже (1-й визит — 67,2 (21,23;913,4) пмоль/л, 2-й визит — 64,95(14,24;82,2) пмоль/л, р=0,0425. Однако оба показателя — в пределах референсных значений для инсулина.
Через 30 мин. после нагрузки уровень инсулина на первом визите также был значимо выше (238,9 (52;508,7)), чем на втором (127,9 (54,62;201,2)), р <0,05.
Через 120 мин. после нагрузки уровень инсулина на первом визите вновь оказался значимо выше (388,9 (50,52;663,5)), чем на втором (179,8 (127,2;232,4)), р <0,05.
Следует отметить, что у этих пациентов (до назначения иДПП4) был значимо более высокий уровень гликемии (HbA1c 8,1).
Оценка секреции С-пептида
При сравнении исходного уровня С-пептида в группах Метформин+СМ и Метформин+иДПП4 не было выявлено значимых различий ни натощак, ни после нагрузки.
При сравнении динамики уровня С-пептида натощак и после пищевой нагрузки до добавления иДПП4 и через шесть месяцев терапии были выявлены статистически значимые различия в уровне С-пептида через 120 мин., который стал значимо ниже (первыйй визит — 8,94 (2,58;9,9) нг/мл), второй — 4,37 (6,37;2,37) нг/мл, р <0,05.
Оценка секреции глюкагона
При оценке секреторной функции α-клеток было показано, что во всех обследованных группах отмечалась выраженная гиперглюкагонемия натощак, хотя в группе Метформин+СМ (810 (470;2090)) она был значительно выше, чем в группе Метформин+иДПП4 (485 (220;1770)), р <0,05, несмотря на сопоставимый контроль гликемии. Значимых различий в уровне глюкагона после стандартного завтрака выявлено не было.
При сравнении динамики уровня глюкагона до добавления иДПП4 и через шесть месяцев терапии были выявлены статистически значимые различия в его уровне натощак (первый визит — 760 (80,2190), второй — 560 (80,1120) р<0,05), который значимо снизился в процессе терапии иДПП4. Статистически значимых различий в уровне глюкагона через 30 и 120 мин. после стандартного завтрака выявлено не было.
Таким образом, выраженная гиперглюкагонемия отмечена во всех лечебных группах, однако терапия иДПП4 была ассоциирована со значительно меньшей её выраженностью как на ранних сроках терапии (6 мес.), так и в процессе длительного лечения.
Оценка индексов HOMA β и HOMA IR
Индекс НОМА β значимо не различался в группах Метформин+СМ 86,6 (15,14;202,2), и Метформин+иДПП4 (47,2 (16,7;152,2)), р >0,05, как и индекс НОМА-IR р >0,05.
Несмотря на значимую динамику уровня инсулина в группе впервые получивших иДПП4 в добавление к Метформину значимой динамики индекса НОМА β (на первом визите 67,09 (10,1;202,2), на втором 29 (5,9;50,8), р>0,05 и индекса НОМА IR р >0,05 отмечено не было.
Многофакторный анализ
Оценено влияние длительности СД, возраста, пола, фенотипа, ИМТ, длительности терапии, индексов НОМА B и НОМА IR, гликированного гемоглобина, уровня глюкозы натощак на показатели и динамику изменений инсулина, глюкагона, C-пептида.
Была построена модель линейной регрессии (табл. 3).
Таблица / Table 3
Результаты многофакторного анализа (оценивалось влияние различных факторов на показатели инсулина до (А) и после(В) стандартного завтрака)
Results of multivariate analysis (the influence of various factors on insulin parameters before and after a standard breakfast was evaluated)
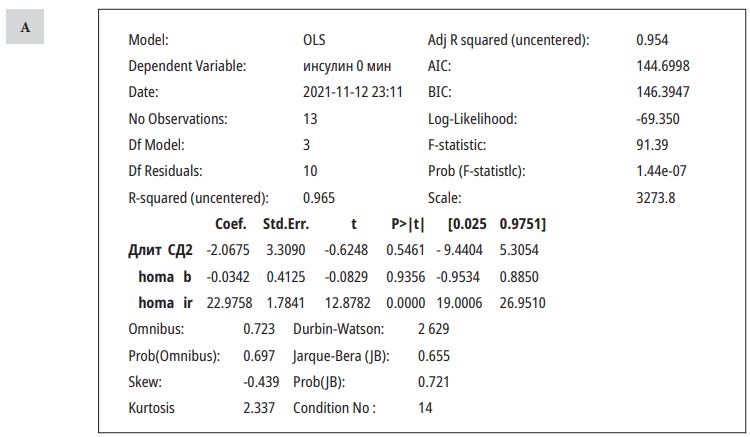
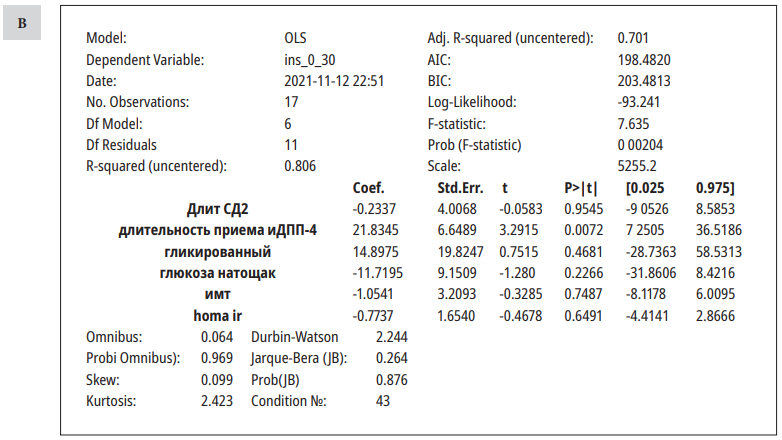
На показатель инсулина натощак значимо влиял показатель индекса HOMA IR, после стандартного завтрака — длительность терапии иДПП4. Другие показатели не оказывали влияния на уровни инсулина.
Оценка вклада вышеперечисленных параметров на уровни глюкагона и С-пептида не выявила значимых связей.
Обсуждение
В исследованиях последних лет выявляют пять стадий в развитии СД 2 типа. Наиболее ранними, формирующимися ещё до развития нарушений углеводного обмена изменениями являются гиперинсулинемия/инсулинрезистентность и гиперглюкагонемия. [5] Эти изменения в высокой степени детерминируют все последующие патологические изменения, ведущие как к развитию гипергликемии и СД 2 типа, так и к развитию сосудистых осложнений СД 2 типа. Полученные в настоящем исследовании результаты позволяют сделать вывод о положительном влиянии терапии иДПП4 на секрецию инсулина, глюкагона.
Добавление к терапии Метформином иДПП4 впервые оказывало положительное влияние на концентрацию инсулина, С-пептида и глюкагона. Это сопровождалось снижением выраженности гиперинсулинемии и гиперглюкагонемии, что может свидетельствовать о тенденции к нормализации функции α- и β-клеток, отмеченной нами ранее в экспериментальных исследованиях. [6] Уровень инсулина натощак у пациентов, длительно получающих иДПП4, был выше, чем у пациентов, длительно получавших СМ, а дельта между тощаковым и постпрандиальным уровнем инсулина была меньше. Это может свидетельствовать как о начале формирования истощения резерва β-клеток на терапии СМ, так и о презервации β-клеточной функции на иДПП4. При этом значения уровня инсулина не выходили за пределы нормы в обеих группах. Подобные эффекты иДПП4 подтверждаются экспериментальными и клиническими исследованиями.
По данным литературы, иДПП4 способны увеличивать репликацию β-клеток и ингибировать их апоптоз. [7][8] В некоторых работах даже высказывалось предположение, что препараты данной группы могут не только улучшать функцию оставшихся β-клеток, но и стимулировать образование новых β-клеток у больных СД 2 типа. [9]
Выявлено, что через глюкагоноподобный пептид-1 (ГПП1) иДПП4 также способствует клеточной дифференцировке из незрелых клеток предшественников островковых клеток в β-клетки или редифференцировке из других типов экзокринных клеток. [10] Согласно данным литературы, ГПП1 стимулирует транскрипцию циклина D1, необходимого для G1- и S-фазы клеточного цикла. [11,12] При этом исследования показали, что пролиферативный и антиапоптотический эффекты ГПП1 могут быть достигнуты фармакологическими, но не физиологическими концентрациями инкретинов [13]. Также сохранение массы β-клеток может проявляться за счёт антиапоптотического эффекта ГПП1, он может способствовать прямому сопротивлению апоптозу в клетках, экспрессирующих его рецепторы. [14] В одном из исследований выявили, что ГПП1 задерживает морфологические изменения, которые произошли в человеческих островках при СД 2 типа. Это происходит, вероятно, за счёт повышения экспрессии антиапоптотического белка bcl-2 и пониженной секреции активной формы каспазы-3. [8]
Снижение патологической секреции глюкагона происходит, возможно, за счёт механизма паракринного взаимодействия α и β-клеток. В некоторых исследованиях подтверждалось, что α- и β-клетки поджелудочной железы находятся в паракринных взаимодействиях, регулируя число и функцию друг друга. Было показано, что нормализация функции β-клеток может приводить к ингибированию активности α-клеток. [15] Известно, что при неконтролируемом СД 2 типа возрастает уровень глюкагона [16], что может отражать общую дисфункцию островков поджелудочной железы. Однако мы не обнаружили значимой зависимости между степенью контроля СД 2 типа и уровнем глюкагона, в то время как связь с характером терапии присутствовала. Кроме того, повышение секреции глюкагона может быть потенциальным показателем степени трансдифференцировки α- и β-клеток. Трансдифференцировка β-клеток определяется как потеря их фенотипа, превращение в совершенно новую островковую эндокринную клетку, которой присуща секреция не только инсулина, но и глюкагона. [17]
Таким образом, данные изменения при впервые начатой терапии иДПП4 могут быть связаны с тем, что происходит трансдифференцировка глюкагон-продуцирующих клеток в инсулин-продуцирующие.
Заключение
Мы не обнаружили статистически значимой динамики функции β-клеток по индексу НОМА-β, что ещё раз подчеркивает более низкую ценность этого показателя у пациентов с СД 2 типа на фоне медикаментозной терапии
В целом, полученные данные свидетельствуют о способности иДПП4 влиять на два наиболее ранних и высокозначимых звена патогенеза СД 2 типа, в том числе оказывающих выраженное влияние на риск развития сердечно-сосудистых заболеваний у пациентов с СД 2 типа.
Список литературы
1. Shanik MH, Xu Y, Skrha J, Dankner R, Zick Y, Roth J. Insulin resistance and hyperinsulinemia: is hyperinsulinemia the cart or the horse? Diabetes Care. 2008;31 Suppl 2:S262-8. DOI: 10.2337/dc08-s264
2. Herman GA, Stein PP, Th ornberry NA, Wagner JA. Dipeptidyl peptidase-4 inhibitors for the treatment of type 2 diabetes: focus on sitagliptin. Clin Pharmacol Th er. 2007;81(5):761-7. DOI: 10.1038/sj.clpt.6100167
3. Sorkin JD, Muller DC, Fleg JL, Andres R. Th e relation of fasting and 2-h postchallenge plasma glucose concentrations to mortality: data from the Baltimore Longitudinal Study of Aging with a critical review of the literature. Diabetes Care. 2005;28(11):2626-32. DOI: 10.2337/diacare.28.11.2626
4. Woerle HJ, Neumann C, Zschau S, Tenner S, Irsigler A, et al. Impact of fasting and postprandial glycemia on overall glycemic control in type 2 diabetes Importance of postprandial glycemia to achieve target HbA1c levels. Diabetes Res Clin Pract. 2007;77(2):280-5. DOI: 10.1016/j.diabres.2006.11.011
5. Rydén L., J. Grant P., D. Anker S., Berne C., Cosentino F., et al. Рекомендации по диабету, предиабету и сердечно-сосудистым заболеваниям. EASD/ESC. Российский кардиологический журнал. 2014;(3):7-61. DOI: 10.15829/1560-4071-2014-3-7-61
6. Taisiia Pavlovna T, Kseniia Petrovna S, Anna Anatolievna V, Ivan Sergeyevich U, Olga Vladimirovna R, et al. Dynamics of total volume of pancreatic α- and β -cells under the infl uence sulfonylureas and their combination with dipeptidyl peptidase-4 inhibitors. Endocrinol Diabetes Metab. 2021;4(3):e00238. DOI: 10.1002/edm2.238
7. Xu G, Stoff ers DA, Habener JF, Bonner-Weir S. Exendin-4 stimulates both beta-cell replication and neogenesis, resulting in increased beta-cell mass and improved glucose tolerance in diabetic rats. Diabetes. 1999;48(12):2270-6. DOI: 10.2337/diabetes.48.12.2270
8. Farilla L, Bulotta A, Hirshberg B, Li Calzi S, Khoury N, et al. Glucagon-like peptide 1 inhibits cell apoptosis and improves glucose responsiveness of freshly isolated human islets. Endocrinology. 2003;144(12):5149-58. DOI: 10.1210/en.2003-0323
9. Perfetti R, Zhou J, Doyle ME, Egan JM. Glucagon-like peptide-1 induces cell proliferation and pancreatic-duodenum homeobox-1 expression and increases endocrine cell mass in the pancreas of old, glucose-intolerant rats. Endocrinology. 2000;141(12):4600-5. DOI: 10.1210/endo.141.12.7806
10. Vasu S, Moff ett RC, Th orens B, Flatt PR. Role of endogenous GLP-1 and GIP in beta cell compensatory responses to insulin resistance and cellular stress. PLoS One. 2014;9(6):e101005. DOI: 10.1371/journal.pone.0101005
11. Friedrichsen BN, Neubauer N, Lee YC, Gram VK, Blume N, et al. Stimulation of pancreatic beta-cell replication by incretins involves transcriptional induction of cyclin D1 via multiple signalling pathways. J Endocrinol. 2006;188(3):481-92. DOI: 10.1677/joe.1.06160
12. Buteau J, Foisy S, Joly E, Prentki M. Glucagon-like peptide 1 induces pancreatic beta-cell proliferation via transactivation of the epidermal growth factor receptor. Diabetes. 2003;52(1):12432. DOI: 10.2337/diabetes.52.1.124
13. Miyawaki K, Yamada Y, Yano H, Niwa H, Ban N, et al. Glucose intolerance caused by a defect in the entero-insular axis: a study in gastric inhibitory polypeptide receptor knockout mice. Proc Natl Acad Sci U S A. 1999;96(26):14843-7. DOI: 10.1073/pnas.96.26.14843
14. Hui H, Nourparvar A, Zhao X, Perfetti R. Glucagon-like peptide-1 inhibits apoptosis of insulin-secreting cells via a cyclic 5’-adenosine monophosphate-dependent protein kinase A- and a phosphatidylinositol 3-kinase-dependent pathway. Endocrinology. 2003;144(4):1444-55. DOI: 10.1210/en.2002-220897
15. Briant LJB, Reinbothe TM, Spiliotis I, Miranda C, Rodriguez B, Rorsman P. δ-cells and β-cells are electrically coupled and regulate α-cell activity via somatostatin. J Physiol. 2018;596(2):197-215. DOI: 10.1113/JP274581
16. Gromada J, Franklin I, Wollheim CB. Alpha-cells of the endocrine pancreas: 35 years of research but the enigma remains. Endocr Rev. 2007;28(1):84-116. DOI: 10.1210/ er.2006-0007
17. Stefan Y, Orci L, Malaisse-Lagae F, Perrelet A, Patel Y, Unger RH. Quantitation of endocrine cell content in the pancreas of nondiabetic and diabetic humans. Diabetes. 1982;31(8 Pt 1):694-700. DOI: 10.2337/diab.31.8.694
Об авторах
Т. П. ТучинаРоссия
Тучина Таисия Павловна – младший научный сотрудник НИЛ диабетологии Института эндокринологии.
Санкт-Петербург
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Я. А. Колчанова
Россия
Колчанова Яна Андреевна - слушатель, НИЛ диабетологии Института эндокринологии.
Санкт-Петербург
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
А. Р. Мелтонян
Россия
Мелтонян Ася Робертовна - аспирант.
Санкт-Петербург
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Л. К. Абрамян
Россия
Абрамян Левон Кароевич – студент.
Санкт-Петербург
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
А. Ю. Бабенко
Россия
Бабенко Алина Юрьевна - доктор медицинских наук, главный научный сотрудник НИЛ диабетологии Института эндокринологи.
Санкт-Петербург
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
М. М. Галагудза
Россия
Галагудза Михаил Михайлович - доктор медицинских наук, проф., членкорреспондент РАН, директор Института экспериментальной медицины.
Санкт-Петербург
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Рецензия
Для цитирования:
Тучина Т.П., Колчанова Я.А., Мелтонян А.Р., Абрамян Л.К., Бабенко А.Ю., Галагудза М.М. Оценка эффектов терапии иДПП4 на функциональное состояние α- и β-клеток у пациентов с сахарным диабетом 2 типа. Медицинский вестник Юга России. 2022;13(1):88-97. https://doi.org/10.21886/2219-8075-2022-13-1-88-97
For citation:
Tuchina T.P., Kolchanova I.A., Meltonyan A.R., Abramyan L.K., Babenko A.Yu., Galagudza M.M. Evaluation eff ects of IDPP4 therapy diff erent duration on the functional state of α- and β- cells in patients with type 2 diabetes mellitus. Medical Herald of the South of Russia. 2022;13(1):88-97. (In Russ.) https://doi.org/10.21886/2219-8075-2022-13-1-88-97







































