Перейти к:
Случай поздней диагностики первичного гиперпаратиреоза с клиническим проявлением в виде фиброзно-кистозного остеита, осложнившего развитием гипокальциемии в послеоперационном периоде
https://doi.org/10.21886/2219-8075-2022-13-1-102-108
Аннотация
Фиброзно-кистозный остеит (ФКО) является редким, но тяжёлым проявлением первичного гиперпаратиреоза (ПГПТ). Представленный клинический случай демонстрирует позднюю диагностику ПГПТ, осложнённого развитием ФКО и нефрокальциноза со снижением СКФ до ХБП 4 стадии. Несвоевременная диагностика, длительно существующая продукция ПТГ и гиперкальцемия, некомпенсируемый дефицит 25(OH)D, а также использование внутривенных форм бисфосфонатов в высоких дозах явились причиной возникновения синдрома «голодных костей», развившегося в послеоперационном периоде. Тяжёлая гипокальцемия потребовала назначения не только пероральных нативных и активных форм витамина D, а также препаратов кальция, но и парентерального введения глюконата кальция в больших дозах. Поздняя диагностика ПГПТ не только способствует ухудшению состояния пациента, снижению качества жизни и его инвалидизации, но и провоцирует развитие тяжёлой гипокальциемии в послеоперационном периоде (синдром «голодных костей»).
Ключевые слова
Для цитирования:
Погосян К.А., Яневская Л.Г., Семенова А.Н., Молоткова М.А., Беркович Г.В., Рыжкова Д.В., Белоусова Л.В., Цой У.А. Случай поздней диагностики первичного гиперпаратиреоза с клиническим проявлением в виде фиброзно-кистозного остеита, осложнившего развитием гипокальциемии в послеоперационном периоде. Медицинский вестник Юга России. 2022;13(1):102-108. https://doi.org/10.21886/2219-8075-2022-13-1-102-108
For citation:
Pogosian K.A., Yanevskaya L.G., Semenova A.N., Molotkova M.A., Berkovich G.V., Ryzhkova D.V., Belousova L.V., Tsoi U.A. Hungry bone syndrome in delay diagnosed primary hyperparathyroidism with fi brocystic osteitis: A case report. Medical Herald of the South of Russia. 2022;13(1):102-108. (In Russ.) https://doi.org/10.21886/2219-8075-2022-13-1-102-108
Введение
Первичный гиперпаратиреоз (ПГПТ) является третьим по частоте эндокринным заболеванием [1]. Однако определение уровня кальция в сыворотке крови до настоящего времени не входит в состав рутинного обследования в Российской Федерации, в связи с чем манифестная форма заболевания продолжает преобладать среди клинической картины ПГПТ [2]. Фиброзно-кистозный остеит (ФКО), или «бурые опухоли», представляет собой поражение костной ткани с формированием очагов субпериостальной резорбции, связанное с повышением активности остеокластов с образованием кистозных полостей, замещением кости фиброзной тканью и грануляциями с отложением гемосидерина, вследствие чего очаги приобретают бурый оттенок [3]. Наличие множественных очагов резорбции в костях черепа, позвонках, трубчатых костях конечностей, а также в ребрах не только приводит к деформациям скелета, но и ассоциируется с наличием болезненности в области опухолей, припухлостей и (в некоторых случаях) переломов [4]. Более ста лет назад именно ФКО был классическим проявлением ПГПТ [5]. В настоящее время такое поражение костной ткани является довольно редкой формой ПГПТ в странах Северной Америки и Европы, однако всё ещё встречается у больных, проживающий в развивающихся странах, например в Индии [3][4]. За последние десятилетия распространённость поражения костей при ПГПТ значительно снизилась (с 80% до 15%) [6], на долю ФКО приходится примерно 5% среди пациентов с ПГПТ [6]. Наличие поражения костной системы, а именно ФКО, не только отрицательно влияет на качество жизни больных ПГПТ, но и повышает вероятность развития синдрома «голодных костей» со стойкой гипокальцемией и гипофосфатемией после паратиреоидэктомии [4]. Считается, что быстрое развитие гипокальцемии связано с нормализацией уровня паратиреоидного гормона (ПТГ) и прекращением стимуляции остеокластов, что способствует быстрому и массивному поглощению фосфата и кальция костной тканью из кровотока [7]. Таким образом, проблема своевременной диагностики ФКО является весьма актуальной и требует дополнительных знаний и навыков.
Цель исследования — представление клинического случая манифестного первичного гиперпаратиреоза с поражением костной ткани в виде фиброзно-кистозного остеита, а также развитием синдрома «голодных костей» после хирургического лечения.
Описание клинического случая
Пациентка З., 66 лет, поступила в отделение эндокринологии ФГБУ «НМИЦ им. В.А. Алмазова». Из анамнеза известно о наличии мочекаменной болезни в течение более 20 лет, с неоднократными почечными коликами, по поводу чего, со слов больной, неоднократно проводилась литотрипсия, обращают на себя внимание анамнестические указания на наличие двух низкотравматичных переломов правой и левой лучевой костей. Также в этот период впервые было зарегистрировано повышение уровня общего кальция крови, однако уровень ПТГ не определялся. Дополнительно к этим жалобам пациентка отмечала уменьшение роста в течение жизни со 168 см до 162 см, неустойчивость походки. В течение последнего года обратила внимание на появление «утиной» походки, снижение массы тела с 57 кг до 49 кг, а также изменений в анализах крови в виде повышения уровня креатинина и снижения СКФ до 38 мл/мин/1,732 (CKD-EPI). В связи с появлением новых жалоб было выполнено МРТ пояснично-крестцового отдела позвоночника, по результатам которого выявлены структурные изменения в телах позвонков L3 и L4. С учётом полученных результатов было рекомендовано проведение дифференциального диагноза между атипичными гемангиомами и вторичными изменениями тел позвонков, для уточнения диагноза было выполнено МСКТ поясничного отдела позвоночника, при котором обнаружены деструктивные изменения в позвонках грудного и поясничного отдела (Th12, L2–L5), в крестце и подвздошной кости слева. Данные изменения расценены как проявления множественной миеломы, в связи с чем было рекомендовано выполнение остеосцинтиграфии. На основании проведённого исследования и наличия признаков диффузного поражения скелета, проводилась дифференциальная диагностика между множественной миеломой, гемобластозами, метаболическими заболеваниями и вторичными поражениями костей.
Пациентке была выполнена трепанобиопсия костного мозга, по результатам которой данных о онкогематологической патологии получено не было. Дополнительное определение моноклонального парапротеина в сыворотке крови и в моче выявило негативный результат. Выше проведенное обследование позволило на данном этапе исключить диагноз множественной миеломы. Однако, учитывая максимальные изменения в теле позвонка L3, больной была выполнена трепанобиопсия, по результатам которой заподозрена гигантоклеточная опухоль, и больная для дообследования была направлена в профильное онкологическое учреждение. Также в этот период больной была начата терапия внутривенными бисфосонатами (золендроновая кислота 4 мг) 1 раз в 28 дней, которая проводилась на протяжении четырех месяцев. В дальнейшем при пересмотре гистологического материала трепанобиоптата образования тела позвонка L3 были выявлены признаки «бурой опухоли», и впервые заподозрен гиперпаратиреоз. С представлением о гиперпаратиреозе больная была консультирована эндокринологом НМИЦ им. В.А. Алмазова, выполнен контроль уровня ионизированного кальция сыворотки крови, показатели которого составили 2,24 ммоль/л (референсное значение 1,16–1,32 ммоль/л) и ПТГ — 1776 пг/мл (референсное значение 15–65 пг/мл). Больной была рекомендована госпитализация в отделение эндокринологии ФГБУ «НМИЦ им. В.А. Алмазова», а с целью снижения уровня кальция крови на амбулаторном этапе инициирована терапия петлевыми диуретиками.
При поступлении в отделение эндокринологии ФГБУ «НМИЦ им. В.А. Алмазова» повторно выполнено лабораторное обследование с определением уровня общего кальция — 3,86 ммоль/л (референсное значение 2,15–2,65 ммоль/л), ионизированного кальция — 2,17 ммоль/л (референсное значение 1,11–1,29 ммоль/л), ПТГ — 2306,9 пг/мл (референсное значение 15,0–68,3) (табл. 1). С целью снижения уровня кальция крови была инициирована инфузионная регидратационная терапия и терапия петлевыми диуретиками.
Таблица / Table 1
Лабораторные данные
Laboratory data
|
Показатель Parametr |
Референсное значение Normal range |
Исходные Baseline |
Интраоперационно Intraoperative |
На 2-ой день после ПТЭ 2 days after PTX |
На 5–6-й дни после ПТЭ 5-6 days after PTX |
|
Кальций ионизированный, ммоль/л Serum ionized calcium, mmol/L |
1,11–1,29 |
2,11 |
- |
1,29 |
0,98 |
|
Кальций общий, ммоль/л Serum total calcium, mmol/L |
2,15–2,65 |
3,97 |
3,66 |
2,51 |
1,65 |
|
ПТГ, пг/мл intact PTH, pg/mL |
15,0–68,3 |
2531,2 |
94,3 |
- |
45,8 |
|
Фосфор, ммоль/л Serum phosphorus, mmol/L |
0,81–1,45 |
1,08 |
- |
- |
1,0 |
|
Щелочная фосфотаза, ммоль/л Alkaline phosphatase, mmol/L |
<105,0 |
1144,1 |
- |
- |
3268,5 |
|
25(OH)D, нг/мл 25(OH)D, ng/mL |
9,4–59,1 |
10,8 |
- |
- |
- |
|
Креатинин крови, мкмоль/л Creatinine, mcmol/L |
53,0–106,0 |
158,7 |
- |
327,9 |
258,0 |
Примечание: ПТГ — паратиреоидный гормон, ПТЭ — паратиреоидэктомия, 25(ОН)D — 25-гидрокси витамин D
Notes: PTH — parathyroid hormone, PTX — parathyroidectomy, 25(ОН)D — 25-hydroxyvitamin D
Учитывая отсутствие данных о наличии образований ОЩЖ, по результатам проведённого УЗИ, топическая диагностика была расширена с включением МСКТ органов шеи и грудной клетки с контрастированием. По результатам МСКТ в передне-верхнем средостении, по срединной линии было визуализировано солидной структуры образование овальной формы размерами 3,0×2,1×4,8 см, с зоной кистозной трансформации, с участками обызвествления. Дополнительно ретротрахеально, по правой стенке пищевода на уровне средних отделов щитовидной железы обнаружено овальной формы образование размерами до 0,8×0,5×0,9 см, с чёткими ровными контурами. Оба выявленные образования могли соответствовать эктопированным образованиям ОЩЖ (рис. 1).
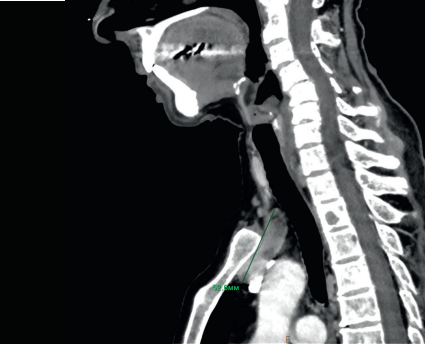
Рисунок 1. Результаты МСКТ шеи и грудной клетки с контрастированием
Figure 1. Neck and thorax CT-scan
С учётом дискордантных данных УЗИ и МСКТ для верификации расположения источников гиперпродукции ПТГ было решено выполнить ПЭТ-КТ с 11С-метионином всего тела, по результатам которого в ретростернальном пространстве за рукояткой грудины были визуализированы два объёмных образования, характеризующиеся высоким захватом РФП. Образование, расположенное краниально, выступало над яремной вырезкой на 17 мм, имело продолговатую форму, задней поверхностью прилежало к левой брахиоцефальной вене и брахиоцефальному стволу, размерами 21×11×25 мм. Образование, расположенное каудально, имело овальную форму, задней поверхностью прилежало к дуге аорты, с включением кальция и кистозным компонентом, размерами 32×16×21 мм. На серии ПЭТ-КТ томограмм костной системы зарегистрированы множественные очаги остеодеструкции, локализованные в рёбрах, обеих лопатках, в эпифизах обеих плечевых костей, в рукоятке грудины, в грудинной оконечности левой ключицы, телах Th3, Th11, L1, L3, правых поперечных отростках Th7, Th8, боковых массах крестца, костях таза, в эпифизах обеих бедренных костей, а также в диафизе правой бедренной кости (рис. 2).
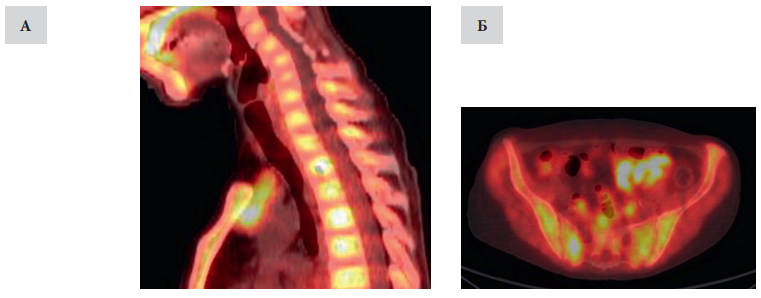
Рисунок 2. Результаты ПЭТ/КТ с 11С-метионином: метаболически активное мягкотканное образование, соответствующее аденоме нижней эктопированной ОЩЖ (А), патологическое образование подвздошной кости и крестца (Б)
Figure 2. PET-CT with 11С-methionin: pathological ectopic parathyroid gland on the left side (А), iliac and sacrum lesions (Б)
Таким образом, на основании проведённого лабораторного и инструментального исследований больной был подтвержден диагноз манифестной формы ПГПТ с поражением костной системы и почек. С учётом нарастания гиперкальцемии были определены показания для проведения гемодиализа, который был выполнен дважды в рамках предоперационной подготовки.
Больной была выполнена селективная паратиреоидэктомия. Данные гистологического исследования подтвердили наличие двух нижних эктопированных аденом ОЩЖ с правой и левой стороны. С учётом большого размера левого образования ОЩЖ, высоких значений ПТГ и тяжёлой гиперкальциемии в рамках проведения дифференциальной диагностики с аденокарциномой ОЩЖ был оценён индекс пролиферативной активности Ki67, который составил 0,5%. Данных о наличии периневрального роста (S-100) и лимфоваскулярной инвазии образования (CD34) также не получено.
Интраоперационный уровень ПТГ составил 94,3 пг/мл с последующим снижением до 45,83 пг/мл (табл. 1). В раннем послеоперационном периоде у больной наблюдались нормализация уровня общего (2,51 ммоль/л) и ионизированного (1,29 ммоль/л) кальция крови (табл. 1). Однако с третьих суток было отмечено значимое снижение уровня ионизированного кальция крови (0,85 ммоль/л), сопровождающиеся появлением клинической симптоматики в виде судорог в конечностях, болей в мышцах, появления галлюцинаций, общей слабости, брадикардии. По данным ЭКГ, отмечалось удлинение интервала QTс до 500 мс. Данные изменения были интерпретированы как развитие синдрома «голодных костей» на фоне длительно существующего ФКО, что потребовало назначение пероральных и парентеральных препаратов кальция (карбонат (3000 мг/сут.) и глюконат (максимально до 24 мг/сут.), нативная и активная формы витамина D (колекациферол 4000 МЕ/сут. и альфакальцидол до 4 мкг/сут.)). На четвёртые сутки после инициации терапии достигнута нормализация показателей кальция крови.
Таким образом, представленный клинический случай демонстрирует позднюю диагностику ПГПТ, клинически проявлявшегося фиброзно-кистозным остеитом, нефрокальцинозом со снижением СКФ до уровня ХБП 4 стадии и развитием синдрома «голодных костей» в послеоперационном периоде.
Обсуждение
Описанный клинический случай иллюстрирует позднюю диагностику ПГПТ, проявляющегося поражением внутренних органов в виде ФКО и нефрокальциноза. Как известно, длительное течение заболевания с выраженным повышением уровня ПТГ и кальция крови нередко приводит к тяжелому течению послеоперационного периода, сопровождающегося стойкой гипокальцемией в рамках, так называемого синдрома «голодных костей». Считается, что при ПГПТ это состояние связано с активным поглощением кальция костной тканью из кровотока на фоне удаления источника гиперпродукции ПТГ [8].
Доказано, что ПТГ осуществляет двойное действие на костную ткань. Взаимодействуя с рецепторами на остеобластах, он стимулирует костеобразование и таким образом осуществляет своё анаболическое действие. В то же время ПТГ стимулирует активацию остеокластов путем увеличения выработки рецептора-активатора ядерного фактора каппа-В (RANKL) и усиливает резорбцию кости [7]. При длительном преобладании костной резорбции наблюдается формирование литических очагов – «бурых опухолей», которые впоследствии замещаются фиброзной тканью и грануляциями с формированием кровоизлияний [3]. По данным литературы, наличие ФКО резко повышает риск развития синдрома «голодных костей» у больных ПГПТ [4].
Паратиреоидэктомия является методом выбора лечения манифестной формы ПГПТ [9]. После проведения хирургического лечения ПГПТ отмечается прирост минеральной плотности костной ткани, связанный с нормализацией уровня ПТГ и преобладанием его анаболического действия над резорбтивными эффектами [4]. Однако длительно недиагностированная гиперпродукция ПТГ с резким прекращением стимуляции остеокластов в послеоперационом периоде может приводить к тяжёлой, быстро развивающейся и продолжительной (в редких случаях до 9 месяцев) гипокальциемии. Это относительно редкое, но серьёзное осложнение паратиреоидэктомии получило название синдром «голодных костей» [8]. По данным литературы, данный синдром регистрируется у 25–90% пациентов с рентгенологическими признаками костной формы ПГПТ и только у 0–6% пациентов без признаков поражения скелета [4]. К дополнительному фактору, оказывающему влияние на риск возникновения синдрома «голодных костей», по мнению ряда авторов, можно отнести и использование бисфосфонатов перед оперативным лечением. Хорошо известно, что бисфосфонаты уменьшают темпы резорбции костной ткани, подавляя активность остеокластов и уменьшая число сайтов костного ремоделирования, что приводит к повышению минерализации костной ткани и, следовательно, предотвращает развитие тяжёлой послеоперационной гипокальциемии и её осложнений [4][8]. В то же время краткосрочное предоперационное использование бисфосфонатов, особенно внутривенных, может усугублять гипокальциемию в послеоперационном периоде. При таком режиме приёма бисфосфонатов снижаются темпы костной резорбции при сохранной скорости костеобразования, что также может играть роль в развитии гипокальциемического синдрома после паратиреоидэктомии [4]. В представленном нами случае необходимо обратить внимание, что больная получила четыре инфузии золендроновой кислоты перед оперативным лечением в течение четырёх месяцев в связи с тем, что изменения костной ткани трактовались как проявления миеломной болезни или вторичные поражения при онкопатологии. Таким образом, за короткий период времени больная получила 16 мг золендроновой кислоты, что также могло явиться одним из пусковых факторов развития синдрома «голодных костей».
К факторам, повышающим вероятность появления синдрома «голодных костей», вместе с объёмом и массой резецированных патологических ОЩЖ [4] относится и дефицит витамина D. Согласно имеющимся клиническим рекомендациям, как российским [10], так и зарубежным [11], при наличии низкого уровня 25(ОН)D в крови необходимо своевременное его восполнение даже в условиях гиперкальциемии у больных ПГНПТ на дооперационном этапе. В некоторых ситуациях, как в нашем случае, такая терапия должна была быть назначена на амбулаторном этапе, однако тяжёлая гиперкальциемия, имеющая место у больной, явилась ограничивающим фактором такого лечения.
В настоящее время при развитии синдрома «голодных костей» нет единого стандартного терапевтического подхода. Лечение проводят с использованием как внутривенных, так и пероральных форм препаратов кальция, суточная потребность в котором может составлять от 6 до 12 г в день. Дополнительно используются активные (2–4 мкг/день) и нативные формы витамина D, а также препараты магния по мере необходимости. Объём терапии может быть индивидуален и зависит от тяжести гипокальциемии [4].
Таким образом, развитие синдрома «голодных костей» является прогнозируемым состоянием, которое возможно избежать при своевременной постановке диагноза, хирургическом лечении, а также профилактических мерах на дооперационном периоде. Следует отметить тот факт, что изменения костной ткани в виде фиброзно-кистозного остеита хоть и являются классическим проявлением ПГПТ, однако, сохраняются лишь в некоторых странах, например в Индии, и являются уже редкостью для стран Европы и Северной Америки [12]. Вместе с тем, следует помнить, что рентгенологическая картина, так называемых «бурых опухолей» при фиброзно-кистозном остеите, не имеет патогномоничных признаков [13], что может приводить к неправильному диагнозу и тактике ведения. К сожалению, в представленном случае мы видели именно такую трактовку результатов данных проведённого обследования, позднюю постановку диагноза и неправильную тактику на догоспитальном этапе.
Заключение
Длительное течение ПГПТ с высоким уровнем ПТГ может привести не только к возникновению фиброзно-кистозного остеита с множественным поражением костей скелета, но и провоцировать возникновение и тяжёлое течение синдрома «голодных костей» в послеоперационном периоде. Несмотря на редкость возникновения этого синдрома, практикующие врачи должны помнить о возможности его развития, а также способах коррекции. Хочется отметить, что своевременные диагностика и хирургическое лечение ПГПТ являются основными способами профилактики как ФКО, так и синдрома «голодных костей».
Список литературы
1. Melton LJ 3rd. The epidemiology of primary hyperparathy-roidism in North America. J Bone Miner Res. 2002;17 Suppl 2:N12-7. PMID: 12412772.
2. Yanevskaya LG, Karonova T, Sleptsov IV, Boriskova ME, Bakhtiyarova AR, et al. Clinical phenotypes of primary hyperparathyroidism in hospitalized patients who underwent parathyroidectomy. Endocr Connect. 2021;10(2):248-255. DOI: 10.1530/EC-20-0515.
3. Hamidi S, Mottard S, Berthiaume MJ, Doyon J, Bégin MJ, Bondaz L. Brown tumor of the iliac crest initially misdiagnosed as a giant cell tumor of the bone. Endocrinol Diabetes Metab Case Rep. 2020;2020:20-0029. DOI: 10.1530/EDM-20-0029. Epub ahead of print.
4. Witteveen JE, van Th iel S, Romijn JA, Hamdy NA. Hungry bone syndrome: still a challenge in the post-operative man-agement of primary hyperparathyroidism: a systematic re-view of the literature. Eur J Endocrinol. 2013;168(3):R45-53. DOI: 10.1530/EJE-12-0528.
5. Ferraz-de-Souza B. Th e evolution of primary hyperpara-thyroidism. Arch Endocrinol Metab. 2015;59(5):381-2. DOI: 10.1590/2359-3997000000124.
6. Naji Rad S, Deluxe L. Osteitis Fibrosa Cystica. StatPearls. Treasure Island (FL): StatPearls Publishing; 2021.
7. Makras P, Anastasilakis AD. Bone disease in primary hyper-parathyroidism. Metabolism. 2018;80:57-65. DOI: 10.1016/j.metabol.2017.10.003.
8. Bandeira F, Cusano NE, Silva BC, Cassibba S, Almeida CB, et al. Bone disease in primary hyperparathyroidism. Arq Bras Endocrinol Metabol. 2014;58(5):553-61. DOI: 10.1590/0004-2730000003381.
9. Bilezikian JP, Cusano NE, Khan AA, Liu JM, Marcocci C, Bandeira F. Primary hyperparathyroidism. Nat Rev Dis Primers. 2016;2:16033. DOI: 10.1038/nrdp.2016.33.
10. Мокрышева Н.Г., Еремкина А.К., Мирная С.С., Крупи-нова Ю.А., Воронкова И.А., и др. Клинические рекомендации по первичному гиперпаратиреозу, краткая версия. Проблемы Эндокринологии. 2021;67(4):94-124. DOI: 10.14341/probl12801
11. Wilhelm SM, Wang TS, Ruan DT, Lee JA, Asa SL, et al. Th e American Association of Endocrine Surgeons Guide-lines for Defi nitive Management of Primary Hyperparathyroidism. JAMA Surg. 2016;151(10):959-968. DOI: 10.1001/jamasurg.2016.2310.
12. Bilezikian JP. Primary Hyperparathyroidism. J Clin En-docrinol Metab. 2018;103(11):3993-4004. DOI: 10.1210/jc.2018-01225.
13. Misiorowski W, Bilezikian JP. Osteitis Fibrosa Cystica. JBMR Plus. 2020;4(9):e10403. DOI: 10.1002/jbm4.10403.
Об авторах
К. А. ПогосянРоссия
Погосян Карина Александровна - младший научный сотрудник НИЛ нейроэндокринных опухолей НИЦ персонализированной онкологии, Центр персонализированной медицины».
СанктПетербург
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Л. Г. Яневская
Россия
Яневская Любовь Геннадьевна - младший научный сотрудник НИЛ клинической эндокринологии Института эндокринологии.
СанктПетербург
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
А. Н. Семенова
Россия
Семенова Алиса Николаевна - студент лечебного факультета.
Санкт-Петербург
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
М. А. Молоткова
Россия
Молоткова Мария Александровна - врач-эндокринолог эндокринологического отделения.
Санкт-Петербург
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Г. В. Беркович
Россия
Беркович Глеб Владимирович - заведующий отделением лучевой диагностики №2.
Санкт-Петербург
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Д. В. Рыжкова
Россия
Рыжкова Дарья Викторовна - доктор медицинских наук, проф., врачрадиолог высшей категории, профессор РАН, главный научный сотрудник научно-исследовательского отдела ядерной медицины и тераностики Института онкологии и гематологии, руководитель научно-клинического объединения ядерной медицины, заведующий кафедрой ядерной медицины и радиационных технологий Института медицинского образования.
СанктПетербург
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Л. В. Белоусова
Россия
Белоусова Лидия Викторовна - врач-эндокринолог высшей категории, заведующий эндокринологическим отделением.
Санкт-Петербург
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
У. А. Цой
Россия
Цой Ульяна Александровна - кандидат медицинских наук, руководитель НИЛ нейроэндокриннных опухолей, ведущий научный сотрудник, НЦМУ «Центр персонализированной медицины».
Санкт-Петербург
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Рецензия
Для цитирования:
Погосян К.А., Яневская Л.Г., Семенова А.Н., Молоткова М.А., Беркович Г.В., Рыжкова Д.В., Белоусова Л.В., Цой У.А. Случай поздней диагностики первичного гиперпаратиреоза с клиническим проявлением в виде фиброзно-кистозного остеита, осложнившего развитием гипокальциемии в послеоперационном периоде. Медицинский вестник Юга России. 2022;13(1):102-108. https://doi.org/10.21886/2219-8075-2022-13-1-102-108
For citation:
Pogosian K.A., Yanevskaya L.G., Semenova A.N., Molotkova M.A., Berkovich G.V., Ryzhkova D.V., Belousova L.V., Tsoi U.A. Hungry bone syndrome in delay diagnosed primary hyperparathyroidism with fi brocystic osteitis: A case report. Medical Herald of the South of Russia. 2022;13(1):102-108. (In Russ.) https://doi.org/10.21886/2219-8075-2022-13-1-102-108







































