Перейти к:
Тимический стромальный лимфопоэтин у пациентов разных возрастных групп с бронхиальной астмой: связь с другими маркерами, показателями функции лёгких и контролем заболевания
https://doi.org/10.21886/2219-8075-2022-13-2-113-121
Аннотация
Цель: исследовать связь тимического стромального лимфопоэтина с течением и контролем бронхиальной астмы у пациентов разных возрастных групп.
Материалы и методы: в открытое проспективное исследование длительностью 1 год включили 104 пациента трёх возрастных групп: дети (6–11 лет, n=38), подростки (14–17 лет, n=35), взрослые (25–50 лет, n=31). Давность установления диагноза астмы (≥12 месяцев), неконтролируемое течение и отсутствие острой респираторной инфекции (≥14 дней) были критериями включения. Оценивали контроль астмы по валидизированным вопросникам, функцию внешнего дыхания, данные клинического анализа крови. Концентрации тимического стромального лимфопоэтина исследовали в сыворотке крови и в назальном материале. Пациенты дважды повторно обследовались с интервалом в 6 месяцев. Статистическая обработка включала ANOVA (критерий КраскелаУоллиса) и коэффициент Пирсона. Различия считали значимыми при р<0,05.
Результаты: в возрастных группах различаются факторы риска потери контроля астмы (низкий комплайенс, ожирение, неатопический фенотип, неполная обратимость обструкции в тесте с сальбутамолом). Искомый медиатор не обнаружен в назальном материале. Концентрация тимического стромального лимфопоэтина сыворотки крови значимо коррелировала с длительностью неконтролируемого течения астмы в предшествующие 12 месяцев (r=0,74). Подгруппа пациентов, не достигших нормальных значений ОФВ1 к Визиту 3, имела максимальную концентрацию этого алармина.
Выводы: концентрация тимического стромального лимфопоэтина в сыворотке крови это фактор риска будущих обострений астмы и снижения спирометрических показателей.
Ключевые слова
Для цитирования:
Камаев А.В., Кривская С.А., Ляшенко Н.Л., Камаева И.А., Мизерницкий Ю.Л., Шапорова Н.Л. Тимический стромальный лимфопоэтин у пациентов разных возрастных групп с бронхиальной астмой: связь с другими маркерами, показателями функции лёгких и контролем заболевания. Медицинский вестник Юга России. 2022;13(2):113-121. https://doi.org/10.21886/2219-8075-2022-13-2-113-121
For citation:
Kamaev A.V., Krivskaya S.A., Lyashenko N.L., Kamaeva I.A., Mizernitsky Yu.L., Shaporova N.L. Thymic stromal lymphopoietin in bronchial asthma patients of different age groups: correlation with other markers, lung function results and disease control. Medical Herald of the South of Russia. 2022;13(2):113-121. (In Russ.) https://doi.org/10.21886/2219-8075-2022-13-2-113-121
Введение
В разных возрастных группах, от дошкольников до взрослых пациентов, широко распространена (до 7% популяции) бронхиальная астма (БА), целью лечения которой актуальные рекомендации постулируют достижение контроля, но не излечение1 [1]. В основе патогенеза БА лежит хроническое воспаление бронхиальной стенки, которое регулируется дисбалансом цитокинов, выделяемых различными иммунокомпетентными клетками. Самым изученным и наиболее распространённым вариантом хронического воспаления является Т2-тип, ключевыми цитокинами которого выступают интерлейкины 4, 5 и 13 [2]. Одним из ключевых факторов, определяющих Т2-поляризацию иммунного ответа, является повреждение эпителия дыхательных путей и спектр биологически активных молекул, выделяемых клетками эпителия и врожденной иммунной системы после этого повреждения. Важным иммунологическим маркером этого повреждения выступает молекула тимического стромального лимфопоэтина (ТСЛП), изучению которой в патогенезе БА придается большое значение [3].
Ведущий маркер эпителиального повреждения, ТСЛП, относится к группе «аларминов», неспецифических сигнальных молекул, куда также входят интерлейкин-25 и интерлейкин-33. Эти белки синтезируются эпителиальными клетками как верхних, так и нижних дыхательных путей после контактов с повреждающими факторами как инфекционной (вирусы, бактерии), так и неинфекционной природы (поллютанты, аллергены) [4]. В норме ТСЛП выступает как хемоатрактант клеток врождённого иммунного ответа и инициатор защитной воспалительной реакции; его избыточная, патологическая секреция приводит к формированию хронического воспалительного очага с вовлечением множества Т2-поляризованных иммунокомпетентных клеток (эозинофилов, дендритных клеток, врожденных лимфоидных клеток 2 типа и Т-хелперов 2 типа) [5].
Вырабатывая ТСЛП, клетки дыхательного эпителия одновременно активируют оба звена иммунного ответа: и неспецифического (секреция воспалительных цитокинов врожденными лимфоидными клетками второго типа), и адаптивного (дифференцировка наивных Т-хелперов по второму типу, активация дендритных клеток). Таким образом, ТСЛП отличается от других аларминов воздействием как на местном, тканевом уровне, так и на организменном — стимуляция созревания и дифференцировки дендритных клеток и лимфоцитов в гемопоэтических органах [6]. Также ТСЛП прямо активирует тучные клетки, вызывая независимую от IgЕ секрецию провоспалительных медиаторов. Кроме мастоцитов, ТСЛП воздействует на другие ключевые эффекторы аллергического воспаления — эозинофилы (через сигнальные пути протеиновых киназ и ядерного фактора каппа-бета), — предотвращая их апоптоз и стимулируя секрецию медиаторов и ферментов из их гранул [7]. В сравнении со здоровыми добровольцами, у пациентов с БА уровень секреции ТСЛП в тканях дыхательных путей выше [8]; в группе пациентов с БА концентрация ТСЛП коррелирует с нарастанием других медиаторов Т2 воспаления (интерлейкин-5, фактор некроза опухоли альфа) [9]. У пациентов с более тяжёлым течением БА по клиническим признакам, а также с более выраженным ухудшением показателей функции внешнего дыхания (ФВД) описано коррелирующее нарастание содержания ТСЛП сыворотки крови [8][9].
Учитывая описанную выше значимую роль ТСЛП в поляризации иммунного ответа в сторону хронического аллергического воспаления, а также участие этого белка в патогенезе трудно контролируемой обструкции при БА, в настоящее время ТСЛП рассматривается не только как значимый диагностический маркер респираторных аллергических заболеваний, но и как терапевтическая мишень при тяжёлой неконтролируемой БА [10].
На протяжении жизни пациента с БА подбор терапии может представлять особенную сложность в дебюте заболевания, при Т2-эндотипе нередко приходящемся на дошкольный период; в подростковом возрасте и в возрасте «молодых взрослых», когда меняется внутренняя картина болезни и может снижаться приверженность лечению [11]. Также в эти возрастные периоды важно оценивать будущие риски в течении БА, для чего рационально использовать анализ комплекса анамнестических, лабораторных и инструментальных критериев [12][13].
Цель исследования — оценка концентрации ТСЛП в сыворотке крови и назальном секрете у пациентов с неконтролируемой БА и их корреляции с показателями функции внешнего дыхания, эозинофилов периферической крови и достижением контроля БА.
Материалы и методы
За 6 месяцев (с сентября 2018 до февраля 2019 г.) в исследование были включены 104 пациента. Критериями включения были давность постановки диагноза бронхиальной астмы не менее 1 года, неконтролируемое либо частично контролируемое течение БА (по критериям GINA и данным АСТ/сАСТ теста), отсутствие признаков острой респираторной инфекции (ОРИ) в течение 14 дней от даты включения. В исследование не включались курящие. Все пациенты и/или их законные представители заполняли информированное согласие на использование личных и медицинских данных. Данный фрагмент работы входит в многолетнее обсервационное исследование реальной клинической практики (3029GP48APP7) одобренное Этическим комитетом ПСПбГМУ им. И. П. Павлова (заседание от 21.11.2017).
Для всех пациентов заполняли формализованную историю болезни, включавшую данные анамнеза и медицинских документов, данные аллергообследования, а также объективного осмотра на момент включения. Атопический фенотип обозначили как наличие анамнестически подтвержденной сенсибилизации к ингаляционным аллергенам и/или сопутствующего аллергического ринита или атопического дерматита.
Возрастные и демографические характеристики, а также отдельные данные аллергологического анамнеза в группах включенных пациентов, представлены в таблице 1.
Таблица / Table 1
Демографические характеристики включённых в исследование пациентов
Demographic features of included patients
|
Группа Group Показатель Feature |
Дети Children |
Подростки Adolescents |
Взрослые Adults |
|
Возрастной интервал, годы Age interval, years |
6-11 |
14-17 |
25-49 |
|
Количество пациентов, чел. Number of patients, prs |
38 |
35 |
31 |
|
Возраст, годы Age, years Me [Q25; Q75] |
8,3 [ 6,8; 9,9] |
16,5 [ 15,1; 17,3] |
33,7 [ 27,7; 34,7] |
|
Доля мужчин, n (%) Men share, n (%) |
27 (71) |
21 (60) |
14 (45,2) |
|
Давность постановки диагноза БА, годы Asthma duration, years Me [Q25; Q75] |
1,9 [ 1,2; 2,3] |
4,7 [ 3,5; 5,1] |
8,6 [ 5,9; 17,4] |
Анализировали факторы, связанные с началом обострений БА за предшествовавшие 12 месяцев (аллергены, респираторные инфекции, физическая нагрузка, стресс или контакт с табачным дымом), а также объём и возрастную динамику базисной терапии БА. Оценивали частоту отдельных фенотипических характеристик, ранее описанных как факторы риска потери контроля астмы (ожирение, выраженное снижение исходного ОФВ1 и ОФВ1 после бронхолитика, не достигавший 80% возрастной нормы, признаки гиперреактивности бронхов — появление симптомов БА после физической нагрузки либо контакта с поллютантами либо вдыхания холодного/сухого воздуха).
На каждом из трёх визитов в клинику (включение и дважды с интервалом 6 мес. в ходе динамического наблюдения) выполняли спирометрию, тест с сальбутамолом (200 мкг пациентам до 12 лет и 400 мкг — старше 12 лет), результаты оценивали относительно возрастных и ростовых нормативов по Quanier (GLI-ERS, 2012) и выражали в процентах от должного [16]. Также на каждом визите пациенты (и их родители при возрасте менее 12 лет) без участия врача заполняли вопросник по контролю астмы за предшествовавшие 4 недели (АСТ/сАСТ, https://www.asthmacontroltest.com/ru-ru/welcome/).
На визите включения у всех пациентов выполняли венепункцию, кровь центрифугировали 10 минут при 1500 об./мин., формировали банк замороженных (-20°C) образцов сыворотки. Также формировали банк замороженных образцов назального эпителия, полученных по методу2 Григорьевой И. Н.: стерильный цитологический зонд последовательно заводили в оба нижних носовых хода, а затем интенсивно промывали в 1 мл стерильного физиологического раствора. Жидкость центрифугировали (10 минут, 1500 об./мин.), супернатант замораживали. Фиксировали результаты клинического анализа крови, выполненного не далее 7 дней от визита включения, вне эпизода респираторной инфекции.
После завершения включения пациентов, образцы сыворотки и назального эпителия размораживали и исследовали концентрацию тимического стромального лимфопоэтина (пг/мл) с помощью лабораторного набора «Abcam human ELISA kit» (Кат. № ab155444, Abcam, Великобритания) с калибровкой и внутритестовым контролем в соответствии с рекомендациями производителя, диапазон измерения 10 –800 пг/мл, погрешность измерения не более 3 пг/мл.
Собранные данные обрабатывались использованием пакета компьютерных программ Statistica for Windows 10.0 (Statsoft Inc., USA). Нормальность распределения полученных результатов проверяли по критерию Шапиро; данные с нормальным распределением представлены в виде среднего (М) и его среднеквадратичного отклонения (±SD); данные с другим типом распределения — в виде медианы и верхнего, нижнего квартиля Me [Q25; Q75]. При сравнении количественных показателей между группами использовали ANOVA критерий Краскела-Уоллиса, затем критерий Уилкоксона (w-test). Доли (частоту признака в группах) сравнивали с помощью критерия хи-квадрат с поправкой Бонферрони. Различия считали статистически значимыми при р<0,05. Силу корреляционных связей оценивали с помощью коэффициента Пирсона (r).
Результаты
В ходе одного года наблюдения выбыли 4 пациента: по одному в группах «Дети» и «Подростки» и двое — из группы «Взрослые». Причины выбывания были исключительно немедицинскими: переезды и нежелание посещать центр для проведения процедур визитов; нежелательных явлений, требовавших завершения исследования, не зарегистрировано. Сохранение 96,2% пациентов на всем периоде наблюдения позволяет считать полученные данные репрезентативными.
Выявлено увеличение частоты встречаемости фенотипа с неподтвержденной атопией с нарастанием возраста пациентов с неконтролируемой БА (5,3%, 8,6% и 19,4% для групп «Дети», «Подростки» и «Взрослые» соответственно), однако различия достигли статистической значимости только при сравнении подгрупп «Дети» и «Взрослые» (р=0,02). Значимые различия выявлены между частотой встречаемости установленного диагноза ожирения любой степени (2,6%, 14,3% и 22,6% для групп «Дети», «Подростки» и «Взрослые» соответственно), хотя доли пациентов с избыточной массой тела были примерно равными (около 15%) между группами. Интересно, что пациенты с установленным ожирением, коморбидным БА, во всех возрастных группах имели большую давность постановки основного диагноза (астмы), чем их сверстники с нормальными значениями массы тела; тем не менее, в связи с малым объемом подгруппы пациентов с ожирением, статистически корректно оценить корреляцию стажа БА и ожирения не представляется возможным (рис. 1).
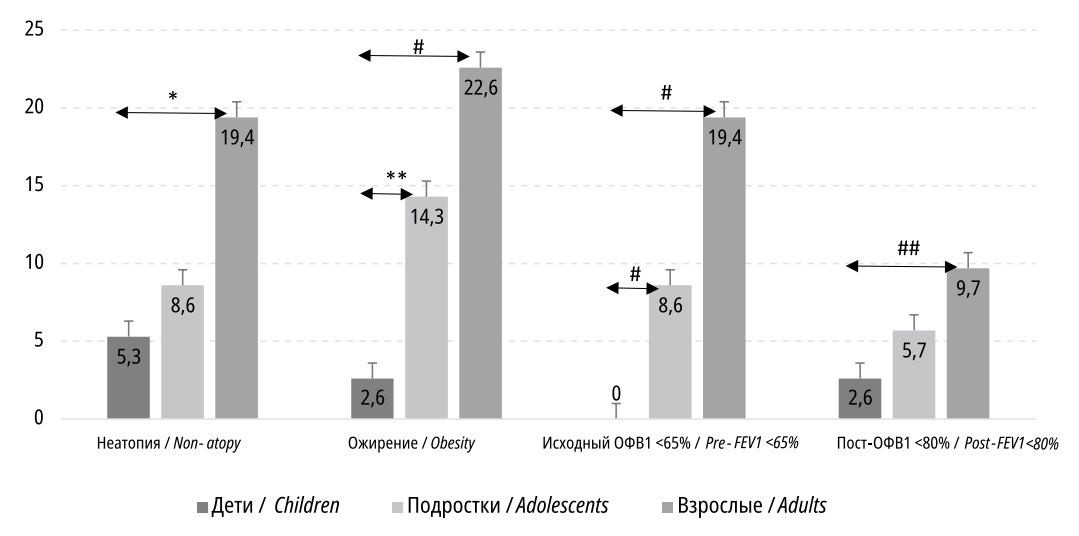
Рисунок 1. Доли пациентов (%) с отдельными фенотипическими и функциональными маркерами астмы, по группам. * p=0,02; ** p=0,01; # p=0,001; ## p=0,015
Figure 1. Patient shares (%) with peculiar phenotype and functional asthma markers, by groups
Функциональные характеристики БА (фенотип выраженной и частично-обратимой обструкции) также значимо различались в возрастных группах. Доля пациентов с исходно низким уровнем ОФВ1 значимо повышалась с возрастом (0%, 8,6% и 19,4% для групп «Дети», «Подростки» и «Взрослые» соответственно), различия представлены на рисунке 1.
В результате коррекции терапии (увеличение дозы и/или смена молекулы иГКС, присоединение тиотропия или интраназальных ГКС), элиминационных мероприятий, рекомендаций по регулярной физической нагрузке, большинство пациентов в возрастных группах «Дети» и «Подростки» достигли контроля БА к уже Визиту 2, далее доля пациентов с контролируемой БА также увеличивалась. В возрастной группе «Взрослые» доли пациентов с неконтролируемой БА на обоих визитах значимо превышали педиатрические группы, но также имели тенденцию к снижению (табл. 2).
Таблица / Table 2
Количество пациентов с контролируемой астмой в группах по визитам
Asthma controlled patients number per group, per visit
|
Группа Group Показатель Feature |
Дети (1) / Children (1), n=38 |
Подростки (2) / Adolescents (2), n= 35 |
Взрослые (3) / Adults (3), n= 31 |
Значимые различия Significant differences |
|
Контролируемая астма на Визите 2, n (%) Controlled asthma at Visit 2, n (%) |
22 (57,9) |
22 (62,9) |
13 (43,3) |
р(2-3)=0,029 |
|
Контролируемая астма на Визите 3, n (%) Controlled asthma at Visit 3, n (%) |
28 (75,7) |
24 (71,6) |
16 (55,2) |
р(1-3)=0,018 р(2-3)=0,035 |
Биоматериал, полученный методом назальной браш-биопсии, не содержал ТСЛП в концентрации, достаточной для обнаружения использованной тест-системой, ни у одного из обследованных пациентов.
Сравнение возрастных групп по содержанию ТСЛП сыворотки крови (Ме [Q25; Q75] пг/мл) не выявило значимых различий: «Дети» (715,6 [ 490,8; 883,7] пг/мл), «Подростки» (763,3 [ 508,3; 913,5] пг/мл) и «Взрослые» (852,2 [ 516,4; 971,2] пг/мл). Несмотря на то, что с увеличением возраста наблюдался тренд к увеличению концентрации ТСЛП, он представляется статистически незначимым, дальнейший анализ ТСЛП проводился без разделения пациентов по возрастным группам. Пациенты любого возрастного интервала демонстрировали очень выраженный разброс значений ТСЛП сыворотки, что требовало группировки на основании другого критерия для формирования более однородных групп пациентов. В объединённой группе пациентов, не достигших контроля БА к Визиту 3, медиана сывороточной концентрации ТСЛП была выше, чем в объединенной группе пациентов с контролируемым к Визиту 3 течением БА, хотя статистическая значимость этого различия и была пограничной: 893,3 пг/мл [ 681,9; 1031,4] против 611,7 пг/мл [ 411,5; 697,3] (р=0,047).
Оценена продолжительность неконтролируемого течения БА по ретроспективным анамнестическим данным, в неделях за год, полученным в ходе анкетирования пациентов на Визите 1. Диапазон значений составил от 18 до 39 недель в год, пациенты с более продолжительным неконтролируемым течением БА встречались во всех возрастных группах. Чаще всего, причинами более продолжительного неконтролируемого течения БА были указания на продолжающийся контакт с выявленным причинным аллергеном (сохранение дома животных) или пассивное курение. При объединённом анализе данных пациентов всех возрастных групп выявлена сильная прямая корреляция длительности неконтролируемого течения БА в предшествующие 12 месяцев и концентрации ТСЛП сыворотки (r=0,74).
Важным свойством атопической БА является коморбидность с аллергическим ринитом (АР) и/или атопическим дерматитом (АтД). В нашем исследовании сопутствующий АР имели 84 (80,8%) пациента; при этом разница частоты коморбидного АР статистически значимо снижалась при сравнении подгрупп «Дети» (35 пациентов, 92,1%) и «Взрослые» (20 пациентов, 64,5%) (р=0,01). Сопутствующий АтД встречался значительно реже (21 (20,2%) пациентов), тенденция к снижению частоты сочетания АтД и БА с увеличением возраста наблюдалась так же, как и для АР, однако из-за малого объёма выборок статистической значимости не было получено. Сравнение концентраций ТСЛП в группах пациентов изолированной БА (Ме=489,3 [ 399,7; 631,6] пг/мл), сочетания БА только с АтД (Ме=541,7 [ 415,4; 710,2] пг/мл), сочетания БА только с АР (Ме=602,7 [511,6; 834,9] пг/мл) и одновременного наличия трех нозологий (БА+АтД+АР) (Ме=691,8 [ 554,2; 913,1] пг/мл) выявило статистически значимые различия (рис. 2).
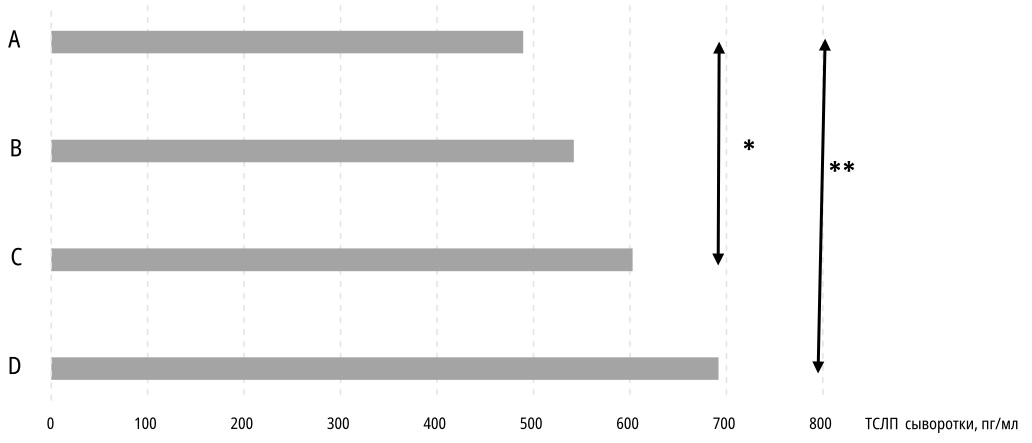
Рисунок 2. Медианы концентраций тимического стромального лимфопоэтина сыворотки крови у пациентов с изолированной бронхиальной астмой (А), а также бронхиальной астмой в сочетании с атопическим дерматитом (В), аллергическим ринитом (С) или сочетанием всех трех заболеваний (D). * p=0,01; ** p=0,001
Figure 2. Thymic stromal lymphopoietin median serum concentrations in patients with isolated bronchial asthma (A), bronchial asthma with atopic dermatitis (B), bronchial asthma with allergic rhinitis (C) or all three diseases combination (D). * p=0,01; ** p=0,001
Содержание эозинофилов периферической крови заметно колебалось между пациентами независимо от принадлежности к возрастной группе. В то же время, более чем у 90% пациентов в каждой возрастной группе эти колебания оставались в пределах нормальных значений (до 350 клеток в микролитре для группы «Дети», до 500 кл/мкл — для групп «Подростки» и «Взрослые»). Значимой связи между концентрацией ТСЛП сыворотки крови и содержанием эозинофилов в клиническом анализе крови не обнаружено.
Обсуждение
Атопический фенотип БА оказался самым распространённым во всех возрастных группах, что ранее было неоднократно описано [11][15]. При этом даже группа пациентов с атопическим фенотипом демонстрирует клиническую (по наличию контроля над течением БА, по наличию коморбидности с АтД и/или АР) и функциональную (по выраженности исходной обструкции и степени её обратимости, а также по устойчивости снижения ОФВ1 на протяжении 1 года наблюдения) неоднородность, что необходимо учитывать при индивидуализации терапии у конкретного пациента. Для группы атопической БА в разные календарные периоды и у пациентов с разными исходными показателями ФВД оптимизация базисной терапии включала и добавление тиотропия, и увеличение дозы иГКС, и смену устройства доставки. Одной из важных характеристик атопического фенотипа БА является более высокая, чем при неатопическом фенотипе, вероятность достижения контроля астмы средствами стандартной (ингаляционной) базисной терапии и коррекцией комплайенса. Понимание отдельных факторов, как биохимических, так и иммунологических, направляющих и модулирующих хроническое воспаление в бронхах, способствует оптимизации выбора средств базисной терапии астмы и персонализации изменения лекарственной нагрузки пациентов, особенно в педиатрической практике [16].
В литературе опубликованы лишь отдельные сведения по содержанию ТСЛП в сыворотке крови у пациентов с БА [9]. Представленная нами корреляция с показателями контроля БА, с включением пациентов разных возрастных групп добавляет новые сведения в понимание патогенеза воспаления при БА. Неожиданной оказалась высокая концентрация ТСЛП в группе атопической БА; впервые получены результаты, показывающие взаимосвязь концентрации этого биомаркера в сыворотке крови и типа сенсибилизации, а именно максимальную концентрацию у пациентов, сенсибилизированных к клещам домашней пыли. Вероятно, такое преобладание может быть вызвано выраженной протеиназной активностью клещевых аллергенов и их активным повреждающим воздействием на эпителий бронхов [17]. В экспериментальных работах была показана способность экстракта клещей домашней пыли, вводимого эндотрахеально, усиливать секрецию ТСЛП дендритными клетками бронхиального дерева мышей в сравнении с клетками животных, которые были обработаны плацебо (фосфатным буфером) [18].
В доступной литературе нами не обнаружено исследований, изучавших концентрацию ТСЛП в назальном материале. Обоснованием гипотезы для изучения одного из ключевых провоспалительных медиаторов БА в эпителиальных клетках носа послужил опубликованный опыт культивации и моделирования аллергических реакций дыхательного эпителия и исследования различных биомаркеров на назальных клетках, инспирированный общей концепцией «единых дыхательных путей» Жана Бюске [19]. Мы предполагали увидеть бóльшую активность и бóльшую вариабельность концентрации ТСЛП в эпителии дыхательных путей, чем в сыворотке крови. В то же время мы уверенно можем утверждать, что отсутствие ТСЛП в назальном биоматериале не связано с технологическим дефектом отбора биоматериала, так как в аликвотах того же назального супернатанта была обнаружена достаточная концентрация другого важного цитокина, периостина [20] и защитного белка СС-16 (собственные неопубликованные данные). Таким образом, полученные результаты не укладываются в распространённую гипотезу единства верхних и нижних дыхательных путей в отношении патогенеза аллергического воспаления. Остаётся необъяснённым также факт, что TСЛП в назальном материале не был обнаружен, в том числе у пациентов с коморбидным БА аллергическим ринитом.
В русскоязычной литературе нам встретилось лишь одно исследование, посвящённое концентрации ТСЛП в сыворотке крови у детей с аллергической патологией [21]. В цитируемой работе отличался основной диагноз пациентов (АтД), использовался другой тестовый набор реактивов, что не позволяет напрямую сравнивать абсолютные цифры концентрации ТСЛП. Тем не менее, получено четкое указание на различие содержания ТСЛП в сыворотке крови у пациентов с аллергопатологией и здоровых лиц контрольной группы, а также нарастание концентрации этого биомаркера с увеличением степени тяжести аллергического заболевания [21]. Здесь можно провести определенные параллели с данными, полученными в нашем исследовании: более высокая концентрация ТСЛП сыворотки у пациентов с БА, оставшейся неконтролируемой через 12 месяцев наблюдения, и более высокая концентрация ТСЛП сыворотки у мультиморбидных пациентов.
Эти данные могут быть важны в определении сроков использования препаратов традиционной базисной терапии у пациентов с БА разного возраста, а также при отборе кандидатов на терапию моноклональными антителами, как уже зарегистрированными в РФ, так и с учётом ожидаемого вхождения в клиническую практику тезепелумаба [10].
Заключение
Неконтролируемая бронхиальная астма существенно снижает качество жизни пациента, повышает риски неблагоприятных исходов (снижение функции лёгких, госпитализации, летальность) и повышает затраты системы здравоохранения в целом и трудозатраты конкретного врача, наблюдающего такого пациента. Исходя из современных научных данных, прогноз таких пациентов определяет регулярная персонализированная противовоспалительная терапия и мониторинг воспаления в бронхах. Высоко инвазивный метод бронхоальвеолярного лаважа и бронхиальной биопсии неприменимы в клинической, особенно амбулаторной, практике; практикующему врачу необходимы инструменты щадящего мониторинга аллергического воспаления. В комплексе с детальной анамнестической оценкой, динамическим исследованием функциональных показателей, определение ТСЛП сыворотки может рассматриваться как перспективный мониторинговый и прогностический инструмент долгосрочного ведения БА у пациентов разного возраста.
1. Федеральные клинические рекомендации – Бронхиальная астма. 2021, Москва, РРО/РААКИ/СПР, 114 с.
2. РАДАР. Аллергический ринит у детей: рекомендации и алгоритм при детском аллергическом рините. — Москва: Оригинал-макет, 2015. — 80 с.
Список литературы
1. Батожаргалова Б.Ц., Мизерницкий Ю.Л., Подольная М.А. Мета-анализ распространенности астмоподобных симптомов и бронхиальной астмы в России (по результатам ISAAC). Рос.вестн. перинатол. и педиатрии. 2016;61(4):59-69. DOI: 10.21508/1027-4065-2016-61-4-59-69
2. Koczulla AR, Vogelmeier CF, Garn H, Renz H. New concepts in asthma: clinical phenotypes and pathophysiological mechanisms. Drug Discov Today. 2017;22(2):388-396. DOI: 10.1016/j.drudis.2016.11.008
3. Comeau MR, Ziegler SF. The influence of TSLP on the allergic response. Mucosal Immunol. 2010;3(2):138-47. DOI: 10.1038/mi.2009.134
4. Loxham M, Davies DE. Phenotypic and genetic aspects of epithelial barrier function in asthmatic patients. j Allergy Clin Immunol. 2017;139(6):1736-1751. DOI: 10.1016/j.jaci.2017.04.005
5. Hellings Pw, Steelant B. Epithelial barriers in allergy and asthma. J Allergy Clin Immunol. 2020;145(6):1499-1509. DOI: 10.1016/j.jaci.2020.04.010
6. Lin SC, Cheng FY, Liu jj, Ye YL. Expression and Regulation of Thymic Stromal Lymphopoietin and Thymic Stromal Lymphopoietin Receptor Heterocomplex in the InnateAdaptive Immunity of Pediatric Asthma. Int J Mol Sci. 2018;19(4):1231. DOI: 10.3390/ijms19041231
7. Roan F, Obata-Ninomiya K, Ziegler SF. Epithelial cellderived cytokines: more than just signaling the alarm. j Clin Invest. 2019;129(4):1441-1451. DOI: 10.1172/jCI124606
8. Ziegler SF. Thymic stromal lymphopoietin and allergic disease. J Allergy Clin Immunol. 2012;130(4):845-52. DOI: 10.1016/j.jaci.2012.07.010
9. Shikotra A, Choy DF, Ohri CM, Doran E, Butler C, et al. Increased expression of immunoreactive thymic stromal lymphopoietin in patients with severe asthma. J Allergy Clin Immunol. 2012;129(1):104-11.e1-9. DOI: 10.1016/j.jaci.2011.08.031
10. Dorey-Stein ZL, Shenoy KV. Tezepelumab as an Emerging Therapeutic Option for the Treatment of Severe Asthma: Evidence to Date. Drug Des Devel Ther. 2021;15:331-338. DOI: 10.2147/DDDT.S250825
11. Семерник О.Е., Лебеденко А.А., Аппоева А.А., Кобцева Д.Ю., Руденко В.Р. Частота стационарной помощи детям с бронхиальной астмой и атопическим дерматитом в крупном промышленном городе. Аллергология и иммунология в педиатрии. 2020;63(4):23-28. DOI 10.24411/2500-1175-2020-10015
12. Лебеденко А.А., Шкурат Т.П., Машкина Е.В., Семерник О.Е., Дрейзина Т.К. Анализ ассоциации полиморфных вариантов генов факторов роста с риском развития бронхиальной астмы у детей. Пульмонология. 2018;28(1):7-12. DOI 10.18093/08690189-2018-28-1-7-12
13. Chipps BE, Haselkorn T, Paknis B, Ortiz B, Bleecker ER, et al. More than a decade follow-up in patients with severe or difficult-to-treat asthma: The Epidemiology and Natural History of Asthma: Outcomes and Treatment Regimens (TENOR) II. J Allergy Clin Immunol. 2018;141(5):1590- 1597.e9. DOI: 10.1016/j.jaci.2017.07.014
14. Quanjer PH, Brazzale Dj, Boros Pw, Pretto jj. Implications of adopting the Global Lungs Initiative 2012 all-age reference equations for spirometry. Eur Respir J. 2013;42(4):1046-54. DOI: 10.1183/09031936.00195512
15. Ненашева Н.М. Т2-бронхиальная астма: характеристика эндотипа и биомаркеры. Пульмонология. 2019;29(2):216– 228. DOI: 10.18093/0869-0189-2019-29-2-216-228
16. Лебеденко А.А., Семерник О.Е., Тюрина Е.Б., Аппоева А.А., Мусийчук Н.С., Донскова Н.С. Роль макроэлементов в патогенезе бронхиальной астмы у детей. Медицинский вестник Юга России. 2021;12(2):43-47. DOI: 10.21886/2219-8075-2021-12-2-43-47
17. jacquet A, Robinson C. Proteolytic, lipidergic and polysaccharide molecular recognition shape innate responses to house dust mite allergens. Allergy. 2020;75(1):33-53. DOI: 10.1111/all.13940
18. Kashyap M, Rochman Y, Spolski R, Samsel L, Leonard wj. Thymic stromal lymphopoietin is produced by dendritic cells. J Immunol. 2011;187(3):1207-11. DOI: 10.4049/jimmunol.1100355
19. Stokes AB, Kieninger E, Schögler A, Kopf BS, Casaulta C, et al. Comparison of three different brushing techniques to isolate and culture primary nasal epithelial cells from human subjects. Exp Lung Res. 2014;40(7):327-32. DOI: 10.3109/01902148.2014.925987
20. Камаев А.В. Периостин как предиктор неконтролируемого течения астмы и снижения показателей функции легких у пациентов разных возрастных групп. Ученые записки Санкт-Петербургского государственного медицинского университета имени академика И. П. Павлова. 2020;27(4):71-79. DOI: 10.24884/1607-4181-2020-27-4-71-79
21. Зайнуллина О.Н., Печкуров Д.В., Хисматуллина З.Р., Ганковская Л.В. Пилотное исследование уровней Toll-подобного рецептора 2 и тимического стромального лимфопоэтина в сыворотке крови детей с атопическим дерматитом. Педиатрия им. Г.Н. Сперанского. 2021;100(2):64–71. DOI: 10.24110/0031-403x-2021-100-2-64-71
Об авторах
А. В. КамаевРоссия
Камаев Андрей Вячеславович, к.м.н., доцент, кафедра общей врачебной практики (семейной медицины)
Санкт-Петербург
SPIN 8554-8565
С. А. Кривская
Россия
Кривская Светлана Андреевна, врач аллерголог-иммунолог высшей категории
Санкт-Петербург
Н. Л. Ляшенко
Россия
Ляшенко Наталья Леонидовна, врач аллерголог-иммунолог, ассистент кафедры общей врачебной практики (семейной медицины)
Санкт-Петербург
И. А. Камаева
Россия
Камаева Ирина Александровна, к.м.н., доцент кафедры общей врачебной практики (семейной медицины)
Санкт-Петербург
Ю. Л. Мизерницкий
Россия
Мизерницкий Юрий Леонидович, д.м.н., проф., зав. отделом хронических, воспалительных и аллергических болезней легких
Москва
Н. Л. Шапорова
Россия
Шапорова Наталия Леонидовна, д.м.н., проф., заведующая кафедрой общей врачебной практики (семейной медицины)
Санкт-Петербург
Рецензия
Для цитирования:
Камаев А.В., Кривская С.А., Ляшенко Н.Л., Камаева И.А., Мизерницкий Ю.Л., Шапорова Н.Л. Тимический стромальный лимфопоэтин у пациентов разных возрастных групп с бронхиальной астмой: связь с другими маркерами, показателями функции лёгких и контролем заболевания. Медицинский вестник Юга России. 2022;13(2):113-121. https://doi.org/10.21886/2219-8075-2022-13-2-113-121
For citation:
Kamaev A.V., Krivskaya S.A., Lyashenko N.L., Kamaeva I.A., Mizernitsky Yu.L., Shaporova N.L. Thymic stromal lymphopoietin in bronchial asthma patients of different age groups: correlation with other markers, lung function results and disease control. Medical Herald of the South of Russia. 2022;13(2):113-121. (In Russ.) https://doi.org/10.21886/2219-8075-2022-13-2-113-121







































