Перейти к:
Биомаркеры патогенетических вариантов рецидивов миоматозного роста.
https://doi.org/10.21886/2219-8075-2021-12-4-6-11
Аннотация
Цель: оценить информативность биомаркеров — микробиологических имолекулярно-биологических, иммунологических, характерных для различных вариантов рецидивов миоматозного роста.
Материалы и методы: обследовано 70 женщин репродуктивного возраста с рецидивами миомы матки и её сочетанием с аденомиозом после органосберегающего лечения в Клинике ФГБОУ ВО КубГМУ Минздрава России.
Методы — микробиологическое исследование, сонография, допплерометрия, гистология, иммуногистохимия, морфометрия. Результаты: доказана обусловленность рецидивов вариантов миоматозного роста молекулярно-биологическими характеристиками опухолей, наличием инфицированности и особенностями кровоснабжения. Установлено, что женщины с рецидивами миоматозного роста по «ложному» типу отличались высоким инфекционным индексом (наличием репродуктивных потерь, хронических воспалительных заболеваний органов малого таза), значительной бактериальной обсеменённостью локусов генитального тракта. Определены особенности кровоснабжения при истинном и «ложном» типах рецидивов миоматозного роста на основании данных допплерометрии, соотносимые с особенностями морфометрии сосудов опухолей. Анализ различных патоморфологических вариантов миомы матки и их соотношение с тем или иным типом кровоснабжения опухоли выявил корреляцию форм с повышенной тенденцией к пролиферации опухоли на молекулярно-клеточном уровне (умеренной, повышенной) экспрессии рецепторов к стероидным гормонам совместно с Ki-67, увеличение ширины сосудистого сечения с доминирующими показателями индексов васкуляризации и васкуляризационно-поточного.
Выводы: комплексное обследование женщин с гиперпластическими процессами матки определяет возможность прогнозирования патогенетически отличных вариантов рецидивов миоматозного роста, адекватного выбора технологий лечения и реабилитационного курса.
Ключевые слова
Для цитирования:
Баширов Э.В., Крутова В.А., Куценко И.И. Биомаркеры патогенетических вариантов рецидивов миоматозного роста. Медицинский вестник Юга России. 2021;12(4):6-11. https://doi.org/10.21886/2219-8075-2021-12-4-6-11
For citation:
Bashirov E.V., Krutova V.A., Kutsenko I.I. Biomarkers of the type of recurrent uterine myoma-associated growth. Medical Herald of the South of Russia. 2021;12(4):6-11. (In Russ.) https://doi.org/10.21886/2219-8075-2021-12-4-6-11
Введение
Высокая частота рецидивов миомы матки (ММ) и её сочетания с аденомиозом делает актуальным вопрос уточнения закономерностей их развития с фокусом на факторы, стимулирующие рост клеток слизистой оболочки тела матки и миометрия, генетической детерминированности заболеваний1 [1][2]. Несмотря на общепризнанные механизмы молекулярно-клеточного роста миомы матки и её сочетания с аденомиозом, разрозненность данных и спорность отдельных фактов не позволяет структурировать их с целью определения тактики ведения контингента до и после различных технологий лечения. Данные о типах роста узлов упоминались в литературе с позиций гистологических особенностей опухолей – пролиферации миогенных элементов, определяющих эффективность гормональной терапии при истинном варианте; увеличение размеров за счет нарушения питания узла, отека, дегенеративных изменений – «ложном»2 [1]. Представляется значимым расширение представлений о генезе рецидивов вариантов миоматозного роста на основании многоаспектного изучения молекулярно-биологических особенностей опухоли и различных типов васкуляризации узлов, уточнения особенностей микробиоты отделов генитального тракта, анамнестических факторов инфекционно-воспалительного генеза.
Цель исследования — оценить информативность биомаркеров – микробиологических и молекулярно-биологических, иммунологических, характерных для различных вариантов рецидивов миоматозного роста.
Материалы и методы
Обследовано 70 женщин репродуктивного возраста с рецидивами ММ и её сочетанием с аденомиозом после органосберегающего лечения в Клинике ФГБОУ ВО КубГМУ Минздрава России.
Пациентки, включённые в исследование, проспективно разбиты на группы на основании результатов клинических и инструментальных методов, составивших диагностический комплекс для постановки ММ и её сочетания с аденомиозом.
Контингент женщин в зависимости от типа рецидивов миоматозного роста стратифицирован по следующим группам: «ложный» рост узлов (n = 32) и истинный (n = 38). Возраст женщин в группах сравнения находился в диапазоне от 22 до 45 лет, средний возраст составил 36,2 ± 5,2 года.
Критерии включения в исследование — миоматозные узлы всех типов диаметром от двух до десяти сантиметров, а также их сочетание с аденомиозом, отрицание медикаментозной подготовки (гормонотерапии) к хирургическому лечению на протяжении не менее 3 месяцев до вмешательства, информированное согласие на участие.
Программа исследований предусматривала сонографию органов малого таза, гистероскопию, патоморфологическое изучение полученных препаратов, а именно слизистой оболочки тела матки, энуклеированных узлов миомы и иссечённых участков аденомиоза. Комплекс изучения микробиоты включал урогениталный мазок, бактериологическое исследование отделяемого из цервикального канала, эндометрия. Экспрессия рецепторов к эстрогенам (clon SP-1), прогестерону (clon SP-2), белку Ki-67 (clon SP-6), виментину (clon SP20), коллагену IV типа (Spring BioScience, США) в опухолевых узлах изучалась с применением разведенных, готовых к использованию моноклональных антител. Выделяли следующие варианты экспрессии: отсутствие, слабую, умеренную, выраженную, с показателями до десяти, до ста, до двухсот, до трёхсот баллов соответственно.
При проведении морфометрии использовалось модульное программное обеспечение Zen 2012 (blue edition). Для анализа системы кровоснабжения иссеченных препаратов изучались площадь и ширина сосудистого сечения, толщина стенки. Результаты расчётов объединялись в системных таблицах и обрабатывались с использованием программ расчетов.
При 3D-допплерометрии в опухолях матки оценивали индексы васкуляризации (VI), кровотока (FI) и васкуляризационно-поточного индекса (VFI).
При выборе варианта хирургического лечения (традиционное чревосечение, эндоскопия, эмолизация маточных артерий) подходили персонализировано, руководствуясь как объективными, так и субъективными факторами.
Статистический анализ проведён с использованием программы IBM SPSS Statistics 23. Материалы исследования подвергли статистической обработке с использованием методов параметрического анализа в соответствии с результатами проверки сравниваемых совокупностей на нормальность распределения. Для оценки межгрупповых различий значений признаков, имеющих непрерывное распределение, применяли t-критерий Стьюдента. Критический уровень достоверности нулевой статистической гипотезы (об отсутствии значимых различий или факторных влияний) принимали равным «0,05».
Ранее материалы, включённые в данное исследование, были использованы и отражены в диссертации на соискание ученой степени доктора медицинских наук «Дифференцированный выбор органосохраняющих технологий оперативного лечения миомы матки и её сочетания с аденомиозом».
Результаты
С целью выявления и систематизации предвестников развития гиперпластических процессов матки (ГПМ), а в последующем и рецидивирования миоматозного роста, и углубления понимания о возможных вариантах последнего, а именно истинном пролиферативном или ложном инфекционно-ассоциированном, проводили тщательное изучение гинекологического анамнеза в исследуемых группах. Акценты были поставлены на репродуктивные потери и внутриматочные манипуляции, а также на инфекционно-воспалительные предикторы рецидивов.
У пациенток с ложным фенотипом миомы матки неудовлетворительные репродуктивные исходы встречались в два раза чаще при сочетании миомы с аденомиозом (78,6% против 33,3%, p <0,05). Со схожей ситуацией столкнулись и в отношении вмешательств в полость матки (81,7% против 43,2% в среднем на всю выборку с ГПМ, p <0,05).
Гинекологическая история женщин с «ложным» вариантом миомы отмечена более высокой частотой хронических воспалительных процессов органов малого таза (в два раза больше, чем с истинным типом): при ММ с аденомиозом — в полтора раза чаще, чем с изолированной опухолью (64,3% против 44,4%), однако без статистически значимых отличий. При структурировании данных по патологическим процессам шейки матки получены схожие результаты — практически вдвое чаще в ситуации с «ложным» ростом миомы (62,7% против 34,6%). Также в выборке пациенток с фенотипически «ложным» вариантом роста превалировал хронический эндометрит, а именно при сочетании ММ с аденомиозом (50,0% против 10,7%, p <0,05).
Выявление микробов и их ассоциаций в миоматозных узлах при культуральном исследовании и ПЦР-диагностике имело место при высоком индексе инфицированности отделов генитального тракта.
Процент поражения инфектом канала шейки матки в группе с ММ составил 23,9%, а в случае сочетании с аденомиозом частота инфицированности преобладала при «ложном» росте узла (71,4% против 32,1%, p <0,05) (рис. 1).
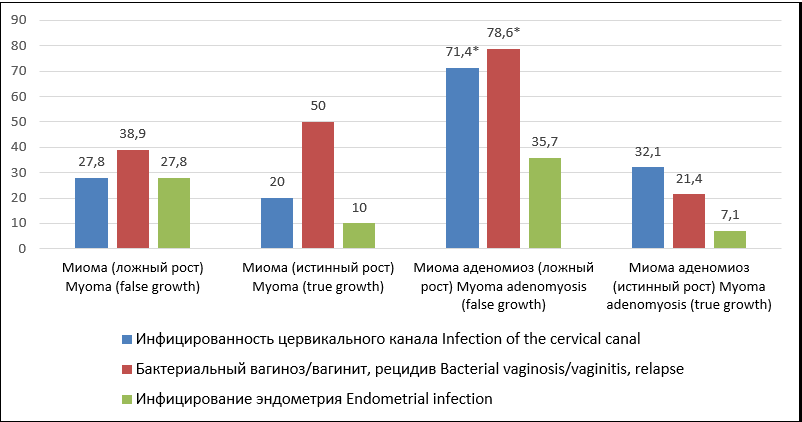
Рисунок 1. Инфицированность локусов половой сферы при рецидивах миоматозного роста — «ложном» и истинном.
Figure 1. Infection of biotopes of the genital tract with recurrent myomatous growth — "false" and true.
Примечание: *(p <0,05) — различия показателей статистически значимы (от группы с ММ).
Note: *(p <0.05) — the differences in indicators are statistically significant (from the group with UM).
Частота встречаемости бактериальных вагинозов и вагинитов при сочетанных ГПМ в четыре раза (78,6%) превышала таковую при рецидивах с фенотипически истинным миоматозным ростом.
Инфицирование эндометрия выявляли у трети женщин с рецидивами ММ по типу «ложного» роста узлов при сочетании с аденомиозом, 84,4% — при изолированной опухоли.
Определена возможность прогнозирования гистотипов опухолевого роста на основании уточнения особенностей кровоснабжения миоматозных и аденомиозных узлов. При анализе результатов трехмерной сонографии с допплером за истинный фенотип роста выступал высокоскоростной кровоток в узловых образованиях, в пользу фенотипически ложного роста свидетельствовали снижение показателей VI и VFI на фоне отёка с периферическим типом кровоснабжения3 (рис. 2).
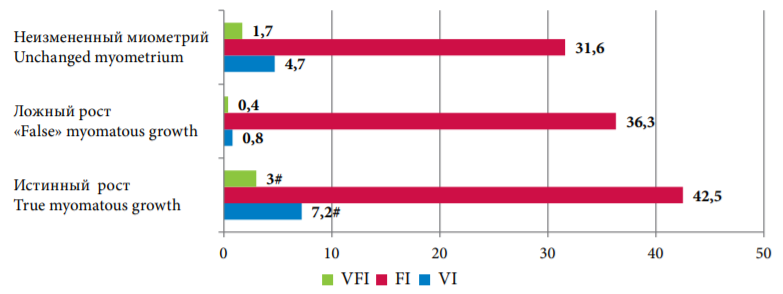
Рисунок 2. Динамика трехмерной сонографии с допплером в зависимости от фенотипа узлов — истинного или «ложного»
Figure 2. Features of 3D-power Doppler ultrasonography depending on the genesis of nodes — true or "false"
Примечание: #(p <0,05) — различия показателей статистически значимы (от всех групп).
Note: #(p <0.05) — differences in indicators are statistically significant (from all groups).
Обсуждение
Констатация очагов хронического воспаления в локусах генитального тракта позволяет предположить его триггерную роль в генезе рецидивов миоматозного «ложного» роста, что согласуется с утверждениями отдельных авторов [3].
Подобные наблюдения указывают на значимую роль инфектов в процессах дифференцировки и апоптоза тканей матки, срыв иммунно-эндокринного гомеостаза на локальном уровне, особенно на фоне рецидивирующих дисбиозов генитального тракта. Изменения влагалищной флоры с развитием вагинитов и дисбиозов на фоне хронических воспалительных процессов гениталий подтверждают исследования других авторов со значимой ролью U. Urealyticum (91,0%) в моноварианте или в сочетаниях с хламидиями, вирусами и некоторыми представителями условно-патогенной микрофлоры в диагностически значимых титрах выявляемой в различных локусах генитального тракта и миоматозных узлах.
Среди патоморфологических характеристик, присущих фенотипически-ложному типу роста миомы, можно выделить дистрофические и некротические изменения, клеточную лимфоцитарную инфильтрацию с явлениями деструкции, гидропическую дегенерацию и гиалиноз. Данные гистологические изменения укладываются в версию о воздействии инфекционного провоцирующего фактора с избыточным синтезом клетками миометрия внеклеточного матрикса [4].
Гистологическое описание тумора с избыточной митотической активностью и преимущественно клеточным типом строения соответствовало фенотипически-истинному росту. Из клинических проявлений, свойственных данной группе, можно выделить мено-метроррагии, анемизирующие женщин и снижающие качество жизни. Зачастую симптоматика объяснялась быстрым ростом доминантного узла, сочетанием с гиперпластическими процессами слизистой оболочки. Заключения об избыточной пролиферативной активности тканей матки формируются на фактах о генетической детерминации механизмов локального стероидогенеза более, чем у трети женщин [5][6]. Подобные наблюдения соответствуют характеристикам группы – выявление крупных миоматозных узлов в раннем репродуктивном возрасте, их сочетание с аденомиозом, гиперплазией эндометрия и молочных желез.
Результаты изучения особенностей кровоснабжения миоматозных и аденомиозных узлов указывают на высокую чувствительность 3D-исследования в оценке сосудистой сети опухоли [7] и прогнозировании рецидивов ГПМ. Подобные наблюдения обусловленности значений трехмерной энергетической допплерографии морфоструктурой и характеристиками миоматозного роста приведены в исследованиях других авторов [8][9].
Мультифакториальность (уровень экспрессии к эстрогену и прогестерону, тип кровоснабжения, уровень пролиферативного индекса) генеза истинного рецидивирования миоматозного роста показана при структурировании иммуногистохимических показателей узлов (табл. 1).
Таблица / Table 1
Молекулярно-биологические характеристики миоматозных узлов различного генеза
Molecular biological characteristics of myomatous nodes of various origins
|
Группы Groups
|
N |
Экспрессия рецепторов к прогестерону (выраженная) Expression of progesterone receptors (pronounced) |
Экспрессия рецепторов к эстрогенам (выраженная) Expression of estrogen receptors (pronounced) |
Диаметр сосудов Diameter of vessels |
Уровень Ki-67 высокий (6-10%) Ki-67 level is high (6-10%) |
||
|
Миома матки Uterine myoma |
«Ложный» рост узла «False» myomatous growth |
N |
18 |
4 |
3 |
4587 |
0 |
|
% |
22,2 |
16,7 |
|||||
|
Истинный рост узла True myomatous growth |
N |
10 |
7∞ |
5 |
6287∞ |
6,3∞ |
|
|
% |
70,0 |
50,0 |
|||||
|
Миома матки в сочетании с аденомиозом Uterine myoma with adenomyosis |
«Ложный» рост узла «False» myomatous growth |
N |
14 |
4 |
5 |
4390 |
0,3 |
|
% |
28,6 |
35,7 |
|||||
|
Истинный рост узла True myomatous growth |
N |
28 |
21∞ |
13 |
8049∞ |
7,3∞ |
|
|
% |
75,0 |
46,4 |
|||||
Note: ∞ (p <0.05) — differences in indicators are statistically significant (intragroup).
Повышенные значения экспрессии стероидных рецепторов, несколько ярче выраженные при сочетании миомы с аденомиозом, характеризовали пролиферативный эффект при истинном рецидивировании. Данный факт совпадает с мнением об увеличении площади повреждений зон роста с нарушением стромально-мезенхимальных контактов [10].
Так, повышенный уровень индекса пролиферации Ki-67 указывал на рецидивы миомы матки, чаще при множественной опухоли и быстром росте доминантного нодуса, комбинированном поражении с аденомиозом, при повышенной экспресии рецепторов стероидных гормонов, чувствительности к виментину и коллагену [1].
Морфометрическое определение показателей сосудистого сечения (как с наружной оболочкой, так и без неё) косвенно указывало на уровень кровоснабжения локусов гиперпролиферации миометрия, ярче выраженной у пациенток с рецидивами ГПМ. Пониженная степень васкуляризации была свойственна простым типам лейомиомы со зрелой стромой и очагами гиалиноза. Большая площадь сосудистого русла (2024 против 1654, µm²) за счёт диаметра сосудов (37,8 против 25,3, µm) указывала на активность процесса формирования сосудистой сетки и соответствовала фенотипически истинному росту, что подтверждало вероятность рецидивов ММ, особенно сочетанных форм, в условиях высокой клеточной активности и избыточного метаболизма, доказанной роли локальной гиперэстрогении в эндометриоидных гетеротопиях [2].
Заключение
Многоаспектное предоперационное обследование пациенток с гиперпластическими процессами матки путём изучения комбинации маркеров и анамнестических факторов риска позволяет смоделировать различные фенотипы рецидивирования миоматозного роста и подобрать адекватную технологию лечения и курс реабилитации.
1. Краснова И.А., Аксенова В.Б., Краснова А.С. Место ультразвукового исследования у пациенток с миомой матки до и после эмболизации маточных артерий. Ультразвуковая и функциональная диагностика. 2015;(4S):93b. eLIBRARY ID: 25611446
2. Тихомиров А.Л. Миома, патогенетическое обоснование органосохраняющего лечения. Монография. М.;2013.
3. Краснова И.А., Аксенова В.Б., Краснова А.С. Место ультразвукового исследования у пациенток с миомой матки до и после эмболизации маточных артерий. Ультразвуковая и функциональная диагностика. 2015;(4S):93b. eLIBRARY ID: 25611446
Список литературы
1. Сидорова И.С., Коган Е.А., Унанян А.Л. Клиникоморфологические параллели и молекулярные механизмы стромально-паренхиматозных взаимоотношений при миоме матки. Молекулярная медицина. 2009;(1):9–15. eLIBRARY ID: 12111184
2. Benagiano G, Brosens I, Habiba M. Structural and molecular features of the endomyometrium in endometriosis and adenomyosis. Hum Reprod Update. 2014; 20(3):386-402. DOI: 10.1093/humupd/dmt052.
3. Sparic R, Mirkovic L, Malvasi A, Tinelli A. Epidemiology of Uterine Myomas: A Review. Int J Fertil Steril. 2016; 9(4):424- 35. DOI: 10.22074/ijfs.2015.4599.
4. Сосин С.А., Зазерская И.Е. Эмболизация маточных артерий как метод лечения лейомиомы матки. Эффективность и безопасность. Бюллетень Федерального центра сердца, крови и эндокринологии им. В.А. Алмазова. 2011;(6):20–22. eLIBRARY ID: 17800207
5. Styer AK, Rueda BR. The Epidemiology and Genetics of Uterine Leiomyoma. Best Pract Res Clin Obstet Gynaecol. 2016; 34:3-12. DOI: 10.1016/j.bpobgyn.2015.11.018.
6. Wise LA, Laughlin-Tommaso SK. Epidemiology of Uterine Fibroids: From Menarche to Menopause. Clin Obstet Gynecol. 2016; 59(1):2-24. DOI: 10.1097/GRF.0000000000000164.
7. Наумова Н.В., Болдовская Е.А., Макухина В.В., Крутова В.А. Интраоперационная ультразвуковая навигация при хирургическом лечении миом матки. Кубанский научный медицинский вестник. 2018; 25(1):30-33. DOI: 10.25207/1608-6228-2018-25-1-30-33.
8. Буянова С.Н., Титченко Л. И., Карева Е.Н., Гаспарян И.Д., Титченко И.Р., Чечнева М.А. Клиническое значение оценки показателей внутриопухолевого кровотока в диагностике эстроген- и прогестеронзависимой миомы матки. Российский вестник акушера-гинеколога. 2006; 6(3):42–45. eLIBRARY ID: 9247532
9. Буянова С.Н., Мгелиашвили М.В., Петракова С.А. Современные представления об этиологии, патогенезе и морфогенезе миомы матки. Российский вестник акушерагинеколога. 2008; 8(6):45–51. eLIBRARY ID: 13333253
10. Ciavattini A, Di Giuseppe J, Stortoni P, Montik N, Giannubilo SR, et al. Uterine fibroids: pathogenesis and interactions with endometrium and endomyometrial junction. Obstet Gynecol Int. 2013; 2013:173184. DOI: 10.1155/2013/173184.
Об авторах
Э. В. БашировРоссия
Баширов Эдуард Владимирович, доктор медицинских наук, доцент, врач отделения гинекологии
Краснодар
В. А. Крутова
Крутова Виктория Александровна, доктор медицинских наук, профессор, главный врач
Краснодар
И. И. Куценко
Куценко Ирина Игоревна, доктор медицинских наук, профессор, кафедра акушерства, гинекологии и перинатологии
Краснодар
Рецензия
Для цитирования:
Баширов Э.В., Крутова В.А., Куценко И.И. Биомаркеры патогенетических вариантов рецидивов миоматозного роста. Медицинский вестник Юга России. 2021;12(4):6-11. https://doi.org/10.21886/2219-8075-2021-12-4-6-11
For citation:
Bashirov E.V., Krutova V.A., Kutsenko I.I. Biomarkers of the type of recurrent uterine myoma-associated growth. Medical Herald of the South of Russia. 2021;12(4):6-11. (In Russ.) https://doi.org/10.21886/2219-8075-2021-12-4-6-11






































