Перейти к:
Клинико-диагностическое значение маркеров апоптоза при инфаркте миокарда на фоне хронической обструктивной болезни лёгких
https://doi.org/10.21886/2219-8075-2021-12-4-46-53
Аннотация
Цель: изучить уровни белка теплового шока 70 и зависимого от аннексина V апоптоза клеток при инфаркте миокарда с различным течением заболевания и на фоне сопутствующей хронической обструктивной болезни лёгких.
Материалы и методы: обследованы 65 больных инфарктом миокарда; у 37 из них инфаркт миокарда развился на фоне хронической обструктивной болезни легких, у 28 — без таковой. Обследуемые были разделены на подгруппы в зависимости от наличия подъёма сегмента ST. В группу контроля вошли 30 соматически здоровых лиц.
Результаты: у всех обследуемых больных значения исследуемых биомаркеров были значимо выше, чем у соматически здоровых лиц. Значение изучаемых биомаркеров было достоверно выше у больных без сопутствующей хронической обструктивной болезни лёгких. У больных с инфарктом миокарда с подъёмом сегмента ST значение исследуемых биомаркеров было достоверно больше, чем у больных без подъёма сегмента ST у всех больных.
Заключение: более высокие значения исследуемых биомаркеров в группе коморбидных больных по сравнению с лицами с инфарктом миокарда без хронической обструктивной болезни лёгких можно связать с интенсификацией процесса апоптоза на фоне хронического системного воспаления, которое ухудшает клиническое течение обоих заболеваний. Большее значение уровней белка теплового шока 70 и зависимого от аннексина V апоптоза клеток у больных с инфарктом миокарда с подъёмом сегмента ST по сравнению с больными без подъема сегмента ST обусловлено объёмом поражения миокарда.
Ключевые слова
Для цитирования:
Наумов А.В., Прокофьева Т.В., Полунина О.С., Сароянц Л.В., Полунина Е.А. Клинико-диагностическое значение маркеров апоптоза при инфаркте миокарда на фоне хронической обструктивной болезни лёгких. Медицинский вестник Юга России. 2021;12(4):46-53. https://doi.org/10.21886/2219-8075-2021-12-4-46-53
For citation:
Naumov A.V., Prokofieva T.V., Polunina O.S., Saroyants L.V., Polunina E.A. Clinical and diagnostic significance of apoptosis markers in myocardial infarction in the setting of chronic obstructive pulmonary disease. Medical Herald of the South of Russia. 2021;12(4):46-53. (In Russ.) https://doi.org/10.21886/2219-8075-2021-12-4-46-53
Введение
В настоящее время существенно увеличивается распространённость заболеваний, при которых развивается коморбидное состояние, в частности на фоне хронической обструктивной болезни лёгких (ХОБЛ). Часто это приводит к летальному исходу [1]. ХОБЛ, по ряду клинических и лабораторных показателей, усугубляет течение абсолютного большинства известных сегодня заболеваний. В длинном списке болезней, сопутствующих ХОБЛ, сердечно-сосудистые заболевания (ССЗ), как правило, считаются наиболее значимыми. Среди пациентов с ХОБЛ сосуществующие ССЗ неизменно связаны с более высокими показателями госпитализации, внутрибольничной смертности и повторной госпитализации в течение 30 дней, а также с увеличением продолжительности пребывания в стационаре [2]. Кроме того, наличие ССЗ повышает риск и продолжительность обострений ХОБЛ [3], а возникновение этих обострений, в свою очередь, увеличивает риск последующих сердечно-сосудистых нарушений [4].
Основной причиной ХОБЛ является курение сигарет, которое, как известно, вызывает эндотелиальную дисфункцию. У пациентов с ХОБЛ наблюдаются изменения в эндотелии, как в лёгочном, так и в системном кровообращении, что может предрасполагать к лёгочной гипертензии и/или сердечно-сосудистым событиям [5][6]. Проблема сочетанной патологии ИБС и ХОБЛ сложна и до сих пор недостаточно изучена. Несомненно, рассматриваемые патологические состояния утяжеляют течение чего? и ускоряют темпы взаимного развития.
Понимание патогенетических аспектов, связывающих ХОБЛ и различные формы ССЗ, за последнее десятилетие значительно расширилось [7][8], но механизмы, которые лежат в их основе, недостаточно понятны. К ключевым относятся общие факторы риска, хроническое системное воспаление, гиперинфляция лёгких, тканевая гипоксия, лёгочная гипертензия, окислительный стресс, а также генетические факторы и фенотип ХОБЛ [9]. Одним из общих механизмов, привлекающих всё большее внимание исследователей, является апоптоз. Фактически апоптоз эндотелиальных клеток — это один из факторов, способствующих развитию эмфиземы лёгких, и дополнительный критерий повреждения эндотелия и гемостаза. При ИМ апоптозу принадлежит решающая роль в реализации поражения сердца.
Часто используемым маркером апоптоза является аннексин V. Это кальций-зависимый гликопротеин с сильной антикоагулянтной способностью, проявляющейся in vitro. Данное свойство обусловлено способностью аннексина V вытеснять белки свёртывания с поверхности фосфолипидов, продлевая фосфолипид-зависимые реакции свертывания. Аннексин V обладает высоким сродством к апоптотическим структурам благодаря тому факту, что они продуцируют большое количество фосфолипидов, в частности фосфатидилсерина (ФС). Это было подтверждено в различных исследованиях как in vitro [10], так и in vivo [11]. Aннексин V является белком с положительным потенциалом, который с высокой аффинностью и специфичностью связывается с отрицательно заряженным ФС на поверхности апоптотических клеток. При флуоресцентной индикации аннексина V фосфолипиды могут быть обнаружены с помощью цитометрии потока. Имеются данные о возможности применения аннексина V для мониторинга апоптоза в реальном времени [12].
В регуляции процессов апоптоза участвуют индуцируемые стрессом белки теплового шока (БТШ), одним из основных представителей которых является белок теплового шока с массой 70кДа (БТШ70). БТШ70 — это белок самосохранения, который поддерживает клеточный гомеостаз в условиях стресса. Он действует как молекулярный шаперон, играя важную роль в укладке, сборке, транспорте и деградации белка. Он же помогает предотвратить денатурацию и агрегацию белка [13]. Однако роль этого белка не сводится только к антиапоптическому эффекту. Имеются свидетельства того, что он способен проявлять также противоположные проапоптические свойства. То есть механизмы взаимосвязи апоптоза и экспрессии БТШ при заболеваниях сердца остаются во многом не ясными.
Лучшее понимание обстоятельств, которые вызывают апоптоз во время инфаркта миокарда и после него, а также понимание клеточных механизмов, которые контролируют апоптоз, может привести к новым терапевтическим стратегиям, ограничивающим повреждение тканей миокарда при инфаркте.
Цель исследования — изучить уровни БТШ70 и зависимого от аннексин V апоптоза клеток при ИМ с различным течением заболевания и на фоне сопутствующей ХОБЛ.
Материалы и методы
Было обследовано 65 больных ИМ; у 37 из них ИМ развился на фоне ХОБЛ, у 28 не имелось ХОБЛ в качестве сопутствующего заболевания. Наблюдение за больными осуществлялось в региональном сосудистом центре ГБУЗ АО Александро-Мариинской областной клинической больницы г. Астрахани в период с 2018 по 2019 гг. Перед включением в исследование от всех пациентов было получено письменное информированное согласие на участие в нём.
Медиана возраста обследованных составила 52,8 [ 45,8; 60] года. Диагноз ИМ устанавливался на основании клинических рекомендаций «Четвёртое универсальное определение инфаркта миокарда» Европейского общества кардиологов (2018 г.). Критериями включения в основные группы являлись возраст до 60 лет, I тип ИМ. В исследование не включались пациенты с другими типами ИМ, с терминальной печёночной и почечной недостаточностями (скорость клубочковой фильтрации менее 30 мл/мин.), онкологическими заболеваниями.
В группе больных ИМ на фоне ХОБЛ диагноз «Лёгочная патология», а также тяжесть течения ХОБЛ были верифицированы ранее. Все больные с ХОБЛ имели II–III стадии заболевания вне обострения. Диагноз ХОБЛ устанавливался в соответствии с программой «Глобальная стратегия диагностики, лечения и профилактики хронической обструктивной болезни лёгких» (пересмотр 2019 г.). Медиана длительности ХОБЛ составила 17,5 [ 7,4; 24,6 ] лет. У всех пациентов отмечалось курение в анамнезе. На момент госпитализации курящими были 87,8% пациентов с ХОБЛ. Средний индекс курения составил 34,6 пачка-лет. В 96% случаев наблюдаемыми были мужчины с длительным анамнезом курильщика на момент исследования.
Для изучения взаимосвязи изучаемых показателей у больных с ИМ в зависимости от подъема на ЭКГ сегмента ST обследуемые были разделены на подгруппы — с подъёмом ST и без. Среди больных ИМ без сопутствующей ХОБЛ у 14 человек был диагностирован ИМпST и у 14 — ИМбпST. Среди больных ИМ на фоне ХОБЛ у 19 человек был диагностирован ИМпST, у 18 — ИмбпST.
Группа контроля была представлена 30 соматически здоровыми лицами, проходившими обследование в поликлиниках г. Астрахани. Лица группы контроля были сопоставимы с группой больных ИМ по возрастно-половому составу и являлись соматически здоровыми.
Клиническое исследование было одобрено Региональным Независимым Этическим комитетом (от 15.09.2016, протокол № 1). Исследование было проведено в соответствии с международными стандартами GCP.
Для оценки количества апоптотических клеток использовался набор ANNEXIN V-FITC/7 AAD (Beckman Coulter, USA). Принцип действия реагентов основан на высоком сродстве аннексина V и ФС и специфичном связывании 7-аминоактиномицина (7AAD) с нуклеотидными парами гуанин-цитозин в ДНК. Выделение мононуклеаров осуществляли с помощью центрифугирования венозной крови на градиенте плотности «Фикол-гипак» Pharmacia Fine Chemicals (Швеция). Среди популяции лимфоцитов определяли клетки, находящиеся в апоптозе и/или некрозе, с помощью двумерных гистограмм. Апоптоз анализировали в процессе проточной цитометрии с использованием проточного цитометра «Navios» (Beckman Coulter, USA). Контроли, включённые в настройку компенсации и квадранты, представляли собой клетки, окрашенные только аннексином V FITC, и клетки, окрашенные только 7ADD. Клетки были определены как интактные, то есть жизнеспособные клетки (AV-/7AAD-), клетки на ранней стадии апоптоза (AV+/7AAD-), клетки на поздней стадии апоптоза (AV+/7AAD+), погибшие клетки (AV-/7AAD+). Каждую субпопуляцию выражали как процент от общей численности мононуклеаров. Концентрацию белка БТШ70 (нг/мл) определяли в сыворотке крови методом ИФА с помощью набора («Enzo Life Science», США) на микропланшетном фотометре «Invitrologic» (Россия) с использованием промывателя планшет «Stat Fax 2600» (США) и шейкера-встряхивателя «ST-3 SkyLine» (Латвия).
Статистическую обработку данных проводили с применением программы STATISTICA 10.0. Описательные характеристики представлены медианой, 25-м и 75-м перцентилями. Для сравнения двух независимых групп использовался анализ ранговых вариаций с применением непараметрического критерия Вилкоксона-Манна-Уитни, трех и более групп — с помощью критерия Краскела-Уоллиса. Отличия считались статистически значимыми при р <0,05.
Результаты
При анализе содержания циркулирующих аннексин V-мононуклеаров в периферической крови у больных ИМ и здоровых лиц было установлено, что наибольшее число апоптотических клеток выявляется при ИМ на фоне ХОБЛ (рис. 1).
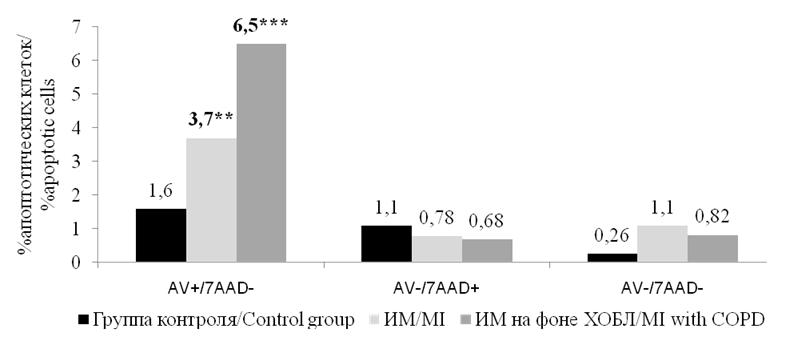
Рисунок 1. Медианы количества циркулирующих аннексин V-мононуклеаров (%) в периферической крови у больных ИМ и соматически здоровых лиц. Примечание: ** — р <0,01, *** — р<0,001; статистически значимые различия с группой контроля.
Figure 1. Medians of the number of circulating annexin V-mononuclears (%) in peripheral blood in patients with MI and somatically healthy individuals. Note: ** — p<0.01, *** — p<0.001, statistically significant differences with the control group.
В этой группе больных содержание апоптотических мононуклеаров составило 6,5 [ 3,4–12,3 ] %, что было статистически значимо выше как по сравнению с группой контроля, где содержание этих клеток составило 1,6 [ 0,8–2,4 ] % (р <0,001), так и с больными ИМ без ХОБЛ — 3,7 [ 2,1–4,9 ] % (р<0,01). У больных с ИМ без ХОБЛ также отмечались статистически значимые различия с группой контроля (р<0,01). Статистически значимых различий в содержании других циркулирующих мононуклеаров, как жизнеспособных (интактные клетки), так и клеток на поздней стадии апоптоза и погибших клеток, не выявлено .
При исследовании уровня БТШ70 установлено, что у больных с ИМ независимо от сопутствующей бронхолегочной патологии этот показатель был значимо выше по сравнению с группой здоровых лиц, причём наиболее высокий его уровень отмечался в группе ИМ на фоне ХОБЛ (рис. 2).
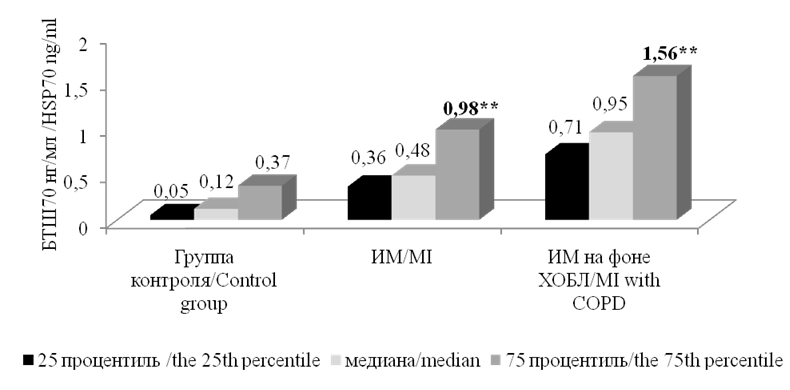
Рисунок 2. Уровни БТШ70у больных ИМ и здоровых лиц. Примечание: ** — статистически значимые различия с группой контроля, р <0,01.
Figure 2. The levels of BTSH70U of MI patients and healthy individuals. Note: ** — statistically significant differences with the control group, p <0.01.
У лиц в этой группе уровень БТШ70 составил 0,95 [ 0,71–1,56 ] нг/мл, что было достоверно выше как по сравнению с группой ИМ без ХОБЛ — 0,48 [ 0,36–0,98 ] нг/мл (р <0,05), так и с группой контроля — 0,12 [ 0,05–0,37 ] нг/мл ( р<0,01). В группе больных ИМ без ХОБЛ также отмечался статистически значимо (р <0,01) более высокий уровень БТШ70 по сравнению с группой контроля.
При изучении взаимосвязи уровней аннексин-зависимового апоптоза у больных с ИМ от подъёма сегмента ST было установлено (табл. 1), что у больных с ИМ с подъёмом ST независимо от сопутствующей бронхолегочной патологии отмечается повышение содержания апоптотических клеток.
Таблица / Table 1
Содержание циркулирующих аннексин V-мононуклеаров (%) в зависимости от подъёма сегмента ST при ИМ
The content of circulating annexin V-mononuclears (%) depending on the riseof the ST segment at MI
|
Показатели / Indicators |
ИМ / MI |
ИМ на фоне ХОБЛ / MI withCOPD |
||
|
ИМпST / STEMI, n=14 |
ИМбпST / non-STEMI, n=14 |
ИМпST / STEMI, n=19 |
ИМбпST / non-STEMI, n=18 |
|
|
Интактные клетки (аннексинV-7AAD-клетки) / Intact cells (AnnexinV-7AADcells) |
94,5 [ 92,8–96,5] |
96,3 [ 95,3–97,2] |
90,2 [ 84,4–94,3] |
92,4 [ 82,7–95,5] |
|
Ранняя стадия апоптоза (аннексинV+7AAD- клетки) / Early stage of apoptosis (annexinV+7AAD cells) |
3,9 [ 2,3–4,9] р1<0,05 |
2,4 [ 1,8–3,1] |
7,6 [ 4,4–12,3] р1 <0,01 р2 <0,05 р3=0,16 |
5,9 [ 3,1–9,7] р1 <0,05 |
|
Поздняя стадия апоптоза (аннексин V+7AAD+ клетки) / Late stage of apoptosis (annexin V+7AAD+ cells) |
0,95 [ 0,76–1,34] |
0,73 [ 0,59–0,87] |
1,2 [ 0,77–1,53] |
1,01 [ 0,89–1,13] |
|
Погибшие клетки (аннексин V-7AAD+ клетки) / Dead cells (annexin V-7AAD+ cells) |
0,65 [ 0,44–0,96] |
0,58 [ 0,45–0,71] |
0,97 [ 0,55–1,79] р1 <0,05 р2 <0,05 р3 <0,05 |
0,67 [ 0,47–0,75] |
Note: p1 — statistically significant differences with the group of non-STEMI; p2 — statistically significant differences with the group of patients with STeMI; p3 — statistically significant differences with the group of patients with non-STEMI with COPD.
При ИМпST число клеток, находящихся на стадии раннего апоптоза, составило 3,9 [ 2,3–4,9] %, что было достоверно (р <0,05) выше, чем в группе больных ИМбпST, где этот показатель составил 2,4 [ 1,8–3,1] %. Самое значительное повышение числа апоптотическихклеток на этой стадии апоптоза отмечалось при ИМ с подъёмом сегмента ST в группе коморбидных больных — 7,6 [ 4,4–12,3] %, что статистически значимо превышало данный показатель как у больных ИМбпST (р <0,01), так и у больных ИМпST (р <0,05).
В коморбидной группе ИМбпSTна фоне ХОБЛ этот показатель составил 5,9 [ 3,1–9,7] %, что было достоверно выше (р <0,05) данного показателя в группе больных ИМбпST. При сопоставлении содержания погибших клеток выявлено, что в коморбидной группе с подъёмом сегмента ST их число было значимо выше (р <0,05) по сравнению со всеми группами больных. Статистически значимых различий в содержании других клеток не выявлено.
При анализе зависимости уровня БТШ70 от подъёма сегмента ST (табл. 2) установлено, что у больных ИМпST на фоне ХОБЛ отмечался самый высокий его уровень, который составил 1,22 [ 0,95–1,56] нг/мл.
Таблица / Table 2
Значение уровня БТШ70 (нг/мл) в зависимости от подъёма сегмента ST при ИМ
The value of the BTSH70 level (ng/ml) depending on the ST segment elevation at MI
|
ИМ/MI |
ИМ на фоне ХОБЛ/MIwithCOPD |
||
|
ИМпST / NSTEMI, n=14 |
ИМбпST / non-STEMI, n=14 |
ИМпST / NSTEMI, n=19 |
ИМбпST / non-STEMI, n=18 |
|
0,57 [ 0,46–0,98] р1 <0,05 р3=0,16 |
0,41 [ 0,36–0,69] |
1,22 [ 0,95–1,56] р1 <0,01 р2 <0,05 р3 <0,05 |
0,81 [ 0,71–1,2] р2 <0,05 р3=0,16 |
Note: p1 — statistically significant differences with the group of non-STEMI; p2 — statistically significant differences with the group of patients with STeMI; p3 — statistically significant differences with the group of patients with non-STEMI with COPD.
Этот показатель был значимо выше как по сравнению с группой ИМпST, где он составил 0,57 [ 0,46–0,98] нг/мл (р <0,05), так и с группой ИМбпST — 0,41 [ 0,36–0,69] нг/мл (р <0,01). Кроме того, статистически значимые различия отмечались с группой ИМбпSTна фоне ХОБЛ — 0,81 [ 0,71–1,2] нг/мл (р <0,05).
В группе ИМ отмечалось статистически значимое повышение уровня БТШ70 у больных с подъемом ST по сравнению с группой ИМбпST — 0,41 [ 0,36–0,69] нг/мл (р <0,05). Во всех группах больных уровень БТШ70 был значимо выше у больных с подъёмом сегмента ST по сравнению с больными без подъёма.
Обсуждение
Более 70% лиц старше 65 лет имеют мультиморбидные заболевания, и в значительной части случаев по крайней мере одно из заболеваний имеет сердечно-сосудистую основу [14]. Типичный пациент с ХОБЛ с такой же вероятностью может умереть от сердечно-сосудистой причины, как и от респираторной [15].
Ранее было показано, что при ХОБЛ наблюдается увеличение числа клеток, вступивших в апоптоз, что обусловлено высоким уровнем проапоптотических факторов и вследствие этого активацией апоптоза [16]. При ИМ отмечается усиление апоптоза эндотелия с увеличением прокоагулянтной активности крови [17].
ИМпST является наиболее тяжёлым исходом коронарной болезни, на него приходится 12,8% всех смертей во всем мире [18]. В процессе ишемического повреждения наряду с некротической гибелью кардиомиоцитов имеет место активизация процесса апоптоза [19]. Апоптоз начинается в течение нескольких минут после ишемии и предшествует некрозу. Апоптоз характеризуется усадкой клеток, деструкцией хроматина и систематическим расщеплением ДНК. В апоптотический процесс могут в равной степени вовлекаться кардиомиоциты, интерстициальные и эндотелиальные клетки. Некоторые авторы предполагают, что постнекротический апоптоз сохраняется длительное время, он является ответственным за желудочковое ремоделирование и прогрессирование сердечной недостаточности [20]. Выявленное нами повышение числа аннексин V-положительных мононуклеаров в крови при ИМ происходит, вероятно, в результате эндотелиального повреждения, связанного с разрушением атеросклеротической бляшки. Аннексин V, связываясь на поверхности апоптотических клеток с ФС, повышает защитную реакцию, направленную на снижение риска тромбоза с активацией прокоагулянтных реакций [21].
Основным фактором, вызывающим экспрессию БТШ70, является ишемия. Продукция БТШ70 в этих условиях может быть расценена как механизм адаптации миокарда к повреждениям. Wei Y. и соавт. продемонстрировали, что повышение экспрессии БТШ70 в кардиомиоцитах часто развивается вследствие ишемической или дилатационной кардиомиопатии [22]. Повышение уровня БТШ70, выявленное в нашем исследовании, вероятно, связано с антиапоптотическими свойствами белка БТШ70. Показано, что БТШ70 может защитить клетки от апоптоза, вызванного действием TNF-α, после активации эффекторных каспаз и задержать процесс гибели, вызванной цитохромом С, в том числе в отношении кардиомиоцитов [23].
Заключение
Выявленное в нашем исследовании у обследуемых больных повышение в крови численности аннексин V-ассоциированных апоптотических клеток и содержания белка БТШ70, способствующего устойчивости к воздействию гипоксии и оптимизации реперфузии, вероятно, является проявлением защитной реакции, направленной на снижение тромбогенного потенциала крови при ИМ. Мы полагаем, что большее количество аннексин V-положительных мононуклеаров и более высокий уровень БТШ70 в крови больных ИМпST по сравнению с больными ИМбпST обусловлены объёмом поражения миокарда. Ведь известно, что при ИМбпST имеет место неокклюзирующий тромбоз коронарной артерии, в то время как развитие ИМпST обусловлено полной тромботической окклюзией коронарной артерии. Более высокие значения исследуемых биомаркеровв группе коморбидных больных ИМ на фоне ХОБЛ по сравнению с лицами, у которых имел место ИМ без фоновой ХОБЛ, можно связать с интенсификацией процесса апоптоза на фоне хронического системного воспаления, которое ухудшает клиническое течение обоих заболеваний.
Список литературы
1. Погосова Н.В., Соколова О.Ю., Юферова Ю.М., Осипова И.В., Рямзина И.Н. Первые результаты анализа российской части европейского регистра по кардиореабилитации (European cardiac rehabilitation database-eurocared) с участием 13 стран. Кардиология. 2015; 55(2):49-56.
2. Morgan AD, Zakeri R, Quint JK. Defining the relationship between COPD and CVD: what are the implications for clinical practice? Ther Adv Respir Dis. 2018; 12:1753465817750524. DOI: 10.1177/1753465817750524.
3. Goedemans L, Bax JJ, Delgado V. COPD and acute myocardial infarction. Eur Respir Rev. 2020; 29(156):190139. DOI: 10.1183/16000617.0139-2019.
4. Kunisaki KM, Dransfield MT, Anderson JA, Brook RD, Calverley PMA, et al. Exacerbations of Chronic Obstructive Pulmonary Disease and Cardiac Events. A Post Hoc Cohort Analysis from the SUMMIT Randomized Clinical Trial. Am J Respir Crit Care Med. 2018; 198(1):51-57. DOI: 10.1164/rccm.201711-2239OC.
5. Pizarro S, García-Lucio J, Peinado VI, Tura-Ceide O, Díez M, et al. Circulating progenitor cells and vascular dysfunction in chronic obstructive pulmonary disease. PLoS One. 2014; 9(8):e106163. DOI: 10.1371/journal.pone.0106163. Erratum in: PLoS One. 2014; 9(12):e115566.
6. García-Lucio J, Peinado VI, de Jover L, Del Pozo R, Blanco I, et al. Imbalance between endothelial damage and repair capacity in chronic obstructive pulmonary disease. PLoS One. 2018; 13(4):e0195724. DOI: 10.1371/journal.pone.0195724
7. Trinkmann F, Saur J, Borggrefe M, Akin I. Cardiovascular Comorbidities in Chronic Obstructive Pulmonary Disease (COPD)-Current Considerations for Clinical Practice. J Clin Med. 2019; 8(1):69. DOI: 10.3390/jcm8010069.
8. Roversi S, Fabbri LM, Sin DD, Hawkins NM, Agustí A. Chronic Obstructive Pulmonary Disease and Cardiac Diseases. An Urgent Need for Integrated Care. Am J Respir Crit Care Med. 2016; 194(11):1319-1336. DOI: 10.1164/rccm.201604-0690SO.
9. Lee H, Shin SH, Gu S, Zhao D, Kang D, et al. Racial differences in comorbidity profile among patients with chronic obstructive pulmonary disease. BMC Med. 2018; 16(1):178. DOI: 10.1186/s12916-018-1159-7.
10. Hamon Y, Broccardo C, Chambenoit O, Luciani MF, Toti F, et al. ABC1 promotes engulfment of apoptotic cells and transbilayer redistribution of phosphatidylserine. Nat Cell Biol. 2000; 2(7):399-406. DOI: 10.1038/35017029.
11. Hofstra L, Liem IH, Dumont EA, Boersma HH, van Heerde WL, et al. Visualisation of cell death in vivo in patients with acute myocardial infarction. Lancet. 2000; 356(9225):209- 12. DOI: 10.1016/s0140-6736(00)02482-x.
12. Kupcho K, Shultz J, Hurst R, Hartnett J, Zhou W, et al. A realtime, bioluminescent annexin V assay for the assessment of apoptosis. Apoptosis. 2019; 24(1-2):184-197. DOI: 10.1007/s10495-018-1502-7.
13. Mathangasinghe Y, Fauvet B, Jane SM, Goloubinoff P, Nillegoda NB. The Hsp70 chaperone system: distinct roles in erythrocyte formation and maintenance. Haematologica. 2021; 106(6):1519-1534. DOI: 10.3324/haematol.2019.233056.
14. Vanfleteren LE, Spruit MA, Groenen M, Gaffron S, van Empel VP, et al. Clusters of comorbidities based on validated objective measurements and systemic inflammation in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2013; 187(7):728-35. DOI: 10.1164/rccm.201209-1665OC.
15. Кузьмичев Б.Ю., Воронина Л.П., Тарасочкина Д.С., Полунина О.С., Прокофьева Т.В. и др. Гипергомоцистеинемия как фактор риска осложненного течения инфаркта миокарда на фоне хронической обструктивной болезни легких. Астраханский медицинский журнал. 2019; 14(3):79-87. eLIBRARY ID: 41550888
16. Васина Л.В., Луговая А.В., Петрищев Н.Н., Серебряная Н.Б. Патогенетическое значение изменения относительного содержания аннексин V+мононуклеаров и CD 59+-лимфоцитов периферической крови при остром коронарном синдроме. Медико-биологические и социальнопсихологические проблемы безопасности в чрезвычайных ситуациях. 2088;(1):74-80. eLIBRARY ID: 21139575
17. Chiong M, Wang ZV, Pedrozo Z, Cao DJ, Troncoso R, et al. Cardiomyocyte death: mechanisms and translational implications. Cell Death Dis. 2011; 2(12):e244. DOI: 10.1038/cddis.2011.130.
18. Masoudi FA, Ponirakis A, Yeh RW, Maddox TM, Beachy J, et al. Cardiovascular care facts: a report from the national cardiovascular data registry: 2011. J Am Coll Cardiol. 2013; 62(21):1931-1947. DOI: 10.1016/j.jacc.2013.05.099.
19. Foo RS, Mani K, Kitsis RN. Death begets failure in the heart. J Clin Invest. 2005; 115(3):565-71. DOI: 10.1172/JCI24569.
20. Shekhar A, Heeger P, Reutelingsperger C, Arbustini E, Narula N, et al. Targeted Imaging for Cell Death in Cardiovascular Disorders. JACC Cardiovasc Imaging. 2018; 11(3):476- 493. DOI: 10.1016/j.jcmg.2017.11.018.
21. Osende Olea JI. Anexina V en jóvenes con infarto de miocardio: nuevas respuestas traen nueva preguntas [Annexin V levels in young patients with acute myocardial infarction: new answers bring new questions]. Rev Esp Cardiol. 2002; 55(12):1223-5. (in Spanish). DOI: 10.1016/s0300-8932(02)76792-4.
22. Wei YJ, Huang YX, Shen Y, Cui CJ, Zhang XL, et al. Proteomic analysis reveals significant elevation of heat shock protein 70 in patients with chronic heart failure due to arrhythmogenic right ventricular cardiomyopathy. Mol Cell Biochem. 2009; 332(1-2):103-11. DOI: 10.1007/s11010-009-0179-1.
23. Patterson C, Cyr D. Welcome to the machine: a cardiologist’s introduction to protein folding and degradation. Circulation. 2002; 106(21):2741-6. DOI: 10.1161/01.cir.0000041145.30519.6b.
Об авторах
А. В. НаумовНаумов Андрей Валентинович, аспирант кафедры внутренних болезней педиатрического факультета
Астрахань
Т. В. Прокофьева
Прокофьева Татьяна Васильевна, кандидат медицинских наук, доцент кафедры внутренних болезней педиатрического факультета
Астрахань
О. С. Полунина
Полунина Ольга Сергеевна, доктор медицинских наук, профессор, заведующая кафедрой внутренних болезней педиатрического факультета
Астрахань
Л. В. Сароянц
Сароянц Людмила Валентиновна, доктор медицинских наук, заведующая лабораторно-экспериментальным отделом
Астрахань
Е. А. Полунина
Россия
Полунина Екатерина Андреевна, доктор медицинских наук, доцент кафедры внутренних болезней педиатрического факультета
Астрахань
Рецензия
Для цитирования:
Наумов А.В., Прокофьева Т.В., Полунина О.С., Сароянц Л.В., Полунина Е.А. Клинико-диагностическое значение маркеров апоптоза при инфаркте миокарда на фоне хронической обструктивной болезни лёгких. Медицинский вестник Юга России. 2021;12(4):46-53. https://doi.org/10.21886/2219-8075-2021-12-4-46-53
For citation:
Naumov A.V., Prokofieva T.V., Polunina O.S., Saroyants L.V., Polunina E.A. Clinical and diagnostic significance of apoptosis markers in myocardial infarction in the setting of chronic obstructive pulmonary disease. Medical Herald of the South of Russia. 2021;12(4):46-53. (In Russ.) https://doi.org/10.21886/2219-8075-2021-12-4-46-53







































