Перейти к:
Применение комплексной терапии в лечении больных анкилозирующим спондилитом с расстройствами тревожно-депрессивного спектра
https://doi.org/10.21886/2219-8075-2021-12-1-38-45
Аннотация
Цель: изучение влияния терапии нестероидными противовоспалительными препаратами (НПВП) в сочетании с мелатонином на динамику качества жизни (КЖ), клинико-лабораторную активность и расстройства тревожно-депрессивного спектра (РТДС) у пациентов с анкилозирующим спондилитом (АС).
Материалы и методы: в исследовании приняли участие 65 пациентов с АС и РТДС. Пациентам I группы (n = 32) в дополнение к стандартной терапии АС назначался мелатонин в дозе 3 мг в сутки на ночь, за 30–40 минут до сна. Пациенты II группы (n = 33) получали стандартную терапию. Через 8 недель оценивали динамику показателей КЖ, клинико-лабораторной активности и выраженности РТДС больных обеих групп.
Результаты: на фоне применения мелатонина в дополнение стандартной терапии пациентов с АС и РТДС отмечается статистически значимое улучшение функциональных и клинико-лабораторных данных (частота и уровень выраженности тревожности и депрессии, показателей болевого синдрома, СОЭ, СРБ, интегративных показателей физического и психологического компонентов здоровья).
Выводы: применение мелатонина в комплексной терапии пациентов с АС и РТДС способствует улучшению клинико-лабораторных показателей, психоэмоционального состояния и КЖ данной категории больных.
Ключевые слова
Для цитирования:
Благинина И.И. Применение комплексной терапии в лечении больных анкилозирующим спондилитом с расстройствами тревожно-депрессивного спектра. Медицинский вестник Юга России. 2021;12(1):38-45. https://doi.org/10.21886/2219-8075-2021-12-1-38-45
For citation:
Blaginina I.I. Complex therapy for patients with ankylosing spondylitis with mixed anxiety–depressive disorder. Medical Herald of the South of Russia. 2021;12(1):38-45. https://doi.org/10.21886/2219-8075-2021-12-1-38-45
Введение
Одной из значимых проблем современной ревматологии является изучение взаимного влияния аутоиммунного воспаления и психических расстройств. На сегодняшний день установлено, что у пациентов с различными ревматологическими заболеваниями частота расстройств тревожно-депрессивного спектра (РТДС) превышает таковую в общей популяции в 7-15 раз, что нашло своё отражение в большом числе исследований, в основном в проводимых среди пациентов с ревматоидным артритом и системной красной волчанкой [1][2].
Установлено, что для пациентов с хроническим болевым синдромом, обусловленным наличием иммуновоспалительного процесса, характерна высокая частота коморбидных состояний, усугубляющих течение основного заболевания, к числу которых относятся РТДС. Постоянное наличие боли способствует изменению психоэмоционального статуса пациентов и проявляется тревогой, депрессией, апатией, усталостью, повышенной возбудимостью, раздражительностью [3][4]. Традиционными факторами риска развития депрессии являются женский пол, отягощённый семейный анамнез, социальная депривация, отсутствие социальной поддержки и хронический психосоциальный стресс, а наличие хронической боли, снижение работоспособности, негативные мысли о болезни, присущие пациентам с аутоиммунными заболеваниями, играют существенную роль в развитии у них РТДС.
На сегодняшний день не вызывает сомнений, что хроническое воспаление является первостепенным патофизиологическим механизмом развития психоэмоциональных расстройств, в частности, депрессии, а саму депрессию рассматривают как системное заболевание, которое ассоциируется с повышением уровней маркеров воспалительных реакций — концентрации СРБ, ФНОальфа, интерлейкинов-1 и 6 [5][6].
Теория двусторонних патогенетических связей, согласно которой иммуновоспалительные заболевания и РТДС имеют общие провоцирующие факторы, в частности стрессовые, и во многом схожий провоспалительный патогенез, подтверждает возможность их взаимного прогрессирования [7][8]. Провоспалительные цитокины активируют гипоталамо-гипофизарно-надпочечниковую систему (ГГНС) и в результате воздействия стрессорных факторов стимулируют новый выброс цитокинов с последующей сенсибилизацией ГГНС, что ухудшает вегетативное обеспечение деятельности организма, снижая его адаптационные возможности, тем самым усугубляя эндокринную дисфункцию, регулирующую стрессовый и иммунный ответы в организме, что повышает уровень провоспалительных цитокинов, а клинически проявляется снижением настроения, хронической болью, усталостью, нарушениями сна [9][2].
В части исследований указывается на высокую частоту и уровень выраженности РТДС у пациентов с серонегативными спондилоартритами, в частности с псориатическими спондилоартропатиями и анкилозирующим спондилитом (АС) [10][11]. Проводились единичные работы по изучению причин развития психоэмоциональных расстройств у мужчин с АС [12]. Однако на сегодняшний день недостаточно внимания уделяется вопросам медикаментозной коррекции у пациентов с АС, имеющих РТДС.
Установленная общность патогенетических механизмов иммунного воспаления и РТДС, характерная для данной категории больных, говорит о необходимости разработки модифицированных подходов к терапии АС, сочетанного с РТДС. В связи с этим представляется перспективным использование нейрогормона мелатонина, чаще применяемого как средство для коррекции биоритмов, однако обладающего и другими доказанными клиническими эффектами. На сегодняшний день изучен широкий спектр эффектов мелатонина — его хронобиотические, антиоксидантные, цитопротекторные, анальгетические, антиапоптические свойства. Не менее значимым, но менее изученным является периферическое противовоспалительное действие препарата, связанное с ингибированием ЦОГ-2 и NO-синтазы [13]. В клинических исследованиях доказано антидепрессивное действие препарата [14, 15]. Также обращает на себя внимание способность мелатонина ингибировать активность матриксной металлопротеиназы, изученная у пациентов с ревматоидным артритом [16].
Целью исследования — изучение влияния терапии нестероидными противовоспалительными препаратами (НПВП) в сочетании с мелатонином на динамику качества жизни, клинико-лабораторную активность и РТДС у пациентов с АС.
Материалы и методы
В исследовании принимали участие 65 пациентов с АС, от 25 до 58 лет (43,4 ± 7,7 лет), 41 мужчина и 26 женщин; средняя длительность заболевания — 10,1 ± 4,6 лет; 25 из них имели высшее образование. Инвалидность имели 34 (52,3%) пациентов: III группу — 21 (61,8%), II — 13 (38,2%); преобладали функциональные нарушения ФК III — 69,2% наблюдений. Диагноз АС устанавливался в соответствии с модифицированными Нью-Йоркскими критериями (ACR, 1984), степень активности патологического процесса оценивали с учётом индекса активности заболевания Bath AS disease activity index (BASDAI) в соответствии с критериями EULAR. У всех пациентов, вошедших в исследование, были зарегистрированы основные диагностические признаки, соответствующие проявлениям тревожной депрессии (F41.2), а именно угнетённое настроение, потеря интересов и чувства удовольствия, тревога и беспокойство; также отмечалось наличие дополнительных симптомов (нарушение сна и аппетита, нарушение концентрации внимания, напряжение и суетливость, тремор, раздражительность, снижение либидо). Всем пациентам было предложено наблюдение и лечение у психиатра, поскольку для назначения психофармакологических препаратов, относящихся к группе антидепрессантов, необходим контроль лечения у данного специалиста. Однако большинство из обследуемых отказались от партнёрской модели помощи (совместное ведение больного лечащим врачом и психиатром). В связи с этим была разработана альтернативная схема с использованием мелатонина, одним из плейотропных эффектов которого является антидепрессивное действие, доказанное в клинических исследованиях [14][15].
Критериями включения в исследование являлись информированное согласие пациента, верифицированный диагноз АС, длительность АС более трёх лет, отсутствие у пациентов диагностированных нарушений центральной нервной системы, которые могут приводить к возникновению РТДС.
Болевой синдром, длительность утренней скованности и показатель собственного здоровья пациента (СЗП) оценивались по визуальной аналоговой шкале (ВАШ) самими пациентами; лабораторная активность оценивалась по динамике СРБ и СОЭ.
Для изучения психоэмоционального состояния была использована шкала самооценки тревоги Спилбергера в соответствии с которой уровень тревожности менее 30 баллов расценивали как низкий, 30–45 — умеренный, более 45 — высокий. Для выявления симптомов депрессии использовали шкалу депрессии Гамильтона (ШДГ), по данным которой при суммировании полученных баллов результат 16–18 у молодых и 18–20 у пожилых свидетельствует о наличии непсихотического депрессивного состояния. Для оценки уровня тревожности была использована шкала Тейлора TMAS (Taylor Manifest Anxiety Scale) с русскоязычной адаптацией Немчинова. Опросник состоит из 50 вопросов, на которые пациент должен ответить «да» или «нет». Результат оценивается в баллах, которые больной набирает, отвечая на соответствующие вопросы положительно либо отрицательно. Интерпретация результатов происходит по следующему принципу: 0–5 баллов свидетельствуют о низком уровне тревоги пациента, 5–15 баллов — о среднем с тенденцией к низкому уровню тревожности, 15–25 баллов — о среднем с тенденцией к высокому уровню тревожности, 20–40 баллов являются показателем высокого уровня тревожности, 40–50 баллов отображают очень высокий уровень тревожности.
Качество жизни (КЖ) пациентов оценивали по опроснику Medical Outcomes Study Short Form (SF-36), отражающему 8 концепций (шкал) здоровья (физическую работоспособность (Physical Functioning — PF), влияние физического состояния на повседневную деятельность (Role-Physical Functioning — RP), интенсивность боли (Bodily pain — BP), общее состояние здоровья (General Health — GH), жизненную активность (Vitality — VT), социальное функционирование (Social Functioning — SF), ролевое функционирование, обусловленное эмоциональным состоянием (Role-Emotional — RE), психическое здоровье (Mental Health — MH)). В целом, анкетирование по SF-36 позволяет оценить два компонента здоровья — суммарный физический (PSH) и психологический (MSH). Результаты каждой из 8 шкал выражают в баллах от 0 до 100. При этом чем выше значение показателя, тем лучше состояние по избранной шкале [17].
Статистический анализ полученных результатов проводился с использованием пакета статистических программ Statistica 10.0 (Statsoft, США). При нормальном распределении данные приводились в виде среднее ± стандартное отклонение (m±σ), в остальных случаях — в виде Me (LQ-UQ), где Me — медиана, LQ — нижний квартиль, UQ — верхний квартиль. Для сравнения количественных признаков в группах до и после лечения применяли тест Вилкоксона, между двумя независимыми группами — непараметрический критерий U Манна-Уитни. Для анализа качественных данных использовали анализ таблиц сопряженности с использованием критерия χ2. Различия считали статистически значимыми при р < 0,05.
Результаты
На момент начала исследования низкая активность установлена у 17 человек, умеренная — 32, высокая — 16. Индекс BASDAI в среднем составил 3,9 (3,3; 4,3); у 40% больных он был выше 4, у 4,6% — выше 7. Индекс BASFI составил 4,1 (3,6; 4,6); в 52,3% случаев он был выше 4, а у 3,6% — ниже 2. Среднее значение СОЭ составило 25,9 ± 8,7 мм/ч, причем у 17 (30,4%) пациентов этот показатель был в пределах нормы. Среднее значение уровня СРБ составило 19,7 ± 20,3 мг/л; у 35 (53,8%) оно было выше 10 мг/л, а у 7,7% — выше 50 мг/л.
При оценке выраженности болевого синдрома, утренней скованности у пациентов с АС получены следующие данные: боль в позвоночнике — 61,2±18,0 мм, утренняя скованность — 61,6±17,6 мм, СЗП — 60,9±17,2 мм. Показатели выраженности РТДС у обследованных составили: уровень выраженности депрессии — по ШДГ 17 (14; 19) баллов, что в целом, с учётом возрастных параметров исследуемых, соответствует непсихотическому депрессивному состоянию; показатели тревожности по шкале Спилбергера — РТ 32 (29; 37) и ЛТ 40 (35; 44) баллов и шкале Тейлора 28 (19; 36) баллов в целом соответствуют умеренно высокому уровню тревожности в группе обследованных пациентов.
Показатели КЖ по опроснику SF-36 продемонстрировали в целом низкие показатели как суммарного физического компонента здоровья (PSH), который составил 28,6 (26,6; 32,7), так и общего психологического компонента здоровья (MSH), который составил у обследованных 39,2 (34,1; 42,9) баллов. Снижение PSH, в основном, объяснялось низким показателем (RP — 25 (0; 25) балла), отражающим влияние физического состояния пациента на его повседневную активность, а также влиянием интенсивности болевого синдрома (BP – 32 (22; 32) балла). Говоря о психологической составляющей следует отметить, что показатель социального функционирования SF сохранялся на достаточном уровне (50 (37,5; 62,5) баллов), однако низким было RE (33,3 (33,3; 66,6) баллов), обусловленное эмоциональным состоянием пациентов.
Учитывая цель исследования, все пациенты методом случайной выборки были рандомизированы на две группы: I группа — 32 больных, которые на протяжении периода наблюдения постоянно получали какой-либо НПВП из нижеперечисленных в суточной дозе, сопоставимой с 150 мг диклофенака (целекоксиб — 400 мг/сутки, нимесулид — 200 мг/сутки, эторикоксиб — 90 мг/сутки, кетопрофен — 200 мг/сутки, ацеклофенак — 200 мг/сутки) и мелатонин в дозе 3 мг в сутки на ночь, за 30–40 минут до сна, II группа — 33 пациента, пролеченных по той же схеме, но без приёма мелатонина. Как и следовало ожидать, исходные клинико-лабораторные характеристики пациентов обеих групп не имели между собой статистически значимых различий (во всех случаях р > 0,05).
Эффективность лечения оценивали по динамике всех исследуемых показателей (клинико-лабораторная активность, уровни тревожности, данные шкал депрессии и SF-36) через 8 недель наблюдения. В течение периода наблюдения не было зафиксировано нежелательных явлений (утренняя сонливость, чувство усталости, ночные кошмары, головные боли), потребовавших отмены мелатонина.
У всех обследованных пациентов на момент начала исследования регистрировались расстройства сна различного характера и степени выраженности. Так, уменьшение продолжительности сна наблюдалось у 68,7% пациентов I группы и 66,7% II группы, а увеличение времени засыпания зарегистрировано практически во всех случаях: в 90,6% наблюдений в I и 94% — во II группе. Чувство неудовлетворённости ночным сном вследствие частых ночных пробуждений выявлено у 62,5% пациентов I и 66,7% больных II группы; чувство усталости утром после пробуждения зарегистрировано у 78,1% и 72,7% обследованных соответственно. На фоне проведённой терапии пациенты I группы отмечали снижение частоты и выраженности расстройств сна: уменьшение продолжительности сна сохранялось лишь у 21,8% пациентов (χ2 = 5,4; р = 0,02); увеличенное время засыпания — у 40,6% (χ2 = 3,8; р = 0,056); чувство неудовлетворённости сном снизилось до 28,1% (χ2 = 2,9; р = 0,08), а утренняя усталость — до 31,3% (χ2 = 4,2; р = 0,039). Во II группе положительной динамики по исследуемым показателям зарегистрировано не было. Отмечалось лишь незначительное уменьшение чувства неудовлетворённости ночным сном (χ2 = 0,6; р = 0,43) и чувства утренней усталости после пробуждения (χ2 = 1,0; р = 0,32), которые оставались у 48,5% пациентов II группы.
По окончании периода наблюдения в группе пациентов, принимавших мелатонин, высоко достоверно (р < 0,001) снизились частота и уровень выраженности депрессивных расстройств по ШДГ, тревожности по TMAS, а также показатели РТ и ЛТ. Во II группе зарегистрировано достоверное снижение ЛТ и тревожности по TMAS. Сравнение результатов, полученных в группах после лечения, продемонстрировало достоверно более значимое (р < 0,05) снижение тревожности у пациентов I группы. Данные представлены в табл. 1.
Таблица / Table 1
Динамика показателей тревоги и депрессии в группах
Dynamics of indicators of anxiety and depression in groups
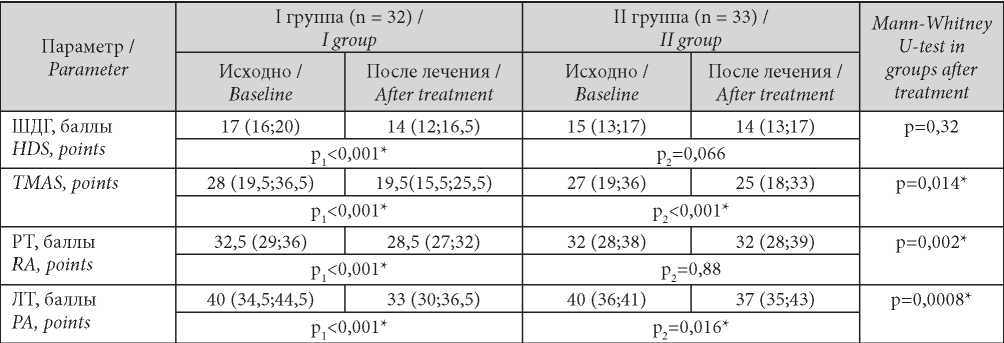
Примечание: * —показатели, при сравнении которых получены статистически значимые результаты (р ≤ 0,05); р1 — уровень статистической значимости различий при сравнении показателей до и после лечения I группы; р2 — уровень статистической значимости различий при сравнении показателей до и после лечения II группы.
Note: * — statistical significance of the differences (p ≤ 0.05); р1 — significance of differences when comparing indicators before and after treatment of the I group; р2 — significance of differences when comparing indicators before and after treatment of the II group
В табл. 2 представлены результаты показателей болевого синдрома и лабораторной активности, полученные в обеих группах больных до и после проводимой терапии. Динамика данных показателей была положительной в обеих группах наблюдения. Следует отметить, что в I группе регресс показателей BASDAI, BASFI и выраженности скованности в позвоночнике был более значимым, чем у пациентов II группы. Однако при сравнении данных показателей в группах I и II после лечения достоверных различий выявлено не было. Проведённый после лечения сравнительный анализ относительно показателя СЗП, по которому была зарегистрирована сходная положительная динамика в группах, позволил установить достоверно значимую (р = 0,025) тенденцию к улучшению в I группе. Это подтверждает влияние мелатонина на эмоционально-личностную сферу пациентов. В отношении показателей СОЭ и СРБ положительная динамика была значима в обеих группах. При этом следует отметить более выраженную тенденцию к улучшению данных показателей после лечения у больных I группы (р = 0,075; р = 0,15 соответственно).
Таблица / Table 2
Динамика показателей болевого синдрома и клинико-лабораторной активности в группах
Dynamics of indicators of pain syndrome and clinical and laboratory activity in groups
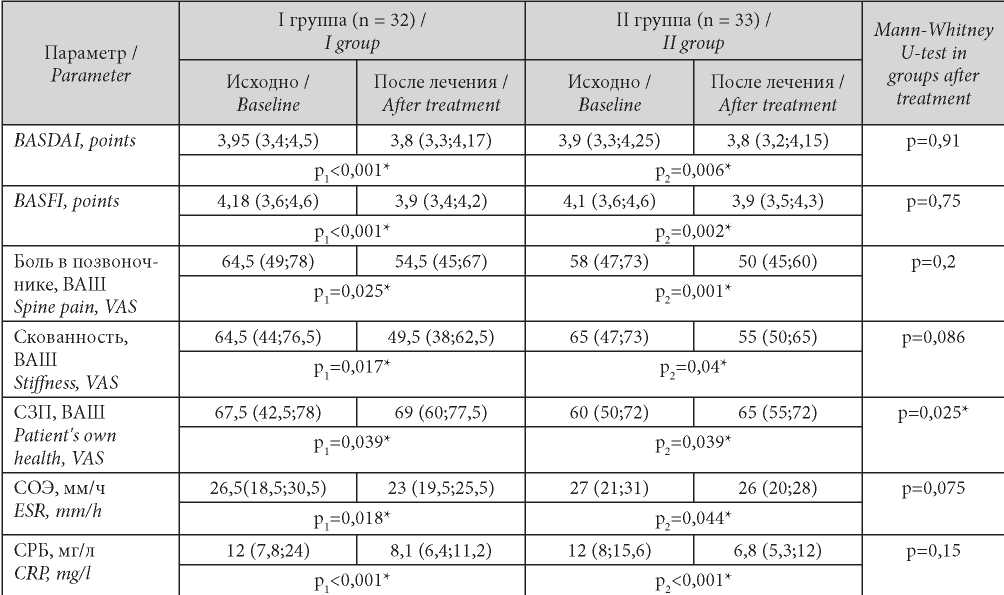
Примечание: * — знаком отмечены показатели, при сравнении которых получены статистически значимые результаты (р ≤ 0,05); р1 — уровень статистической значимости различий при сравнении показателей до и после лечения I группы; р2 — уровень статистической значимости различий при сравнении показателей до и после лечения II группы.
Note: * — statistical significance of the differences (p ≤ 0.05); р1 — significance of differences when comparing indicators before and after treatment of the I group; р2 — significance of differences when comparing indicators before and after treatment of the II group
Проведённая в динамике оценка показателей КЖ (опросник SF-36) выявила у больных I группы значимое улучшение параметров физического компонента здоровья в большей мере за счёт показателей, отражающих влияние физического состояния и интенсивности боли на повседневную деятельность пациентов, о чём свидетельствует увеличение PF и ВР на 35,7% и 22,6% от исходных показателей. Жизненная активность, социальное и ролевое функционирование, обусловленные эмоциональным состоянием, также возросли на 44%, 23% и 49,6% соответственно, что обусловлено уменьшением выраженности депрессивных и психовегетативных расстройств на фоне лечения препаратом мелатонина. Эти результаты подтверждаются достоверным улучшением интегративных показателей физического и психологического компонентов здоровья пациентов I группы. Во II группе наблюдения достоверная положительная динамика установлена в отношении показателей интенсивности боли и суммарного показателя физического здоровья. Сравнение показателей в группах после проведённого лечения выявило достоверно более высокую жизненную активность и интегративный показатель психологического компонента здоровья у пациентов, пролеченных с применением мелатонина. Данные представлены в табл. 3.
Таблица / Table 3
Динамика показателей качества жизни в группах
Dynamics of indicators of quality of life in groups
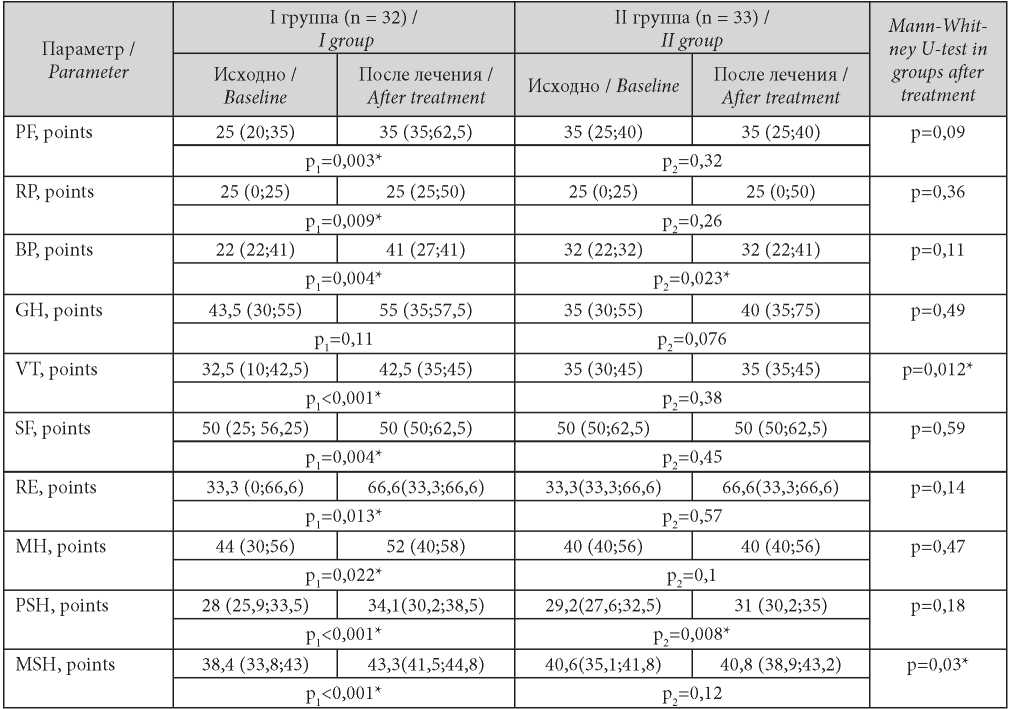
Примечание: * — знаком отмечены показатели, при сравнении которых получены статистически значимые результаты (р ≤ 0,05); р1 — уровень статистической значимости различий при сравнении показателей до и после лечения I группы; р2 — уровень статистической значимости различий при сравнении показателей до и после лечения II группы.
Note: * — statistical significance of the differences (p ≤ 0.05); р1 — significance of differences when comparing indicators before and after treatment of the I group; р2 — significance of differences when comparing indicators before and after treatment o the II f group.
Обсуждение
На сегодняшний день доказано, что иммуновоспалительные заболевания и РТДС имеют сходные патогенетические механизмы, в основе которых лежит реакция на стресс, связанная с активацией ГГНС, следствием чего является повышение уровня катехоламинов, кортизола, а также формирование серотонинергической и норадренергической недостаточности [18]. Таким образом, стрессовое воздействие нарушает гомеостаз нейроэндокринной и иммунной систем, тем самым усиливая интенсивность болевых ощущений, активируя негативный компонент восприятия действительности и формируя дезадаптивное поведение пациентов. Кроме того, постоянное присутствие боли и недостаточная адаптация к заболеванию, характерные для больных АС с РТДС, дополнительно повышают уровень болевых ощущений, замыкая «порочный круг».
Основной целью терапии данной категории пациентов является достижение клинико-лабораторной ремиссии путём одновременного уменьшения воспалительной активности, выраженности болевого синдрома и улучшения физических и психологических параметров КЖ, позволяющих достигнуть психоэмоциональной стабильности.
Широкий спектр вышеперечисленных клинических эффектов мелатонина, отсутствие серьёзных побочных эффектов при его краткосрочном (до 3 месяцев постоянного приёма) применении позволили нам использовать его в схеме, комбинированной с НПВП терапии у больных АС с РТДС, проявляющимися клиническими признаками тревожной депрессии.
Полученные данные позволяют говорить о том, что назначаемая комбинированная терапия способствует не только улучшению психоэмоционального статуса пациентов, но и путём стабилизации показателей КЖ ведёт к ускорению регресса проявлений хронического болевого синдрома, интенсивности воспаления больных АС с РТДС.
Выводы
Включение в комплексную терапию АС у больных с РТДС мелатонина способствует не только улучшению показателей эмоциональной сферы (снижение частоты и выраженности нарушений сна, тревожно-депрессивных расстройств), но и уменьшению выраженности болевых ощущений, снижению лабораторной активности и, как следствие, улучшению КЖ пациентов с данной патологией.
Список литературы
1. Margaretten M., Julian L., Katz P., Yelin E. Depression in patients with rheumatoid arthritis: description, causes and mechanisms // Int. J. Clin. Rheumtol. – 2011. – V.6(6). - Р. 617-623. DOI: 10.2217/IJR. 11. 6
2. Лисицына Т.А., Вельтищев Д.Ю., Насонов Е.Л. Стрессовые факторы и депрессивные расстройства при ревматических заболеваниях // Научно-практическая ревматология. – 2013. – Т. 51, № 2. – С. 98-103. DOI: 10.14412/1995-4484-2013-634
3. Барулин А.Е., Курушина О.В., Калинченко Б.М., Черноволенко Е.П. Хроническая боль и депрессия // Лекарственный вестник. – 2016. – Т. 10, № 1. – С. 3-10. eLIBRARY ID:27316712
4. Miller A.H., Raison Ch.L. The role of inflammation in depression: from evolutionary imperative to modern treatment target // Nature reviews. Immunology. – 2016. - V.16. - Р. 22-34. DOI: 10.1038/nri.2015.5
5. Howren M.B., Lamkin D.M., Suls J. Associations of depression with C-reactive protein, IL-1, and IL-6: a meta-analysis // Psychosom Med. – 2009. – V.71. – Р. 171-86. DOI: 10.1097/PSY.0b013e3181907c1b
6. Schmidt F.M., Lichtblau N., Minkwitz J.,Chittka T., Thormann J., et al. Cytokine levels in depressed and non-depressed subjects, and masking effects of obesity // J. Psychiatr. Res. – 2014. - V.55. – Р. 29-34. DOI: 10.1016/j.jpsychires. 2014.04.021
7. Лисицына Т.А., Вельтищев Д.Ю., Краснов В.Н., Насонов Е.Л. Клинико-патогенетические взаимосвязи иммуновоспалительных ревматических заболеваний и психических расстройств // Клиническая медицина. – 2014. – Т. 92, №1. – С. 12-20. eLIBRARY ID: 21179822
8. Abbott R., Whear R., Nikolaou V., Bethel A., Coon T., et al. Tumour necrosis factor-α inhibitor therapy in chronic physical illness: A systematic review and metaanalysis of the effect on depression and anxiety // J. Psychosom Res. – 2015. V.79 (3). – Р. 175-184. DOI: 10.1016/j.jpsychores.2015.04.008
9. Rohleder N. Acute and chronic stress induced changes in sensitivity of peripheral inflammatory pathways to the signals of multiple stress systems // Psychoneuroendocrinology. – 2012. - V.37 (3). - P. 307-316. DOI: 10.1016/j.psyneuen.2011.12.015
10. Филимонова О.Г., Симонова О.В. Особенности качества жизни и вегетативного статуса у больных псориатическим артритом при тревожно-депрессивных расстройствах // Фарматека. – 2016. - №7. – С. 59–62. eLIBRARY ID: 26010197
11. Афанасьева Т.Ю., Гимадеева А.М., Афанасьева М.А., Сухорукова Е.В., Абдулганиева Д.И., Лапшина С.А. Оценка психологического состояния пациентов с анкилозирующим спондилитом и его влияния на качество лечения // Вопросы организации и информатизации здравоохранения. – 2016. – №S. – С. 36-38. eLIBRARY ID: 29855318
12. Peláez-Ballestas I., Boonen A., Vázquez-Mellado J., ReyesLagunes I., Hernández-Garduño A., et al. Coping Strategies for Health and Daily-Life Stressors in Patients With Rheumatoid Arthritis, Ankylosing Spondylitis, and Gout // Medicine (Baltimore). – 2015. - V.94(10). – P. e600. DOI: 10.1097/MD.0000000000000600
13. Mayo J.C., Sainz R.M., Tan D.X., Hardeland R., Leon J., et al. Anti-Inflammatory Actions of Melatonin and Its Metabolites, N1-Acetyl-N2-formyl-5-methoxykynuramine (AFMK) and N1-Acetyl-5-methoxykynuramine (AMK), in Macrophages // Journal of Neuroimmunology. – 2005. – V.165(1-2). – Р. 139-149. DOI: 10.1016/j.jneuroim.2005.05.002
14. Den Boer J.A., Bosker F.J., Meesters Y. Clinical efficacy of agomelatine in depression: the evidence // Int Clin Psychopharmacol. - 2006. - V.21(1). – Р. 21-24. DOI: 10.1097/01.yic.0000195661.37267.86
15. Loo H., Dalery J., Macher J.P., Payen A. Etude pilote comparant en aveugle l’effet thérapeutique de deux doses d’agomélatine - agoniste des récepteurs de la mélatonine et antagoniste des récepteurs 5HT2c - chez 30 patients [Pilot study comparing in blind the therapeutic effect of two doses of agomelatine, melatoninergic agonist and selective 5HT2C receptors antagonist, in the treatment of major depressive disorders]. // Encephale. – 2002. – V.28(4). – Р. 356–362. (In French). PMID: 12232545.
16. Rudra D.S., Pal U., Maiti N.C., Reiter R.J., Swarnakar S. Melatonin inhibits matrix metalloproteinase-9 activity by binding to its active site // Journal of Pineal Research. - 2013. - V.54(4). – Р. 398-405. DOI: 10.1111/jpi.12034
17. Law L., Rehnman J.B., Deminger A., Klingberg E., Jacobsson E.T.H., Forsblad-d’Eliva H. Factors related to health-related quality of life in ankylosing spondylitis, overall and stratified by sex // Arth. Res. Ther. - 2018. – V.20(1). – P. 284. DOI: 10.1186/s13075-018-1784-8
18. Муслимова Е.В. Стратегии преодоления хронической боли при ревматоидном артрите // Практическая медицина. - 2014.- № 4(80). - С.72-74. eLIBRARY ID: 21845038
Об авторе
И. И. БлагининаУкраина
Благинина Ирина Ивановна, к.м.н., доцент, доцент кафедры внутренней медицины Факультета Последипломного Образования
Луганск, ЛНР
Рецензия
Для цитирования:
Благинина И.И. Применение комплексной терапии в лечении больных анкилозирующим спондилитом с расстройствами тревожно-депрессивного спектра. Медицинский вестник Юга России. 2021;12(1):38-45. https://doi.org/10.21886/2219-8075-2021-12-1-38-45
For citation:
Blaginina I.I. Complex therapy for patients with ankylosing spondylitis with mixed anxiety–depressive disorder. Medical Herald of the South of Russia. 2021;12(1):38-45. https://doi.org/10.21886/2219-8075-2021-12-1-38-45







































