Перейти к:
Новые молекулярные мишени действия антидепрессантов
https://doi.org/10.21886/2219-8075-2021-12-1-24-32
Аннотация
Эффективность лечения депрессивных расстройств недостаточна. Это обусловлено неполным пониманием как патогенеза депрессии, так и механизмов действия антидепрессантов. Повышение эффективности лечения депрессивных расстройств тесно связано с получением более полных представлений о патогенезе заболевания и механизмах действия антидепрессантов. Первая линия действия применяемых сейчас антидепрессантов — накопление моноаминов и длительная активация мембранных рецепторов. Однако снижению плотности мембранных рецепторов, обусловленному включением гомеостатических механизмов вследствие длительной активации рецепторов, противодействует вторая линия активности антидепрессантов. Она связана с экспрессией под действием антидепрессантов индуцибельного регуляторного белка S100А10 (р11) и его партнёров. В обзоре рассмотрены структура и функции белка р11, его взаимодействие с белками аннексином А2, Ahnak, регулятором хроматина SMARCA3. Проанализировано влияние р11 на мембранную плотность серотониновых 5-НТ1В и 5-НТ4 рецепторов, метаботропных глутаматных рецепторов 5, потенциалозависимых калиевых Кv3 и кальциевых Саv1.2 и 1.3 каналов, которые играют существенную роль как в действии антидепрессантов, так и в патогенезе депрессивных расстройств. Системный поиск литературы проводился по базам данных Scopus, WebofScience, MedLine, elibrary и другим.
Для цитирования:
Кузнецов Ю.В., Евдокимов Д.В., Абрамец И.И. Новые молекулярные мишени действия антидепрессантов. Медицинский вестник Юга России. 2021;12(1):24-32. https://doi.org/10.21886/2219-8075-2021-12-1-24-32
For citation:
Kuznetsov Yu.V., Evdokimov D.V., Abramets I.I. The new molecular targets for antidepressants. Medical Herald of the South of Russia. 2021;12(1):24-32. https://doi.org/10.21886/2219-8075-2021-12-1-24-32
Введение
Риск развития большого депрессивного расстройства на протяжении жизни составляет 20–25% у женщин и 7–12% — у мужчин. Несмотря на семидесятилетние интенсивные исследования, понимание патофизиологии заболевания далеко не полное. Лечение депрессивных расстройств — сложная проблема, поскольку терапевтический эффект развивается с большим латентным промежутком, наблюдается не у всех больных и сопровождается многочисленными побочными эффектами [1]. Отсюда очевидна необходимость повышения эффективности лечения депрессивных расстройств, а это тесно связано с получением более полных представлений как о патогенезе заболевания, так и о механизмах действия антидепрессантов.
Используемые в настоящее время антидепрессанты разных функциональных классов — селективные и неселективные ингибиторы обратного захвата моноаминов серотонина, норадреналина и дофамина, а также ингибиторы ферментов моноаминоксидаз — усиливают сигнальный путь вторичного посредника цАМФ, повышая уровни регуляторного белка Gas в мембранах нейронов, а также активируя рецепторы моноаминов, сопряжённые с аденилатциклазой, что приводит к активации протеинкиназы А (ПКА) в цитоплазме и ядре нейронов. ПКА наряду с кальций / кальмодулин-зависимой протеинкиназой IV (СаМКIV) и митоген-активируемыми протеинкиназами (МАПК) фосфорилируют и повышают активность фактора транскрипции СRЕВ, который обеспечивает образование белков. Усиление активности ПКА, МАПК ERK1/2 и фактора транскрипции СRЕВ на фоне хронического введения антидепрессантов приводит к повышению уровней мРНК и белков нейротрофинов и факторов роста. Последние обеспечивают нормальную жизнедеятельность нейронов, синаптогенез и нейрогенез в зубчатой извилине, а также гомеостатические процессы в нейронных сетях [2][3].
Следовательно, первая линия действия антидепрессантов — это рецепторы, позитивно сопряжённые с аденилатциклазой моноаминергические рецепторы, НМДА глутаматные рецепторы, метаботропные глутаматные рецепторы, М-холинорецепторы и др. Поскольку моноаминергические антидепрессанты при хроническом введении на длительное время повышают внеклеточную концентрацию моноаминов в мозге, естественная реакция мембранных рецепторов на это нарушение гомеостаза — снижение их плотности. Однако при хроническом введении моноаминергических антидепрессантов возникают интересные коллизии: мембранная плотность одних и тех же рецепторов в различных структурах мозга изменяется по-разному. Так, плотность и активность серотониновых 5-НТ1А рецепторов в сомато-дендритных синапсах нейронов ядер шва понижается, а в гиппокампе и коре — повышается; там же повышается уровень серотониновых 5-НТ1В и 5-НТ4 рецепторов. Мембранная плотность альфа2-адренорецепторов в сомато-дендритных синапсах голубого пятна снижается, а в нейронах переднемозговых структур, напротив, повышается, хотя там же выявлено снижение плотности бета-адренорецепторов [4].
Терапевтическое действие наиболее употребляемых сейчас антидепрессантов, селективных ингибиторов обратного захвата серотонина (СИОЗС), связано с активацией серотониновых 5-НТ1В и 5-НТ4 рецепторов. Тем не менее, почему мембранная плотность этих рецепторов на фоне вызываемого антидепрессантами СИОЗС стойкого повышения уровня серотонина во внеклеточной жидкости не снижается, а даже возрастает — остаётся не ясным. В последнее десятилетие установлено, что это является следствием взаимодействия серотониновых рецепторов с индуцибельным регуляторным белком р11, также известным как S100А10, индуцируемый фактором роста нервов белок 42С, легкая цепь кальпактина I, легкая цепь аннексина [5].
Белок р11, его функции и партнеры
Этот белок является членом семейства малых (11-12 кДа) кислых белков S100. В структуре р11 (рис. 1) имеется две EF-руки, которые связывают Са2+. Между второй и третьей спиралями имеется петля (шарнир), обеспечивающая сгибание молекулы. Белок образует гомодимеры, которые, в свою очередь, могут образовывать гетеротетрамеры с белком цитоскелета аннексином А2. Установлено, что р11 помимо мембранных рецепторов также может взаимодействовать с ионными каналами Nav1.8, Kv, Н+-активируемыми, и TRVP5 катионными каналами и с ферментами — тканевым активатором плазминогена, фосфолипазой А2 и др. [5][6].
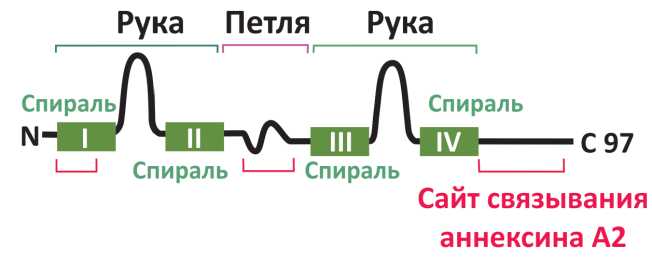
Рисунок 1. Схематическое строение белка р11. Римскими цифрами отмечены спирализованные участки молекулы.
Слева на амино-терминальном участке находится сайт связывания с другой молекулой р11 при образовании гомодимера. Справа карбокси-терминальный участок молекулы содержит сайт связывания аннексина А2 при образовании гетеротетрамера.
Figure 1. Schematic structure of a protein p11. The spiralized regions of the molecule are marked with Roman numerals.
On the left, at the amino-terminal region, there is a site for binding with another p11 molecule during the formation of a homodimer. On the right, the carboxy-terminal region of the molecule contains a binding site for annexin A2 during the formation of a heterotetramer.
Тем не менее, роль регуляторного белка р11 и его мишеней в развитии депрессивного фенотипа поведения и действии антидепрессантов остаётся неясной из-за множества противоречивых фактов. С одной стороны, установлено, что введение антидепрессантов, антипаркинсонического средства леводопы и серотонина (5-НТ) повышают уровни мРНК и белка р11 в коре и гиппокампе мышей и эти эффекты опосредованы сигнальными путями нейротрофинов, рецепторной тирозинкиназой TrkB и протеинкиназой ERK. С другой стороны, обладающие продепрессивным действием глюкокортикоиды, интерлейкины, фактор некроза опухолей, интерфероны также повышают уровень р11 в коре и гиппокампе грызунов [7]. Кроме того, установлено, что нестероидные противовоспалительные средства препятствуют вызываемым антидепрессантами СИОЗС повышению уровня р11 и их поведенческим эффектам, но усиливают эти же эффекты, вызываемые другими антидепрессантами [8]. Предполагают, что наблюдаемое под влиянием депрессогенных воздействий повышение уровня р11 вероятно является гомеостатической реакцией мозга, противодействующей развитию депрессивных расстройств.
Тотальный генный нокаут р11, вызывающий потерю этого белка в мозге и теле, сопровождается развитием депрессивного фенотипа поведения, судя по изменениям показателей целой батареи поведенческих тестов, и ослаблением влияния антидепрессантов на эти показатели [9][10]. Установлено, что прилежащее ядро (ПЯ) является ключевой структурой, с которой связано развитие депрессивного поведения у грызунов с дефицитом белка р11. Действительно, угнетение образования р11 только в ПЯ с помощью введения вирусной мРНКi воспроизводит все признаки депрессивного поведения, как и при тотальном генном нокауте р11. У интактных мышей уровень р11 в холинергических интернейронах ПЯ в 30 раз больше по сравнению ГАМКергическими среднешипиковыми нейронами и удаление р11 из холинергических интернейронов порождает депрессивный фенотип поведения. Напротив, избыточное образование р11 с помощью вирусов в этих интернейронах, но не в нейронах дорсального стриатума устраняет нарушения поведения у мышей с тотальным генным нокаутом р11. Интересно, что дефицит р11 в холинергических интернейронах ПЯ не ослабляет влияние антидепрессантов СИОЗС на время иммобилизации мышей в тесте подвешивания за хвост [11][12]. Следовательно, р11 ПЯ необходим для регуляции эмоций и настроения, но не для действия антидепрессантов.
В то же время биосинтез белка р11 в кортикальных нейронах необходим для развития поведенческих эффектов антидепрессантов у грызунов. Так, хроническое введение антидепрессантов повышает уровень р11 в коре и гиппокампе и усиливает экспрессию серотониновых 5-НТ4 рецепторов в содержащих р11 кортикальных нейронах мышей. Удаление р11 из проекционных нейронов 5а слоя коры ослабляет поведенческие эффекты антидепрессантов СИОЗС и предотвращает повышение плотности серотониновых 5-НТ4 рецепторов в мембранах нейронов, но не влияет на проявления депрессивного фенотипа поведения [9][13].
Влияние р11 на мембранные серотониновые и глутаматные рецепторы
Будучи регуляторным белком, р11 либо сам, либо в комплексе с другими белками может взаимодействовать с другими белками-мишенями и изменять их активность. У мышей в коре, гиппокампе и ПЯ р11 локализован в непосредственной близости к серотониновым 5-НТ1В/5-НТ4 рецепторам в мембранах нейронов. Белок р11 взаимодействует с третьей внутриклеточной петлей серотониновых рецепторов и повышает их плотность в мембранах нейронов. В результате усиливаются опосредуемые цАМФ сигнальные пути этих рецепторов. Однако генный нокаут р11 сопровождается угнетением активности 5-НТ1В/4 серотониновых рецепторов вследствие снижения их плотности в мембранах нейронов [14][15]. Следовательно, р11 регулирует мембранную плотность, а не транскрипцию и трансляцию серотониновых рецепторов. В культивируемых кортикальных нейронах р11 усиливает влияние серотониновых рецепторов на трансмембранный ток Са2+ и активность протеинкиназ ERK1/2. Влияние серотонина и агонистов 5-НТ1В рецепторов на фосфорилирование пресинаптического белка синапсина I и кортикостриатную глутаматергическую синаптическую передачу также зависит от р11 [14].
Антидепрессанто-подобные эффекты агонистов серотониновых 1В и 4 рецепторов в тестах вынужденного плавания и подвешивания за хвост ослаблены у мышей с нокаутом р11 по сравнению с интактными животными. Анксиолитическое действие этих же агонистов в тесте открытого поля также уменьшалось у мышей с дефицитом р11 [14]. Агонисты 5-НТ1В рецепторов по-разному влияют на эмоциональное обучение в тесте пассивного избегания, нарушая его у интактных и усиливая его у мышей с нокаутом р11. Избыточная экспрессия р11 с помощью вирусов в зубчатой извилине и области СА1 гиппокампа восстанавливала нарушенное эмоциональное обучение у мышей с нокаутом р11 [16].
В исследованиях на пирамидных кортикостриатных нейронах 5а слоев моторной и сенсорной коры крыс установлено, что только часть этих нейронов экспрессирует белок р11. Эти нейроны обладают большей электрической возбудимостью по сравнению с р11- негативными пирамидными нейронами, и в этих нейронах антидепрессанты СИОЗС при хроническом введении повышают плотность серотониновых 5-НТ2А, а не 5-НТ4 рецепторов. Стрессогенное воздействие (хроническая социальная изоляция) вызывала снижение плотности серотониновых 5-НТ2А рецепторов в р11- позитивных пирамидных нейронах, а хроническое введение флуоксетина обращало эти изменения [17].
Регуляторный белок р11 помимо разных типов серотониновых рецепторов также взаимодействует с G белок-зависимыми метаботропными глутаматными (мГлу) рецепторами. Эти рецепторы делятся на три группы: I группа — мГлу 1 и 5 рецепторы; II группа — мГлу 2 и 3 рецепторы; III группа — мГлу4, 6, 7 и 8 рецепторы [18]. В поведенческих исследованиях установлено, что блокаторы мГлу 5 и 2/3 рецепторов обладают быстро развивающимся антидепрессивным действием у мышей. Кроме того, выявлено, что цитоплазматический хвост мГлу 5 рецепторов имеет участок связывания белка р11, состоящий из последовательности аминокислот сер-тре-вал. С помощью метода иммунопреципитации показано, что с мГлу 5 рецепторами связывается гетеротетрамер р11 / аннексин А2 (Анка2). В исследованиях на культивируемых клетках линии НЕК293 со встроенными мГлу 5 рецепторами установлено, что воздействие агониста этих рецепторов вызывает осцилляции внутриклеточной концентрации Са2+, которые возрастают при избыточном образовании р11 и, напротив, снижаются при повреждении Анка2. Следовательно, гетеротетрамеры р11 / Анка2 усиливают функции мГлу 5 рецепторов. Последующие исследования на этих же клетках и клетках линии COS-7 показали, что р11 и мГлу 5 рецепторы взаимно усиливают их накопление в цитоплазматических мембранах, а р11 повышает мембранную плотность мГлу 5 рецепторов.
Белок р11 и мГлу 5 рецепторы совместно выявляются в глутаматергических и ГАМКергических нейронах. Генный нокаут мГлу 5 рецепторов в глутаматергических нейронах вызывал увеличение времени иммобилизации в тестах вынужденного плавания и подвешивания за хвост и уменьшал показатель предпочтения потребления сладкого раствора, то есть развивался депрессивный фенотип поведения. Эта же процедура в ГАМКергических нейронах изменяла показатели поведения в противоположном направлении, вызывая антидепрессанто-подобное действие. Аналогичные результаты получены в условиях генного нокаута р11 в ГАМКергических нейронах. Генный нокаут р11 в глутаматергических нейронах не вызывал депрессивного поведения, но повышал чувствительность мышей к действию хронического умеренного стресса. В другом поведенческом тесте угнетения новизной употребления пищи, который характеризует депрессивное и тревожное поведение, установлено, что блокатор мГлу 5 рецепторов МРЕР обнаруживал антидепрессанто-подобное действие, которое не проявлялось у мышей с генным нокаутом р11. Блокатор же мГлу 2/3 рецепторов также обнаруживал антидепрессанто-подобное действие, однако оно не изменялось при удалении р11. Следовательно, антидепрессанто-подобный эффект МРЕР у интактных мышей устраняется генным нокаутом р11 и воспроизводится генетической делецией мГлу 5 рецепторов в ПВ+ ГАМКергических интернейронах [19]. Известно, что влияние возбуждающих синаптических входов в ПВ+ интернейроны обусловлено активацией ионотропных АМРА и НМДА глутаматных рецепторов, а мГлу 5 рецепторы повышают функциональную активность НМДА рецепторов [20][21]. Поэтому можно думать, что фармакологическое или генетическое угнетение активности мГлу 5 рецепторов ингибирует активность ПВ+ ГАМКергических тормозных интернейронов и вызывает дезингибицию глутаматергических пирамидных нейронов коры и гиппокампа. На поведенческом уровне это реализуется в виде антидепрессанто-подобного действия.
Влияние р11 на потенциало-зависимые калиевые и кальциевые каналы
Помимо серотониновых и глутаматных рецепторов белок р11 регулирует мембранную плотность и активность калиевых каналов, которые определяет возбудимость нейронов, продолжительность и частоту генерации спайков нейроном. У мышей с генным нокаутом р11 в гиппокампе выявлено, угнетение трансмембранных токов калиевых Kv3.1 каналов, с высокой плотностью находящихся в мембранах, содержащих парвальбумин (ПВ+) интернейронов, которое сопровождалось уменьшением частоты разрядов нейронов в ответ на деполяризацию мембраны ступенькой входящего тока 100 пА. В этих же условиях токи катионных HCN каналов не изменялись. Ослабление трансмембранных токов Kv3.1 каналов в ПВ+ корзинчатых интернейронах зубчатой извилины обусловлено уменьшением количества каналов вследствие усиления их деградации. Помимо этого, у мышей с генным нокаутом р11 в зернистых клетках зубчатой извилины наблюдали двукратное увеличение амплитуд ГАМКергических ТПСТ, вызываемых оптогенетической стимуляцией ПВ+ интернейронов. Это обусловлено потерей Kv3.1 каналов в аксонных терминалях ПВ+ интернейронов, которые ограничивают длительность потенциалов действия и пресинаптическое высвобождение ГАМК. Генный нокаут р11 в ПВ+ интернейронах также вызывал усиление тревожного поведения в новой обстановке и снижение устойчивости мышей к депрессогенному действию защитного социального стресса, хотя в этих условиях у мышей не изменялись время иммобилизации при подвещивании за хвост и показатель предпочтения потребления сладкого раствора [22].
ПВ+ интернейроны играют важную роль в когнитивных и эмоциональных процессах, обучении и памяти. Нарушение их активности может приводить к развитию эмоциональных нарушений, эпилепсии, либо шизофрении. В этих нейронах Kv3 калиевые каналы обеспечивают ускорение реполяризации спайков и укорочение межспайкового интервала, а в пресинаптических терминалях этих нейронов Kv3 каналы регулируют высвобождение ГАМК, изменяя продолжительность спайков [23][24][25]. Интересно, что при шизофрении в мембранах нейронов префронтальной и париетальной коры понижена плотность Kv3.1 каналов и антипсихотики повышают плотность каналов до уровня здоровых людей [26]. С другой стороны, у мышей с генным нокаутом р11 снижение плотности Kv3.1 каналов выявлено только в гиппокампе, но не в других структурах мозга, то есть регуляция плотности Кv3.1 каналов в разных структурах мозга регулируется различными механизмами. Если хроническое введение антипсихотиков вызывает повышение плотности Kv3.1 каналов в кортикальных структурах, то хроническое введение антидепрессантов понижает плотность этих каналов в гиппокампе. Ингибиторный эффект хронически вводимых антидепрессантов на Kv3.1 каналы в ПВ+ интернейронах зубчатой извилины связан с активацией серотониновых 5-НТ5А рецепторов и вызываемым ПКА фосфорилированием 503 остатка серина в структуре альфа-субъединицы Kv3.1b [27]. Таким образом, создается впечатление, что активность Кv3.1 каналов в ПВ+ интернейронах модулируется в процессе хронического введения антидепрессантов с максимумом в начале лечения и последующим угнетением. Действительно, в начале воздействия антидепрессантов спайковая активность ПВ+ интернейронов возрастает и это обусловлено активацией серотониновых 5-НТ1В рецепторов, снижением уровня цАМФ и активности протеинкиназы А, приводящем к уменьшению фосфорилирования альфа-субъединицы Kv3.1 и усилению функций Кv3.1 каналов, но в дальнейшем активность этих нейронов снижается в связи с даун-регуляцией Кv3.1 каналов, вызванной повышением активности серотониновых 5-НТ5А рецепторов [27].
Другая, помимо серотониновых рецепторов и калиевых каналов, молекулярная мишень белка р11, имеющая отношение к депрессии и действию антидепрессантов, — п/з Са2+ каналы. Действительно, п/з Са2+ каналы L-типа (Саv1.2 и 1.3) обеспечивают поступление Са2+ в цитоплазму нейронов, активацию киназ СаМКIV и МАРК и усиление процессов транскрипции. Эти каналы необходимы для созревания нейронов, синаптической пластичности и гомеостаза нейронных сетей [28][29]. В генетических исследованиях установлено, что полиморфизм гена Саv1.2 (САСNА1С) связан с угрозой развития большого депрессивного и биполярного расстройств, а также шизофрении [29].
Взаимодействие с серотониновыми рецепторами и калиевыми каналами белок р11 осуществляет в виде гетеротетрамера с белком цитоскелета Анка2. В свою очередь, гетеротетрамер р11/Анка2 может образовывать комплекс с ремоделирующим хроматин фактором SMARCA3. Генный нокаут последнего не вызывает развития депрессивного фенотипа поведения у мышей, но ослабляет поведенческие эффекты антидепрессантов СИОЗС и их влияние на нейрогенез [30]. Позже было установлено, что гетеротетрамер р11/Анка2 способен образовывать комплекс сбольшим белком Ahnak с молекулярной массой 680 кДа. Этот белок участвует в образовании щелевых контактов между эпителиальными клетками в стенках желудочков мозга [30]. Установлено также, что Ahnak может связываться с бета-субъединицей п/з Са2+ каналов в миокардиоцитах и участвует в регуляции плотности каналов Саv1.2 в мембранах миокардиоцитов, остеобластов и Т-лимфоцитов [31][32].
В биохимических исследованиях на материалах из нейронов зубчатой извилины и 2/3 слоев префронтальной коры мышей установлено, что белок Ahnak стабилизирует комплекс р11/Анка2; кроме того, N-терминальная область Ahnak взаимодействует с порообразующей альфа-субъединицей Са каналов L-типа, а С-терминальная область — с модуляторной бета-субъединицей этого канала и комплексом р11/Анка2. На культивируемых кортикальных нейронах, полученных от эмбрионов, установлено, что генный нокаут Ahnak снижает тотальную амплитуду токов Са2+, за счёт уменьшения связанного с активацией кальциевых каналов L-типа компонента трансмембранного тока. В исследованиях на срезах префронтальной коры и гиппокампа мышей установлено, что в пирамидных нейронах 2/3 слоев коры и в ПВ+ интернейронах зубчатой извилины мышей с генным нокаутом Ahnak снижены амплитуды кальциевых токов, вызываемых активацией Саv1.2 каналов. Существенно, что при этом общее количество белков альфа-субъединиц и дополнительных бета-субъединиц Саv1.2 и Саv1.3 каналов не изменялось, несмотря на 50% уменьшение трансмембранных токов. Следовательно, тройной белковый комплекс р11/Анка2/Ahnak регулирует фиксацию в мембранах нейронов кальциевых каналов L-типа, но не их транскрипцию и трансляцию [33].
На поведенческом уровне у мышей с генным нокаутом Ahnak наблюдали депрессивно-подобный фенотип поведения, который проявлялся снижением показателя предпочтения потребления раствора сахарозы по сравнению с водой (признак ангедонии) и увеличением времени иммобилизации мышей в тестах вынужденного плавания и подвешивания за хвост. В то же время локальный генный нокаут Ahnak в глутаматергических нейронах переднего мозга вызывал депрессивно-подобное поведение у мышей, судя по изменениям показателей используемых поведенческих тестов. Локальный генный нокаут Ahnak в ПВ+ интернейронах вызывал антидепрессанто-подобное действие, тестах предпочтения потребления сладкого раствора и вынужденного плавания [33].
Известно, что каналы Са2+ L-типа регулируют возбудимость нейронов и генерацию спайков нейронами. Это достигается несколькими путями: подобно каналам Са2+ Т-типа (Cav3) активация каналов L-типа вызывает длительную деполяризацию мембран нейронов, приводящую к генерации спайков; повышение внутриклеточной концентрации Са2+ активирует калиевые каналы ВК, а деполяризация возбуждает п/з каналы Кv3.1, причём оба типа калиевых каналов способствуют укорочению продолжительности спайка и увеличению частоты их генерации. Поэтому генный нокаут Ahnak вызывает снижение плотности кальциевых каналов L-типа в мембранах глутаматергических нейронов лимбических структур и угнетает их активность, что приводит к развитию депрессивного фенотипа поведения. С другой стороны, локальный нокаут Ahnak в ПВ+ интернейронах также угнетает их активность, но при этом дезингибируются пирамидные нейроны коры и гиппокампа, как это наблюдается при использовании быстродействующих антидепрессантов — кетамина и блокаторов mGlu5 рецепторов [34][35].
Заключение
Подводя итоги, можно утверждать, что вторая линия действия антидепрессантов, представлена индуцибельными регуляторными белками S100A10 (р11), аннексином А2 и др., которые могут взаимодействовать с мембранными рецепторами и ионными каналами. Их внутриклеточный карбокси-терминальный конец или одна из внутриклеточных петель содержат определенную последовательность аминокислот, которая определяет сродство к регуляторным белкам. Кроме того, регуляторные белки также могут взаимодействовать с элементами цитоскелета. Комплексы этих белков регулируют транспорт белковых молекул и их фиксацию в мембранах. Поскольку при хроническом введении антидепрессантов повышается уровень белка р11 в нейронах, это приводит к повышению плотности серотониновых 5-НТ1 и 5-НТ4 рецепторов, несмотря на гомеостатический механизм, который оказывает противоположное влияние. С другой стороны, в серотонин- и норадренегических нейронах заднего мозга наблюдается низкий уровень р11 или его отсутствие, поэтому преобладает гомеостатическая реакция на введение антидепрессантов. То есть комплексы белков р11, аннексина А2 и др. стабилизируют и усиливают действие как моноаминергических, так и некоторых быстро действующих (блокаторы мГлу 5 рецепторов) антидепрессантов. Наконец, тотальный или локальный дефицит р11 в мозге приводит к развитию депрессивных расстройств, наиболее вероятно, из-за нарушений фиксации и изменений плотности в мембранах нейронов рецепторов и ионных каналов.
1. Archived: WHO Timeline - COVID-19 https://www.who.int/news/item/27-04-2020-who-timeline-covid-19
2. Johns Hopkins Coronavirus Resource Center https://coronavirus.jhu.edu/map.html
Список литературы
1. Belmaker RH, Agam GN. Major depressive disorder. // New Engl J Med. – 2008. – V.358 (1). – P. 55–68. doi: 10.1056/NEJMra073096
2. Pittenger C, Duman RC. Stress, depression, and neuroplasticity: a convergence of mechanisms. // Neuropsychopharmacology. – 2008. – V.33 (1). – P. 88-109. doi: 10.1038/sj.npp.1301574
3. Tiraboschi E, Tardito D, Kasahara J, Moraschi S, Pruneri P, et al. Selective phosphorylation of nuclear CREB by fluoxetine is linked to activation of CaMK IV and MAP kinase cascades. // Neuropsychopharmacology. – 2004. – V. 29(10). – P.1831–1840. doi: 10.1038/sj.npp.1300488
4. Reuter LE, de Montigni C, Blier P. Electrophysiological characterization of the effect of long-term duloxetine administration on the rat serotonergic and noradrenergic systems. // JPharmacolExpTher. – 1998. – V.285 (2). – P. 404-412. PMID: 9580577
5. Svenningsson P, Greengard P. p11 (S100A10)-an inducible adaptor protein that modulates neuronal functions. // Curr. Opin. Pharmacol. – 2007. – V. 7 (1). – P.27–32. doi: 10.1016/j.coph.2006.10.001
6. Rescher U, Gerke V. S100A10/p11: family, friends and functions. // Pflugers Arch. – 2008. – V. 455(4). – P.575–582. doi: 10.1007/s00424-007-0313-4
7. Svenningsson P, Kim Y, Warner-Schmidt J, Oh Y-S, Greengard P. p11 and its role in depression and therapeutic responses to antidepressants. // Nat Rev Neurosci. – 2013. – V.14(10). – P.673–680. doi:10.1038/nrn3564
8. Warner-Schmidt JL, Vanover KE, Chen EY, Marshall JJ, Greengard P. Antidepressant effects of selective reuptake serotonine inhibitors (SSRIs) are attenuated by antiinflammatory drugs in mice and humans. // ProcNatlAcadSci U S A. – 2011. – V.108(22). – P. 9262-9267. doi: 10.1073/pnas.1104836108
9. Warner-Schmidt JL, Chen EI, Zhang X, Marshal JJ, Morozov A, et al. A role for p11 in the antidepressant action of brain-derived neurotrophic factor. // Biol. Psychiatry. – 2010. – V.68 (6). – P. 528–535. doi: 10.1016/j.biopsych.2010.04.029
10. Egeland M, Warner-Schmidt J, Greengard P, Svenningsson P. Neurogenic effects of fluoxetine are attenuated in p11 (S100A10) knockout mice. // Biol. Psychiatry. – 2010. – P.67 (11). – V. 1048–1056. doi: 10.1016/j.biopsych.2010.01.024
11. Warner-Schmidt JL, Schmidt EF, Marshall JJ, Rubin AJ, Arango-Lievano M, et al. Cholinergic interneurons in the nucleus accumbens regulate depression-like behavior. // Proc. Natl Acad. Sci. USA. – 2012. – V. 109 (28). – P. 11360–11365. doi: 10.1073/pnas.1209293109
12. Alexander B, Warner-Schmidt JL, Eriksson TM, Tamminga C, Arango-Lievano M, et al. Reversal of depressed behaviors in mice by p11 gene therapy in the nucleus accumbens. // Science Transl Med. – 2010. – V.2(54). – p.54ra76. doi: 10.1126/scitranslmed.3001079
13. Schmidt EF, Warner-Schmidt JL, Otopalik BG, Pickett SB, Greengard P, Heintz N. Identification of the cortical neurons that mediate antidepressant responses. // Cell. – 2012. – V.149 (5). – P. 1152–1163. doi: 10.1016/j.cell.2012.03.038
14. Svenningsson P, Chergui K, Rachleff I, Flajolet M, Zhang XEl, et al. Alterations in 5-HT1B receptor function by p11 in depression-like states. // Science. – 2006. – P. 311 (5757). – P. 77–80. doi:10.1126/science.1117571
15. Warner-Schmidt JL, Flajolet M, Maller A, Chen EY, Qi H, et al. Role of p11 in cellular and behavioral effects of 5-HT4 receptorstimulation. // J. Neurosci. – 2009. – V. 29 (6). – P. 1937–1946. doi:10.1523/JNEUROSCI.5343-08.2009
16. Eriksson TM, Delagrange P, Spedding M, Popoli M, Mate AA, et al. Bidirectional regulation of emotional memory by 5-HT1B receptors involves hippocampal p11. // Mol. Psychiatry. – 2012. – V.17 (2). – P. 173-184. doi10.1038/mp.2010.131
17. Sargin D, Chottekalapanda RU, Perit KE, Yao V, Chu D, et al. Mapping the physiological and molecular markers of stress and SSRI antidepressant treatment in S100a10 corticostriatal neurons. // Molecular Psychiatry. – 2020. – V. 25 (6). – P. 1112–1129. doi: 10.1038/s41380-019-0473-6
18. Conn PJ, Pin JP. Pharmacology and functions of metabotropic glutamate receptors. // Annu Rev PharmacolToxicol. – 1997. – V.37. – P. 205–237. doi: 10.1146/annurev.pharmtox.37.1.205
19. Lee K-W, Westin L, Kim J, Chang JC, Oh Y-S, et al. Alteration by p11 of mGluR5 localization regulates depression-like behaviors. // Mol Psychiatry. – 2015. – V. 20(12). – P.1546–1556. doi:10.1038/mp.2015.132
20. Awad H, Hubert GW, Smith Y, Levey AI, Conn PJ. Activation of metabotropic glutamate receptor 5 has direct excitatory effects and potentiates NMDA receptor currents in neurons of the subthalamic nucleus. // J Neurosci. – 2000. – V. 20(21). – P.7871–7879. doi: 10.1523/JNEUROSCI.20-21-07871.2000
21. Rosenbrock H, Kramer G, Hobson S, Koros E, Grundl M, et al. Functional interaction of metabotropic glutamate receptor 5 and NMDA-receptor by a metabotropic glutamate receptor 5 positive allosteric modulator. // Eur J Pharmacol. – 2010. – V.639(1–3). – P. 40–46. doi: 10.1016/j.ejphar.2010.02.057
22. Seo SJ, Sveninngsson P. Modulation of ion channels and receptors by p11 (S100A10). // Trends Pharmacol Sci. – 2020. – V. 41 (7). – P. 487-497. doi: 10.1016/j.tips.2020.04.004
23. Rudy B, McBain CJ. Kv3 channels: voltage-gated K1 channels designed for high-frequency repetitive firing. // Trends Neurosci. – 2001. – V. 24. – P. 517–526. doi:10.1016/s0166-2236(00)01892-0
24. Hoppa MB, Gouzer G, Armbruster M, Ryan TA. Control andplasticity of the presynaptic action potential waveform at small CNS nerve terminals. // Neuron. – 2014. – V.84(4). – P.778–789. doi: 10.1016/j.neuron.2014.09.038
25. Hu H, Roth FC, Vandael D, Jonas P. Complementary tuning of Na+ and K+ channel gating underlies fast and energyefficient actionpotentials in GABAergic interneuron axons. // Neuron. – 2018. – V.98 (1). – P. 156–165.E6. doi: 10.1016/j.neuron.2018.02.024
26. Yanagi M, Joho RH, Southcott SA, Shukla AA, Ghose S, Tamminga CA. Kv3.1-containing K(1) channels are reduced in untreated schizophrenia and normalized with antipsychotic drugs. // MolPsychiatry. – 2014. – V.19(5). – P. 573–579. doi: 10.1038/mp.2013.49
27. Sagi Y, Medrihan L, George K, Barney M, McCabe KA, Greengard P. Emergence of 5-HT5A signaling in parvalbumin neurons mediates delayed antidepressant action. // MolPsychiatry. – 2020. – V.25 (6). – P. 1191–1201. doi: 10.1038/mp.2013.49
28. Simms BA, Zamponi GW. Neuronal voltage-gated calcium channels: structure, function, and dysfunction. // Neuron. – 2014. – V. 82 (1). – P. 24–45. doi: 10.1016/j.neuron.2014.03.016
29. Heyes S, Pratt WS, Rees E, Dahimene S, Ferron L, et al. Genetic disruption of voltage-gated calcium channels in psychiatric and neurological disorders. // ProgNeurobiol. – 2015. – V.134 (Nov). – P.36–54. doi: 10.1016/j.pneurobio.2015.09.002
30. Oh YS, Gao P, Lee KW, Ceglia I, Seo JS, et al. SMARCA3, a chromatin-remodeling factor, is required for p11-dependent antidepressant action. // Cell. – 2013. – V.152 (4). – P. 831– 843. doi: 10.1016/j.cell.2013.01.014
31. Alvarez J, Hamplova J, Hohaus A, Morano I, Haase H, Vassort G. Calcium current in rat cardiomyocytes is modulated by the carboxylterminal ahnak domain. // J Biol Chem. – 2004. – V.279 (13). – P. 12456–12461. doi: 10.1074/jbc.M31217720
32. Matza D, Badou A, Kobayashi KS, Goldsmith-Pestana K, Masuda Y, et al. A scaffold protein, AHNAK1, is required for calcium signaling during T cell activation. // Immunity. – 2008. – V. 28 (1). – P. 64–74. doi: 10.1016/j.immuni.2007.11.020
33. Jin J, Bhatti DL, Lee K-W, Medrihan L, Jia Cheng J, et al. Ahnak scaffolds p11/Anxa2 complex and L-type voltagegatedcalcium channel and modulates depressive behavior. // Mol Psychiatry. – 2020. – V. 25 (5). – P.1035–1049. doi:10.1038/s41380-019-0371-y
34. Striessnig J, Pinggera A, Kaur G, Bock G, Tuluc P. L-type Ca(2+) channels in heart and brain. // Wiley Interdiscip Rev MembrTranspSignal. – 2014. – V.3 (2). – P. 15–38. doi: 10.1002/wmts.102
35. Liu Y, Harding M, Pittman A, Dore J, Striessnig J, et al. Cav1.2 and Cav1.3 L-type calcium channels regulate dopaminergic firing activity in the mouse ventral tegmental area. // J Neurophysiol. – 2014. – V.112 (5). – P. 1119–1130. doi:10.1152/jn.00757.2013
Об авторах
Ю. В. КузнецовУкраина
Кузнецов Юрий Васильевич, к.м.н., доц., доцент кафедры фармакологии и клинической фармакологии им. проф. И.В. Комиссарова
Донецк, ДНР
Д. В. Евдокимов
Украина
Евдокимов Дмитрий Владимирович, к.м.н., доц., доцент кафедры фармакологии и клинической фармакологии им. проф. И.В. Комиссарова
Донецк, ДНР
И. И. Абрамец
Украина
Абрамец Игорь Игоревич, д.м.н., проф., профессор кафедры фармакологии и клинической фармакологии им. проф. И.В. Комиссарова
Донецк, ДНР
Рецензия
Для цитирования:
Кузнецов Ю.В., Евдокимов Д.В., Абрамец И.И. Новые молекулярные мишени действия антидепрессантов. Медицинский вестник Юга России. 2021;12(1):24-32. https://doi.org/10.21886/2219-8075-2021-12-1-24-32
For citation:
Kuznetsov Yu.V., Evdokimov D.V., Abramets I.I. The new molecular targets for antidepressants. Medical Herald of the South of Russia. 2021;12(1):24-32. https://doi.org/10.21886/2219-8075-2021-12-1-24-32







































