Перейти к:
Некоторая характеристика пациентов с миелодиспластическим синдромом
https://doi.org/10.21886/2219-8075-2020-11-4-32-42
Аннотация
Цель: эпидемиологический анализ миелодиспластического синдрома.
Материалы и методы: проведён ретроспективный анализ данных историй болезней 115 пациентов (61 мужчина и 54 женщины) с диагнозом миелодиспластический синдром, которые получали лечение в гематологическом отделении МБУЗ «Городская больница № 7 города Ростова-на-Дону» в период с 2010 по 2019 гг.
Результаты: наиболее вероятными сопутствующими заболеваниями были сердечно-сосудистые, которые являются основной причиной внезапной смерти, и эндокринные, что в совокупности влияет на исходы миелодиспластического синдрома.
Выводы: отсутствуют алгоритмы оценки индивидуального риска, которые могли бы определять целеполагание терапии у пациентов с миелодиспластическим синдромом, чья продолжительность жизни больше зависит от течения сопутствующих заболеваний.
Ключевые слова
Для цитирования:
Липилкин П.В., Шатохин Ю.В., Мацуга А.А. Некоторая характеристика пациентов с миелодиспластическим синдромом. Медицинский вестник Юга России. 2020;11(4):32-42. https://doi.org/10.21886/2219-8075-2020-11-4-32-42
For citation:
Lipilkin P.V., Shatokhin Yu.V., Matsuga A.A. Some characteristics of patients with myelodysplastic syndrome. Medical Herald of the South of Russia. 2020;11(4):32-42. (In Russ.) https://doi.org/10.21886/2219-8075-2020-11-4-32-42
Введение
На данный момент в Российской Федерации не существует единого государственного реестра миелодиспластического синдрома (МДС), причём это — общемировая действительность [1]. Тем не менее, неоднократно продемонстрировано, что заболеваемость МДС недооценивается [2]. Однако исследователи всё же пытаются ответить на базовые вопросы об этиологии, факторах риска и частоте возникновения этого заболевания.
По результатам исследований [3][4], показано, что 5–10 % пожилых людей приобретают более одной мутации соматических клеток, тогда как молодые люди менее склонны к возникновению клонального гемопоэза с соматическими мутациями. Это позволяет предполагать, что происхождение МДС связано c поэтапным приобретением онкогенных мутаций в соматических клетках в течение жизни с максимальной вероятностью при возрасте старше 60 лет [5].
Ряд исследователей предпринимал попытки поиска причин мутаций в соматических клетках, которые индуцируют развитие МДС de novo (табакокурение, употребление алкоголя, ожирение, радиация, пестициды, цитостатические лекарственные препараты (ЛП), некоторые химикаты) [6][7][8]. Однако в большинстве исследований не было выявлено достоверной корреляции между развитием МДС и воздействием предполагаемого этиологического фактора [9]. Поэтому заболевание, скорее всего, является полиэтилогичным и выделение одного этиологического фактора не представляется возможным.
Также у течения МДС есть такое свойство, как трансформация в острый миелоидный лейкоз (ОМЛ) [10]. Группа пожилых людей с диагнозом МДС гетерогенна в прогнозе и часто, помимо риска трансформации в ОМЛ, имеет другие сопутствующие заболевания, которые могут значительно повлиять на их выживание, поэтому до конца не ясно, что должно являться главным целеполаганием в назначаемой терапии в этой группе пациентов [11][12].
Цель исследования — эпидемиологический анализ клинических случаев МДС на основании имеющихся ретроспективных данных.
Материалы и методы
Проведён ретроспективный анализ данных историй болезней 115 пациентов (61 мужчина и 54 женщины) с диагнозом МДС, которые получали лечение в гематологическом отделении МБУЗ «Городская больница № 7 города Ростова-на-Дону» в период с 2010 по 2019 гг. Все пациенты — городские жители.
Большинство пациентов (61 ± 4,5 %) — пожилые и старческие люди (≥ 60 лет), по возрастным категориям Всемирной организации здравоохранения (ВОЗ). Самой частой причиной поступления пациентов в гематологическое отделение были обнаруженные нарушения в общем анализе крови (рис. 1), в частности, долго сохраняющаяся анемия.
Пациенты при обследовании получали основной диагноз, согласно классификации ВОЗ опухолей гемопоэтической и лимфоидной ткани 2017 [13] и регистрировались все существующие типы МДС (рис. 2).
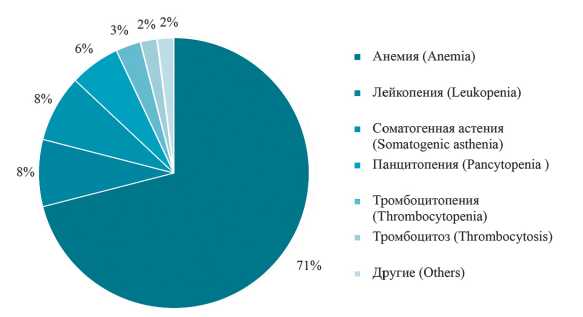
Рисунок 1. Заключения, на основании которых пациентов направляли для консультации гематолога (n = 115)
Figure 1. Conclusions on the basis of which patients were referred for consultation with a hematologist (n = 115)
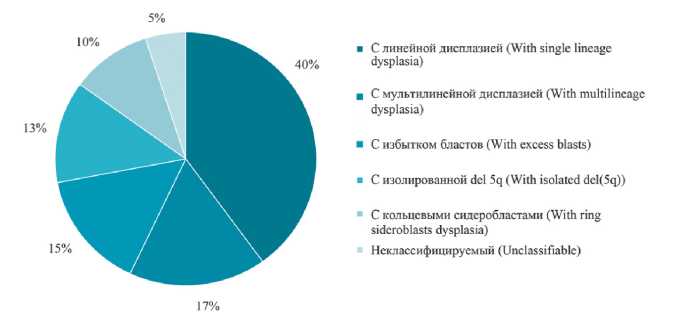
Рисунок 2. Удельный вес верифицированных типов миелодиспластического синдрома (n = 115)
Figure 2. The proportion of verified types of myelodysplastic syndrome (n = 115)
Медиана возраста на момент постановки диагноза составила 63 года (17 – 82). При этом медиана возраста женщин на момент постановки диагноза составила 63 (17 – 82), мужчин — 64 (41 – 81).
В контрольную группу вошло 32 госпитализированных пациентов обоего пола терапевтического профиля без гематологических заболеваний в анамнезе, но сопоставимые по возрасту и местожительству. В анкете были представлены следующие вопросы:
Табакокурение?
- Употребление алкоголя (более двух раз в месяц)?
- Вредные условия труда (работа в сельском хозяйстве, атомной промышленности или энергетике, ликвидатор аварии ЧАЭС)?
- Гематологические заболевания у ближайших родственников, включая гемобластозы?
Также совместно с анкетированием производился расчет индекса массы тела (ИМТ).
Статистическая обработка данных проводилась с использованием программы Microsoª O³ce Excel. Проводился расчет относительных величин, показателей относительного риска, а также анализ данных с использованием непараметрического статистического критерия хи-квадрат Пирсона при уровне значимости p = 0,05.
Результаты
Большинство пациентов имело очень низкий или низкий риск прогрессирования МДС, на основании шкал IPSS-R и WPSS [14][15] (табл. 1).
Индекс коморбидности Charlson [16] в среднем составил 4±0,3, что соответствует 77 % 10-летней выживаемости. Производилась оценка по шкале коморбидности MDS-CI [17] (табл. 2), которая выявила наибольший удельный вес пациентов промежуточного риска, что отражает увеличение риска смерти от причин, не связанных с трансформацией в ОМЛ.
Таблица / Table 1
Распределение пациентов в зависимости от группы риска (n = 115)
Distribution of patients depending on the risk group (n = 115)

Таблица / Table 2
Распределение пациентов по шкале MDS-CI (n = 115)
Distribution of patients on the MDS-CI scale (n = 115)
У 11 (9,5 ± 2,7 %) пациентов МДС трансформировался в ОМЛ, а продолжительность заболевания от МДС до ОМЛ в среднем составила 12 ± 1,5 месяцев. У 21 (18 ± 3,6%) пациента (9 мужчин и 12 женщин) зарегистрированы повторные госпитализации. Летальность составила 3±1,7 %. Длительность терапии составила от 0,5 до 1 месяца.
Наиболее вероятными сопутствующими заболеваниями были сердечно-сосудистые (ССЗ), которые являются основной причиной внезапной смерти, и эндокринные (рис. 3), что в совокупности влияет на исходы у пациентов.

Рисунок 3. Удельный вес сопутствующих заболеваний, по рубрикам Международной классификации болезней 10-го пересмотра (А) и по верифицированным диагнозам (Б) (n=115)
Figure 3. The proportion of concomitant diseases by headings of the International Classification of Diseases of the 10th revision (A) and by verified diagnoses (B) (n = 115)
У 38 (33 ± 4,4 %) пациентов возник гемосидероз органов. Возникновение этого состояния зависит от течения МДС, а именно появления зависимости от гемотрансфузий, которая была у 43 (37 ± 4,5 %) пациентов, то есть индивидуально проводилась минимум одна гемотрансфузия каждые 8 недель на протяжении 4 месяцев.
Уровень лактатдегидрогеназы в крови был измерен 64 пациентам, но без определения изоформы. У 59 (92 ± 3,4 %) пациентов регистрировался повышенный уровень этого фермента (> 225 Ед/л), из них у 54 (92 ± 3,6 %) индекс Mentzer составил больше 13 с сопряжённым повышением количества сывороточного железа, ферритина (> 1000 мкг/л при трёхкратном измерении) и процента сатурации железом у 32 (59 ± 6,7 %) пациентов при дублировании у них в заключениях наличия гемосидероза органов после проведения компьютерной томографии или магнитно-резонансной томографии.
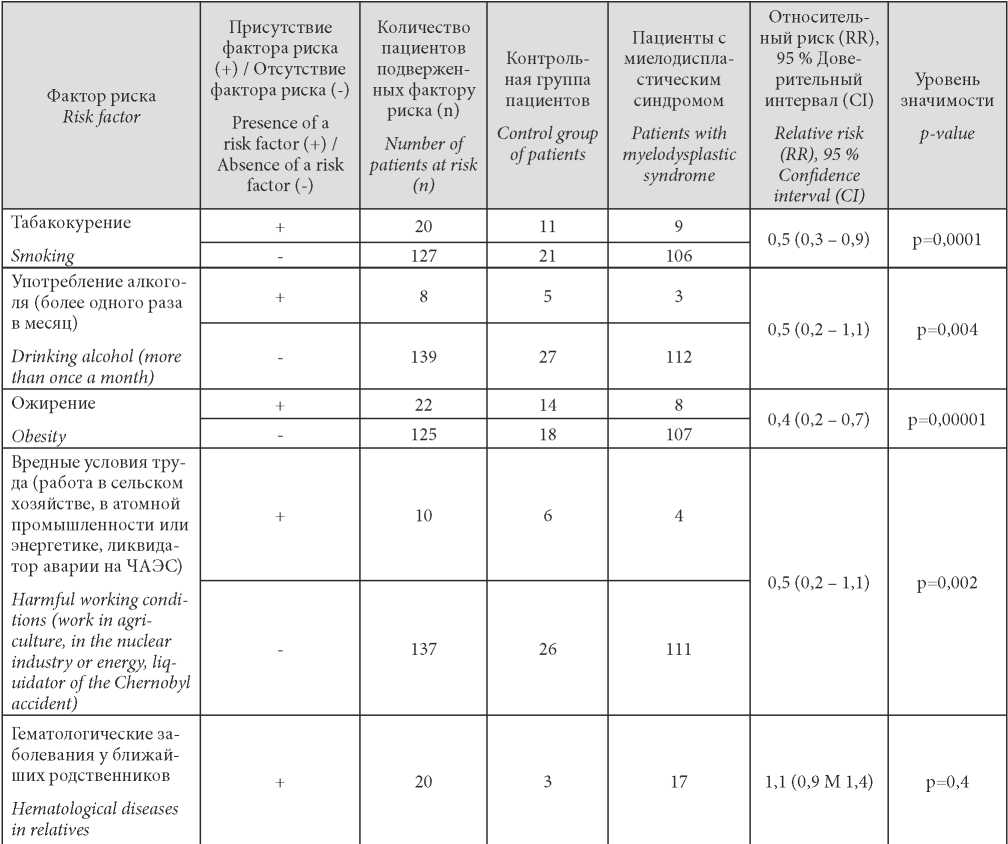
При анализе возможных факторов риска у 8 (7 ± 2,4%) пациентов зарегистрировано ожирение (ИМТ ≥ 30), 9 (8 ± 2,5 %) табакокурение и только 6 (5 ± 2 %) в анамнезе отмечали вредные условия труда (табл. 3). У 4 (3 ± 1,7 %) была обнаружена ВИЧ-инфекция (при этом антиретровирусную терапию на момент исследования получали 2) и 3 (3 ± 1,5 %) были инфицированы гепатитом С.
Таблица / Table 3
Показатели относительного риска МДС в сравнении с контрольной группой анкетирования
Indicators of the relative risk of MDS in comparison with the control group of the questionnaire
Продолжительность консервативной терапии в стационаре в среднем составила 16,4 ± 0,6 дней, а медиана количества назначаемых ЛП составила 5. Были обнаружены рекомендации групп ЛП с недоказанной эффективностью таких, как гепатопротекторов [18][19] или ноотропов [20][21][22] 24 (21 ± 3,8 %) пациентам. Ранжирование ЛП по частоте назначения показало, что самой назначаемой является антигипертензивная группа (рис. 4).
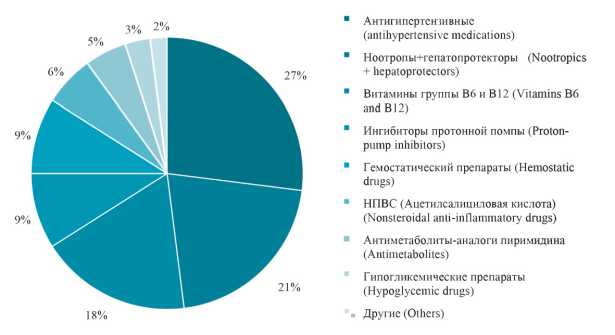
Рисунок 4. Соотношение назначения разных групп препаратов.
Figure 4. Correlation between prescribing different groups of drugs.
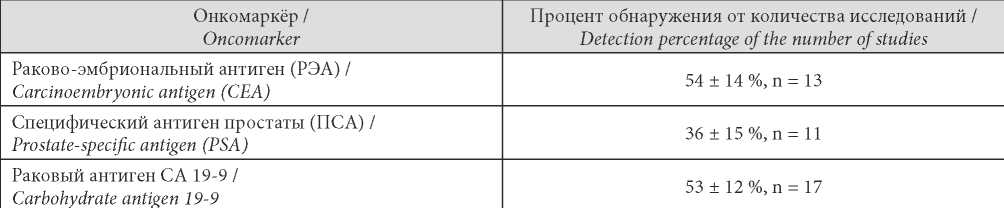
Молекулярно-генетические исследования и исследования на онкомаркёры прошли 24 (21 ± 3,8 %) пациента (табл. 4 и 5).
Таблица / Table 4
Частота обнаружения аномалий генов
Frequency of detection of gene abnormalities
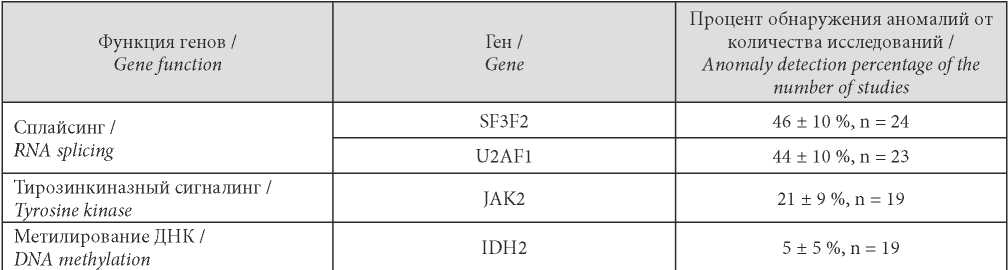
Таблица / Table 5
Частота обнаружения онкомаркёров
Frequency of detection of tumor markers
Обсуждение
Возраст постановки диагноза МДС не имел различий по полу. Больных мужчин было незначительно больше, чем женщин. Но по результатам нельзя назвать МДС однозначно старческим заболеванием. Вероятнее, болезнь появляется в среднем возрасте и протекает без клинических проявлений [4][23] по типу клонального гемопоэза с неопределённым потенциалом (CHIP), так как большинство пациентов имело очень низкий и низкий риск трансформации МДС в ОМЛ, по прогностическим шкалам IPSS-R и WPSS, а коморбидные заболевания препятствовали верификации и интерпретации самостоятельного онкогематологического процесса. Полученные данные, по шкале IPSS-R, являются надёжными предикторами по прогнозу выживаемости [24], но пациенты с CHIP имеют повышенный риск смерти от ССЗ [25][26].
Частым сопутствующим заболеванием были ССЗ, включая сахарный диабет II типа (СД II), как эквивалента ИБС [27]. СД II является значимым коморбидным заболеванием при прогнозе выживаемости пациентов с МДС [28].
В исследовании была попытка установить факторы риска для возникновения МДС. Было обнаружено повышение частоты исходов в группе МДС с гематологическими заболеваниями у ближайших родственников, но с отсутствием статистической значимости. Однако курение, употребление алкоголя, ожирение, потенциально вредные условия труда оказались установлены как факторы устойчивости. Такой феномен можно объяснить явлением конфаундинга. В анамнезе не у всех пациентов могли отражаться вредные привычки или, наоборот, пациенты в бремя болезни начинали вести здоровый образ жизни. При этом существенным недостатком проводимого анкетирования оказалось отсутствие оценки компетентности респондентов в вопросах их здоровья.
Установлено, что распространённым осложнением от получаемой терапии является гемосидероз органов и 48 пациентов имели зависимость от гемотрансфузий. Однако лишь 21 пациент был повторно госпитализирован. В таком случае можно предположить, что повторные госпитализации осуществлялись частью пациентов в другие клиники. У небольшой части пациентов былигемоконтактные инфекции. Следовательно, обеспечение безопасности гемотрансфузии у пациентов с МДС не является решённым.
Данные других исследований показывают, что пациенты с низким риском трансформации МДС в ОМЛ умирают от осложнений, связанных именно с влиянием МДС на сопутствующие заболевания [29]. То есть клинически значимы сами последствия костномозговой недостаточности, но и ОМЛ после трансформации МДС является устойчивым к существующей терапии [30][31]. Учитывая зарегистрированные повторные госпитализации и трансформации МДС в ОМЛ, можно предполагать, что клональная эволюция при МДС протекает с приобретением устойчивости к терапии и является триггером трансформации в ОМЛ.
В листах назначения были ЛП, которые не регламентированы клиническими рекомендациями по лечению МДС. Учитывая частоту назначения и количество применения определённых ЛП, вероятность предотвратить неудачные лекарственные комбинации снижается [32][33]. С другой стороны, большое количество назначенных ЛП было обусловлено наличием сопутствующих заболеваний, которые наряду с основным диагнозом могли стать причиной смерти или частого рецидива, но и это создаёт трудности, так как при совместном приёме трёх и более ЛП пациенты перестают принимать большинство из них [34[]35][36][37][38][39].
Вместе с тем невозможно предложить технологии предотвращения МДС или его скрининга. Опираясь на мировой опыт, скрининг может нести больше негативного [40][41][42][43] при условии, что клинически значимый МДС и так выявляется в большинстве случаев, но не считается частым онкогематологическим заболеванием. Нельзя утверждать, что скрининг на МДС приведёт к улучшению выживаемости.
Несмотря на то, что пациенты получали положительные результаты на онкомаркёры, это не всегда отражалось в верифицированных диагнозах других онкологических заболеваний. Можно предполагать, что часть пациентов была подвержена гипердиагностике и получением ложноположительных результатов. Проводимый пациентам анализ ПСА может указывать на любую патологию предстательной железы, что приводит к частым ложноположительным результатам [44][45].
Необходимо учесть, что пациентам, которые прошли молекулярно-генетические тестирования, в индивидуальном порядке проводился поиск аномалий более чем в одном гене. Поэтому с нарастанием актуальности молекулярно-генетических методов исследования при МДС [46][47][48] появляется спрос на подобные исследования. Но на данный момент любые генетические тесты не рекомендованы клиническими рекомендациями по диагностике и лечению МДС взрослых [49][50]. Это обусловлено их неоднозначным клиническим значением и сложностью в интерпретации.
Выводы
Большинство пациентов входит в группы очень низкого и низкого риска согласно шкалам IPSS-R и WPSS, что даёт возможность их лечения в амбулаторном порядке. Для этого ещё предстоит переосмыслить МДС, как заболевание среднего возраста и разработать дополнительные критерии индивидуального риска.
Рассмотренные факторы риска (табакокурение, употребление алкоголя, ожирение, вредные условия труда, гематологические заболевания у ближайших родственников) несут значение в прогрессировании сопутствующих заболеваний.
Таким образом, отсутствуют алгоритмы оценки индивидуального риска, которые могли бы определять целеполагание терапии у пациентов с МДС, чья продолжительность жизни больше зависит от течения сопутствующих заболеваний.
Финансирование. Исследование не имело спонсорской поддержки.
Financing. The study did not have sponsorship.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interest. Authors declares no conflict of interest.
Список литературы
1. Rollison D.E., Howlader N., Smith M.T., Strom S.S., Merritt W.D., et al. Epidemiology of myelodysplastic syndromes and chronic myeloproliferative disorders in the United States 2001-2004 using data from the NAACCR and SEER programs. // Blood. – 2008. – V. 112(1). - P. 45-52. DOI: 10.1182/blood-2008-01-134858
2. Cogle C.R. Incidence and Burden of the Myelodysplastic Syndromes. // Curr Hematol Malig Rep. – 2015. – Vol. 10 – №3. – P. 272-81. DOI: 10.1007/s11899-015-0269-y
3. Xie M., Lu C., Wang J., McLellan M.D., Johnson K.J., et al. Age-related mutations associated with clonal hematopoietic expansion and malignancies. // Nat Med. – 2014. – Vol. 20. – P. 1472-18. DOI: 10.1038/nm.3733
4. Genovese G., Kahler A.K., Handsaker R.E., Lindberg J., Rose S.A., et al. Clonal hematopoiesis and blood-cancer risk inferred from blood DNA sequence.// N Engl J Med. – 2014. – Vol. 371(26). – P. 2477-87. DOI:10.1056/NEJMoa1409405
5. Greenberg P.L., Tuechler H., Schanz J., Sanz G., Garcia-Manero G., et al. Revised international prognostic scoring system for myelodysplastic syndromes. // Blood. – 2012. – Vol. 120. – P. 2454-65. DOI:10.1182/blood-2012-03-420489
6. Avgerinou C., Giannezi I., Theodoropoulou S., Lazaris V., Kolliopoulou G., et al. Occupational, dietary, and other risk factors for myelodysplastic syndromes in Western Greece. // Hematology. – 2017. – Vol. 22. – №7. – P. 420- 429. DOI:10.1 080/10245332.2016.1277006
7. Neukirchen J., Schoonen W.M., Strupp C., Gattermann N., Aul C., et al. Incidence and prevalence of myelodysplastic syndromes: data from the Dusseldorf MDS-registry. // Leuk Res – 2011. – Vol. 35. – P. 1591-1596. DOI:10.1016/j.leukres.2011.06.001
8. Iwanaga M., Hsu W.L., Soda M., Takasaki Y., Tawara M., et al. Risk of myelodysplastic syndromes in people exposed to ionizing radiation: a retrospective cohort study of Nagasaki atomic bomb survivors. // J Clin Oncol. – 2011. – Vol. 29. – P. 428-434. DOI:10.1200/JCO.2010.31.3080
9. Du Y., Fryzek J., Sekeres M.A., Taioli E. Smoking and alcohol intake as risk factors for myelodysplastic syndromes (MDS) // Leuk Res. – 2009. – Vol. 9. – P. 9. DOI:10.4172/1747-0862.1000217
10. Schmalzing M., Aringer M., Bornhäuser M., Atta J. Myelodysplastic syndrome, acute leukemia and stem cell transplantation. // Z Rheumatol. – 2017. – Vol. 76. – №2. – P. 26-32. DOI:10.1007/s00393-017-0369-2.
11. Falantes J.F., Calderón C., Márquez Malaver F.J., Alonso D., Martín Noya A., et al. Clinical prognostic factors for survival and risk of progression to acute myeloid leukemia in patients with myelodysplastic syndromes with less than 10% bone marrow blasts and non unfavorable cytogenetic categories. // Clin Lymphoma Myeloma Leuk. – 2013. – Vol. 13. – P. 144- 152. DOI: 10.1016/j.clml.2012.09.013
12. Falantes J., Garcia-Manero G. Does the concept of lowerrisk myelodysplastic syndrome need to be revisited? // Leuk Res. – 2015. – Vol. 39. – P. 1003-1005. DOI: 10.1016/j.leukres.2015.06.010
13. Bruneau J., Molina T.J. WHO Classification of Tumors of Hematopoietic and Lymphoid Tissues. // In: van Krieken J. (eds) Encyclopedia of Pathology. Encyclopedia of Pathology. Springer, Cham. – 2019. DOI: 10.1007/978-3-319-28845-1_3817-1
14. Greenberg P, Cox C, LeBeau MM, Fenaux P, Morel P, et al. International scoring system for evaluating prognosis in myelodysplastic syndromes. // Blood. – 1997. – Vol. 89. – P. 2079- 2088. PMID: 9058730.
15. Malcovati L., Porta M.G., Pascutto C., Invernizzi R., Boni M., et al. Prognostic factors and life expectancy in myelodysplastic syndromes classified according to WHO criteria: A basis for clinical decision making. // J Clin Oncol – 2005. – Vol. 23. – P. 7594-7603. DOI:10.1200/JCO.2005.01.7038
16. Charlson M.E., Pompei P., Ales K.L., MacKenzie C.R. A new method of classifying prognostic comorbidity in longitudinal studies: development and validation. // J Chron Dis – 1987. – Vol. 40. – P. 373-383. DOI:10.1016/0021-9681(87)90171-8
17. Della Porta M.G., Malcovati L., Strupp C., Ambaglio I., Kuendgen A., et al. Risk stratification based on both disease status and extra-hematologic comorbidities in patients with myelodysplastic syndrome. // Haematologica. – 2011. – Vol. 96. – P. 441-449. DOI: 10.3324/haematol.2010.033506
18. Lieber C.S., Weiss D.G., Groszmann R., Paronetto F., Schenker S.; Veterans Affairs Cooperative Study 391 Group. II. Veterans Affairs Cooperative Study of Polyenylphosphatidylcholine in Alcoholic Liver Disease. // Alcohol Clin Exp Res. – 2003. – Vol. 27. – №11. – P. 1765-1771. DOI:10.1097/01.ALC.0000093743.03049.80
19. Rambaldi A., Gluud C. S-adenosyl-L-methionine for alcoholic liver diseases. // Cochrane Database of Systematic Reviews. – 2006. – №2. DOI:10.1002/14651858.cd002235.pub2
20. Ricci S., Celani M.G., Cantisani T.A., Righetti E. Piracetam for acute ischaemic stroke. // Cochrane Database of Systematic Reviews. – 2012. – №9. DOI:10.1002/14651858.cd000419.pub2
21. Flicker L., Grimley Evans J. Piracetam for dementia or cognitive impairment. // Cochrane Database of Systematic Reviews. – 2004. – №1. DOI: 10.1002/14651858.CD001011
22. Al Hajeri A., Fedorowicz Z., Omran A., Tadmouri G.O. Piracetam for reducing the incidence of painful sickle cell disease crises. // Cochrane Database of Systematic Reviews – 2007. – №2. DOI: 10.1002/14651858.CD006111.pub2
23. Jaiswal S., Fontanillas P., Flannick J., Manning A., Grauman P.V., et al. Age-related clonal hematopoiesis associated with adverse outcomes. // N Engl J Med. – 2014. – Vol. 371. – №26. – P. 2488-2498. DOI:10.1056/NEJMoa1408617
24. Voso. M.T., Fenu S., Latagliata R., Buccisano F., Piciocchi A., et al. Revised International Prognostic Scoring System (IPSS) Predicts Survival and Leukemic Evolution of Myelodysplastic Syndromes Significantly Better Than IPSS and WHO Prognostic Scoring System: Validation by the Gruppo Romano Mielodisplasie Italian Regional Database. // J Clin Oncol. – 2013. – Vol. 31. – №21. – P. 2671-2677. DOI:10.1200/jco.2012.48.0764
25. Fuster J.J., MacLauchlan S., Zuriaga M.A., Polackal M.N., Ostriker A.C., et al. Clonal hematopoiesis associated with TET2 deficiency accelerates atherosclerosis development in mice. // Science. – 2017. – Vol. 355. – №6327. – P. 842-847. DOI:10.1126/science.aag1381
26. Jaiswal S., Natarajan P., Silver A.J., Gibson C.J., Bick A.G., et al. Clonal Hematopoiesis and Risk of Atherosclerotic Cardiovascular Disease. // N Engl J Med – 2017. – Vol. 377. – P. 111- 121. DOI:10.1056/NEJMoa1701719
27. Мусихина Н.А., Гапон Л.И., Петелина Т.И., Махнева Е.А., Еменева И.В. Особенности дисфункции эндотелия и вариабельности ритма сердца при артериальной гипертензии и ишемической болезни сердца. // Артериальная гипертензия. – 2016. – Т. 22. – № 4. – С. 414-424. DOI:10.18705/1607-419X-2016-22-4-414-424
28. Falantes J.F., Márquez-Malaver F.J., Knight T., Calderón-Cabrera C., Martino M.L., et al. The incorporation of comorbidities in the prognostication of patients with lower-risk myelodysplastic syndrome*. // Leukemia & Lymphoma. – 2016. – Vol. 58. – №8. – P. 1895-1901. DOI:10.1080/10428194.2016.1267350
29. Dayyani F., Conley A.P., Strom S.S., Stevenson W., Cortes J.E., et al. Cause of death in patients with lower-risk myelodysplastic syndrome. // Cancer. – 2010. – Vol. 116. – P. 2174-2179. DOI:10.1002/cncr.24984
30. Welch J.S., Petti A.A., Miller C.A., Fronick C.C., O’Laughlin M., et al. TP53 and Decitabine in Acute Myeloid Leukemia and Myelodysplastic Syndromes. // N Engl J Med. – 2016. – Vol. 375. – №21. – P. 2023-2036. DOI:10.1056/NEJMoa1605949.
31. DiNardo C.D., Pratz K., Pullarkat V., Jonas B.A., Arellano M., et al. Venetoclax combined with decitabine or azacitidine in treatment-naive, elderly patients with acute myeloid leukemia. // Blood. – 2019. – Vol. 133. – №1. – P. 7-17. DOI:10.1182/blood-2018-08-868752
32. Rothwell P.M., Cook N.R., Gaziano J.M., Price J.F., Belch J.F., et al. Effects of aspirin on risks of vascular events and cancer according to bodyweight and dose: analysis of individual patient data from randomised trials. // The Lancet. – 2018. – Vol. 392. – №10145. – P. 387-398. DOI:10.1016/s0140-6736(18)31133-4
33. Лузина Е.В., Ларева Н.В., Жилина А.А., Жигжитова Е.Б., Устинова Е.Е. Эрозивно-язвенные поражения верхних отделов желудочно-кишечного тракта у пациентов с ишемической болезнью сердца. Лечение и профилактика. // Российский медицинский журнал. – 2017. – Vol. 23. – №6. – P. 327-330. DOI: 10.18821/0869-2106-2017-23-6-327- 330
34. Tomaszewski M., White C., Patel P., Masca N, Damani R, et al. High rates of non-adherence to antihypertensive treatment revealed by high-performance liquid chromatographytandem mass spectrometry (HP LC-MS/MS) urine analysis. // Heart. – 2014. – Vol. 100. – P. 855-861. DOI:10.1136/heartjnl-2013-305063
35. Ector G.I.C.G., Govers T.M., Westerweel P.E., Grutters J.P.C. , Blijlevens N.M.A. The potential health gain and cost savings of improving adherence in chronic myeloid leukemia. // Leukemia & Lymphoma. – 2019. – P. 1-8. DOI: 10.1080/10428194.2018.1535113
36. Hall A.E., Paul C., Bryant J., Lynagh M.C., Rowlings P., et al. To adhere or not to adhere: rates and reasons of medication adherence in hematological cancer patients. // Crit Rev Oncol Hemat. – 2016. – №97. – P. 247-262. DOI:10.1016/j.critrevonc.2015.08.025
37. Kekäle M., Talvensaari K., Koskenvesa P., Porkka K., Airaksinen M. Chronic myeloid leukemia patients’ adherence to peroral tyrosine kinase inhibitors compared with adherence as estimated by their physicians. // Patient Prefer Adherence. – 2014. – Vol. 8. – P. 1619-1627. DOI:10.2147/PPA.S70712
38. Yeoh A., Collins A., Fox K., Shields S., Ritchie P., et al. Treatment delay and the risk of relapse in pediatric acute lymphoblastic leukemia. // Pediatric Hematology and Oncology. – 2017. – Vol. 34. – №1. – P. 38-41. DOI:10.1080/08880018.20 16.1276235
39. Haynes R.B., McKibbon K.A., Kanani R. Systematic review of randomised trials of interventions to assist patients to follow prescriptions for medications. // Lancet. – 1996. – Vol. 348. – №9024. – P. 383-386. DOI:10.1016/s0140-6736(96)01073-2
40. Krogsbøll L.T., Jørgensen K.J., Gøtzsche P.C. General health checks in adults for reducing morbidity and mortality from disease. // Cochrane Database of Systematic Reviews. – 2019. – №1. Art. No.: CD009009. DOI: 10.1002/14651858.CD009009.pub3.
41. Prasad V., Lenzer J., Newman D.H. Why cancer screening has never been shown to “save lives”—and what we can do about it. // BMJ. – 2016. – Vol. 352. h6080. DOI:10.1136/bmj.h6080
42. Brawley O.W., Kramer B.S. Cancer screening in theory and in practice. // J Clin Oncol. – 2005. – Vol.23. – P. 293 -300. DOI:10.1038/bjc.2013.427
43. Zahl P.H., Jørgensen K.J., Gøtzsche P.C. Overestimated lead times in cancer screening has led to substantial underestimation of overdiagnosis. // Br J Cancer. – 2013. – Vol. 109. – P. 2014-2019. DOI:10.1038/bjc.2013.427
44. Schroder F.H., Hugosson J., Roobol M.J., Tammela T.L.J., Ciatto S., et al. Screening and prostate-cancer mortality in a randomized european study. // The New England Journal of Medicine. – 2009. – Vol. 360. – №13. – P. 1320-1328. DOI:10.1056/NEJMoa0810084
45. Draisma G., Boer R., Otto S.J., van der Cruijsen I.W., Damhuis R.A.M., et al. Lead times and overdetection due to prostatespecific antigen screening: estimates from the European Randomized Study of Screening for Prostate Cancer. // Journal of the National Cancer Institute. – 2003. – Vol. 95. – №12. – P. 868-878. DOI:10.1093/jnci/95.12.868
46. Bejar R., Stevenson K.E., Caughey B., Lindsley R.C., Mar B.G., et al. Somatic mutations predict poor outcome in patients with myelodysplastic syndrome after hematopoietic stem-cell transplantation. // J. Clin. Oncol. – 2014. – Vol. 32. – P. 2691- 2698. DOI:10.1200/JCO.2013.52.3381
47. Gill H., Leung A.Y, Kwong Y.L. Molecular and Cellular Mechanisms of Myelodysplastic Syndrome: Implications on Targeted Therapy. // Int J Mol Sci. – 2016. – Vol. 17. – №4. – P. 444-451. DOI:10.3390/ijms17040440
48. Kwok B., Hall J.M., Witte J.S., Xu Y., Reddy P., et al. MDS associated somatic mutations and clonal hematopoiesis are common in idiopathic cytopenia of undetermined significance. // Blood. – 2015. – Vol. 126. – P. 2355-2361. DOI:10.1182/blood-2015-08-667063
49. Савченко В.Г., Паровичникова Е.Н., Кохно А.В., Семочкин С.В., Афанасьев Б.В., и др. Национальные клинические рекомендации по диагностике и лечению миелодиспластических синдромов взрослых. // Гематология и трансфузиология. - 2016. - Т. 61 № 1S (4). - С. 3–5. eLIBRARY ID: 21689282
50. Fenaux P., Haase D., Sanz G.F., Santini V., Buske C., & ESMO Guidelines Working Group (2014). Myelodysplastic syndromes: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. // Ann Oncol. – 2014. – V.25 Suppl 3:iii57-69. DOI: 10.1093/annonc/mdu180
Об авторах
П. В. ЛипилкинРоссия
ассистент кафедры «Биология и общая патология»,
Ростов-на-Дону
Ю. В. Шатохин
Россия
д.м.н., профессор кафедры гематологии и трансфузиологии с курсами клинической лабораторной диагностики, генетики и лабораторной генетики ФПК и ППС,
Ростовна-Дону
А. А. Мацуга
Россия
ассистент кафедры гематологии и трансфузиологии с курсами клинической лабораторной диагностики, генетики и лабораторной генетики ФПК и ППС;
заведующий гематологическим отделением,
остов-на-Дону
Рецензия
Для цитирования:
Липилкин П.В., Шатохин Ю.В., Мацуга А.А. Некоторая характеристика пациентов с миелодиспластическим синдромом. Медицинский вестник Юга России. 2020;11(4):32-42. https://doi.org/10.21886/2219-8075-2020-11-4-32-42
For citation:
Lipilkin P.V., Shatokhin Yu.V., Matsuga A.A. Some characteristics of patients with myelodysplastic syndrome. Medical Herald of the South of Russia. 2020;11(4):32-42. (In Russ.) https://doi.org/10.21886/2219-8075-2020-11-4-32-42
JATS XML







































