Перейти к:
Клинический cлучай врожденного гиперинсулинизма у ребенка раннего возраста
https://doi.org/10.21886/2219-8075-2020-11-3-54-59
Аннотация
Клинический случай врожденного гиперинсулинизма, диффузная форма, фармакорезистентное течение (гетерозиготная мутация с. 1361 1363 dup CGG в гене GCK) у ребенка раннего возраста представлен как пример орфанного тяжелого заболевания с крайне неблагоприятным течением и вероятностью ухудшения отдаленного прогноза. Целью явилось освещение клинических проявлений, вариантов течения, сложности терапии данной патологии широкому кругу врачей разной специализации в области педиатрии с позиций повышения качества и своевременности диагностики, снижения числа осложнений с формированием непоправимых последствий. Представляет интерес наиболее тяжелое течение гипогликемических состояний в раннем неонатальном периоде, зависимость формирования выраженного неврологического дефицита от степени и продолжительности гипогликемий, что подчеркивает важность их своевременной коррекции для сохранения качества жизни данному контингенту детей.
Ключевые слова
Для цитирования:
Бережанская С.Б., Афонин А.А., Папшева Е.А., Вострых Н.Н., Галкина Г.А., Созаева Д.И., Лукьянова Е.А. Клинический cлучай врожденного гиперинсулинизма у ребенка раннего возраста. Медицинский вестник Юга России. 2020;11(3):54-59. https://doi.org/10.21886/2219-8075-2020-11-3-54-59
For citation:
Berezhansky S.B., Afonin A.A., Papsheva E.A., Vostrykh N.N., Galkina G.A., Sozaeva D.I., Lukyanova E.A. A clinical case of congenital hyperinsulinism in an early child. Medical Herald of the South of Russia. 2020;11(3):54-59. (In Russ.) https://doi.org/10.21886/2219-8075-2020-11-3-54-59
Глюкоза — один из основных компонентов метаболических процессов, необходимых для жизнедеятельности клеток всех систем организма человека, в первую очередь клеток головного мозга и сердечно-сосудистой системы. Концентрация глюкозы в крови человека поддерживается в достаточно узких пределах (2,8 – 7,8 ммоль/л) и не зависит от пола, возраста, характера питания и физической нагрузки. Это постоянство обеспечивает ткани мозга достаточным, стабильным количеством глюкозы, которая является для них основой энергетического обмена и уникальным источником энергии. Так как клетки головного мозга не могут самостоятельно производить и накапливать глюкозу, снижение концентрации в крови ниже допустимого уровня ограничивает ее поступление к тканям мозга, обусловливая их гипоксию и атрофию [1].
Особое положение при изучении гипогликемических состояний занимают новорожденные в раннем неонатальном периоде. В России показателем гипогликемии в неонатальном периоде является уровень глюкозы менее 2,6 ммоль/л. Анализ результатов большого числа исследований, посвященных гипогликемиям у детей, выявил значительный диапазон колебаний глюкозы (1,8 – 6,2 ммоль/л), наличие корреляционной связи между низким ее уровнем и летальным исходом [2]. В то же время исследования, начиная с 60 – 70-х гг. прошлого столетия, не выражали единого мнения о влиянии гипогликемии на развитие отдаленных психоневрологических расстройств, особенно после «бессимптомной гипогликемии» [3]. Указанное пытались объяснить наличием у новорожденных, особенно в первые 48 – 72 часа, компенсаторных механизмов, в том числе альтернативных субстратов энергии (жирных кислот, кетоновых тел), препятствующих развитию повреждений ткани мозга, а главное, различными методологическими подходами, не учитывавшими четко степень тяжести и продолжительность гипогликемии. Правомочность последнего предположения была подтверждена экспериментальными данными, показавшими, что тяжелая продолжительная гипогликемия коррелирует с неврологическими повреждениями [4]. С помощью электронной микроскопии установлено, что они являются следствием не просто метаболического истощения, а активного повреждения нейронов, преимущественно в коре головного мозга, гиппокампе, хвостатом ядре, что позволяет говорить о специфичности поражения при экспериментальной гипогликемии в отличие от гипоксическиишемического повреждения [5].
В настоящее время утвердилось мнение, что нейрогликемия вследствие персистирующих и рецидивирующих гипогликемических состояний на ранних этапах онтогенеза у детей в период формирования основных структур головного мозга, может приводить к необратимым изменениям ЦНС с развитием выраженного неврологического дефицита и задержки психомоторного развития.
В клинике неонатальных гипогликемий выделены две большие группы:
- транзиторные гипогликемии, включающие раннюю неонатальную гипогликемию (6 – 12 часов); классическую транзиторную гипогликемию (12 – 48 часов жизни); вторичную гипогликемию вследствие анте-интранатальных факторов риска, гипоксии-ишемии, инфекционных факторов, кровоизлияний в надпочечники и ряда других;
- персистирующие гипогликемии (после 7 суток), предполагающие большой спектр патологических состояний, обусловленных разными этиопатогенетическими механизмами, в основе которых — дефицит гормонов; гиперинсулинизм; нарушение синтеза аминокислот; заболевания, связанные с окислением жирных кислот, а также с нарушением образования глюкозы и другие состояния, обусловленные наследственными нарушениями обмена.
Гиперинсулинемические гипогликемии (ГГ), являющиеся следствием гиперпродукции инсулина, могут быть как персистирующими (при врожденном гиперинсулинизме, инсулиномах), так и транзиторными (при синдроме Бэквита – Видемана, диабетической фетопатии, затяжном неонатальном гиперинсулинизме). Неадекватно высокая секреция инсулина приводит к утилизации глюкозы клетками инсулинозависимых тканей, одновременно подавляя продукцию глюкозы, свободных жирных кислот и кетоновых тел, что формирует биохимическую основу, лишающую пациентов с ГГ глюкозы и альтернативных источников энергии для головного мозга, увеличивая риск развития неврологических расстройств [6].
Врожденный гиперинсулинизм (ВГИ) был впервые описан как «идиопатическая гипогликемия детского возраста» ученым I. MacQuarrie [7] в 1954 г. В дальнейшем ВГИ обозначали такими терминами, как, например, «лейцин чувствительная гипогликемия», «синдром дисрегуляции β-клеток», «персистирующие гиперинсулинемические гипогликемии младенческого возраста». Длительное время для определения ВГИ использовался термин «незидиобластоз», введенный Г. Лейдло еще в 1938 г. [8].
Врожденный гиперинсулинизм — одна из наиболее частых причин персистирующих гипогликемий у новорожденных и детей, которая представляет собой гетерогенное заболевание в отношении как клинических проявлений и гистологических форм, так и молекулярно-генетических дефектов, лежащих в основе данной патологии [6][9]. Частота встречаемости ВГИ составляет 1:30000 – 1:50000 в общей популяции. В то же время есть указания на повышение частоты встречаемости до 1:2500 в популяциях, имеющих территориальные ограничения и большое число близкородственных браков. Исследования, проведенные в Российской Федерации за последние 10 – 15 лет, внесли существенный вклад в изучение клинических, генетических, радиологических данных, что позволило уточнить патогенетические механизмы врожденного гиперинсулинизма с последующей разработкой персонализированных протоколов лечения детей с данной патологией. Установлено, что в Российской Федерации первичная заболеваемость ВГИ за последние годы составила 1:50638 живых новорожденных, что соотносимо с данными Европейских регистров [10, 11].
В настоящий момент в литературе описаны 13 генов, участвующих в регуляции секреции инсулина, повреждения которых могут приводить к развитию ВГИ [9]. Наиболее часто выявляются дефекты генов, участвующих в регуляции закладки и функционирования АТФ-зависимых К+- каналов β-клеток поджелудочной железы. К ним относятся гены KCNJ11 и ABCC8 [12]. Мутации гена GLUD1 являются второй по частоте причиной ВГИ [13][14]. В 5 – 7 % случаев причиной ВГИ служат мутации гена глюкокиназы (GCK), кодирующего одноименный фермент [13]. К крайне редким генетическим причинам ВГИ относятся мутации генов HADH, HNF4A, SLC16A1, INSR, UCP2. В 40 % случаев молекулярно-генетический вариант ВГИ установить не удается [15].
Помимо разделения ВГИ в зависимости от характера мутаций генов выделены морфологические формы, влияющие на тяжесть течения и прогноз заболевания. Дифференциальная диагностика морфологических форм осуществляется с помощью позитронно-эмиссионной томографии [6][16], позволяющей выделить три основные морфологические формы заболевания:
- диффузная, при которой поражены все β-клетки поджелудочной железы, встречается в 50 – 60 % случаев;
- фокальная, когда очаг поражения лимитирован определенной областью, встречается в 40 – 50 % случаев;
- атипичная форма < 5 % случаев.
Заболевание манифестирует, как правило, в неонатальном периоде, хотя возможен и более поздний дебют, вплоть до 3-х летнего возраста. В большинстве случаев, особенно при развитии в раннем неонатальном периоде, гипогликемии носят тяжелый характер, а для поддержания нормогликемии требуются высокие дозы глюкозы, что не всегда дает стойкую нормализацию гликемии, вероятности повторных гипогликемических состояний в ближайшие часы и полной безопасности введения большого количества высоко концентрированных растворов глюкозы. В связи с этим в большинстве случаев тяжелого течения ВГИ возникает необходимость включения в комплекс терапии инсулиностатических препаратов (табл. 1).
Таблица / Table 1
Перечень инсулиностатических препаратов для терапии ВГИ (по Меликян М.А. 2014 г. с изменениями[6])
List of insulin static drugs for the treatment of inborn hyperinsulinism (by Melikyan M. A. 2014. with changes)
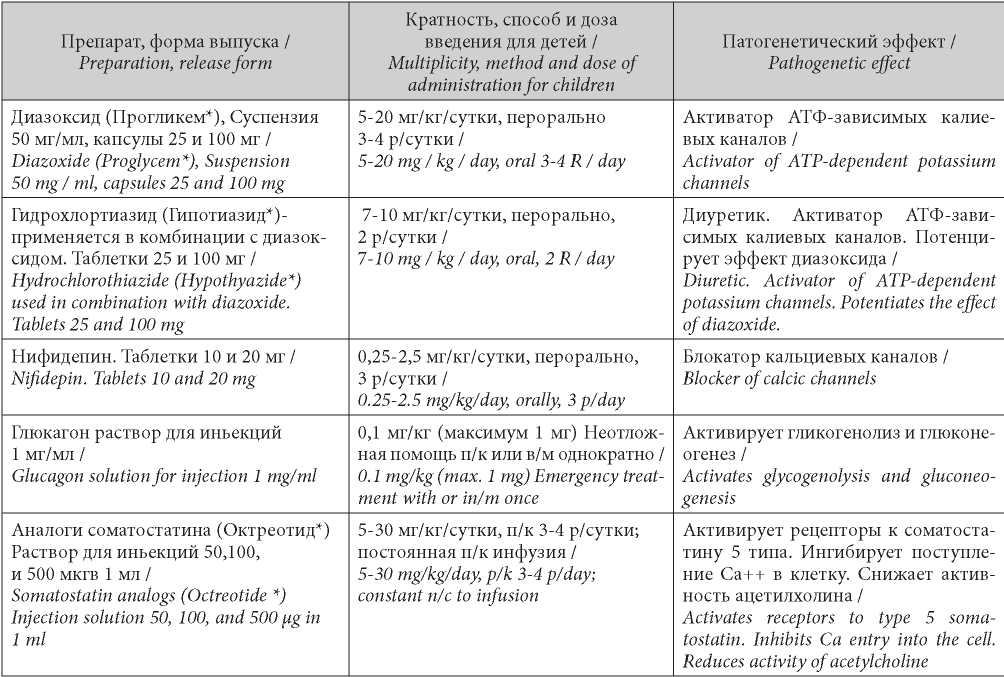
*В скобках приведены коммерческие названия препаратов.
*Commercial names of drugs are shown in brackets.
Для иллюстрации приводим клинический случай из собственной практики.
Девочка Г. родилась 27.06.17 г. от 2-й беременности (1-я — роды в 2016 г., ребенок здоров), протекавшей на фоне явлений раннего токсикоза, угрозы прерывания, от 2-х срочных оперативных родов в связи с ягодичным предлежанием, массой 3700,0 г., длиной 52,0 см с оценкой по шкале Апгар 8-8 баллов. Наследственный анамнез отягощен родственным браком — мать и отец являются троюродными сибсами. Ранний неонатальный период протекал без особенностей. В возрасте 2-х месяцев появилась отсроченная неврологическая симптоматика, характеризовавшаяся вегетативными нарушениями (срыгивания, метеочувствительностью), беспокойным ночным сном. На первом году жизни отмечалась темповая задержка стато-моторного развития (голову держит после 3 месяцев, сидит после 8 месяцев, ходит с 1 г. 1 месяца), по результатам нейросонограммы выявлены признаки гипоксически-ишемических изменений паренхимы головного мозга. В связи с указанным ребенок получал лечение в условиях детской поликлиники по поводу перинатального гипоксически-ишемического поражения ЦНС. После 13 месяцев жизни у девочки появились приступы, возникавшие, со слов родителей, после длительного перерыва в приемах пищи, сопровождавшиеся слабостью, вялостью, потерей сознания, цианозом лица. Подобные приступы трижды трансформировались в генерализованные судороги тонико-клонического характера. Во время последнего приступа было выявлено снижение уровня глюкозы (3,1 ммоль/л), в связи с чем ребенок в возрасте 1 г. 2 месяцев был госпитализирован в детское отделение «Научно-исследовательского института акушерства и педиатрии» ФГБОУ ВО РостГМУ МЗ РФ.
Общее состояние при поступлении расценивалось средней тяжести. Масса при поступлении — 10,2 кг; рост — 74,0 см. Обращали на себя внимание общая вялость, сменявшаяся возбуждением, умеренная бледность кожи, выраженная мышечная гипотония с сохранными живыми сухожильными рефлексами, темповая задержка стато-моторного и предречевого развития. Гликемия при поступлении соответствовала 2,6 ммоль/л.
Учитывая указание в анамнезе на гипогликемические состояния после первого года жизни, ребенок был консультирован детским эндокринологом и генетиком, высказавшими предположение о необходимости исключения эндокринного генеза гипогликемических состояний, возможно, на фоне наследственной патологии. В связи с чем проводилось определение иммунореактивного инсулина (ИРИ) и С-пептида, выявившее повышение уровня С-пептида до 5,0 нг/мл (норма 0,5-3,2 нг/мл) и уровня ИРИ до 28,0 мкМЕ (норма 2-25мкМЕ/мл). При ультразвуковом исследовании органов брюшной полости отмечалось повышение эхогенности и диффузные изменения паренхимы печени и поджелудочной железы. Данные ЭЭГ характеризовались диффузно-выраженными общемозговыми изменениями с признаками задержки формирования основного ритма, без пароксизмальной активности.
Выявленные клинические и лабораторные изменения в совокупности с данными анамнеза не исключали возможности врожденного гиперинсулинизма на фоне перинатального гипоксически-ишемического поражения ЦНС с синдромом вегето-висцеральных нарушений. Для уточнения этиологии заболевания, проведения молекулярно-генетического обследования и согласования лечебной тактики ребенок был направлен в ФГБУ «НМИЦ эндокринологии» Минздрава России.
Девочка впервые госпитализирована в ФГБУ «НМИЦ эндокринологии» Минздрава России в 1 г. 4 месяца, где был поставлен диагноз врожденный гиперинсулинизм, диффузная форма, фармакорезистентное течение (гетерозиготная мутация с. 1361 1363 dup CGG в гене GCK) МКБ 10 - Е16.1
Обоснованием для постановки вышеуказанного диагноза явились:
- рецидивирующие субклинические гипогликемии (1,9-2,2 ммоль/л) на фоне повышенного уровня инсулина (28,3 мкМЕ/мл);
- выявленная по результатам молекулярно-генетического обследования гетерозиготная мутация в гене глюкокиназы, описанная как патогенная, приводящая к фармакорезистентной форме ВГИ;
- данные позитронно-эмиссионной томографии, соответствовавшие диффузной форме ВГИ;
- сохранение гипогликемии с нарастанием кетоновых тел на фоне инсулиностатической терапии (диазоксид и октреотид), проводившейся в клинике;
- усугубление гипогликемии и повышение уровня инсулина на фоне отмены инсулиностатической терапии и пробной инфузионной терапии раствором глюкозы.
По данным отечественной и зарубежной литературы, при диффузных формах основным методом лечения является субтотальная панкреатэктомия. Исход операции в первые годы после оперативного лечения варьирует: эугликемия (у 50 – 60 % больных), гипогликемия (у 30 – 40 %), сахарный диабет (у 10 – 20 %). В динамике наблюдения частота сахарного диабета экзокринной этиологии может нарастать [10][11].
Первоначально, несмотря на рецидивирующие гипогликемические состояния, от хирургического лечения решено было отказаться. Девочка находилась на диетотерапии с ограничением глюкозы и легкоусвояемых углеводов на фоне инсулиностатической терапии. Однако рецидивирующий характер и тяжесть гипогликемических состояний поставили вопрос о целесообразности оперативного лечения. 15.01.19 г в возрасте 1 года 7 месяцев девочке проведена лапароскопическая субтотальная резекция поджелудочной железы (98 %).
После выписки из стационара в течение недели сохранялась эугликемия, затем на фоне интеркуррентного заболевания возобновились ежедневные гипогликемии до 1,3 ммоль/л, непостоянно сопровождавшиеся рвотой, слабостью, потерей сознания на фоне гипогликемии, потребовавших введения глюкагона.
В возрасте 1 г. 9 месяцев девочка повторно поступила в ФГБУ «НМИЦ эндокринологии» Минздрава России в связи с сохранявшимися персистирующими гипогликемиями, что послужило основанием для назначения октреотида в виде непрерывной подкожной инфузии 8 мкгр/час через помпу Medtronic Minimed 722. В последующем на фоне указанной терапии для коррекции подкожной инфузии октреотида ребенок неоднократно поступал в эндокринологическое отделением «НИИАП» ФГБОУ ВО РостГМУ МЗ РФ.
Таким образом, данный клинический случай представлен как пример орфанного тяжелого заболевания с крайне неблагоприятным фармакорезистентным течением и вероятностью ухудшения отдаленного прогноза. Необходимость освещения данной проблемы заключается в недостаточной осведомленности широкого круга педиатров, неонатологов, невропатологов, эндокринологов поликлинического звена и неспециализированных стационаров о клинических проявлениях, вариантах течения и сложностях терапии данной патологии. Это приводит к несвоевременной диагностике, осложненному течению с формированием непоправимых последствий.
В контексте с обсуждаемой проблемой необходимо повторно указать на важность своевременного выявлении гипогликемических состояний независимо от их этиологии и патогенеза. Поскольку между выраженной гипогликемией и тяжелым гипоксически-ишемическим поражением головного мозга может быть условно поставлен знак равенства в плане глубины церебральной патологии в неонатальном периоде. Это касается и персистирующих, и транзиторных гипогликемий. Поэтому следует обратить внимание на то, что на фоне крайне тяжелого течения представленного заболевания ребенок имел относительно удовлетворительное стато-моторное и нервно-психическое развитие. Возможно, в какой-то мере это обусловлено дебютом его не в раннем неонатальном периоде, а после первого года жизни. В то же время, логично предположение о своевременном выявлении и относительно адекватной коррекции гипогликемических состояний, чему, к сожалению, противоречит фармакорезистентное течение заболевания. Резюмируя представленный случай, хочется особенно обратить внимание, что при любой тяжести ВГИ своевременность диагностики и патогенетической коррекции, включая купирование гипогликемических состояний, определяют сохранение жизни ребенку и, что не менее значимо, ее качества.
Список литературы
1. Щедеркина И.О., Меликян М.А., Заваденко А.М., Козлова Е.В., Заваденко Н.Н. Неврологические пароксизмальные нарушения у детей с гипогликемиями на фоне врожденного гиперинсулинизма: полиморфизм клинических проявлений // Эпилепсия и пароксизмальные состояния. – 2015. – Т. 7, № 2. - С. 49-58. eLIBRARY ID: 24169991
2. Achoki R., Opiyo N., English M. Mini-review: Management of hypoglycaemia in children aged 0-59 months. // JTropPediatr. –2010. – V.56, № 4. – P. 227-234. https://doi.org/10.1093/tropej/fmp109
3. Boluyt N., van Kempen A., Offringa M. Neurodevelopment After Neonatal Hypoglycemia: A Systematic Review and Design of an Optimal Future Study. // Pediatrics.–2006. – V. 117, № 6. – P. 2231-2243. https://doi.org/10.1542/peds.2005-1919.
4. Иванов Д.О., ШабаловН.П., ПетренкоЮ.В. Диагностика и лечение гипогликемии новорожденных. Клинические рекомендации. - М; 2015.
5. Auer R.N., Siesjö B.K. Hypoglycaemia: brain neurochemistry and neuropathology. // Baillieres Clin Endocrinol Metab. – 1993. – V. 7, № 3. – P. 611-625. https://doi.org/10.1016/s0950-351x(05)80210-1.
6. Меликян М.А. Федеральные клинические рекомендации по диагностике, лечению и ведению детей и подростков с врожденным гиперинсулинизмом. // Проблемы эндокринологии. – 2014. – Т. 60, № 2. – С. 31-41. https://doi.org/10.14341/probl201460231-41
7. McQuarrie I. Idiopathic spontaneously occurring hypoglycemia in infants: clinical significance of problem and treatment. // AMA Am J Dis Child. – 1954. – V. 87. – P. 399-428. https://doi.org/10.1001/archpedi.1954.02050090387001.
8. De Leon D.D., Stanley C.A. Mechanisms of disease: advances in diagnosis and treatment of hyperinsulinism in neonates. // Nat Clin Pract Endocrinol Metab. – 2007. – V. 3. – P. 57-68. https://doi.org/10.1038/ncpendmet0368.
9. Cabezas O.R., Flanagan S.E., Stanescu H., García-Martínez E., Caswell R. et al. Polycystic Kidney Disease with Hyperinsulinemic Hypoglycemia Caused by a Promoter Mutation in Phosphomannomutase 2. // J Am SocNephrol. – 2017. – V. 28, № 8. – P. 2529-2539. https://doi.org/10.1681/asn.2016121312.
10. Меликян М.А., Карева М.А., Петряйкина Е.Е., Волков И.Э., Аверьянова Ю.В., и др. Врожденный гиперинсулинизм. Результаты молекулярно-генетических исследований в Российской популяции // Проблемы эндокринологии. – 2012. – Т. 58, № 2. - С.3-9. eLIBRARY ID: 21157203
11. Gubaeva D., Melikyan M., Vasiliev E., Petrov V., Tiulpakov A. Next Generation Sequencing Results in 142 Patients with Congenital Hyperinsulinism. // Horm Res Paediatr. 2018. – V.90(suppl 1):I–V. – P. 92.
12. Saint-Martin C., Arnoux J-B., de Lonlay P., BellanneChantelot C. KATP channel mutations in congenital hyperinsulinism. // Semin Pediatr Surg. – 2011. – V. 20, № 1. – P. 18-22. https://doi.org/10.1053/j.sempedsurg.2010.10.012
13. James C., Kapoor R.R., Ismail D. The genetic basis of congenital hyperinsulinism. // J Med Genet. – 2009. – V. 46. – P. 289-299. https://doi.org/10.1136/jmg.2008.064337.
14. Stanley C.A., Lieu Y.K., Hsu B.Y., Burlina A.B., Greenberg C.R.et al. Hyperinsulinism and hyperammonemia in infants with regulatory mutations of the glutamate dehydrogenase gene. // NEngl J Med. – 1998. – V. 338. – P. 1352-1357. https://doi.org/10.1056/nejm199805073381904.
15. González-Barroso M.M., Giurgea I., Bouillaud F., Anedda A., Bellanné-Chantelot C. et al. Mutations in UCP2 in congenital hyperinsulinism reveal a role for regulation of insulin secretion. // PLoS One. – 2008. – V. 3, № 12. – P. e3850. https://doi.org/10.1371/journal.pone.0003850
16. Treglia G., Mirk P., Giordano A., Rufini V. Diagnostic performance of fluorine-18-dihydroxyphenylalanine positron emission tomography in diagnosing and localizing the focal form of congenital hyperinsulinism: a meta-analysis. // PediatrRadiol. - 2012. – V. 42. – P. 1372-1379. https://doi.org/10.1007/s00247-012-2459-2
Об авторах
С. Б. БережанскаяСофья Борисовна Бережанская, доктор медицинских наук, профессор, главный научный сотрудник педиатрического отдела Научно-исследовательского института акушерства и педиатрии
Ростов-на-Дону
А. А. Афонин
Александр Алексеевич Афонин, доктор медицинских наук, профессор, главный научный сотрудник педиатрического отдела Научно-исследовательского института акушерства и педиатрии
Ростов-на-Дону
Е. А. Папшева
Елена Александровна Папшева, врач-педиатр педиатрического отделения № 2 Научно-исследовательского института акушерства и педиатрии
Ростов-на-Дону
Н. Н. Вострых
Россия
Наталья Николаевна Вострых, кандидат медицинских наук, заведующий педиатрическим отделением № 2 Научно-исследовательского института акушерства и педиатрии
Ростов-на-Дону
Г. А. Галкина
Галина Александровна Галкина, доктор медицинских наук, заведующий эндокринологическим отделением Научно-исследовательского института акушерства и педиатрии
Ростов-на-Дону
Д. И. Созаева
Диана Измаиловна Созаева, доктор медицинских наук, доцент, научный сотрудник педиатрического отдела Научно-исследовательского института акушерства и педиатрии
Ростов-на-Дону
Е. А. Лукьянова
Елена Анатольевна Лукьянова, кандидат медицинских наук, заведующий педиатрическим отделением № 1 Научно-исследовательского института акушерства и педиатрии
Ростов-на-Дону
Рецензия
Для цитирования:
Бережанская С.Б., Афонин А.А., Папшева Е.А., Вострых Н.Н., Галкина Г.А., Созаева Д.И., Лукьянова Е.А. Клинический cлучай врожденного гиперинсулинизма у ребенка раннего возраста. Медицинский вестник Юга России. 2020;11(3):54-59. https://doi.org/10.21886/2219-8075-2020-11-3-54-59
For citation:
Berezhansky S.B., Afonin A.A., Papsheva E.A., Vostrykh N.N., Galkina G.A., Sozaeva D.I., Lukyanova E.A. A clinical case of congenital hyperinsulinism in an early child. Medical Herald of the South of Russia. 2020;11(3):54-59. (In Russ.) https://doi.org/10.21886/2219-8075-2020-11-3-54-59







































