Перейти к:
Молекулярно-генетический анализ SARS-CoV-2 бессимтомных пациентов Ростовской области
https://doi.org/10.21886/2219-8075-2020-11-3-48-53
Аннотация
Цель: провести молекулярно-генетическую диагностику SARS-CoV-2 у бессимптомных индивидуумов Ростовской области.
Материал и методы: было обследовано 22037 индивидуумов, которые на момент сдачи материала не имели клинически выраженных симптомов респираторного заболевания COVID-19. Молекулрно-генетическая диагностика SARS-CoV-2 проводилась методами RT-PCR и изотерической амплификации с ручным и автоматическим выделением вирусной РНК.
Результаты: положительный результат был выявлен у 297 индивидуумов, подтверждён результат региональным референсным центром у 149 человек (0.68 %). Среди общей выборки было обследовано 3090 «контактных» пациентов (положительный результат — в 78 случаях (2.52 %)), 8109 медицинских работников (положительный результат – в 23 случаях (0.28 %)) и 3098 «контактных» медработников (положительный результат — в 24 случаях (0.77 %)).
Выводы: применение молекулярно-генетического тестирования SARS-CoV-2 для выявления асимптомных случаев имеет серьёзные ограничения, поэтому для данной диагностической задачи необходима разработка альтернативных методов лабораторной диагностики, основанной на особенностях этиопатогенеза новой коронавирусной инфекции.
Для цитирования:
Перевезенцев О.А., Холодная Т.О., Новикова Е.А., Самсонов А.Е., Бурцев Д.В. Молекулярно-генетический анализ SARS-CoV-2 бессимтомных пациентов Ростовской области. Медицинский вестник Юга России. 2020;11(3):48-53. https://doi.org/10.21886/2219-8075-2020-11-3-48-53
For citation:
Perevesentsev O.A., Cholodnaja T.O., Novikova E.A., Samsonov A.E., Burtsev, D.V. Molecular genetic analysis SARS-CoV-2 of asymptomatic patients in Rostov region. Medical Herald of the South of Russia. 2020;11(3):48-53. (In Russ.) https://doi.org/10.21886/2219-8075-2020-11-3-48-53
Введение
Коронавирусы (СoV) (Coronoviridae) — это семейство вирусов, содержащих в качестве генетического материала одноцепочечную (+) РНК, со специфическими гликопротеидными шипами (спайками) вокруг вирусного капсида, которые при электронном микрокопировании похожи на солнечную корону [1]. Семейство коронавирусов делится на несколько подсемейств, включающих четыре рода (от альфа- до дельта-), которые потенциально патогенны для различных видов млекопитающих, включая человека [2]. За последние 20 лет кроме ранее известных четырёх видов коронавирусов у человека, входящих в структуру сезонных ОРВИ, были описаны новые более патогенные виды данного семейства: SARS-CoV (подрод Sarbecovirus), описанный в 2002 г., который в 2002-2003 гг. стал причиной вспышки атипичной пневмонии (тяжелый острый респираторный синдром — ТОРС, SARS) в Китае; MERS-CoV (подрод Merbecovirus), который 2012 г. вызвал вспышку ближневосточного респираторного синдрома в Саудовской Аравии и в 2015 г. — в Южной Корее (MERS), и новый коронавирус SARSCoV-2 (как и вирус атипичной пневмонии, относящийся к подроду Sarbecovirus), который вызвал вспышку болезни, названной COVID19, в китайской провинции Ухань, перешедшей в настоящее время в глобальную пандемию1. Достаточно высокая степень передачи нового коронавируса (среднее медианное значение индекса репродукции — 2.2, разброс — 3.3-5.47), его способность, в отличие от вируса SARS-CoV, передаваться от человек к человеку и потенциальная тяжесть последствий заболевания СOVID-19, вызываемого данным вирусом, превратили его в главнейшую медицинскую проблему 2020 г. [1][3].
Изучение факторов патогенности коронавируса SARSCoV-2 показало, что в клетки человека он проникает через рецепторы к ангиотензин-превращающему ферменту 2-го типа (ACE2), который достаточно широко представлен в различных тканях: он экспрессируется в легких на уровне альвеол, кишечнике, гонадах, почках и т.д. [4]. Поэтому потенциально при новой коронавирусной инфекции могут поражаться не только дыхательные пути, но и другие ткани и органы [1][4][5]. С диагностической точки зрения, вирус может обнаруживаться не только в биоматериале из дыхательных путей (назофарингеальные соскобы, БАЛ, мокрота), но и в других биологических жидкостях (фекалии, моча, кровь) [1][4][6][7]. Теоретически он может обнаруживаться в моче и в семенной жидкости у мужчин [1].
В настоящее время специфическими методами диагностики новой коронавирусной инфекции SARS-CoV-2 являются молекулярно-генетические методы, в частности, в качестве референсного используется метод ПЦР в реальном времени с обратной транскрипцией вирусной РНК [8]. Базисным тестовым набором для ПЦР диагностики новой коронавирусной инфекции является рекомендованная ВОЗ тест-система, в котором используются праймеры к генам SARS-CoV РНК зависимой РНК полимеразы (RdRP) и капсидного белка (E), то есть данная тест-систем основана на детекции специфической РНК последовательности двух компонентов вируса [9]. Это связано с тем, что диагностические ПЦР-тест-системы, основанные на выявлении специфической последовательности только одного компонента SARS-CoV-2 (E-гена), хоть и являются более чувствительными, чем основанные на выявлении RdRp, но при использовании такого набора может быть затруднена интерпретация результата из-за высокой зависимости качества ПЦР от сторонних факторов2. Также для ПЦР диагностики в реальном времени новой коронавирусной инфекции могут применяться тест-системы, которые содержат праймеры к двум локусам вирусного нуклеокапсида (N1 и N2) и гену человеческой РНКазы P [8].
Из-за достаточно стремительного распространения нового коронавируса по миру особое значение приобретает максимально широкий охват данным молекулярно-генетическим тестированием населения различных стран для эффективного проведения противоэпидемических мероприятий и быстрое проведение тестирования [8]. Метод ПЦР в реальном времени является достаточно долгим и ограничен применением только в стационарной, хорошо оборудованной лаборатории. Поэтому для ускорения молекулярно-генетической диагностики SARS-CoV-2 был предложен другой метод, основанный на петлевой изотермическиой амплификации с обратной транскрипцией вирусной РНК (метод LAMP) [10]. В нем для детекции вирусной РНК используются 6 праймеров к генам orf1ab, S и N. Преимуществом данного метода является высокая скорость получения результата (до 30 мин.) и достаточно высокая чувствительность (80 копий/мл). Более высокая чувствительность метода LAMP может быть критически важна для выявления бессимптомных носителей SARS-CoV-2, а также пациентов в инкубационном периоде3. В настоящее время показано, что бессимптомные носители новой коронавируснойинфекции являются важнейшими участниками эпидемического процесса [11]. Некоторые исследования показывают, что вирусная нагрузка и вирусовыделение у полностью бессимптомных носителей новой коронавирусной инфекции сходно с больными COVID19, у которых есть симптомы заболевания [12]. Поэтому крайне важно оперативно выявлять таких индивидуумов методами молекулярной генетики [11][13].
Цель исследования — провести оценку выявляемости короновирусной инфекции SARS-CoV-2 у бессимптомных индивидуумов Ростовской области молекулярно-генетическими методами ПЦР в реальном времени и изотермической амплификации.
Материалы и методы
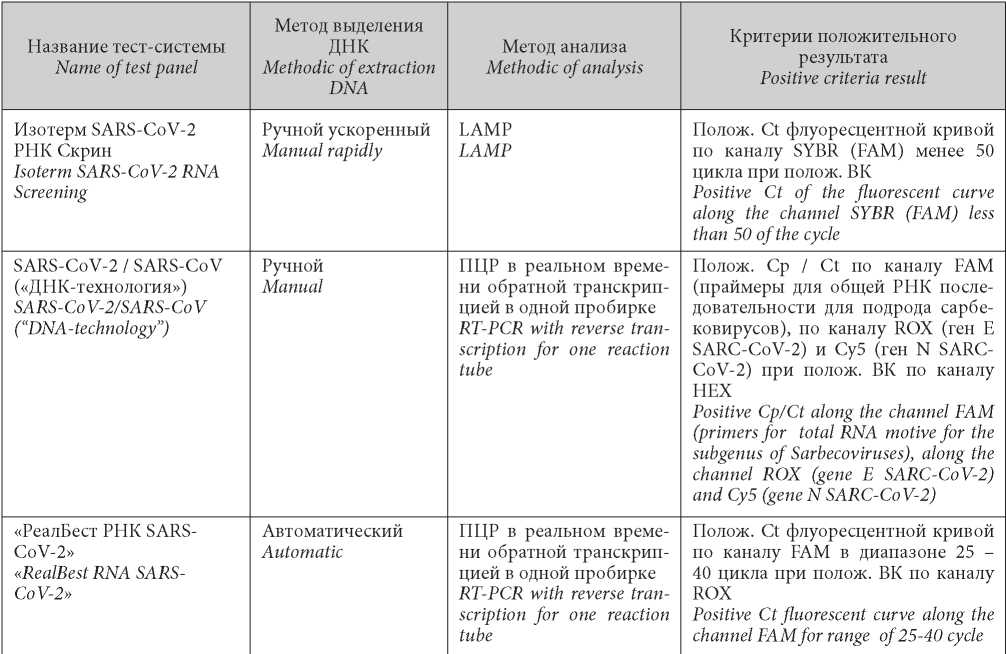
В ПЦР-отделе лаборатории клинической патоморфологии и молекулярно-биологических исследований ГАУ РО Областной консультативно-диагностический центр было протестировано на SARS-CoV-2 22037 индивидуумов, которые на момент сдачи материала не имели клинически выраженных симптомов респираторного заболевания COVID-19. Среди общей выборки было обследовано 3090 человек, контактировавших с больными COVID-19 (группа «контактных»), 8109 медицинских работников и 3098 «контактных» медработников. В качестве биоматериала использовались назальный и фарингеальный соскобы, зонды с которыми помещались в пробирку типа Eppendorf с транспортной средой для увеличения вирусной нагрузки. Молекулярно-генетическое качественное исследование проводилось методом ПЦР в реальном времени с обратной транскрипцией в одной пробирке с использованием тест-систем «РеалБест РНК SARS-CoV-2» (ООО «Вектор бест», Новосибирск) (заявленная чувствительность — 1000 копий/мл) с использованием автоматического выделения вирусной ДНК на платформе KingFisher Flex (Thermo Fisher Scientific) набором «РеалБест УниМаг», тест-системы для выявления РНК коронавирусов SARS-CoV-2 и подобных SARS-CoV (ООО «ДНК-технология», Москва) c ручным выделением вирусной РНК (заявленная аналитическая чувствительность — 500 копий/мл, используются праймеры к специфической последовательности генов E и N РНК SARSCoV-2), а также методом изотермической амплификации с использованием тест-системы Изотерм SARS-CoV-2 РНК Скрин (ООО «Дженериум», резидент Сколково, Владимирская обл.) (заявленная аналитическая чувствительность — 1000 копий/мл). Критерии положительного результата анализа для каждой из тест-систем представлены в табл. 1. При анализе использовался один положительный и один отрицательный контрольный образец. 95 % образцов было проанализировано двумя указанными выше тест-системами, основанными на RT-PCR. Положительные образцы отправлялись для подтверждения результата в референсную лабораторию регионального ФГБУЗ. Полученные результаты анализировались в программе Statictica 6.0.
Таблица / Table 1
Критерии положительного результата молекулярно-генетических тест-систем, использованных для специфической лабораторной диагностики инфекции SARS-CoV-2
Criteria for positive results of molecular genetic test systems, used for specific laboratory diagnostics of infection SARS-CoV-2
Результаты
В табл. 2 представлены обобщенные результаты молекулярно-генетического тестирования бессимптомных индивидуумов на новую коронавирусную инфекцию с выделением ряда подгрупп тестируемых.
В табл. 3 представлен сравнительный анализ положительных и подтверждённых референсным ФБУЗ результатов молекулярно-генетического анализа на COVID-19, выполненных на платформе двух различных тест-систем, основанных на методе ПЦР в реальном времени с обратной транскрипцией вирусной РНК.
Таблица / Table 2
Сводная таблица результатов молекулярно-генетического тестирования бессимптомных пациентов на инфекцию SARS-CoV-2
Summary table of molecular genetic testing asymptomatic patientsfor SARS-C0V-2 infection
|
Группа пациентов (% от общего числа) |
Общее кол-во |
Кол-во положительных результатов |
Кол-во потверж- дённых референсным ФГБУЗ |
Доля положити- тельного результатов (%) |
Доля ложноположительного результатов (%) |
|
Всего (100 %) |
22037 |
297 |
149 |
0,68 |
49,8 |
|
«Контактные» (14 %) |
3090 |
172 |
78 |
2,52 |
54,7 |
|
Медицинские работники (36,8 %) |
8109 |
38 |
23 |
0,28 |
39,4 |
|
«Контактные» медицинские работники (14 %) |
3098 |
38 |
24 |
0,77 |
36,8 |
Таблица / Table 3
Сравнение положительных и подтвержденных рефересным ФБУЗ результатов молекулярно-генетического тестирования на SARS-C.V-2, выполненных на платформе двух тест-систем методом RT-PCR Comparison ofpositive and verified by reference centre molecular genetics results of SARS-CoV-2, made on the platform of two test systems by RT-PCR method
|
Тест-система |
Количество положительных результатов |
Количество подтверждённых ФБУЗ результатов |
% подтверждённых результатов от общего кол-ва тестов |
% ложноположительных результатов |
|
SARS-CoV-2 / SARS-CoV («ДНК-технология») (ручное выделение) |
126 |
68 (до 18.05) |
0,31 |
46,0 |
|
«РеалБест РНК SARS-CoV-2» (автоматическое выделение) |
171 |
81 (до 18.05) |
0,37 |
52,6 |
Обсуждение
Согласно результатам данного исследования, в общей когорте бессимптомных индивидуумов количество выявленных случаев инфекции SARS-CoV-2 составляет всего 0.68 %. Среди общей популяции на порядок выше величина инфицирования среди лиц, которые находились в контакте с заболевшими COVID-19 (2,52 %). Среди медицинских работников уровень инфицируемости составляет 0,28 %, что ниже средних значений, но среди медиков, которые контактируют с больными и инфицированными новой коронавирусной инфекцией, уровень выявленных случаев SARSCoV-2 несколько выше (0,77 %), чем среднее значение.
Таким образом, в выборке лиц, не имеющих симптомов новой коронавирусной инфекции, в том числе и из групп риска, наблюдается достаточно низкое значение положительных результатов молекулярно-генетической диагностики на SARS-CoV-2. Причин этому может быть несколько. Первой из них является действительное отсутствие инфицирования у таких лиц. Видно, что в группе «контактных» индивидуумов выявляемость вируса на порядок выше,чем общей группе, что подтверждает нахождение такихлюдей в группе риска. Но даже в этой подгруппе процент положительных результатов не такой высокий, как можнобыло прогнозировать. Известно, что лабораторного коронавирусной инфекции должны применяться только длярешения определённых диагностических задач [9]. Такжеважным является специфичность и чувствительность тест-системы. Если принять за репликации SARS-CoV-2 в зависимости от стадии заболевания и тяжести его протекания ПЦР-тесты с низкой чувствительностью подойдут для тестирования симптоматических пациентов, но у асимптомных индивидуумов могут дать ложноотрицательный результат. Как показано выше, нижняя граница чувствительности использованы диагностических тест-систем составляет 500 копий/мл, что может быть недостаточным для выявления бессимптомных носителей, у которых может быть уровень репликации вируса [9][10]. Ряд авторов указывает на то, что для эффективного скрининга носителей SARS-CoV-2 или для выявления лиц в инкубационном периоде существующие молекулярно-генетические тест-достаточно невысокую диагностическую значимость [9]. И если для выявления вирусной инфекции у пациентов с симптомами COVID-19 метод RT-PCR является референсным и весьма эффективным, то для выявления асимптомного инфицирования его возможности сильно ограничены. Следует отметить, что и иммунологические методы лабораторной бессимптомного носительства новой коронавирусной инфекции также мало подходят для решения данной диагностической задачи, так как основная цель таких тестов — эпидемиологическое наблюдение и индивидуального и коллективного иммунитета к SARS-CoV-2 [9][14].
Что касательно высокого процента ложно-положительны результатов, которые показаны в настоящем исследовании, то одним из объяснений этого может быть ложное срабатыванием молекулярно-генетических тест-систем на другие виды сезонных коронавирусов, которые уже давно циркулируют в человеческой популяции. В настоящее время четкие причины высокого процента результатов такого рода выявить сложно, учитывая то, что в коммерческих тест-системах дизайн использованных праймеров в открытой печати не публикуется.
Заключение
Несмотря на активное развитие в настоящее время методов специфической лабораторной диагностики новой коронавирусной инфекции остаётся немало сложностей для выявления бессимтомных носителей SARS-CoV-2. До конца не изучена стадийность репликации и вирусовыделения SARS-CoV-2 при бессимптомном носительстве, что также усложняет точное выявление новой коронавирусной инфекции. Поэтому на данный момент необходима разработка тестов для выявления бессимптомных SARS-CoV, которые базировались бы не только свойствах этиологического агента, но и на особенностях патогенеза данной инфекции, что должно повысить их чувствительность, специфичность и диагностическую значимость. Примером таких тестов может служить созданная американским учеными лабораторная диагностическая тест-система, основанная на технологии генетического редактирования CRISPR-Cas 12 [15]. Разработка таких тестов может сыграть решающую роль в выявлении асимптомных носителей заболевания и позволит уточнить особенности его этиопатогенеза и в конечном итоге взять под полный контроль развитие эпидемического процесса [16].
Финансирование. За счёт ГАУ РО Областной консультативно-диагностический центр.
Financing. At the cost Regional consulting and diagnostic center, Rostov-on-Don.
Конфликт интересов. Авторы заявляют об отсутствииконфликта интересов.
Conflict of interest. Authors declares no conflict of interest.
1. Center for Systems Science and Engineering (2020) CoronavirusCOVID-19 global cases. Johns Hopkins University. Accessed 3 Apr 2020. https://coronavirus.jhu.edu/map.html
2. Centers for Disease Control and Pevention. Interim Guidelines for Collecting, Handling, and Testing Clinical Specimens from Persons for Coronavirus Disease 2019 (COVID-19). https://www.cdc.gov/coronavirus/2019-nCoV/lab/guidelines-clinical-specimens%20html
3. FIND. COVID-19 Diagnostics Resource Centre. http://www.finddx.org/covid-19/
Список литературы
1. Paoli D, Pallotti F, Colangelo S, Basilico F, Mazzuti L, Turriziani O, et al. Study of SARS-CoV-2 in semen and urine samples of a volunteer with positive naso-pharyngeal swab. // J Endocrinol Invest. – 2020. – V.23. – P.1–4. https://doi.org/10.1007/s40618-020-01261-1
2. Ashour HM, Elkhatib WF, Rahman MM, Elshabrawy HA. Insights into the Recent 2019 Novel Coronavirus (SARSCoV-2) in Light of Past Human Coronavirus Outbreaks. // Pathogens. – 2020. – V.9(3). – P.186. https://doi.org/10.3390/pathogens9030186
3. Cascella M, Rajnik M, Cuomo A, Dulebohn SC, Di Napoli R. Features, Evaluation, and Treatment of Coronavirus (COVID-19) [Updated 2020 Aug 10]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK554776/
4. Chen Y, Guo Y, Pan Y, Zhao ZJ. Structure analysis of the receptor binding of 2019-nCoV. // Biochemical and Biophysical Research Communications. – 2020. – V.525, Is.1. – P. 135-140. https://doi.org/10.1016/j.bbrc.2020.02.071.
5. Corman VM, Landt O, Kaiser M, Molenkamp R, Meijer A, Chu DK, et al. Detection of 2019 novel coronavirus (2019- nCoV) by real-time RT-PCR. // Euro Surveill. – 2020. – V.25(3). -2000045. https://doi.org/10.2807/1560-7917.ES.2020.25.3.2000045.
6. Xie C, Jiang L, Huang G, Pu H, Gong B, Lin H, et al. Comparison of different samples for 2019 novel coronavirus detection by nucleic acid amplification tests. // Int J Infect Dis. – 2020. – V.93. – P.264-267. https://doi.org/10.1016/j.ijid.2020.02.050.
7. Peng X, Xu X, Li Y, Cheng L, Zhou X, Ren B. Transmission routes of 2019-nCoV and controls in dental practice. // International Journal of Oral Science. – 2020. – V.12(1). https://doi.org/10.1038/s41368-020-0075-9
8. Cheng MP, Papenburg J, Desjardins M, Kanjilal S, Quach C, Libman M, et al. Diagnostic Testing for Severe Acute Respiratory Syndrome–Related Coronavirus-2. A Narrative Review. // Ann Intern Med. – 2020. – V. 172(11). – P. 726-734. https://doi.org/10.7326/M20-1301.
9. Wang W, Xu Y, Gao R, Lu R, Han K, et al. Detection of SARSCoV-2 in Different Types of Clinical Specimens. // JAMA. – 2020. – V. 323(18). – P.1843–4. https://doi.org/10.1001/jama.2020.3786.
10. Huang WE, Lim B, Hsu C, Xiong D, Wu W, Yu Y, et al. RTLAMP for rapid diagnosis of coronavirus SARS‐CoV‐2. // Microbial Biotechnology. – 2020. – V.13(4). – P. 950-961. https://doi.org/10.1111/1751-7915.13586
11. Lai CC, Liu YH, Wang CY, Wang YH, Hsueh SC, et al. Asymptomatic carrier state, acute respiratory disease, and pneumonia due to severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2): Facts and myths. // J Microbiol Immunol Infect. – 2020. – V.53(3). – P.404-412. https://doi.org/10.1016/j.jmii.2020.02.012
12. Zou L, Ruan F, Huang M, Liang L, Huang H, et al. SARSCoV-2 Viral Load in Upper Respiratory Specimens of Infected Patients. N // Engl J Med. – 2020. – V. 382(12). – P.1177- 1179. https://doi.org/10.1056/NEJMc2001737.
13. Lippi G, Sanchis-Gomar F, Henry BM. Coronavirus disease 2019 (COVID-19): the portrait of a perfect storm. // Annals of Translational Medicine. – 2020. – V.8(7). – P.497–497. https://doi.org/10.21037/atm.2020.03.157
14. Guo L, Ren L, Yang S, Xiao M, Chang D, et al. Profiling Early Humoral Response to Diagnose Novel Coronavirus Disease (COVID-19). // Clin Infect Dis. – 2020. – V. 71(15). – P. 778- 785. https://doi.org/10.1093/cid/ciaa310.
15. Broughton JP, Deng X, Yu G, Fasching CL, Servellita V, Singh J, et al. CRISPR-Cas12-based detection of SARS-CoV-2. // Nat Biotechnol. – 2020. – V. 38(7). – P. 870-874. https://doi.org/10.1038/s41587-020-0513-4.
16. Бурцев Д.В., Аванян Н.Л., Кипайкин В.А., Скрипец Н.В. О системе эпидемиологической безопасности в областном консультативно-диагностическом центре. // Инфекция и иммунитет. - 2017. - № S. - С. 113. eLIBRARY ID: 35379622
Об авторах
О. А. ПеревезенцевРоссия
Перевезенцев Олег Александрович, кандидат медицинских наук, ассистент кафедры персонализированной и трансляционной медицины
Ростов-на-Дону
Т. О. Холодная
Россия
Холодная Татьяна Олеговна, кандидат медицинских наук, ассистент кафедры персонализированной и трансляционной медицины
Ростов-на-Дону
Е. А. Новикова
Россия
Новикова Екатерина Александровна, ассистент кафедры персонализированной и трансляционной медицины
Ростов-на-Дону
А. Е. Самсонов
Россия
Самсонов Андрей Евгеньевич, доцент кафедры персонализированной и трансляционной медицины
Ростов-на-Дону
Д. В. Бурцев
Россия
Бурцев Дмитрий Владимирович, доктор медицинских наук, доцент, заведующий кафедрой персонализированной и трансляционной медицины
Ростов-на-Дону
Рецензия
Для цитирования:
Перевезенцев О.А., Холодная Т.О., Новикова Е.А., Самсонов А.Е., Бурцев Д.В. Молекулярно-генетический анализ SARS-CoV-2 бессимтомных пациентов Ростовской области. Медицинский вестник Юга России. 2020;11(3):48-53. https://doi.org/10.21886/2219-8075-2020-11-3-48-53
For citation:
Perevesentsev O.A., Cholodnaja T.O., Novikova E.A., Samsonov A.E., Burtsev, D.V. Molecular genetic analysis SARS-CoV-2 of asymptomatic patients in Rostov region. Medical Herald of the South of Russia. 2020;11(3):48-53. (In Russ.) https://doi.org/10.21886/2219-8075-2020-11-3-48-53







































