Перейти к:
Особенности протеомного профиля сыворотки крови детей с бронхиальной астмой, перенесших перинатальное поражение центральной нервной системы
https://doi.org/10.21886/2219-8075-2019-10-4-59-65
Аннотация
Цель: протеомный анализ сыворотки крови детей с бронхиальной астмой (БА), имеющих в анамнезе указание на патологию перинатального периода.
Материалы и методы: проведено комплексное обследование детей, страдающих БА, и пациентов контрольной группы с использованием протеомного анализа сыворотки крови. Протеомный анализ сыворотки крови осуществляли с помощью двумерного высокоразрешающего гель-электрофореза с последующей окраской гелей флуоресцентным красителем и времяпролетной MALDI-масс-спектрометрии. Белки идентифицировали с использованием алгоритма анализа пептидного фингерпринта Mascot MS и белковой базы данных Swiss-Prot.
Результаты: сравнительный анализ протеомного профиля сыворотки крови детей, перенесших патологию ЦНС в перинатальным периоде и с развившейся в последующем БА, и пациентов контрольной группы позволил установить, что продукция ряда белков снижена при указанной патологии. Были идентифицированы белки в диапазоне молекулярных масс 16-33 кДа (p<0,05): глутатионпероксидаза 3, транстиретин, а также компоненты системы комплимента С4B и С3.
Заключение: модификация продукции данных белков свидетельствует о наличии повреждений на молекулярном уровне, приводящих к метаболическим и функциональным нарушениям в организме больного БА, имеющего в анамнезе указание на патологию перинатального периода.
Ключевые слова
Для цитирования:
Лебеденко А.А., Афонин А.А., Логинова И.Г., Семерник О.Е., Гунько В.О., Аллилуев И.А., Ларичкин А.В. Особенности протеомного профиля сыворотки крови детей с бронхиальной астмой, перенесших перинатальное поражение центральной нервной системы. Медицинский вестник Юга России. 2019;10(4):59-65. https://doi.org/10.21886/2219-8075-2019-10-4-59-65
For citation:
Lebedenko A.A., Afonin A.A., Loginova I.G., Semernik O.E., Gunko V.O., Alliluev I.A., Larichkin A.V. Features of proteomic profi le of blood serum of children with bronchial asthma who underwent perinatal central nervous system damage. Medical Herald of the South of Russia. 2019;10(4):59-65. (In Russ.) https://doi.org/10.21886/2219-8075-2019-10-4-59-65
Введение
В последние годы уделяется большое внимание изучению состояния здоровья детей, перенесших перинатальное поражение ЦНС. По данным современной литературы, новорожденные, перенесшие гипоксию-ишемию в перинатальном периоде, в последующие периоды детства имеют неврологический дефицит различной степени тяжести в виде задержки нервно-психического и двигательного развития, минимальных дисфункций мозга, нарушений социальной адаптации, детского церебрального паралича, эпилепсии [1][2]. В то же время, у детей и подростков с последствиями перинатального поражения ЦНС часто имеются функциональные изменения со стороны разных органов и систем [3]. В качестве сопутствующих состояний отмечаются заболевания гепатобилиарной системы, желудочно-кишечного тракта, сердечно-сосудистой, иммунной систем. В последнее время особое внимание уделяется патологии бронхолегочной системы, в том числе такому тяжелому хроническому заболеванию как бронхиальная астма. Доказано, что перинатальные повреждения способствуют частому развитию бронхиальной обструкции у детей первых лет жизни [4]. Однако, для того чтобы полностью раскрыть патогенетические механизмы формирования БА у детей, необходимо комплексное обследование с применением современных методов диагностики.
Цель исследования — протеомный анализ сыворотки крови детей с БА, имеющих в анамнезе указание на патологию центральной нервной системы в перинатальном периоде.
Материалы и методы
Для реализации поставленной цели на базе педиатрического отделения клиники Ростовского государственного медицинского университета были обследованы 124 пациента с установленным диагнозом БА. Диагноз БА был верифицирован согласно Национальной программе «Бронхиальная астма у детей. Стратегия лечения и профилактика», 2017 [5]. Из числа обследованных пациентов были выбраны дети со среднетяжелым и тяжелым течением заболевания, имеющие указание в анамнезе на перенесенную патологию ЦНС перинатального периода. Контрольную группу составили пациенты I и На групп здоровья, сопоставимые по полу и возрасту с основной выборкой обследованных больных. Средний возраст детей составил 11,0 ± 0,73 лет.
Критерии включения: наличие подтверждённого диагноза БА, поставленного не ранее чем за 6 месяцев до обследования пациентов; наличие в анамнезе патологии перинатального периода, отсутствие сопутствующих хронических заболеваний со стороны других органов и систем.
Критерии исключения: больные с неуточнённым диагнозом БА; больные БА с другими хроническими и острыми заболеваниями легких (туберкулёз, острый трахеобронхит, пневмония и др.); возраст пациентов больше 18 лет.
Всем пациентам проведено комплексное клинико-лабораторное исследование, включающее сбор анамнестических данных, физикальный осмотр, определение общего и аллергенспецифических IgE, а также исследование функции внешнего дыхания с применением пикфлоуметрии, спирографии и бодиплетизмографии. Все исследования выполнены по стандартным методикам.
В группе больных БА с патологией перинатального периода также проведено протеомное исследование сыворотки крови. Материалом для исследования служила сыворотка крови, аликвоты которой хранили в присутствии коктейля ингибиторов протеаз (Thermo Fisher Scientific, США) при -86 °С до проведения исследования. Обеднение сыворотки (удаление альбумина и иммуноглобулина G) проводили с использованием коммерческих наборов Aurum Serum Protein Mini Kit (Bio-Rad, США) согласно протоколу фирмы производителя. Затем обедненные образцы концентрировали и обессоливали на пористых фильтрах Amicon Ultra 10кДа (Millipore, США).
Фракционирование белков сыворотки проводили методом двумерного электрофореза (2Д-ЭФ) в полиакриламидном геле [6]. Первое направление 2Д-ЭФ — изоэлектрофокусирование — осуществляли с использованием иммобилиновых стрипов с градиентом рН = 3-10 (ReadyStripIPGStrips, «Bio-Rad», США) на приборе Protein IEF Cell («Bio-Rad», США). Второе направление электрофореза (вертикальный ДДС-Na-электрофорез в 12,5 % ПААГ) проводили в камере Protean II xi Multi-Cell («Bio-Rad», США) при силе тока 10 mA на гель в течение 18 часов. Для визуализации белковых пятен в гелях (после завершения 2-ого направления 2Д-ЭФ), электро- фореграммы окрашивали флуоресцентным красителем Flamingo («Bio-Rad», США) согласно протоколу производителя, сканировали на приборе ChemidocMP (Bio-Rad, США) и сохраняли в TIFF-формате. Анализ гелей, включающий сопоставление пятен на электрофореграммах, полученных из разных образцов, проводился с помощью специальной программы компьютерного анализа изображений PDQuest версии 8.0.1. (Bio-Rad, США).
Белковые пятна, представлявшие интерес, вырезали из геля, подвергали трипсинолизу согласно методике [7] и смешивали с матрицей. В качестве матрицы использовалась 2,5-дигидроксибензойная кислота (Bruker, Германия). Масс-спектры триптических гидролизатов белков были получены на MALDI-TOF-масс-спектрометре Microflex LRF (Bruker Daltonics, Германия). Для получения и анализа масс-спектров использовали программы FlexControl версии 3.4 и FlexAnalysis версии 3.4 (Bruker Daltonics, Германия). Для идентификации белков использовали программу BioTools версии 3.2 (Bruker Daltonics, Германия). По масс-листу каждого белкового пятна производился поиск по базе данных Swiss-Prot (2013_12) с использованием локальной версии программы Mascot Search 2.4.1 (Matrix Science, США).
После вырезания белкового пятна из геля и процедуры трипсинолиза идентификацию белков проводили методом MALDI-TOF-масс-спектрометрии [7]. Масс-спектры триптических пептидов получали на масс-спектрометре Autoflex II («Bruker Daltonics», Германия) и анализировали с использованием опции Peptide Fingerprint программы Mascot MS Search (Matrix Science, США) и баз данных
NCBI и Swiss-Prot, принимая точность определения массы ионов равной 0,01 %. Результаты идентификации белков принимались как достоверные при уровне значимости не менее 95 % и показателе сиквенс-покрытия не менее 60 %. Сравнительный анализ протеомных карт осуществляли по виртуальным интегрированным «мастер-гелям» двумерных электрофореграмм амниотической жидкости (программа PDQuest, «Bio-Rad», США).
Статистическую обработку данных осуществляли с помощью лицензионного пакета программ Statistica (версия 6.0. фирмы StatSoft. Inc.). Для оценки статистической значимости различий между сравниваемыми группами использовали критерий Стьюдента (t-критерий) и c 2-критерий (для таблиц 2х2 — в точном решении Фишера). Достоверными считались различия при p < 0,05.
Результаты
Сравнительный анализ протеомного профиля сыворотки крови больных в анамнезе имевших перинатальное поражение ЦНС, страдающих БА, и пациентов контрольной группы позволил установить, что продукция ряда белков снижена при указанной патологии, среди которых были идентифицированы белки в диапазоне молекулярных масс 16-33 кДа (p<0,05): глутатионпероксидаза 3 (GPX3), транстиретин (TTHY), а также компоненты системы комплимента С4B (CO4B) и С3 (CO3) [см. табл. 1].
Таблица / Table 1
Дифференциально-экспрессирующие белки сыворотки крови детей, страдающих бронхиальной астмой, имевших в анамнезе патологию перинатального периода
Differential-expressing serum proteins of children suffering from bronchial asthma having a history
of the perinatal period pathology
Название белка Protein names | № в Swiss-Prot № Swiss-Prot | Mm, кДа Mass (Da) | БА Asthma | Название гена Gene names | Цитогенетическая локация Cytogenetic location | Локализация Location | Молекулярная функция Molecular function | Биологический процесс Biological process |
|---|---|---|---|---|---|---|---|---|
GPX3 | P22352 | 25,8 | ↓ | GPX3 | 5q33.1 | Секрети- руемый Secreted | Пероксидазная активность Glutathione peroxidase activity | Клеточный ответ на окислительный стресс Secreted |
TTHY | P02766 | 16 | ↓ | TTR | 18q12.1 | Секрети- руемый Secreted | Белок-переносчик Protein-carrier | Обмен/перенос лигандов Ligand exchange/ transfer |
CO4-b | P0C0L5 | 32,6 | ↓ | C4B | 6p21.33 | Секрети- руемый Secreted | Компонент комплемента Component of complement | Активация системы комплемента Complement system activation |
СО3 | P01024 | 23 | ↓ | C3 | 19p13.3 | Секрети- руемый Secreted | Компонент комплемента Component of complement | Активация системы комплемента Complement system activation |
Примечание: ↓ — снижение экспрессии белка, Mm-молекулярная масса.
Note: ↓ — decrease of protein expression, Mm-molecular weight.
Обсуждение
Глутатионпероксидаза 3 (GPx3) или плазматическая глутатионпероксидаза — внеклеточный тетра- мерный Se-содержащий фермент. GPx3 восстанавливает перекись водорода до воды путем окисления глутатиона [8]. Кроме того, в отличие от каталазы, действие которой она дополняет, GPx3 способна обезвреживать в присутствии глутатиона также органические гидропероксиды, а именно перекиси липидов, образующиеся в результате воздействия свободных радикалов на полиненасыщенные липидные мембраны и продукты реакции, катализируемой липооксигеназой [8]. Кроме того, еще одним косубстратом для глутатионпероксидазы, как было показано, является S-нитрозоглутатион (GSNO), в результате реакции происходит высвобождение оксида азота [8]. S-нитрозоглутатион, в свою очередь, индуцирует экспрессию гена GPx3, в то время как сверхэкспрессия суперокисддисмутазы предотвращает ее индукцию [8].
На долю GPx3 приходится почти 50 % от активности всех глутатионпероксидаз в лёгочной ткани и бронхах [9], что особенно важно, так как дыхательная система в силу своих структурных и физиологических особенностей подвергается множеству внутренних и внешних воздействий, приводящих к избыточной генерации активных форм кислорода (АФК) [10]. GPx3 необходима для удаления токсичных продуктов окисления липидов и H2O2, которые непрерывно генерируются в результате секвестрации и инфильтрации лейкоцитов в легких.
Проведенный протеомный анализ показал, что у всех больных БА отмечается снижение экспрессии данного белка в сыворотке крови по сравнению со здоровыми детьми (см. рис. 1). Причем полученные нами результаты согласуются с данным зарубежных исследователей. Так, в работе Youness E.R. и соавт. было показано, что у больных БА отмечается значимое снижение уровня GPx3 в сыворотке крови. При этом у больных с тяжелым течением ее значения гораздо меньше, чем у пациентов со среднетяжелым и легким течением [11]. В исследованиях, проведенных на пациентах с БА, проживающих в Тунисе также было показано значительное снижение уровня GPX3 активности в сыворотке крови [12]. Аналогичные данные получены у больных БА, проживающих в Египте [13]. Причем показано, что чем тяжелее течение заболевания, тем ниже концентрация данного фермента в сыворотке крови: при легкой БА — 27.95 ± 4.77 mU/mL, тогда как при среднетяжелом течении заболевания — 6.03 ± 0.90 mL.
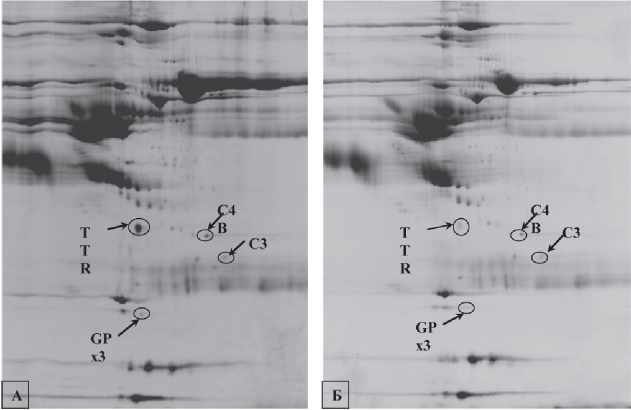
Рисунок 1. Протеомные карты сыворотки крови детей контрольной (А) и основной групп (Б).
Примечание: сокращенные названия белков соответствуют таблице.
Figure 1. Serum proteomic maps of children of control (A) and main groups (B).
Note: abbreviated protein names correspond to the table.
Снижение экспрессии глатионпероксидазы 3 у пациентов основной группы, очевидно, свидетельствует об истощении антиоксидантной защиты, что создает условия для дисбаланса в системе «оксиданты-антиоксиданты» и инициируют развитие окислительного стресса, одного из ключевых механизмов возникновения БА, а также может приводить к вторичным патологическим изменениям дыхательных путей и лёгочной ткани на фоне уже сформировавшегося заболевания.
Идентифицированный нами транстиретин (TTHY) — тетрамерный белок, синтезируемый, в основном, в печени, которая служит основным его источником в сыворотке, и сосудистом сплетении мозга. Он осуществляющий транспорт тироксина, а также витамина А (ретинола) посредством связывания с ретинол-связывающим белком (RBP) [14]. Помимо транспортной активности, установлено, что транстиретин является протеазой [14]. Установлено, что экспрессия печеночного TTHY подавляется, и, следовательно, уровень этого белка в сыворотке резко снижается во время острофазного ответа — процесса, характеризующегося быстрым перепрограммированием экспрессии генов и метаболизма в ответ на передачу сигналов воспалительных цитокинов [15].
Снижение продукции TTHY приводит к нарушению транспорта ретинола —биологически активной форме витамина А, избыток которого накапливается именно в легочной ткани, приводя к образованию ретиноидных метаболитов (ретиноидов). Накопление последних в легочной паренхиме приводит к возрастанию в крови содержания аутоантигенов, усиливается фагоцитоз и межклеточные кооперации, пролиферация и функциональная активность лимфоцитов и полиморфонуклеаров, кроме того активируется хемотаксис и фагоцитарная активность нейтрофильных лейкоцитов, а также выброс ими лизосомных ферментов. Также ретиноиды способствуют дифференциров- ке эпителиальных клеток по мукоидному типу, а образующиеся в результате этого мукоциты интенсивнее секретируют слизь, что клинически проявляется значительным нарушением бронхиальной проходимости у больных БА и является одним из компонентов бронхиальной обструкции (ноздрин).
В результате проведенного протеомного анализа сыворотки крови пациентов было установлено снижение концентрации данного белка у пациентов основной группы, по сравнению с контрольной. Аналогичные результаты были получены в рамках зарубежных исследований [16]. Причем снижение уровня TTHY также было зарегистрировано в жидкости, полученной при бронхоальвеолярном лаваже, у больных с легкой, среднетяжелой и тяжелой БА [17].
Изменение концентрации транстиретина в сыворотке крови у детей, перенесших в анамнезе перинатальное поражение ЦНС, свидетельствует о наличии нарушений в системе иммунного ответа на молекулярном уровне и объясняет с точки зрения протеомных исследований почему у детей с симптомами экзогенных нарушений развития нервной системы отмечаются значительные изменения как со стороны клеточного, так и гуморального иммунитета, способствующие развитию бронхолегочной патологии [18].
Снижение уровня в сыворотке крови у детей основной группы установлено еще для двух белков — компонентов системы комплемента С3 и С4b — белков острой фазы, концентрация которых значительно изменяется во время воспаления и повреждения тканей. С3 участвует в классическом и альтернативном путях активации системы комплемента, С4 — только в классическом пути. Помимо их хемотаксической роли, они вызывают сокращение гладкой мускулатуры, повышают гиперреактивность дыхательных путей и проницаемость сосудов, а также регулируют расширение сосудов в легких [19]. С3 и С4 фракции стимулируют высвобождение гистамина из базофилов и тучных клеток, а также регулируют синтез эозинофильного катионного белка и адгезию эозинофилов к эндотелиальным клеткам, что имеет важное значение в патогенезе БА. Одновременное снижение фракции С3 и С4b компонента связано с их потреблением и указывает на большее участие классического пути, по сравнению с альтернативным путем каскада активации комплемента при БА. Кроме того, сверхактивированный каскад комплемента играет ключевую роль в качестве эффекторов клеточно-опосредованной и гуморальной иммунной системы при повреждении легочной ткани в патогенезе астмы. Результаты наших исследований согласуются с данными авторов, которые также показали снижения концентрации 4-й фракции комплимента у больных неатопической астмой [16].
Принимая во внимание тот факт, что перенесенная ребенком перинатальная гипоксия может привести не только к повреждению нервной системы, но и способствовать нарушению становления и развития иммунной системы у детей старшего возраста и формированию бронхолегочной патологии в будущем. Гипоксия «запускает» механизмы системного воспалительного ответа сначала в локальной зоне, а затем в других органах- «мишенях», что приводит к нарушению барьерных функций, иммунной дезадаптации [20][21]. Таким образом, можно предположить, что снижение концентрации С3 и С4 фракций комплимента у обследованных детей является последствием перенесенных ранее перинатальных поражений ЦНС.
Заключение
Проведенный протеомный анализ сыворотки крови больных БА, имеющих в анамнезе указание на перинатальное поражение ЦНС, выявил несколько дифференцированно выраженных белков по сравнению со здоровыми детьми. Модификация продукции данных белков свидетельствует о наличии повреждений на молекулярном уровне возникших, возможно, в перинатальном периоде, приводящих к метаболическим и функциональным нарушениям в организме больного, страдающего БА. А полученные в ходе данного исследования особенности протеомного спектра у детей с патологией бронхолегочной системы расширяют представления о молекулярных аспектах патогенеза БА, что обеспечит новые возможности для диагностики и терапии этого заболевания у детей.
Список литературы
1. Трепилец С.В., Голосная Г.С., Трепилец В.М., Кукушкин Е.И. Гипоксически-геморрагические поражения мозга у новорожденных: значения определения нейрохимических маркеров, маркеров воспаления и апоптоза в неонатальном периоде и результаты катамнестического наблюдения. // Педиатрия. – 2018. – Т.97. - №1 – С. 31-37.
2. Красноруцкая О.Н., Леднева В.С. Клинико-биохимические показатели в диагностике нарушения развития детей с последствиями перинатального поражения нервной системы. // Педиатрия. – 2018. - Т.97. - №3 – С. 175- 179.
3. Шниткова Е.В., Философова М.С., Чемоданов В.В., Соколова С.В., Пронина И.И., Балдаев А.А. Особенности онтогенетического развития детей, перенесших перинатальную гипоксию. // Вестник Ивановской медицинской академии. – 2007. - Т.12. - № 3-4 – С. 194-195.
4. Павленко В.А., Мельникова И.М., Мизерницкий Ю.Л. Прогностическое значение функциональных показателей дыхательной системы и вегетативной нервной системы у детей раннего возраста, перенесших острый обструктивный бронхит на фоне перинатального поражения центральной нервной системы. // Вопросы практической педиатрии. – 2015. – Т.10. - №1 – С. 7-14.
5. Национальная программа «Бронхиальная астма у детей. Стратегия лечения и профилактика» 5-е изд., испр. и доп. − М.: Изд. дом «Атмосфера». – 2017.
6. Görg A., Boguth G., Obermaier C., Posch A., Weiss W. Two-dimensional polyacrylamide gel electrophoresis with immobilized pH gradients in the fi rst dimension (IPG-Dalt): the state of the art and the controversy of vertical versus horizontal systems. // Electrophoresis. – 1995. – V.16. - P.1079- 1086. DOI: 10.1002/elps.11501601183
7. Shevchenko A., Wilm M., Vorm O., Mann M. Mass spectrometric sequencing of proteins from silver stained polyacrylamide gels. // Anal Chem. – 1996. – V.68. – P.850-858. DOI: 10.1021/ac950914h
8. Comhair SA, Erzurum SC. Redox control of asthma: molecular mechanisms and therapeutic opportunities. Antioxid Redox Signal. 2010;12(1): 93-124. doi: 10.1089/ARS.2008.2425.
9. Полоников А.В., Иванов В.П., Богомазов А.Д., Солодилова М.А. Генетико-биохимические механизмы вовлеченности ферментов антиоксидантной системы в развитие бронхиальной астмы. // Биомедицинская химия. – 2015. – Т.61. - № 4 - С. 427-439. Doi: 10.1134/S1990750814040076
10. Никитин А.В., Золотарева М.А. Роль ферментативной активности в формировании окислительного стресса у больных бронхиальной астмой. (Обзор литературы). // Вестник новых медицинских технологий. – 2013. – Т. ХX. - № 2 – С. 165-169.
11. Youness E.R., Shady M., Nassar M.S., Mostafa R., Abuelhamd W. The role of serum nuclear factor erythroid 2-related factor 2 in childhood bronchial asthma. // J Asthma. – 2019. – P.1-6. doi: 10.1080/02770903.2019.1571081.
12. Ben Anes A., Ben Nasr H., Fetoui H., Bchir S., Chahdoura H. et al. Alteration in systemic markers of oxidative and antioxidative status in Tunisian patients with asthma: relationships with clinical severity and airfl ow limitation. // J Asthma. – 2016. – V.53(3). – P.227-37. doi: 10.3109/02770903.2015.1087559.
13. Youness E.R., Shady M,. Nassar M.S., Rehab M., Walaa Ab. The role of serum nuclear factor erythroid 2-relatedfactor 2 in childhood bronchial asthma. // Journal of Asthma. - 2019. – V.7. – P.1-6. doi:10.1080/02770903.2019.1571081
14. Liz M.A., Faro C.J, Saraiva M.J., Sousa M.M. Transthyretin, a new cryptic protease. // J Biol Chem. – 2004. – V.279(20). – P. :21431-8. DOI: 10.1074/jbc.M402212200
15. Berry D.C., Croniger C.M., Ghyselinck N.B., Noy N. Transthyretin blocks retinol uptake and cell signaling by the holo-retinol-binding protein receptor STRA6. // Mol Cell Biol. – 2012. – V.32(19). – P.3851-9. doi: 10.1128/MCB.00775-12.
16. Ejaz S., Nasim F.U., Ashraf M., Ahmad S. Serum Proteome Profi ling to Identify Proteins Promoting Pathogenesis of Non-atopic Asthma. // Protein Pept Lett. – 2018. – V.25(10). – P.933-942. doi: 10.2174/0929866525666180925142119.
17. Mehrani H., Ghanei M., Aslani J., Golmanesh L. Bronchoalveolar lavage fl uid proteomic patterns of sulfur mustard-exposed patients. // Proteomics Clin Appl. – 2009. – V.3(10). – P.1191-200. doi: 10.1002/prca.200900001.
18. Каримова Х.М., Намазова-Баранова Л.С., Клюшник Т.П., Мамедъяров А.М. Прогностическое значение показателей врожденного иммунитета у детей с последствиями перинатального поражения ЦНС гипоксически-ишемического генеза. // Практика педиатра. – 2012. - №3 – С. 6-12.
19. Marc MM, Korosec P, Kosnik M, Kern I, Flezar M, et al. Complement Factors C3a, C4a, and C5a in Chronic Obstructive Pulmonary Disease and Asthma. // J. Respir. Cell Mol. Biol. – 2004. – V.31. – P.216–219. doi: 10.1165/rcmb.2003-0394OC.
20. Морозов С.Г., Кожевникова Е.Н., Петкевич Н.П., Иншакова В.М., Клюшник Т.П., Сидякин А.А. Нейроиммунный статус детей с перинатальной патологией нервной системы. // Вопросы гинекологии, акушерства и перинатологии. – 2014. – Том 13. - №5 – С.33-39.
21. Созаева Д.И., Бережанская С.Б. Роль иммуноцитокинов в генезе церебральной ишемии у новорожденных из группы высокого перинатального риска. // Кубанский научный медицинский вестник. – 2011. – №2(125) – С.151- 155.
Об авторах
А. А. ЛебеденкоРоссия
д.м.н., проф., зав. кафедрой детских болезней №2,
Ростов-на-Дону
А. А. Афонин
д.м.н., профессор, Заслуженный деятель науки РФ, главный научный сотрудник НИИ акушерства и педиатрии,
Ростов-на-Дону
И. Г. Логинова
к.м.н., заместитель главного врача по педиатрии и экспертизе временной нетрудоспособности НИИ акушерства и педиатрии,
Ростов-на-Дону
О. Е. Семерник
к.м.н., ассистент кафедры детских болезней №2,
Ростов-на-Дону
В. О. Гунько
педиатрии,
Ростовна-Дону
И. А. Аллилуев
младший научный сотрудник НИИ акушерства и педиатрии,
Ростов-на-Дону
А. В. Ларичкин
младший научный сотрудник НИИ акушерства и педиатрии,
Ростов-на-Дону
Рецензия
Для цитирования:
Лебеденко А.А., Афонин А.А., Логинова И.Г., Семерник О.Е., Гунько В.О., Аллилуев И.А., Ларичкин А.В. Особенности протеомного профиля сыворотки крови детей с бронхиальной астмой, перенесших перинатальное поражение центральной нервной системы. Медицинский вестник Юга России. 2019;10(4):59-65. https://doi.org/10.21886/2219-8075-2019-10-4-59-65
For citation:
Lebedenko A.A., Afonin A.A., Loginova I.G., Semernik O.E., Gunko V.O., Alliluev I.A., Larichkin A.V. Features of proteomic profi le of blood serum of children with bronchial asthma who underwent perinatal central nervous system damage. Medical Herald of the South of Russia. 2019;10(4):59-65. (In Russ.) https://doi.org/10.21886/2219-8075-2019-10-4-59-65







































