Перейти к:
Экспериментальный метод замещения костно-хрящевых дефектов суставов (ранние результаты)
https://doi.org/10.21886/2219-8075-2019-10-2-71-76
Аннотация
Цель: разработать и предложить оригинальный метод лечения костно-хрящевых дефектов гиалинового хряща на примере коленного сустава.
Материалы и методы: проспективное исследование проводилось на экспериментальных животных (овцы) в количестве 30 особей, возраст которых составил от 1 года до 3.5 лет, вес от 18 до 28 кг. Все особи разделены на 3 репрезентативные группы по 10 особей в зависимости от метода восполнения дефекта сустава. Во всех группах выполнялся полнослойный дефект гиалинового хряща с захватом поверхностной части субхондральной кости диаметром 4.5 мм по внутренней поверхности мыщелка бедра, несущей нагрузку и замещался различными способами. Выделенные костно-хрящевые фрагменты исследовали визуально, оценивая характер краёв дефекта суставного хряща, состояние его кровенаполнения, глубину дефекта, степень закрытия дефекта формирующимся фибрознохрящевым слоем. Область дефекта субхондральной пластинки изучали морфологически с использованием световой микроскопии.
Результаты: результаты в группе без замещения дефекта сопоставимы с аналогичными исследованиями других авторов, что свидетельствует о невозможности организма самостоятельно восполнить имеющийся костнохрящевой дефект. Наилучшие результаты показаны в третьей группе, где костно-хрящевой дефект практически полностью заместился макроскопически, а микроскопически удалось проследить архитектонику новообразованной гиалиновоподобной ткани, что свидетельствует о хороших ранних результатах применения описываемой методики.
Выводы: Предложенный оригинальный метод лечения костно-хрящевых дефектов коленного сустава позволил получить хорошие результат в ранние сроки. Необходимо дальнейшее наблюдение за поведением регенерата во всех экспериментальных группах.
Для цитирования:
Айрапетов Г.А., Загородний Н.В., Воротников А.А. Экспериментальный метод замещения костно-хрящевых дефектов суставов (ранние результаты). Медицинский вестник Юга России. 2019;10(2):71-76. https://doi.org/10.21886/2219-8075-2019-10-2-71-76
For citation:
Airapetov G.A., Zagorodniy N.V., Vorotnikov A.A. Experimental method replacement of the osteo-chondral defects of the large joints (first results). Medical Herald of the South of Russia. 2019;10(2):71-76. (In Russ.) https://doi.org/10.21886/2219-8075-2019-10-2-71-76
Введение
Одной из наиболее актуальных проблем в травматологии и ортопедии является лечение пациентов с повреждением хряща крупных суставов. Более половины обращений к врачу травматологу-ортопеду в поликлинике связаны с болевым синдромом в суставах [1][2]. Результаты 30 тыс. артроскопических операций коленного сустава показали, что в 62 % определяется хондромаляция гиалинового хряща [3]. Регулярно предлагаются новые методы хирургического лечения патологии крупных суставов, чего не скажешь о консервативных методиках [4][5][6]. Все больше внедряются методики, стимулирующие регенерацию и восстановление гиалинового хряща [7][8][9][10].
Регенерация гиалинового хряща имеет длинную историю. Ранние методики сводились к выполнению трансплантации сустава. Многие методики, которые являются актуальными сегодня, исходят из предложенной Pridie методики туннелизации [11], которую позже продолжил Ficat под названием спонгиализация. Методика включает в себя удаление разволокнившегося гиалинового хряща для обеспечения поступления стволовых клеток из губчатой кости в сустав и последующей дифференцировки их. Gross и соавт. позже разработали метод аллотрансплантации костно-хрящевых блоков [12].
Цель исследования — разработать и предложить оригинальный метод лечения костно-хрящевых дефектов гиалинового хряща на примере коленного сустава.
Материалы и методы
Проспективное исследование проводилось на экспериментальных животных (овцы) в количестве 30 особей, возраст которых составил от 1 года до 3.5 лет, вес от 18 до 28 кг. Выбор данного вида экспериментальных животных обусловлен сопоставимым размером сустава и анатомического строения животного с человеческим, который позволяет воссоздать острый дефект и оценить его поведение под воздействием определенных факторов, а хондроциты баранов очень близки по своим свойствам человеческим. Все особи разделены на 3 группы по 10 особей в зависимости от метода восполнения дефекта сустава. Во всех группах выполнялся полнослойный дефект гиалинового хряща с захватом поверхностной части субхондральной кости диаметром 4.5 мм по внутренней поверхности мыщелка бедра, несущей нагрузку и замещался различными способами. В первую группу включены 10 овец (20 суставов), которым дефект левого сустава не замещался, правого замещался внеклеточным коллагеновым матриксом (ВКМ), во вторую группу включены 10 овец (20 суставов), которым дефект левого сустава не замещался, правого замещался ВКМ и под нее вводилась плазма, обогащенная тромбоцитами (PRP), в 3 группу включены 10 овец (20 суставов), которым дефект левого сустава не замещался, правого замещался ВКМ, вводилась PRP и измельченный гиалиновый хрящ из ненагру- жаемой поверхности сустава.
Для анестезии использовали 0,5 мл 2 % раствора Рометара.
Хирургические манипуляции выполнялись в асептических условиях, после стрижки нижней трети бедра и верхней трети голени овцы. Зона хирургического доступа многократно обрабатывалась антисептиком. Положение овцы на боку. Одна из конечностей фиксировалась к операционному столу, вторая конечность, на которой выполнялась хирургия, фиксировалась в сгибании, что обеспечивало возможность выявить такие ориентиры, как мыщелки большой берцовой кости, собственную связку надколенника и сам надколенник. Параллельно внутренней поверхности собственной связки надколенника в проекции суставной щели выполнялся хирургический доступ длиной 4 см. Стоит отметить, что кожа в данной области достаточно податлива и позволяет смещать края раны в пределах до 2 см. Следующим этапом выполняли рассечение слабо выраженной подкожно-жировой клетчатки, тем самым обеспечивался доступ к капсуле сустава. При рассечении капсулы сустава возможно повреждение ветвей медиальной огибающей артерии, которые в области жирового тела образуют квадрат. В связи с этим в области жирового тела манипуляции необходимо выполнять с особой осторожностью. При повреждении сосудов, выполнялся гемостаз при помощи москита, который оставался на сосуде до ушивания раны. При разведении краев капсулы определялась суставная поверхность медиального мыщелка бедра. Для визуализации нагружаемой поверхности внутреннего мыщелка бедра выполняли максимально возможное сгибание сустава и резекцию части жирового тела. Следующим этапом наносили дефект диаметром 4.5 мм с захватом субхон- дральной кости при помощи бора для аутохондропла- стики (рис. 1). В завершении, выполняли послойное ушивание раны. Капсулу ушивали рассасывающимися шв ами нитью sofil 4-0. Следом ушив али кожу и подкожно - жировую клетчатку узловыми швами.
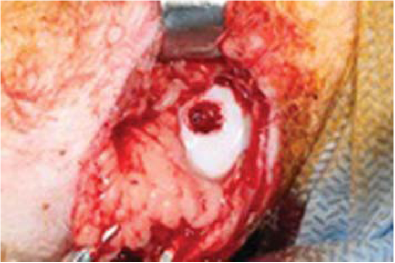
Рисунок 1. Полнослойный дефект нагружаемой поверхности коленного сустава овцы.
Figure 1. Full-layer defect of the loaded surface of the knee joint of sheep.
Все овцы содержались в приспособленном для этого виварии, получали необходимое питание для полноценного существования. Животные давали полную нагрузку на конечность сразу после вмешательства.
Выделенные костно-хрящевые фрагменты исследовали визуально, оценивая характер краёв дефекта суставного хряща, состояние его кровенаполнения, глубину дефекта, степень закрытия дефекта формирующимся фиброзно-хрящевым слоем. Область дефекта субхондральной пластинки изучали морфологически с использованием световой микроскопии.
С целью изучения гистологии материал фиксировали формалином (10 %), затем выполняли декальцинацию костной ткани. Следующим этапом подготавливали материал для заливки в парафиновую среду “Histomix” Полученные в результате блоки обрабатывали на микротоме (LECA 3451 R) и окрашивали пикрофуксином по Ван Гизону и гематоксилином и эозином.
В данной статье представлены результаты, полученные в первой (контрольной) и третьей группах.
Результаты
В исследуемых группах отсутствовали гнойно-септические осложнения. Непосредственно после операции овцы приступали к ходьбе с полной нагрузкой.
Через месяц после формирования дефекта без замещения определялась «минус-ткань», составляющая 1/3-1/4 толщины сформированного дефекта с ровными гладкими краями; граница между новообразованной тканью и сохраненным гиалиновым суставным хрящом прослеживается четко (рис. 2).
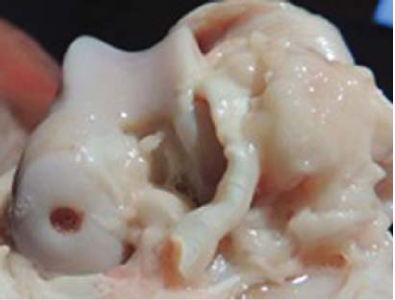
Рисунок 2. Макроскопическая картина в первой группе.
Figure 2. Macroscopic result in I group.
В группе с замещением дефекта коллагеновой мембраной, вводилась плазма, обогащенная тромбоцитами и измельченный гиалиновый хрящ из ненагружаемой поверхности сустава, определялась «минус - ткань», составляющая 2/3 толщины сформированного дефекта с ровными гладкими краями; граница между новообразованной тканью и сохраненным гиалиновым суставным хрящом прослеживается четко (рис. 3.).
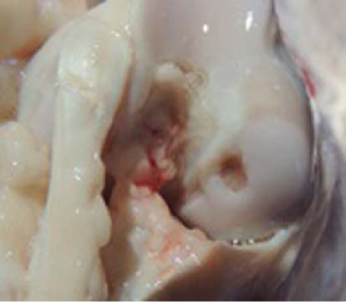
Рисунок 3. Макроскопическая картина в третьей группе.
Figure 3. Macroscopic result in III group.
Микроскопически через месяц после формирования дефекта без замещения на дне дефекта суставного хряща определяется тонкий, прерывистый слой новообразованного гиалиновоподобного хряща. По периферии дефекта хрящевая ткань значительно большей толщины, нежели в ее дне, где толщина новообразованного хряща составляет 1/3-1/4 толщины сформированного дефекта (рис. 4).
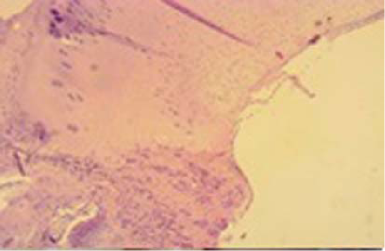
Рисунок 4. Микроскопическая картина в I группе.
Figure 4. Microscopic result in I group.
В группе с замещением дефекта коллагеновой мембраной, вводилась плазма, обогащенная тромбоцитами и измельченный гиалиновый хрящ из ненагружаемой поверхности сустава на дне дефекта суставного хряща, определяется более толстый, слой новообразованного гиалиноподобного хряща. По периферии дефекта хрящевая ткань значительно большей толщины, нежели в ее дне, где толщина новообразованного хряща составляет 2/3 толщины сформированного дефекта. Субхондральная кость и некоторые костные балки, которые располагались ближе к дефекту сформированы не на всем протяжении дна, то есть полноценность субхондральной кости восстановлена не полностью. Некоторые участки костных балок утолщены, расположены хаотично, а межуточное вещество определялось в большом количестве, негомогенного характера. (Рис. 5).
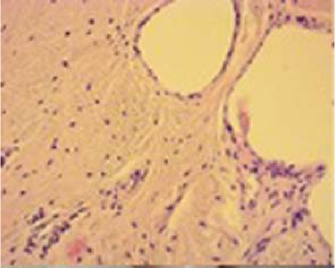
Рисунок 5. Микроскопическая картина в третьей группе.
Figure 5 Microscopic result in III group.
Обсуждение
Целесообразность пластики костно-хрящевых дефектов коленного сустава не подлежит сомнению [13][14]. Существует различное отношение к тому или иному методу пластики дефектов [15][16]. Некоторые авторы считают, что достаточно использовать положительный эффект артроскопического дебридмента за счет удаления существующего детрита [17]. Необходимо отметить, что положительный эффект данной процедуры нивелируется его скоротечностью. Безусловно дополнение артроскопического дебридмента микрофрактурированием позволяет улучшить полученные результаты и на сегодняшний день этот метод наиболее популярен в России ввиду простоты исполнения и дешевизны, однако необходимо отметить, что полученный регенерат неустойчив к нагрузкам и довольно быстро лизируется [18][10][19].
Близким к данному методу пластики относится трансплантация аутологичных хондроцитов (ACI) и индуцированный матрицей аутогенный хондрогенез (AMIC).
Оба метода показывают хорошие результаты, однако в первом случае необходимо выполнять два оперативных вмешательства, а второй метод характеризуется очень высокой стоимостью процедуры [20][21][22][23].
Некоторые авторитетные специалисты считают, что мезенхимальные стволовые клетки могут сместить методики ACI и AMIC. Однако, по мнению других авторов, высокая эффективность использования этой методики включает в себя ряд недостатков, которые связаны с вероятностью неконтролируемой экспрессии разнообразных генов в организме, которые могут иметь негативные последствия и высокой ценой методики [24][25][26][27][28][29].
В предложенном методе пластики костно-хрящевых дефектов используется не только внеклеточный коллагеновый матрикс, но и аутологичные ресурсы организма, такие как плазма, обогащенная тромбоцитами, и измельченный аутохрящ. Полученные результаты в группе без замещения дефекта сопоставимы с аналогичными исследованиями других авторов, что свидетельствует о невозможности организма самостоятельно восполнить имеющийся дефект. Наилучшие результаты показаны в третьей группе, где костно-хрящевой дефект практически полностью заместился макроскопически, а микроскопически удалось проследить архитектонику новообразованной гиалиновоподобной ткани, что свидетельствует о хороших ранних результатах применения описываемой методики.
Заключение
Применение предложенного оригинального метода пластики костно-хрящевых дефектов коленного сустава показал хорошие макро- и микроскопические результаты уже через 1 месяц. Необходимо дальнейшее наблюдение за поведением регенерата.
Список литературы
1. Божокин М.С., Божкова С.А., Нетылько Г.И. Возможности современных клеточных технологий для восстановления поврежденого суставного хряща (аналитический обзор литературы). // Травматология и ортопедия России. - 2016ю - Т.22, №3. - С.122-134. doi: 10.21823/2311-2905-2016-22-3-122-134
2. Белоусова Т.Е., Карпова Ж.Ю., Ковалева М.В. Влияние низкочастотной магнитосветотерапии на динамику электромиографических показателей в процессе медицинской реабилитации пациентов с сочетанной патологией позвоночника и крупных суставов. // Современные технологии в медицине. - 2011. - № 2. - С. 77-80.
3. Ежов М.Ю., Ежов И.Ю., Кашко А.К., Каюмов А.Ю., Зыкин А.А., Герасимов С.А. Нерешённые вопросы регенерации хрящевой и костной ткани (обзорно-аналитическая статья). // Успехи современного естествознания. - 2015. -№ 5. - С. 126-131.
4. Чичасова Н.В. Клиническое обоснование применения различных форм препарата Терафлекс при остеоартрозе. // Современная ревматология. - 2010. - T.4(4). - C.59-64. doi: 10.14412/1996-7012-2010-639
5. Andia I., Abate M. Knee osteoarthritis: hyaluronic acid, platelet-rich plasma or both in association? // Expert Opin Biol Ther. - 2014. - N. 14(5). - P. 635-649 doi: 10.1517/14712598.2014.889677
6. Chang K.V., Hung C.Y., Aliwarga F., Wang T.G., Han D.S., Chen WS. Comparative effectiveness of platelet-rich plasma injections for treating knee joint cartilage degenerative pathology: a systematic review and meta-analysis. // Arch Phys Med Rehabil. - 2014. - N. 95(3). - P. 562-575. doi: 10.1016/j.apmr.2013.11.006
7. Dhollander A., Moens K., Van der Maas J., Verdonk P, Almqvist K.F., Victor J. Treatment of Patellofemoral Cartilage Defects in the Knee by Autologous Matrix-Induced Chon-drogenesis (AMIC). // ActaOrthop. Belg. - 2014. - T. 80. -P. 251-259.
8. Тепляшин А.С., Шарифуллина С.З., Чупикова Н.И., Се-пиашвили РИ. Перспективы использования мультипотентных мезенхимных стромальных клеток костного мозга и жировой ткани в регуляции регенерации опорных тканей. // Аллергология и иммунология. - 2015. - Т. 16. № 1. - С. 138-148.
9. Козадаев М.Н. Применение матриц на основе полика-пролактона для стимуляции регенерации суставного хряща в условиях эксперимента. // Теоретические и прикладные аспекты современной науки. - 2014. - № 3-2. - C. 128-130.
10. Ulstein S., Aroen A., Rotterud J.H., Loken S., Engebretsen L., Heir S. Microfracture technique versus osteochondral autologous transplantation mosaicplasty in patients with articular chondral lesions of the knee: a prospective randomized trial with long-term follow-up. // Knee Surg Sports TraumatolAr-throsc. - 2014. - V.22(6). - P1207-15. doi: 10.1007/s00167-014-2843-6
11. Pridie K. A method of resurfacing osteoarthritic knee joints. // J Bone Joint Surg Am. - 1959. - T. 41. - P 618-619.
12. Gross A.E., Langer F., Houpt J., Pritzker K., Friedlaender G. Allotransplantation of partial joints in the treatment of osteoarthritis of the knee. // Transplant Proc. - 1976. - T. 8. -P. 129-132.
13. Шевцов В.И., Макушин В.Д., Ступина Т.А., Степанов М.А. Экспериментальные аспекты изучения репаративной регенерации суставного хряща в условиях туннелирования субхондральной зоны с введением аутологичного костного мозга. // Гений ортопедии. - 2010. - Т. 2. -P 5-10.
14. Советников Н.Н., Кальсин В.А., Коноплянников М.А., Муханов В.В. Клеточные технологии и тканевая инженерия в лечении дефектов суставной поверхности.// Клиническая практика. - 2013. - №1. - С.52-66
15. Caron M.M., Emans PJ., Coolsen M.M., Voss L., Surtel D. A.,et al. Redifferentiation of dedifferentiated human articular chondrocytes: comparison of 2D and 3D cultures. // Osteoarthritis Cartilage. - 2012. - T. 20(10). - P 1170-1178. doi: 10.1016/j.joca.2012.06.016
16. Kim Y.S., Choi Y.J., Lee S.W, Kwon O.R., Suh D.S., et al. Assessment of clinical and MRI outcomes after mesenchymal stem cell implantation in patients with knee osteoarthritis: a prospective study. // Osteoarthritis Cartilage. - 2016. - T. 24 -P. 237-45. doi: 10.1016/j.joca.2015.08.009
17. Steadman J.R., Briggs K.K., Rodrigo J.J., Kocher M.S., Gill T.J, Rodkey WG. Outcomes of microfracture for traumatic chondral defects of the knee: average 11-year follow-up. // Arthroscopy. - 2003. - T. 19. - P 477-484. doi: 10.1053/jars.2003.50112
18. Kreuz P.C., Erggelet C., Steinwachs M.R., Krause S.J., Lahm A., et al. Is microfracture of chondral defects in the knee associated with different results in patients aged 40 years or younger? // Arthroscopy. - 2006. - T.22. - P. 1180- 1186. Doi: 10.1016/j.arthro.2006.06.020
19. Knutsen G., Engebretsen L., Ludvigsen T.C., Drogset J.O., Grontvedt T., et al. Autologous chondrocyte implantation compared with microfracture in the knee: a randomized trial. // J Bone Joint Surg Am. - 2004 .- T. 86. - P. 455-464. doi: 10.4172/2167-0870.1000e106
20. Jacobi M., Villa V, Magnussen R.A., Neyret P. MACI - a new era? // Sports Med ArthroscRehabilTherTechnol - 2011 - T.3. -P. 10.
21. Khan WS, Johnson DS, Hardingham DS. The Potential Use of Stem Cells for Knee // Articular Cartilage Repair Knee-2010.- T.17(6).- P. 369-74.
22. Zeifang F., Oberle D., Nierhoff C., Richter W, Moradi B., Schmitt H. Autologous chondrocyte implantation using the original periosteum-cover technique versus matrixassociated autologous chondrocyte implantation: a randomised clinical trial. // Am J Sports Med. - 2010.- T. 38(5).- P. 924-933. doi: 10.1016/s0276-1092(10)79804-7
23. Welsch G.H., Mamisch T.C., Zak L., Blanke M., Olk A., et al. Evaluation of cartilage repair tissue after matrix-associated autologous chondrocyte transplantation using a hyaluronic-based or a collagen based scaffold with morphological MOCART scoring and biochemical T2 mapping: preliminary results. // Am J Sports Med. - 2010 - T. 38(5) - P. 934-942. doi: 10.1177/0363546509354971
24. Mafi P., Hindocha S., Mafi R., Griffin M., Khan W.S. Sources of Adult Mesenchymal Stem Cells Applicable for Musculoskeletal Applications- A Systematic Review of the Literature. // Open Orthop J. - 2011. - T.5.- P. 238-244. doi: 10.2174/1874325001105010242
25. Zhai L.J., Zhao K.Q., Wang Z.Q., Feng Y., Xing S.C. Mesenchymal stem cells display different gene expression profiles compared to hyaline and elastic chondrocytes. // Int J ClinExp Med. - 2015. - № 1. - P. 5-11.
26. Tanaka Y. Human mesenchymal stem cells as a tool for joint repair in rheumatoid arthritis. // ClinExpRheumatol.- 2015. -T. 33. - P. 58-62
27. Shin YS, Yoon JR, Kim HS, Lee SH. Intra-Articular Injection of Bone Marrow-Derived Mesenchymal Stem Cells Leading to Better Clinical Outcomes without Difference in MRI Outcomes from Baseline in Patients with Knee Osteoarthritis. // Knee Surg Relat Res. - 2018. - V30(3). - P.206-214. doi: 10.5792/ksrr. 17.201
28. Koh Y.G., Kwon O.R., Kim Y.S., Choi Y.J., Tak D.H. Adipose-derived mesenchymal stem cells with microfracture versus microfracture alone: 2-year follow-up of a prospective randomized trial. // Arthroscopy. - 2016.- T. 32.- P. 97-109. doi: 10.1016/j.arthro.2015.09.010
29. Tan Q., Lui P.P., Rui Y.F. Effect of In Vitro Passaging on the Stem Cell-Related Properties of Tendon-Derived Stem Cells-Implications in Tissue Engineering. // Stem Cells Dev. - 2011. -T. 12. - P. 113-116. doi: 10.1089/scd.2011.0160
Об авторах
Г. А. АйрапетовРоссия
Георгий Александрович Айрапетов - кандидат медицинских наук, доцент кафедры травматологии и ортопедии
Конфликт интересов: нет
Н. В. Загородний
Россия
Николай Васильевич Загородний - член-корреспондент РАН, заведующий кафедрой травматологии и ортопедии.
Москва
Конфликт интересов: нет
А. А. Воротников
Россия
Александр Анатольевич Воротников - заведующий кафедрой травматологии и ортопедии с курсом ДПО
Конфликт интересов: нет
Рецензия
Для цитирования:
Айрапетов Г.А., Загородний Н.В., Воротников А.А. Экспериментальный метод замещения костно-хрящевых дефектов суставов (ранние результаты). Медицинский вестник Юга России. 2019;10(2):71-76. https://doi.org/10.21886/2219-8075-2019-10-2-71-76
For citation:
Airapetov G.A., Zagorodniy N.V., Vorotnikov A.A. Experimental method replacement of the osteo-chondral defects of the large joints (first results). Medical Herald of the South of Russia. 2019;10(2):71-76. (In Russ.) https://doi.org/10.21886/2219-8075-2019-10-2-71-76







































